单核细胞趋化蛋白-1基因多态性与浙江局部地区汉族人群2型糖尿病的相关性研究
马江波 许鑫 马改改 沈洁 黄青华 施育平
单核细胞趋化蛋白-1基因多态性与浙江局部地区汉族人群2型糖尿病的相关性研究
马江波 许鑫 马改改 沈洁 黄青华 施育平
目的 探讨单核细胞趋化蛋白-1(MCP-1)基因多态性与浙江局部地区汉族人群2型糖尿病(T2DM)的相关性。方法 采用病例对照研究,选取浙江局部地区汉族人群中T2DM患者208例(T2DM组)和健康体检者209例(对照组),采用聚合酶链反应-限制性片段长度多态性方法检测受试者CCL2 rs1024611(-2518A/G)的基因型,并用DNA测序法鉴定部分结果。结果CCL2 rs1024611基因多态性与T2DM发生相关,T2DM组和对照组G基因频率差异有统计学意义(P<0.01),T2DM组和对照组GG基因型频率差异有统计学意义(P<0.01),多因素logistic回归分析显示,GG基因型频率可显著降低T2DM风险(校正后OR=0.201,95%CI:0.077~0.526,P<0.01)。结论 CCL2 rs1024611基因多态性与T2DM发生相关,其中GG基因型可能是T2DM的保护性因素,G等位基因可能降低汉族浙江局部地区汉族人群T2DM的风险。
单核细胞趋化蛋白-1 2型糖尿病 单核苷酸多态性
1 对象和方法
1.1 对象 选择2009年10月至2014年10月入住浙江省人民医院内分泌科的T2DM患者208例,男143例,女65例,年龄55~76(65.8±10.1)岁。符合1999年WHO关于T2DM诊断标准,同时排除感染、心脑血管疾病、自身免疫性疾病、非糖尿病引起的肾功能衰竭、恶性肿瘤患者。选择性别、年龄相匹配的同期浙江省人民医院门诊健康体检者209例作为对照组,男143例,女66例,年龄53~74(63.9±10.6)岁。本研究所有受试者均为中国浙江地区汉族人,个体之间无血缘关系。两组性别、年龄比较差异均无统计学意义(均P>0.05)。所有入选者均征得本人或其家属同意并签署知情同意书。本研究获得浙江省人民医院伦理委员会批准。
1.2 方法
1.2.1 白细胞基因组DNA提取 所有对象采集晨起空腹静脉血5ml 2管,其中一管测定血糖、糖化血红蛋白(HbA1c)、血脂等,另一管以EDTA抗凝,以溶液盐析法提取DNA,TE溶解,-80℃保存。
1.2.2 CCL2 rs1024611多态性检测 聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术方法参考文献[8-10]。应用上游引物5′-TCT CTC AGC CCA GCA CTG ACC-3′和下游引物 5′-GAG TGT TCA CAT AGG CTT CTG-3′扩增包含CCL2 rs1024611(-2518A/ G)位点的DNA片段234 bp。当-2518位点为G等位基因时,PCR产物由限制性内切酶PvuⅡ(加拿大生工公司)切割产生2个片段:159 bp和75 bp。随机选择20%的T2DM组和20%的对照组,将每个样本的PCR扩增片段送至上海生工生物工程有限公司,采用ABI_3730XL测序仪(美国ABI公司)进行单向测序。DNA测序图谱中多态性位点仅有一个G或A峰,表示其为纯合GG或AA型;出现双峰则表示其为杂合GA型测序得到的基因型与采用PCR-RFLP得到的基因型进行比对,详见图1。

图1 CCL2rs1024611(-2518A/G)琼脂糖电泳及测序结果[a:M:DL500 DNA分子标志物;1、4、5、6、7:AG型;2、8:AA型;3:GG型;b:小方框位置为多态性位点]
1.3 统计学处理 应用SPSS 19.0统计软件。运用Hardy-Weinberg平衡检验确认研究样本的群体代表性。计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验。以比值比(OR)及其95%可信区间(CI)表示相对风险度。通过非条件logistic回归分析校正危险因素后估算基因型与表型的相关性。未校正的OR值和校正后的OR值分别采用单因素分析和多因素logistic回归分析。
2 结果
2.1 Hardy-Weinberg平衡检验 CCL2 rs1024611在对照人群中的基因分型符合Hardy-Weinberg平衡规律(CCL2:χ2=2.01,P=0.156),表明对照人群的基因分布可反映整体人群基因的分布情况。
2.2 两组对象一般资料的比较 在T2DM组中BMI、TG及LDL-C水平均高于对照组(均P<0.05),而HDLC水平低于对照组(P<0.05)。T2DM组中空腹血糖和HbA1c高于对照组(P<0.05),详见表1。

表1 两组对象一般资料的比较
2.3 两组CCL2 rs1024611(-2518A/G)基因型和等位基因频率的比较 两组CCL2 rs1024611的基因型和等位基因频率分布见表2。T2DM组和对照组G基因频率差异有统计学意义(P<0.01)。T2DM组和对照组GG基因型频率差异有统计学意义(P<0.01),经非条件logistic回归分析校正BMI及血脂水平后,CCL2-2518 GG基因型能显著降低发生T2DM的风险,为T2DM的保护性因素。
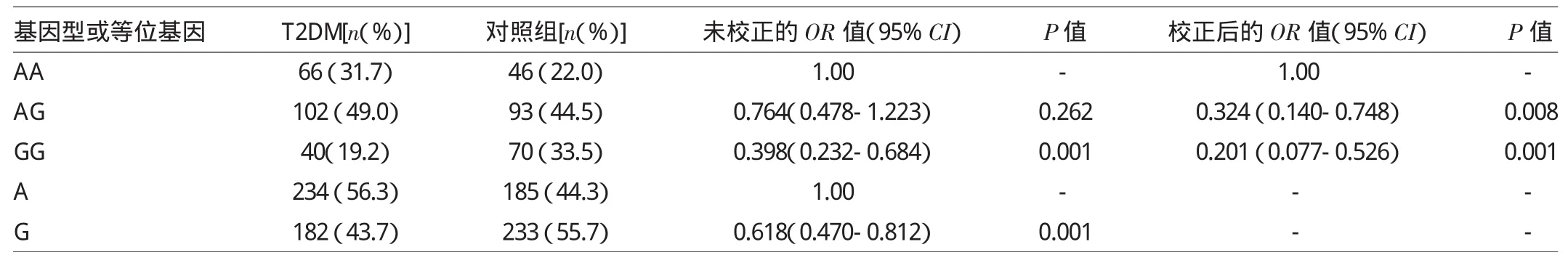
表2 两组CCL2rs1024611(-2518A/G)基因型和等位基因频率的比较
3 讨论
T2DM呈复杂性遗传模式,即多个基因变异加上环境因素的影响共同决定疾病的易感性。近年提出的T2DM的炎症学说,认为T2DM是一种慢性非特异性炎症过程。而MCP-1对各种炎症细胞有趋化激活作用。本研究分析了浙江局部地区汉族人群CCL2 rs1024611(-2518A/G)基因多态性与T2DM的关系,研究结果表明,CCL2 rs1024611(-2518A/G)基因多态性与汉族人群T2DM发生相关,其中GG基因型可能是T2DM的保护性因素,G等位基因可能降低浙江局部地区汉族人群T2DM的风险。
对于MCP-1-2518A/G基因多态性与T2DM的关联研究国内外也有相关报道。本研究中对照组AA、AG、GG基因型分别为22.0%、44.5%、33.5%,这与Jiang等[9]报道的中国人群(病例数416)研究结果无统计学差异,然而与国外Simeoni[11]、Zietz等[12]报道的研究结果相比,G等位基因频率高于高加索人群,提示该基因变异存在种族异质性。
2004年,Simeoni等[11]对大样本量的高加索人群研究后发现,血浆MCP-1水平升高与胰岛素抵抗和T2DM发生呈显著正相关,MCP-1 G-2518等位基因作为一种胰岛素抵抗和T2DM负效因子有统计学意义。Jing等[9]对中国人群的研究亦与本研究结果一致,均表明G等位基因可能为T2DM的保护性因素。然而,Zietz等[12]对高加索人群的另一项研究却未发现MCP-1-2518A/G基因多态性与T2DM相关。其原因可能有:首先,部分研究样本量太小,导致统计效能低,其研究结果可信度不高;其次,糖尿病的不同表型可能有不同的遗传发病机制,目前已有多项研究报道MCP-1基因多态性与糖尿病微血管病变、糖尿病肾病、糖尿病大血管病变等糖尿病并发症相关,若纳入研究的T2DM表型不一致,是否合并糖尿病并发症可能导致结果的差异。
关于MCP-1基因多态性与T2DM关联的机制研究主要集中在不同基因型其MCP-1表达水平的差异方面。研究表明,MCP-1-2518A/G位点的基因多态性影响炎症刺激反应中MCP-1的表达水平[6]。Simeoni等[11]研究也表明,T2DM患者体内MCP-1水平显著高于正常对照。MCP-1是炎症趋化因子CC亚族的一员,对各种炎性细胞尤其是单核/巨噬细胞具有趋化激活作用,研究发现脂肪组织可以产生MCP-1,当脂肪沉积到达一定阈值时,来自脂肪细胞的因子,如TNF-α、MCP-1等引起巨噬细胞激活和浸润,激活的巨噬细胞分泌各种炎症因子,后者可损伤脂肪细胞胰岛素敏感性,同时刺激周围单核细胞和巨噬细胞进一步激活和浸润脂肪,最终引起全身胰岛素抵抗[5]。因此作为一种重要的前炎症细胞因子,MCP-1在炎症-胰岛素抵抗型-糖尿病的病理生理过程中起着重要作用。然而,Zietz等[12]研究却发现,T2DM患者体内MCP-1水平显著升高,但MCP-1-2518A/G基因型和等位基因频率与非糖尿病人群比较差异无统计学意义,与MCP-1水平也无相关性,提示MCP-1水平可能只是MCP-1-2518A/G基因型影响T2DM的发生和发展的部分原因,关于其完整和详尽的机制还有待进一步的研究。
综上所述,本研究从一定角度揭示了 CCL2 rs1024611基因多态性可能与浙江局部地区汉族人群T2DM发生相关,其中GG基因型可能是T2DM的保护性因素,G等位基因可能降低浙江局部地区汉族人群T2DM的风险,但由于T2DM属多基因遗传性疾病,每个易感基因的作用可能都是微小的,而且本研究的研究人群并非来自社区,虽然有明确的排除标准,但住院患者糖尿病并发症发生率显然大于一般人群,这对研究结果造成了一定的偏倚。因此,有必要扩大研究对象的数量,为进一步从基因水平揭示MCP-1基因与糖尿病的关系提供依据。
[1] Esser N,Legrand-Poels S,Piette J,et al.Inflammation as a link between obesity,metabolic syndrome and type 2 diabetes[J].Diabetes Res Clin Pract,2014,105(2):141-150.
[2] 杨立勇.低度慢性炎症与2型糖尿病[J].中华糖尿病杂志,2013,5(9): 527-530.
[3] Calle M C,Fernandez M L.Inflammation and type 2 diabetes[J]. Diabetes&metabolism,2012,38(3):183-191.
[4] Donath M Y,Shoelson S E.Type 2 diabetes as an inflammatory disease[J].Nature Reviews Immunology,2011,11(2):98-107.
[5] SellH,EckelJ.Monocyte chemotactic protein-1 and its role in insulin resistance[J].Current opinion in lipidology,2007,18(3):258-262.
[6] Rovin B H,Lu L,Saxena R.A novel polymorphism in the MCP-1 gene regulatory region that influences MCP-1 expression[J].Biochemical and biophysical research communications,1999,259(2): 344-348.
[7] Madeshiya AK,Singh S,DwivediS,et al.Monocyte chemoattractant protein-1 gene polymorphism and its serum level have an impacton anthropometric and biochemical risk factors of metabolic syndrome in Indian population[J].Int J Immunogenet, 2015,42(2):78-86.
[8] Xu J,Liao YF,Zhou W P,et al.The MCP-1 Gene A-2518G Polymorphism Confers an Increased Risk ofVascular Complications in Type 2 Diabetes Mellitus Patients[J].Genet Test Mol Biomarkers, 2015,19(8):411-417.
[9] Jing Y,Zhu D,Bi Y,et al.Monocyte chemoattractant protein 1-2518 A/G polymorphism and susceptibility to type 2 diabetes in a Chinese population[J].Clin Chim Acta,2011,412(5-6):466-469.
[10] Kaur R,Matharoo K,Arora P,et al.Association of-2518A>G promoter polymorphism in the monocyte chemoattractant protein-1 (MCP-1)gene with type 2 diabetes and coronary artery disease[J].Genet Test MolBiomarkers,2013,17(10):750-755.
[11] Simeoni E,Hoffmann M M,Winkelmann B R,et al.Association between the A-2518G polymorphism in the monocyte chemoattractant protein-1 gene and insulin resistance and Type 2 diabetes mellitus[J].Diabetologia,2004,47(9):1574-1580.
[12] Zietz B,Buchler C,Herfarth H,et al.Caucasian patients with type 2 diabetes mellitus have elevated levels of monocyte chemoattractant protein-1 that are not influenced by the-2518 A-->G promoter polymorphism[J].Diabetes Obes Metab,2005,7(5): 570-578.
(本文编辑:严玮雯)
Association of monocyte chemoattractant protein-1 gene polymorphism with risk of type 2 diabetes mellitus in Han population in Zhejiang province
MA Jiangbo,XU Xin,MA Gaigai,et al. Department of Endocrinology,Zhejiang Provincial People's Hospital, Hangzhou 310009,China
【 Abstract】 Objective To investigate the association of monocyte chemoattractant protein-1(MCP-1)gene rs1024611 (-2518A/G)polymorphisms with risk of type 2 diabetes mellitus(T2DM)in Han population of Zhejiang province. Methods A total of 208 patients with T2DM and 209 healthy control subjects in Han population of Zhejiang province were enrolled in this study.Genotyping wasperformed by polymerase chain reaction-based restriction fragment length polymorphism and subsequently confirmed by DNA sequencing.Odds ratio(OR)and 95%confidence intervals(CI)were calculated for the risk of genotypes and alleles. Results MCP-1 gene polymorphism rs1024611(-2518A/G)was conformed to the Hardy-Weinberg equilibrium.The statistical differences in the G allele(43.7%vs.55.7%,P<0.01)and GG genotype(19.2%vs.33.5%,P<0.01) were found between T2DM patients and controls.The GG genotype was associated with a decreased risk of T2DM(OR=0.201, 95%CI:0.077-0.526,P<0.01). Conclusion The MCP-1 gene rs1024611(-2518A/G)may be associated with T2DM susceptibility in Han population of Zhejiang province;GG genotype may be the protect factor for T2DM and G allele may reduce the risk of T2DM.
Monocyte chemoattractant protein-1 Type 2 diabetes mellitus Single nucleotide polymorphism
310009 杭州,浙江省人民医院内分泌科(马江波、沈洁、黄青华);浙江大学医学院附属儿童医院儿童保健科(许鑫);浙江大学医学院附属第二医院心内科(马改改、施育平)
施育平,E-mail:shiyuping007@hotmail.com不一致,且针对汉族人群的该基因多态性缺少系统性研究,目前仅有Jing等[9]针对江苏地区人群(病例数416)进行过系统研究。笔者拟探讨CCL2 rs1024611基因多态性与浙江局部地区汉族人群T2DM易感性的关系,在不同人群中对该基因多态性与T2DM相关性进行验证,进一步探讨T2DM发生的病理生理机制。
2016-01-18)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种由遗传因素和环境因素共同参与、相互作用所导致的慢性复杂代谢性疾病。近年来一些学者发现许多炎症因子与胰岛素抵抗、T2DM及其并发症的发生、发展密切相关,进而提出了T2DM的炎症学说,认为T2DM是一种慢性非特异性炎症过程[1-4]。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)是炎症趋化因子CC亚族的一员,对各种炎性细胞尤其是单核/巨噬细胞具有趋化激活作用,研究发现MCP-1作为一种胰岛素反应因子,在炎症-胰岛素抵抗-T2DM的病理生理过程中起着重要作用[5]。人类CCL2基因位于染色体17q11.2-q12上,位于远端调控区的SNP位点rs1024611(-2518A/G)能影响MCP-1的表达[6]。近年来有国内外研究报道,MCP-1-2518A/G基因多态性与胰岛素抵抗、T2DM及其并发症相关[7-9],然而研究结果尚

