水杨酸抑制胃癌细胞体外增殖及侵袭转移能力研究
葛曙雄 刘雅辉 张立 李科事 胡岳 王涌
水杨酸抑制胃癌细胞体外增殖及侵袭转移能力研究
葛曙雄 刘雅辉 张立 李科事 胡岳 王涌
目的 探讨水杨酸抑制人胃癌细胞侵袭转移的分子机制。方法 不同浓度水杨酸体外处理胃癌细胞株MGC-803后,采用基质胶黏附试验、迁移试验和Transwell侵袭试验检测胃癌细胞黏附、迁移和侵袭能力的变化;采用荧光定量PCR、Western blot检测细胞黏附相关分子核纤层蛋白(Lamin)、核纤层蛋白C1(LaminC1)、核纤层蛋白B1(LaminB1)、纤连蛋白(FN1)、CD44、整合素A9(ITGA9)、连环蛋白A1(CTNNA1)和E钙粘素(CDH1)表达水平的变化。结果 与空白对照比较,0.5mmol/L和1mmol/L水杨酸体外处理胃癌细胞24h后,胃癌细胞的增殖、黏附、迁移和侵袭能力均受抑制(均P<0.05);Lamin、LaminC1、LaminB1、FN1、CD44、ITGA9和CTNNA1 mRNA表达水平均下降(均P<0.05),CDH1 mRNA表达水平均升高(均P<0.05);LaminB1、FN1、CD44和CTNNA1蛋白表达水平均升高(均P<0.05)。结论 一定浓度的水杨酸可体外抑制胃癌细胞增殖、黏附、侵袭能力,从而抑制胃癌转移,其作用机制可能与调节细胞黏附相关分子的表达水平和抑制胃癌细胞上皮间质转化有关。
水杨酸 胃癌细胞株 侵袭转移 细胞黏附分子
【 Abstract】 Objective To investigate the effects of salicylic acid on adhesion,migration and invasion abilities of gastric cancer cell line and their mechanisms. Methods Human gastric cancer cells were incubated with different concentrations of salicylic acid.The abilities of adhesion,migration and invasion of gastric cancer cells were evaluated with cell adhesion assay, Transwell migration assay and Transwell invasion assay.The mRNA and protein expression levels of cell adhesion moleculars were tested by Real-time RT-PCR and Western blot,respectively. Results Salicylic acid significantly inhibited the proliferation, adhesion,migration and invasion of gastric cancer cells in vitro.The mRNA expression levels of Lamin,LaminC1,LaminB1,FN1, CD44,ITGA9 and CTNNA1 were decreased;however,expression of CDH1 was increased after salicylic acid treatment.While the protein expression levels of LaminB1,FN1,CD44 and CTNNA1 were also decreased(P<0.05). Conclusion Salicylic acid inhibits the proliferation,adhesion,migration and invasion of gastric cancer cell,which is associated with the expression of cell adhesion-related molecules and the resistance to epithelial-mesenchymal transition.
胃癌是常见的恶性肿瘤之一,其发病率在肿瘤中排第4位,病死率列第2位,全球每年大约新增胃癌患者90万[1]。胃癌患者的总体疗效不理想,术后5年生存率不足50%[2],多数患者死于肿瘤复发和转移。因此,胃癌细胞的侵袭转移机制一直是临床研究热点。阿司匹林具有解热、镇痛、抗炎和抑制血小板凝集等作用,研究证实其对直肠癌、乳腺癌等多种恶性肿瘤具有一定的预防和治疗作用。水杨酸作为阿司匹林的主要代谢产物,亦被证实可抑制肿瘤细胞的增殖,但其作用机制尚不明确。本研究旨在探讨一定浓度的水杨酸对胃癌细胞体外侵袭转移能力的影响及其可能的分子机制,以期为水杨酸的抗肿瘤应用提供依据,现报道如下。
1 材料和方法
1.1 材料 人胃癌细胞株MGC-803购自美国ATCC细胞库;水杨酸(国药集团化学试剂有限公司,配制成0.1mol/L的母液);MTS检测试剂盒购自北京Promega公司;Matrigel基质胶和Transwell小室购自美国Corning公司;反转录试剂盒和荧光定量PCR试剂盒均购自日本Takara公司;LAMB1、FN1、CD44和CTNNA1抗体均购自英国Abcam公司;β-actin多克隆抗体和IgG二抗购自康为世纪公司;Hochest染色试剂盒购自碧云天生物科技有限公司。
1.2 细胞增殖试验 采用MTS法检测细胞增殖能力。将生长状态良好的对数生长期胃癌细胞的密度调整为3×104个/ml,以100μl/孔接种于96孔板,细胞贴壁后加入水杨酸,浓度分别为0、0.5、1、1.5、2、2.5、3mmol/L,分别设为空白对照组、0.5mmol/L组、1mmol/L组、1.5mmol/ L组、2mmol/L组、2.5mmol/L组、3mmol/L组,每组设3个复孔;继续培养24h后,去液、清洗,重新加入100μl培养液和20μl MTS反应液,酶标仪490nm波长处测吸光度A值,计算细胞增殖抑制率[细胞增殖抑制率=(1-实验组A值/空白对照组A值)×100%]。
1.3 细胞黏附试验 用无血清的培养基将Matrigel基质胶稀释4倍,按80μl/孔铺入96孔板,风干过夜;次日,每孔加入100μl无血清培养基放置1h,活化Matrigel基质胶;收集对照组、0.5 mmol/L组、1 mmol/L组水杨酸处理24h后的胃癌细胞,每孔接种8 000个细胞,设置3个复孔,共9孔,培养90min;去液清洗后,每孔加入100μl甲醇固定15min,Hochest染色5min,显微镜下观察(×200),选取4个不同视野计数黏附细胞数量。
1.4 细胞迁移试验 消化收集对照组、0.5 mmol/L组、1 mmol/L组水杨酸处理24h后的胃癌细胞,按每孔5×104个细胞接种于Transwell上室;上室加入200μl无血清培养基,下室600μl含10%胎牛血清的培养基;孵育24h后,湿棉棒擦去上室内的细胞,甲醇固定上室基底膜下层细胞20min,0.1%结晶紫染色20min,显微镜下观察(×200);后用33%醋酸脱色,570nm波长处测定吸光度A值,计算细胞迁移抑制率[细胞迁移抑制率=(对照组A值-实验组A值)/空白对照组A值×100%]。
1.5 细胞侵袭试验 采用Transwell检测细胞侵袭能力。Matrigel基质胶用无血清培养基进行1:8稀释,加入Transwell上室,每孔75μl稀释胶,风干过夜;收集对照组、0.5 mmol/L组、1 mmol/L组水杨酸处理24h后的胃癌细胞,按每孔5×104个细胞接种于上室,加入200μl无血清培养基,下室加入600μl含10%胎牛血清的培养基;孵育72h,湿棉棒擦去上室细胞和Matrigel基质胶,甲醇固定上室基底膜下层细胞20min,0.1%结晶紫染色20min,显微镜下观察(×200);33%醋酸脱色,570nm波长处测定A值。
1.6 细胞黏附相关基因mRNA的表达水平检测 采用荧光定量PCR法。分别提取对照组、0.5 mmol/L组、1 mmol/L组水杨酸处理12 h后的胃癌细胞总RNA,逆转录合成cDNA;选取GAPDH作为内参,分别检测核纤层蛋白(Lamin)、核纤层蛋白C1(LaminC1)、核纤层蛋白B1(LaminB1)、纤连蛋白(FN1)、CD44、整合素A9(ITGA9)、连环蛋白A1(CTNNA1)和E钙粘素(CDH1)的mRNA表达。引物序列及产物长度见表1;反应条件为:95℃30 s,95℃5s,60℃30s,40个循环;采用2-ΔΔCt方法计算mRNA表达水平。

表1 引物序列及产物长度
1.7 细胞黏附相关蛋白的表达水平法检测 采用Western blot法。分别提取对照组、0.5mmol/L组、1mmol/L组水杨酸处理24h后的胃癌细胞总蛋白;蛋白样品经电泳、转膜、封闭后,增强化学发光法曝光、显影;应用Image J图像分析软件对图像的灰度值进行分析,以βactin作为内参,检测LaminB1、FN1、CD44和CTNNA1的蛋白表达水平(目的蛋白相对表达水平=目的蛋白条带灰度值/β-actin条带灰度值)。
1.8 统计学处理 应用SPSS18.0统计软件;计量资料以表示,多组间比较采用方差分析,两两比较采用LSD-t检验。
2 结果
2.1 不同浓度水杨酸对胃癌细胞增殖的抑制率 见图1。
由图1可见,细胞增殖实验中,0.5mmol/L和1mmol/L水杨酸处理即可明显抑制胃癌细胞增殖,1.5 mmol/L水杨酸处理后细胞增殖抑制率超过50%。因此,本研究选择0.5mmol/L和1mmol/L浓度的水杨酸处理胃癌细胞24h作为后续实验的处理条件。

图1 不同浓度水杨酸对胃癌细胞增殖的抑制率
2.2 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附能力比较 细胞黏附试验中,与空白对照组细胞黏附数量[(121.00±2.65)个/视野]相比,0.5mmol/L组[(88.00± 1.53)个/视野]和1mmol/L组[(44.00±2.00)个/视野]均减少(均P<0.05),且1mmol/L组更少于0.5mmol/L组(P<0.05)。3组显微镜下细胞黏附数量比较见图2(见插页)。
2.3 0.5mmol/L组、1mmol/L组及空白对照组细胞迁移能力比较 细胞迁移试验中,0.5mmol/L组细胞迁移抑制率为(10.00±3.85)%,1mmol/L组为(12.00±3.61)%,两组比较差异有统计学意义(P<0.05)。3组显微镜下细胞迁移能力比较见图3(见插页)。
2.4 0.5mmol/L组、1mmol/L组及空白对照组细胞侵袭能力比较 细胞侵袭试验中,与空白对照组A值(0.22± 0.01)相比,0.5mmol/L组(0.18±0.00)和1mmol/L组(0.15±0.00)均降低(均P<0.05);且1mmol/L组更低于0.5mmol/L组(P<0.05)。3组显微镜下细胞侵袭能力比较见图4(见插页)。
2.5 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附相关基因mRNA表达水平比较 见表2。
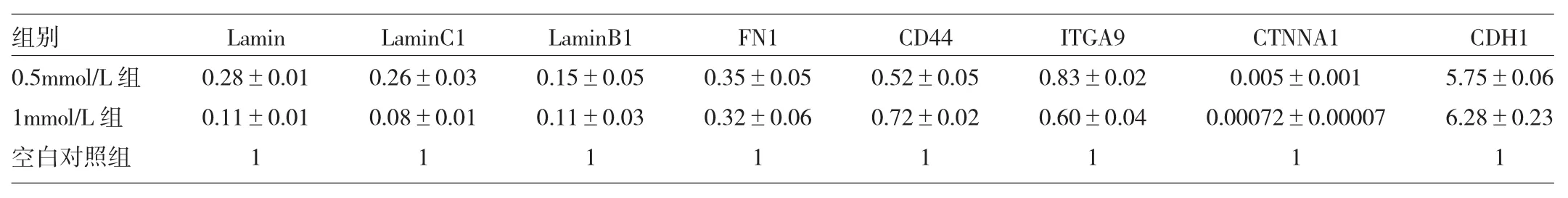
表2 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附相关基因mRNA表达水平比较
由表2可见,0.5mmol/L组、1mmol/L组细胞Lamin、LaminC1、LaminB1、FN1、CD44、ITGA9和CTNNA1 mRNA的表达水平均低于空白对照组(均P<0.05),CDH1 mRNA的表达水平均高于空白对照组(均P<0.05);且0.5mmol/L组与1mmol/L组比较差异均有统计学意义(均P<0.05)。
2.6 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附相关蛋白表达水平比较 见表3。

表3 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附相关蛋白表达水平比较
由表3可见,0.5mmol/L组、1mmol/L组细胞LaminB1、FN1、CD44、CTNNA1蛋白表达水平均低于空白对照组(均P<0.05);0.5mmol/L组与1mmol/L组细胞FN1蛋白表达水平比较有统计学差异(P<0.05),LaminB1、CD44、CTNNA1蛋白表达水平比较均无统计学差异(均P>0.05)。3组细胞黏附相关蛋白表达水平比较条带图见图5。

图5 0.5mmol/L组、1mmol/L组及空白对照组细胞黏附相关蛋白表达水平比较条带图
3 讨论
肿瘤转移被认为是大多数肿瘤患者病死的主要原因,它由一系列连续和相关的步骤组成,包括肿瘤细胞从原始位置的分离,侵入细胞外基质,血管和淋巴管的内渗,分散再循环,依附于转移组织的血管内皮细胞,外溢和定植于转移灶[9]。肿瘤转移与细胞黏附、迁移和侵袭密切相关。肿瘤细胞与细胞外基质和血管内皮细胞的黏附是肿瘤转移的起始点。因此,抑制肿瘤细胞的黏附和迁移能力或可有效降低肿瘤转移率,提高肿瘤患者的生存率。本研究结果表明,水杨酸以浓度梯度的方式抑制胃癌细胞的体外增殖,并明显抑制胃癌细胞的体外侵袭转移能力。
水杨酸作为一种抗炎药物在结肠癌、乳腺癌、直肠癌和胃癌等肿瘤中已展现出一定的抗肿瘤作用。它可以激活p38MAP激酶压力通路和抑制ERK生存通路来促进肿瘤细胞的凋亡,另外还可以激活NF-κB促进细胞凋亡[10]。此外,水杨酸通过抑制肿瘤细胞的增殖和影响肿瘤的代谢进而发挥抗肿瘤作用。Torimura等[11]研究发现,抑制整合素整合素(ITGA)及其下游的信号通路能抑制肝癌细胞的侵袭、转移。本研究结果进一步证实,水杨酸抑制胃癌细胞的体外转移可能与下调细胞黏附分子Lamin、LaminC1、LaminB1、FN1、CD44、ITGA9的表达水平有关。再者,上皮间质转换(EMT)在肿瘤的转移中扮演不可或缺的作用。EMT发生的主要标志是CDH的表达水平下调,基质降解蛋白酶和间质相关蛋白(波形蛋白和N钙粘素)的表达水平上调[12]。另外,有研究发现连环蛋白(CTNN)是促进EMT的重要信号分子[13]。本研究结果表明,水杨酸可通过诱导胃癌细胞CDH1以及下调CTNNA1的表达水平来抑制EMT过程,从而发挥抗肿瘤转移的作用。因此,抑制EMT的发生可能是水杨酸抗肿瘤转移的又一作用机制。
综上所述,一定浓度的水杨酸可体外抑制胃癌细胞的增殖、黏附、侵袭能力,从而抑制胃癌转移。水杨酸发挥抗肿瘤转移的机制可能与下调细胞黏附分子的表达水平和抑制胃癌细胞EMT有关,其具体机制还需进一步深入研究。
[1]DeSantis C E,Lin C C,Mariotto A B.Cancer treatment and survivorship statistics,2014[J].CACancerJ Clin,2014,64(4):252-271.
[2]Wen L,Chen X Z,Yang K.Prognostic value of cancer stem cell marker CD133 expression in gastric cancer:a systematic review [J].PLoS One,2013,8(3):e59154.
[3]Langley RE.Clinicalevidence for the use ofaspirin in the treatment ofcancer[J].Ecancermedicalscience,2013,7(1):297.
[5]Reader J,Holt D,Fulton A.Prostaglandin E 2 E P receptors as therapeutic targets in breast cancer[J].Cancer Metastasis Rev, 2011,30(3-4):449-463.
[6]Pan MR,Chang H C,Hung WC.Non-steroidalanti-inflammatory drugs suppress the ERKsignaling pathway via block ofRas/c-Raf interaction and activation of MAP kinase phosphatases[J].Cell Signal,2008,20(6):1134-1141.
[7]Borthwick G M,Johnson AS,Partington M,et al.Therapeutic levels of aspirin and salicylate directly inhibit a model of angiogenesis through a Cox-independent mechanism[J].FASEB J,2006,20(12): 2009-2016.
[8]Dovizio M,Bruno A,TacconelliS,et al.Mode ofaction ofaspirin as a chemopreventive agent[J].Recent Results Cancer Res,2013,191 (1):39-65.
[9]Leber M F,Efferth T.Molecular principles of cancer invasion and metastasis[J].Int J Oncol,2009,34(1):881-895.
[10]Dovizio M,Bruno A,Tacconelli S,et al.Mode of action of aspirin as a chemopreventive agent[J].Recent Results Cancer Res, 2013,191(1):39-65.
[11]Torimura T,Ueno T,Kin M,et al.Integrin alpha6beta1 plays a significant role in the attachment of hepatoma cells to laminin[J].J Hepatol,1999,31(4):734-740.
[12]Guarino M.Epithelial-mesenchymal transition and tumour invasion[J].Int J Biochem CellBiol,2007,39(12):2153-2160.
[13]Thiery J P,Sleeman J P.Complex networks orchestrate epithelial-mesenchymaltransitions[J].Nat Rev MolCell Biol,2006,7(2): 131-142.
(本文编辑:李媚)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
Effect of salicylic acid on adhesion,migration and invasion of human gastric cancer cells
GE Shuxiong,LIU Yahui,ZHANG Li,et al.Medical School of Ningbo University,Ningbo 315211,China
Salicylic acid Gastric cancer cell line Migration and invasion Cell adhesion molecules
2016-06-09)
315211 宁波大学医学院(葛曙雄、张立、李科事);宁波市第一医院重点实验室(刘雅辉),普外科(胡岳、王涌)
王涌,E-mail:robinwang9401@sina.com

