温度骤降对光滑河兰蛤的胁迫效应
宁军号,常亚青,刘 伟,宋 坚,石明明
( 大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连116023 )
温度骤降对光滑河兰蛤的胁迫效应
宁军号,常亚青,刘 伟,宋 坚,石明明
( 大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连116023 )
设置3种温度骤降模式,研究光滑河兰蛤肌肉中可溶性蛋白、可溶性糖含量及超氧化物歧化酶、过氧化氢酶、总抗氧能力、碱性磷酸酶、酸性磷酸酶和溶菌酶活力。试验结果表明,3种降温模式对试验蛤肌肉中各生化指标均有显著影响(P< 0.05)。试验过程中,可溶性蛋白和可溶性糖含量均能维持初始水平。大幅降温和中幅降温组中超氧化物歧化酶和过氧化氢酶活力在1 h内显著降低,过氧化氢酶活力在3 h后开始趋于稳定;小幅降温组超氧化物歧化酶和过氧化氢酶活力随胁迫时间延长均呈升高-降低-再升高的波动变化;总抗氧能力在3种降温模式中均呈波动变化。碱性磷酸酶和酸性磷酸酶活力在大幅降温组和中幅降温组均呈波动变化;在小幅降温组,二者均在1 h内显著降低,6 h后趋于稳定;溶菌酶活力在3种降温模式中均呈波动变化,6 h后均出现大幅波动。研究结果显示,温度骤降会影响机体生理功能和免疫力,可能是诱发水产动物疾病的原因之一。
光滑河兰蛤; 温度骤降; 可溶性蛋白; 可溶性糖; 免疫因子
光滑河兰蛤(Potamocorbulalaevis),俗称海砂子、粳米蚬子[1],是一种小型经济贝类,喜群居埋栖生活,生活在泥沙滩潮间带,20 ℃生长较快,10 ℃几乎停止生长,温度骤变可致其成体大量死亡[1]。广泛分布于我国南北沿海,可作为养殖家禽、对虾的优质鲜活饵料,是一种具有开发前景的双壳贝类。近年来,酷渔滥捕、海洋污染日趋严重,加之繁殖保护不力,光滑河兰蛤自然资源日渐枯竭[2-3]。研究表明,环境因子变化是引起养殖动物应激反应使其免疫抗病能力下降的主要诱因[4]。目前,温度骤降对光滑河兰蛤生化指标影响尚未见报道,为此笔者对光滑河兰蛤进行了急性温度胁迫试验,研究了温度骤降后不同应激时间肌肉中可溶性蛋白、可溶性糖含量及超氧化物歧化酶、过氧化氢酶、总抗氧能力、碱性磷酸酶、酸性磷酸酶和溶菌酶活力,以探讨温度骤降对光滑河兰蛤生理功能及抗氧化能力的影响,为保护及合理开发利用光滑河兰蛤自然资源提供理论依据。
1 材料与方法
1.1 材料
试验用光滑河兰蛤采自大连庄河海域,壳形完整,活力良好,平均体质量为(2.0±0.3) g。试验蛤运回实验室暂养,海水盐度31±1,温度(12±0.05) ℃,pH为8±0.05。暂养期间连续充气,投喂螺旋藻粉和酵母粉,日换水1次,7 d后运往低温实验室,饥饿24 h后开始试验。
1.2 方法
1.2.1 温度控制
试验蛤放入70 L 白色聚乙烯水槽中,每槽100粒。试验前将水温以1 ℃/d[5]由12 ℃分别降至设定温度8、4、2 ℃,每个温度点维持48 h取样作为对照。试验设置3种骤降模式:8 ℃→ -2 ℃(大幅降温组)、4 ℃→ -2 ℃(中幅降温组)及2 ℃→ -2 ℃(小幅降温组)。海水温度由设定温度8、4、2 ℃在2 h内骤降至-2 ℃,分别在降至-2 ℃(冰点)0、1、3、6、9、24 h时解剖取样。每次随机取蛤5粒,测量其壳长和壳高,取肌肉,称量质量后置于4 ℃保存待用,每组设3个平行。
1.2.2 样品制备及测定
剪碎试验蛤肌肉组织,称量质量后放入研磨器中,加入生理盐水在冰上制成10%的组织匀浆,4 ℃、2000 r/min离心10 min,收集上清液,4 ℃保存,待测。所测指标均采用试剂盒(南京建成生物工程研究所)及Epoch 酶标仪(美国BioTek公司) 进行测定[6-7],可溶性糖含量采用苯酚浓硫酸法进行测定[8]。
1.3 数据处理
利用Excel 2003对数据进行初步整理并做图,SPSS 17.0对数据进行单因素方差分析,显著性水平设为0.05,数值以平均值±标准差表示。
2 结果与分析
2.1 温度骤降对光滑河兰蛤肌肉中可溶性蛋白含量的影响
大幅骤降模式对光滑河兰蛤肌肉中可溶性蛋白含量有显著影响(P<0.05),中幅和小幅2种骤降模式对其可溶性蛋白含量无显著影响(P>0.05)。大幅骤降模式中,0 h时可溶性蛋白含量最低,胁迫1 h时可溶性蛋白含量显著增加(P<0.05),随着胁迫时间的延长,可溶性蛋白含量变化不明显,但维持在较高水平(图1)。
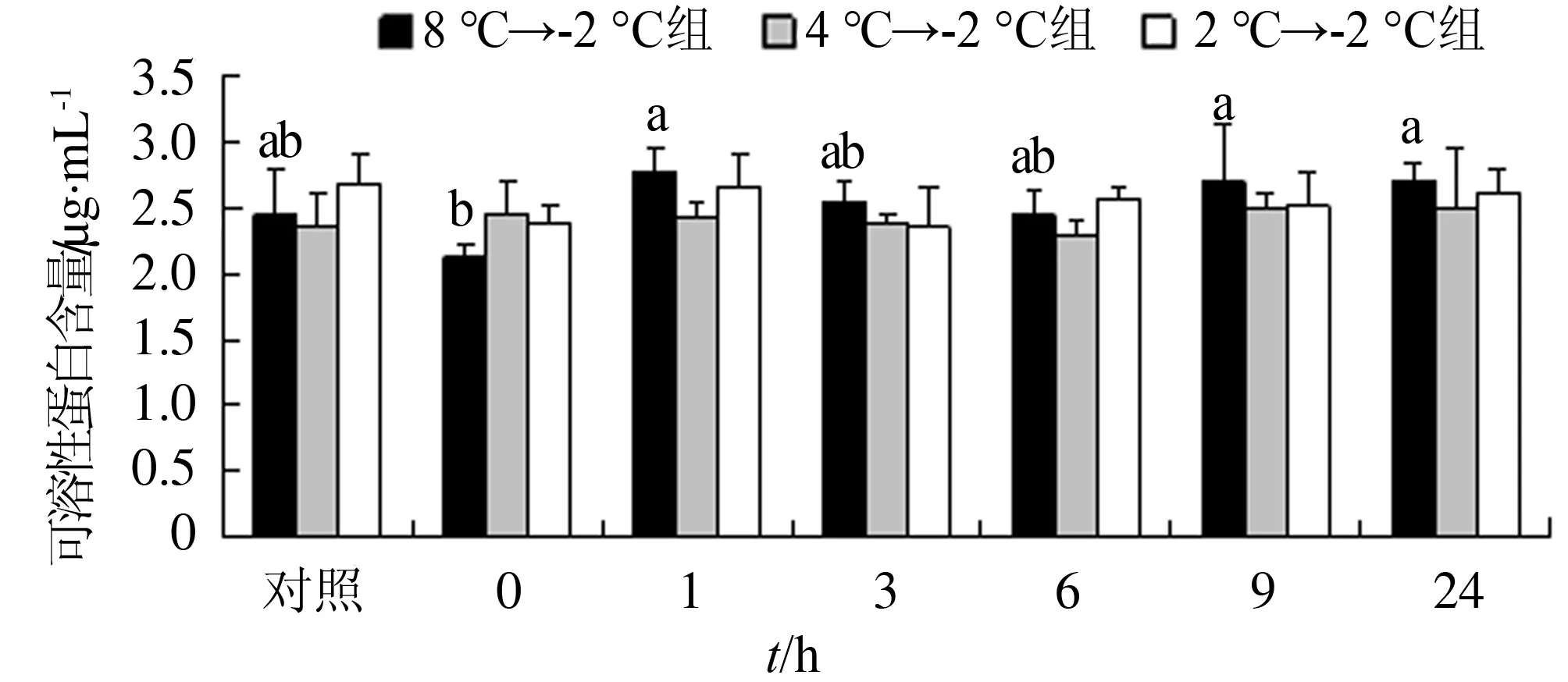
图1 温度骤降对光滑河兰蛤肌肉中可溶性蛋白含量的影响
注:相同处理组标有不同字母表示差异显著(P< 0.05),含有相同字母表示差异不显著.下同.
2.2 温度骤降对光滑河兰蛤肌肉中可溶性糖含量的影响
大幅、中幅2种骤降模式中,可溶性糖含量随胁迫时间变化显著(P<0.05),且均呈升高-降低-再升高趋势,其最低值分别出现在胁迫3 h和6 h,最高值分别在胁迫1 h和24 h;小幅骤降模式中,可溶性糖含量除在胁迫6 h时显著升高(P<0.05),其余均维持较低且不显著水平(P>0.05)(图2)。

图2 温度骤降对光滑河兰蛤肌肉中可溶性糖含量的影响
2.3 温度骤降对光滑河兰蛤肌肉中超氧化物歧化酶含量的影响
3种骤降模式对光滑河兰蛤肌肉中超氧化物歧化酶含量均有显著影响(P<0.05)。大幅和中幅2种骤降模式中超氧化物歧化酶含量均呈降低-升高-再降低趋势,其最低值分别出现在胁迫9 h和24 h,最高值分别出现在胁迫6 h和3 h;在小幅骤降模式中,超氧化物歧化酶含量呈升高-降低-再升高趋势,其最低值和最高值分别出现在胁迫6 h和3 h。在中幅骤降模式中,各取样点超氧化物歧化酶含量均明显高于另外2组(图3)。

图3 温度骤降对光滑河兰蛤肌肉中超氧化物歧化酶活力的影响
2.4 温度骤降对光滑河兰蛤肌肉中过氧化氢酶含量的影响
3种骤降模式对光滑河兰蛤肌肉中过氧化氢酶含量均有显著影响(P<0.05)。大幅和中幅2个骤降模式中过氧化氢酶含量均呈先降后升趋势,其最低值分别出现在胁迫0 h和9 h,最高值分别出现在胁迫24 h和0 h;在小幅骤降模式中,过氧化氢酶含量呈升高-降低-再升高趋势,其最低值和最高值分别出现在胁迫6 h和24 h,且在该骤降模式中,过氧化氢酶含量在胁迫9 h和24 h明显高于另外2组(图4)。
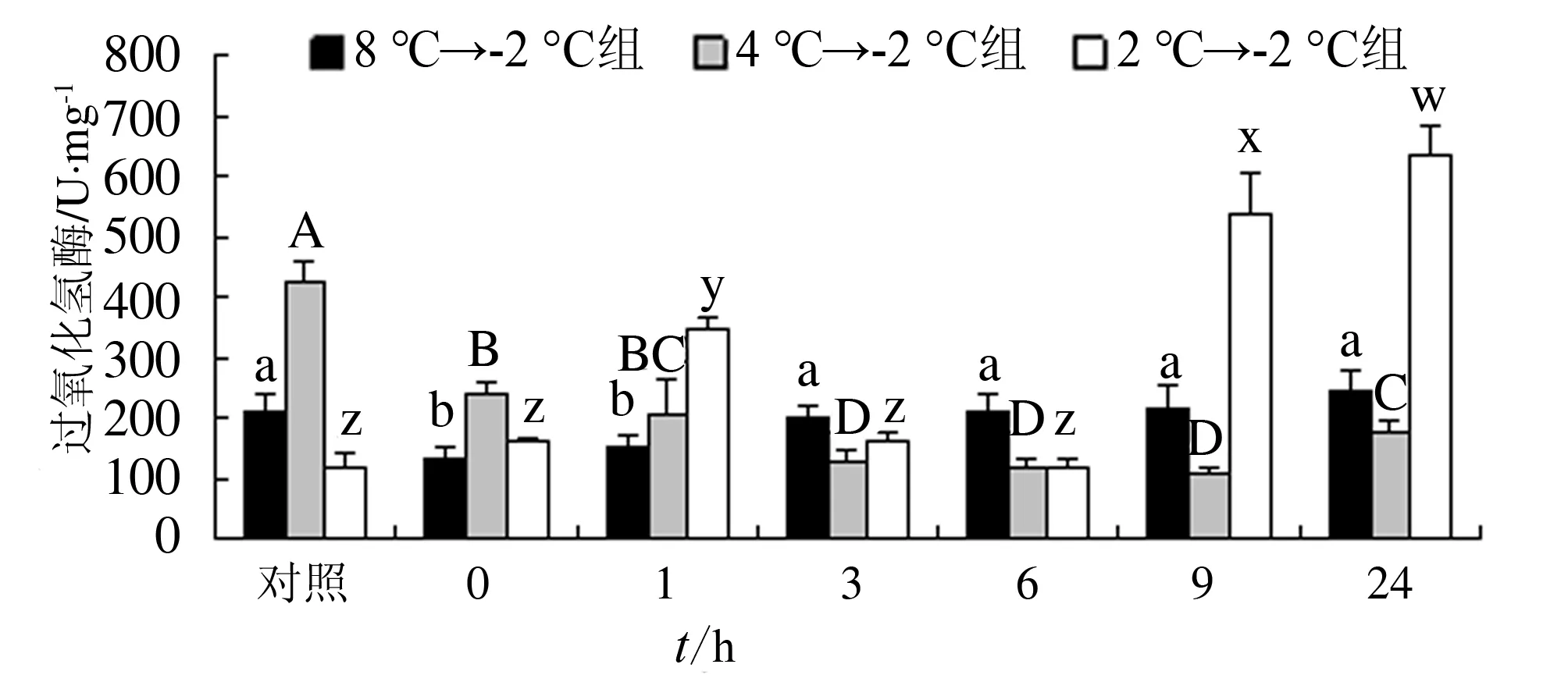
图4 温度骤降对光滑河兰蛤肌肉中过氧化氢酶活力的影响
2.5 温度骤降对光滑河兰蛤肌肉中总抗氧能力含量的影响
3种骤降模式对光滑河兰蛤肌肉中总抗氧能力含量均有显著影响(P<0.05)。大幅和中幅2种骤降模式中总抗氧能力含量均呈升高-降低-再升高-再降低的波动趋势,其最低值分别出现在胁迫0 h和24 h,最高值分别出现在胁迫1 h和6 h;在小幅骤降模式中,总抗氧能力含量呈升高-降低-再升高趋势,其最低值和最高值分别出现在胁迫9 h和3 h(图5)。
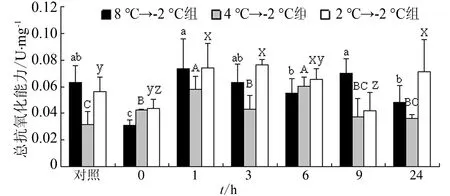
图5 温度骤降对光滑河兰蛤肌肉中总抗氧能力活力的影响
2.6 温度骤降对光滑河兰蛤肌肉中碱性磷酸酶含量的影响
3种骤降模式对光滑河兰蛤肌肉中碱性磷酸酶含量均有显著影响(P<0.05)。中幅和小幅2种骤降模式中碱性磷酸酶含量均呈降低-升高-再降低趋势,其最低值分别出现在胁迫6 h和3 h,最高值均现在胁迫9 h;在大幅骤降模式中,碱性磷酸酶含量呈升高-降低-再升高-再降低的波动趋势,其最低值和最高值分别出现在胁迫6 h和9 h(图6)。

图6 温度骤降对光滑河兰蛤肌肉中碱性磷酸酶活力的影响
2.7 温度骤降对光滑河兰蛤肌肉中酸性磷酸酶含量的影响
3种骤降模式对光滑河兰蛤肌肉中酸性磷酸酶含量均有显著影响(P<0.05)。中幅和小幅2种骤降模式中酸性磷酸酶含量均呈降低-升高-再降低趋势,其最低值分别出现在胁迫6 h和3 h,最高值均现在胁迫9 h;在大幅骤降模式中,酸性磷酸酶含量呈升高-降低-再升高-再降低的波动趋势,其最低值和最高值分别出现在胁迫0 h和9 h(图7)。

图7 温度骤降对光滑河兰蛤肌肉中酸性磷酸酶活力的影响
2.8 温度骤降对光滑河兰蛤肌肉中溶菌酶含量的影响
3种骤降模式对光滑河兰蛤肌肉中溶菌酶含量均有显著影响(P<0.05)。大幅和小幅2种骤降模式中溶菌酶含量均呈波动变化,且均维持在较低水平;在中幅骤降模式中,溶菌酶含量呈降低-升高-再降低的波动趋势,其最低值和最高值分别出现在胁迫1 h和9 h,且在该模式中,溶菌酶含量在胁迫6、9、24 h显著高于另外2组(P<0.05)(图8)。

图8 温度骤降对光滑河兰蛤肌肉中溶菌酶活力的影响
2.9 不同降温幅度对光滑河兰蛤各生化指标的影响
不同降温幅度对光滑河兰蛤肌肉中可溶性蛋白和总抗氧能力含量无显著影响(P>0.05)。在大幅降温组,酸性磷酸酶含量显著高于另外两组(P<0.05);在中幅降温组,超氧化物歧化酶和溶菌酶含量均显著高于另外两组(P<0.05);在小幅降温组,可溶性糖和碱性磷酸酶含量均显著低于其他两组,而过氧化氢酶含量显著高于其他两组(P<0.05)(表1)。

表1 不同降温幅度对光滑河兰蛤各生化指标均值的影响 U/mg
3 讨 论
3.1 温度骤降对光滑河兰蛤肌肉中可溶性蛋白、可溶性糖含量的影响
蛋白质在生物体内可作为结构蛋白和调控蛋白,既是细胞的重要组分又在生理代谢中发挥重要作用[9]。可溶性蛋白中存在很大比例与代谢、免疫相关的酶类,可提高水产动物自我保护、调控和抵抗外界胁迫能力[10]。相关研究表明,低温驯化或温度骤降对水产动物体内可溶性蛋白含量有显著影响[7-8, 10-11]。本研究中,大幅降温对光滑河兰蛤肌肉中可溶性蛋白含量有显著影响,而中幅降温和小幅降温试验蛤肌肉中可溶性蛋白含量维持初始水平,表明大幅变温对水产动物造成更大伤害,这在仿刺参(Apostichopusjaponicus)温度胁迫中已得到了充分验证[8,12]。在温度大幅骤降试验中光滑河兰蛤可溶性蛋白在温度降至冰点很短时间内(1 h)显著升高,随后逐渐降低并维持初始水平,表明光滑河兰蛤遭遇外界温度大幅骤降时能够通过自身调节,维持体内可溶性蛋白含量的稳定。可溶性蛋白含量在短时间内增加,可能是试验蛤快速代谢产生了较多调控蛋白(如酶类)以适应外界温度变化,增强自身抗寒能力[7,13]。
糖类是生物有机体最主要的能源物质,同时作为一类重要的信号分子[7,10]。水产动物体内可溶性糖含量在不同低温胁迫模式下均有明显变化[7-8,10-11],本研究结果表明,可溶性糖可作为衡量水产动物受温度胁迫程度的重要指标。本研究中,3种骤降模式可溶性糖含量均在较短时间内显著升高,表明试验蛤通过调节可溶性糖含量以适应外界骤变环境,Ning等[7,10]在研究温度骤降对刺参、锯缘青蟹(Scyllaserrata)的胁迫中有类似结论。试验结束时,大幅骤降和小幅骤降组可溶性糖含量均能维持初始水平,推测大幅骤降模式下受试动物处于极度应激状态;而中幅骤降组可溶性糖含量显著升高,表明水产动物在低温环境中再次遭遇快速大幅降温机体可能受到更大伤害仿刺参在温度骤降过程中也发现了相同现象[7-8]。
3.2 温度骤降对光滑河兰蛤肌肉中非特异性免疫因子的影响
在降温胁迫下,生物体内超氧阴离子自由基增多,严重破坏机体细胞膜系统[14];而在进化过程中,生物体内形成一套有效清除活性氧自由基的抗氧化体系,超氧化物歧化酶和过氧化氢酶是这套抗氧化体系中相互关联的抗氧化酶,超氧化物歧化酶可将生物体内产生的活性氧自由基转化为H2O2,再经过氧化氢酶催化H2O2产生H2O和O2[6,15]。生物受到胁迫时,体内抗氧化酶活力因清除活性氧自由基而下降,这标志着机体清除活性氧自由基的能力降低[16]。因此,生物体内超氧化物歧化酶和过氧化氢酶等抗氧化酶的动态变化可反映机体组织氧化损伤情况[17-19]。
本研究中,温度骤降初期光滑河兰蛤肌肉中超氧化物歧化酶和过氧化氢酶含量呈相似变化趋势,大幅骤降和中幅骤降组在1 h内显著降低,表明试验蛤体内产生了较多活性氧自由基;而超氧化物歧化酶和过氧化氢酶含量在小幅骤降组1 h内显著升高,从而有效清除机体内自由基,表现为主动适应环境变化[6]。但这种上升维持时间较短,随应激时间延长而逐渐降低,洪美玲等[16]在对中华绒螯蟹(Eriocheirsinensis)的研究中也有相似报道。随着胁迫时间延长,中幅骤降组中,试验蛤超氧化物歧化酶含量显著升高,明显高于另外两组,表明中幅骤降模式可能对水产动物造成的伤害更大。试验蛤超氧化物歧化酶含量在大幅骤降和小幅骤降组中呈波动变化趋势,凡纳滨对虾(Litopenaeusvannamei)、中华绒螯蟹在温度胁迫过程中,超氧化物歧化酶含量也会发生明显波动[20-21]。抗氧化酶含量明显波动是对外界环境剧烈变化的应激反应,表明水产动物可能正在承受较大伤害,Ning等[7]研究温度骤降对仿刺参胁迫效应也得出了相似论断。过氧化氢酶含量在大幅骤降和中幅骤降组随胁迫时间延长有所升高,但维持在较低水平,表明大幅度温度骤降对机体抗氧化酶有强烈抑制作用。3种降温模式下,总氧化能力随胁迫时间延长呈波动变化,短时间达到最高值,并能在6 h内维持在较高水平,表明温度骤降对光滑河兰蛤造成较大伤害,但短时间内试验蛤可通过调节体内抗氧化能力来适应外界环境变化。
磷酸酶既是生物体内重要代谢调控酶,也是溶酶体的标志酶,存在于吞噬细胞内,能够水解并清除侵入体内的外源物,增强机体防御功能[22-23]。本研究3种降温模式中,酸性磷酸酶受温度胁迫均呈波动变化,且均在9 h达到最高值,表明水产动物体内酸性磷酸酶对外界温度变化敏感,但不总是随应激时间延长而降低。孙金辉等[24]研究温度骤降对凡纳滨对虾仔虾胁迫过程中,酸性磷酸酶活力随胁迫时间延长而不断降低,这与本试验结果略有不同。碱性磷酸酶在降温初期(1 h内)均显著降低,且同样在9 h达到最高值,这与酸性磷酸酶的变化趋势相同,表明水产动物在受到外界环境胁迫时,体内酸性磷酸酶和碱性磷酸酶活力受到抑制,仍表现出积极响应外界环境变化的倾向。磷酸酶在室温条件下极不稳定,这也是磷酸酶容易偏低的原因。
溶菌酶代表了一系列酶,是广泛存在于脊椎动物、无脊椎动物、植物和细菌中重要的非特异性免疫因子[25]。溶菌酶作为水产动物血淋巴细胞酶系统的重要物质基础,可反映机体非特异性免疫水平的变化[26-27]。本研究中,试验蛤肌肉中溶菌酶活力在短时间内显著升高,增强自身免疫力抵抗外界不良环境;随着应激时间的延长,试验蛤肌肉中溶菌酶活力开始下降或大幅波动,表明机体免疫力下降,进而可能引起超氧化物歧化酶、过氧化氢酶等相关免疫指标发生变化,强俊等[27]研究急性温度应激对尼罗罗非鱼(Oreochromisniloticus)幼鱼生化指标影响时,亦得出了相似结论。
[1] 孙晋廷. 光滑河兰蛤Potamocorbulalaevis(Hinds) 群体消长规律的初步研究[J]. 海洋湖沼通报, 1988, 10(4):62-68.
[2] 赵匠, 李霞东. 温度对黑龙江河兰蛤胚胎发育的影响[J]. 北京师范大学学报:自然科学报,1990, 21(4): 97-100.
[3] 徐镜波, 郑顺福. 温度和酚对光滑河兰蛤的影响[J]. 生态科学, 1992,11(2):70-74.
[4] Le Moullac G, Haffner P. Environmental factors affecting immune responses in Custacea[J]. Aquaculture, 2000, 191 (1/3):121-131.
[5] Gao F, Yang H S, Xu Q, et al. Effect of water temperature on digestive enzyme activity and gut mass in sea cucumberApostichopusjaponicus(Selenka), with special reference to aestivation[J]. Chin J Oceanol Limnol, 2009, 27(4):714-722.
[6] 刘伟, 常亚青, 丁君. 温度缓降和骤降对刺参“水院1号” 和大连养殖群体非特异性免疫影响的初步研究[J]. 水产学报, 2013, 37(9):1342-1348.
[7] Ning J H, Chang Y Q, Liu W, et al. Stress responses to mild and acute temperature decrease for two strains of sea cucumberApostichopusjaponicus[J]. Aquaculture, 2015(448):552-563.
[8] 王晓燕, 常亚青, 丁君, 等. 降温对刺参免疫酶、可溶性蛋白及可溶性糖影响的初步研究[J]. 农学学报, 2012, 2(4):44-49.
[9] Taylor S S, Kornev A P. Protein kinases: evolution of dynamic regulatory proteins[J]. Trends Biochem Sci, 2011, 36(2):65-77.
[10] 孔祥会, 王桂忠, 李少菁, 等. 低温驯化对锯缘青蟹可溶性蛋白与可溶性糖的影响[J]. 厦门大学学报:自然科学版, 2006, 45(2):257-260.
[11] 孔祥会, 边中春, 王桂忠, 等. 低温驯化对锯缘青蟹可溶性蛋白与可溶性糖的影响[J]. 河南师范大学学报:自然科学版, 2005, 33(3):97-101.
[12] Dong Y W, Dong S L, Ji T T. Effect of different thermal regimes on growth and physiological performance of the sea cucumberApostichopusjaponicusSelenka[J]. Aquaculture, 2008, 275(1/4):329-334.
[13] 孔祥会, 张红绪, 王桂忠, 等. 锯缘青蟹可溶性蛋白与可溶性糖的季节变化[J]. 河南师范大学学报:自然科学版, 2008, 36(1):99-102.
[14] Fearman J, Moltschaniwskyj N A. Warmer temperatures reduce rates of gametogenesis in temperate mussels,Mytilusgalloprovincialis[J]. Aquaculture, 2010, 305(1/4):20-25.
[15] 孙虎山, 李光友. 栉孔扇贝血淋巴中超氧化物歧化酶和过氧化氢酶活性及其性质的研究[J]. 海洋与湖沼, 2000, 31(3):259-265.
[16] 洪美玲, 陈立侨, 顾顺樟, 等. 不同温度胁迫方式对中华绒螯蟹免疫化学指标的影响[J]. 应用与环境生物学报, 2007, 13(6):818-822.
[17] 宋林生, 苏建国, 崔朝霞,等. 中华绒螯蟹(Eriocheirsinensis)幼蟹上岸病的免疫学研究[J]. 海洋与湖沼, 2002, 33(6):657-661.
[18] Finaud J, Lac G, Filaire E. Oxidative stress:relationship with exercise and training[J].Sports Medicine, 2006, 36(4):327-358.
[19] Aksu I, Topcu A, Camsari U M, et al. Effect of acute and chronic exercise on oxidant-antioxidant equilibrium in rat hippocampus, prefrontal cortex and striatum[J]. Neuroscience Letters, 2009, 452(3): 281-285.
[20] 宋林生, 季延宾, 蔡中华, 等. 温度骤升对中华绒螯蟹(Eriocheirsinensis)几种免疫化学指标的影响[J]. 海洋与湖沼, 2004, 35(1):74-77.
[21] 李强, 李华, 姜传俊, 等. 温度对凡纳滨对虾血淋巴免疫指标的影响[J]. 大连水产学院学报, 2008, 23(2):132-135.
[22] 刘树青. 免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J]. 海洋与湖沼, 1999, 30(3):278-283.
[23] 王瑞芳, 庄平, 冯广朋, 等. 盐度升高对中华绒螯蟹几种非特异性免疫因子的影响[J]. 水产学报, 2012, 36(4):546-552.
[24] 孙金辉, 徐赟霞, 季延滨, 等. 温度骤降对南美白对虾仔虾抗氧化机能的影响[J]. 天津农学院学报, 2008, 15(3):7-10.
[25] Wang F Y, Yang H S, Gao F, et al. Effect of acute temperature or salinity stress on immune response in sea cucumber,Apostichopusjaponicus[J]. Comparative Biochemistry Physiology, 2008, 151(4):491-498.
[26] Möck A, Peters G. Lysozyme activity in rainbow trout,Oncorhynchusmykiss(Walbaum), stressed by handling, transport and water pollution[J]. Journal of Fish Biology, 1990, 37(6):873-885.
[27] 强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromisniloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响[J]. 海洋与湖沼, 2012, 43(5):943-953.
StressResponsesofClamPotamocorbulalaevistoSharpDecreaseinTemperature
NING Junhao, CHANG Yaqing, LIU Wei, SONG Jian, SHI Mingming
( Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Dalian Ocean University, Dalian 116023, China )
In this study, the changes in concentration of soluble proteins and soluble sugars, total antioxidant capacity (T-AOC), and activities of superoxide dismutase (SOD), catalase (CAT), alkaline phosphatase (AKP), acid phosphatase (ACP) and lysozyme (LSZ) were investigated in mature clamPotamocorbulalaevisexposed to sharp change in water temperature from 8, 4 and 2 °C to -2 °C for 0, 1, 3, 6, 9 and 24 h. There was significant effect of 3 acute temperature decrease models on all biochemical indices (P< 0.05). During the experiment, the concentrations of soluble proteins and soluble sugars were maintained at the initial level. The activities of SOD and CAT were found to be declined significantly within 1 h, and CAT activity became stable within 3 h in large and medium fluctuation of temperature decrease treatments (Tdec1and Tdec2treatments). However, the activities of SOD and CAT showed an increase-decrease-increase change trend in small fluctuation of temperature decrease treatment (in Tdec3treatment). The fluctuation of T-AOC activity was observed under the 3 kinds of stress models, especially the activities of ACP and AKP in Tdec1and Tdec2treatments. In Tdec3treatment, however, the activities of ACP and AKP were declined significantly within 1 h, and then stable within 6 h. The LSZ activity showed fluctuating changes in the clam exposed to the 3 kinds of temperature decrease models, the large fluctuations 6 h after administration. The findings indicated that the rapid decrease in temperature as an important ecological factor has profound effects on physiological and immune functions inducing diseases of organisms in aquaculture.
Potamocorbulalaevis;sharp temperature decrease;soluble protein;soluble sugar;immune factor
10.16378/j.cnki.1003-1111.2016.02.004
S968.3
A
1003-1111(2016)02-0117-06
2015-09-16;
2015-10-30.
国家海洋局海洋公益项目(201105016);辽宁省科技攻关重大项目(2011203003).
宁军号(1988-),男,硕士研究生;研究方向:水产动物繁育.E-mail:ningjunhaook@126.com.通讯作者:常亚青(1967-),男,教授,博士,硕士生导师;研究方向:海洋生物学及水产动物繁育.E-mail:yqchang@dlou.edu.cn.

