FGF-21促进HepG2细胞摄取葡萄糖研究
刘铭瑶,王文飞,侯玉婷,任桂萍,吴云舟,李德山*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.长春卫尔赛生物药业有限公司,长春 130616)
FGF-21促进HepG2细胞摄取葡萄糖研究
刘铭瑶1,王文飞1,侯玉婷2,任桂萍1,吴云舟1,李德山1*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.长春卫尔赛生物药业有限公司,长春 130616)
肝脏是代谢的中枢性器官,在糖脂代谢中扮演重要角色。FGF-21是近年来发现的一种治疗糖尿病新型药物,研究其对肝脏糖代谢影响及机制将为FGF-21成药性提供理论依据。以HepG2细胞为肝细胞模型,探究FGF-21对HepG2细胞葡萄糖吸收影响及作用机制。FGF-21处理HepG2细胞,采用葡萄糖氧化酶-过氧化物酶(GOD-POD)法检测细胞对葡萄糖摄取情况,并检查胰岛素与FGF-21协同作用,蒽酮法检测细胞内糖原含量,半定量和实时荧光定量PCR检测FGF-21对葡萄糖转运蛋白(GLUTs)mRNA表达影响。结果表明,FGF-21可促进HepG2细胞摄取葡萄糖,与胰岛素具有一定协同作用,增加糖原合成。半定量PCR结果显示在FGF-21作用下,仅GLUT1 mRNA表达有所增加。实时荧光定量PCR检测FGF-21作用时间对GLUT1 mRNA表达量影响,发现FGF-21作用6 h时GLUT1 mRNA表达量倍数增加最大。说明FGF-21可通过增加GLUT1 mRNA表达促进HepG2细胞消耗葡萄糖,参与糖原合成。
糖尿病;糖代谢;FGF-21;HepG2
刘铭瑶,王文飞,侯玉婷,等.FGF-21促进HepG2细胞摄取葡萄糖研究[J].东北农业大学学报,2016,47(5):36-43.
Liu Mingyao,Wang Wenfei,Hou Yuting,et al.Study on FGF-21 regulates glucose uptake in HepG2 cells[J].Journal of Northeast Agricultural University,2016,47(5):36-43.(in Chinese with English abstract)
成纤维细胞生长因子(FGF)-21是FGF家族一员,主要在肝脏中表达[1],是一种安全、可靠、不依赖胰岛素的代谢调节因子,参与糖脂代谢调节过程,有望成为治疗2型糖尿病新型药物。Kharitonenkov等发现在体外环境下FGF-21能促进3T3-L1脂肪细胞和人原代脂肪细胞消耗葡萄糖,而对未分化成纤维细胞、L6-葡萄糖转运肌纤维和肌管细胞等无作用,因此脂肪细胞被认为是FGF-21作用唯一靶细胞[2]。Kharitonenkov研究表明,在动物体内,FGF-21具有降低血糖、甘油三酯低密度胆固醇脂蛋白(LDL),升高高密度胆固醇脂蛋白(HDL)等功能,且不会产生低血糖、高胰岛素血症、体重增加,水肿等常规降糖药物副作用[3]。随着对FGF-21潜在功能开发,研究发现FGF-21不仅在糖脂代谢上具有重要调节作用,其功能还涉及抑制胰高血糖素释放,保存胰岛β细胞数量和功能,预防化学诱导的肝癌,降低体重、减少脂肪堆积、提高胰岛细胞功能及数量、改善胰岛素抵抗等[4-8]。对FGF-21作用靶点的研究也从脂肪器官转移到人体另一个重要代谢器官——肝脏。近年来,Badman和Xu等研究发现FGF-21可以在肝脏中调节脂类代谢,但FGF-21在肝细胞中直接功能效应尚未见报道[9-11]。
肝脏是糖代谢最主要器官之一,对维持血糖稳定有重要作用,主要表现在糖异生、糖原合成和摄取、利用及释放葡萄糖。空腹状态时,肝脏主要通过糖原分解与糖异生维持机体正常葡萄糖水平,餐后肝脏通过糖原合成、抑制糖原分解和糖异生降低葡萄糖浓度,不仅为自身生理活动提供能量,还为周围其他器官提供葡萄糖[12]。肝脏糖代谢异常产生胰岛素抵抗,且为2型糖尿病基本病理生理现象[13-14]。因此,研究FGF-21对肝细胞糖代谢影响对糖尿病治疗具有重要意义。本试验以肝脏为研究靶点,利用HepG2肝细胞模型研究FGF-21对肝细胞糖代谢影响及可能作用机制,为FGF-21成药性提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株
HepG2细胞由东北农业大学生命科学学院生物制药实验室提供。
1.1.2 主要试剂
DMEM培养基、新生牛血清(NCS)、胎牛血清(FBS)购自Invitrogen公司;FGF-21由东北农业大学生命科学学院生物制药实验室纯化获得;人重组胰岛素(Human recombined insulin);细菌内毒素脂多糖(LPS)购自Sigma Corporation;葡萄糖检测试剂盒购自四川迈克科技有限责任公司;RNA酶抑制剂(RNasin,RNase Inhibitor),逆转录酶(MMuLV),RNA提取试剂Trizol,1kb Plus DNA Ladder购自Invitrogen公司;Oligo(dT)15购自Takara公司;其他化学试剂均为分析纯。
1.1.3 引物
半定量PCR引物、实时荧光定量PCR引物由Invitrogen公司合成。半定量PCR引物如下:
GLUT1
上游引物:5'TGAACCTGCTGGCCTTC 3'
下游引物:5'GCAGCTTCTTTAGCACA 3' GLUT2
上游引物:5'CAACAGGTAATAATATC 3'
下游引物:5'CTCGCACACCAGACAGG 3' GLUT3
上游引物:5'AAGGATAACTATAATGG 3'
下游引物:5'GGTCTCCTTAGCAGGCT 3' GLUT4
上游引物:5'CAGAAGGTGATTGAACA 3'
下游引物:5'CAGGTAGCACTGTGAGG 3'
1.2 方法
1.2.1 HepG2葡萄糖消耗细胞模型建立
取生长状态良好HepG2细胞,以2.5×104细胞数·孔-1密度接种于96孔板中,细胞培养液为200 μL·孔-1。37℃、5%CO2,饱和湿度条件下培养。当细胞长至贴壁汇合时,PBS缓冲液洗两次,无血清培养基处理细胞12 h后,用细胞培养基稀释胰岛素贮存液(10 mg·mL-1),使其终浓度为0.01、0.1、1、10、100 mg·L-1,以每孔200 μL量加入细胞中。每个浓度至少设3个重复孔。24 h后葡萄糖氧化酶-过氧化物酶法检测培养基中葡萄糖含量[15],同时以无胰岛素刺激、正常培养细胞为对照。取细胞消耗上清培养基2 μL于葡萄糖检测试剂盒中检测液中,37℃反应5~10 min后,在500 nm波长下测OD值,根据标准品间接计算细胞葡萄糖消耗率,运用统计学分析试验结果。
1.2.2 FGF-21对HepG2细胞糖代谢测定
HepG2细胞血清饥饿12 h后,用培养基稀释FGF-21(0.4 mg·mL-1)蛋白,使其终浓度为0.01、0.1、1、10、100 mg·L-1,以每孔200 μL量将含上述不同稀释浓度FGF-21加入96孔板上细胞中。每个浓度至少设3个重复孔。培养24 h后取上清培养基用葡萄糖试剂盒检测培养基中葡萄糖含量,数据作统计学分析。同时,为排除FGF-21蛋白中微量内毒素干扰,用培养基稀释内毒素标准品作为对照,使其终浓度为10、1、0.1 ng·mL-1,相同条件下孵育细胞24 h后取上清培养基检测培养基中葡萄糖含量。
1.2.3 FGF-21联合胰岛素作用对HepG2细胞糖吸收影响
取生长状态良好HepG2细胞接种于96孔板,血清饥饿12 h后将细胞分为四组,I组加入正常细胞培养基,II组加入含有10 mg·L-1胰岛素培养基,III组加入含有10 mg·L-1FGF-21培养基,IV组加入同时含有10 mg·L-1胰岛素和FGF-21培养基。上述四组培养基孵育细胞24 h后,取上清培养基用葡萄糖试剂盒检测葡萄糖含量,数据作统计学分析。
1.2.4 FGF-21对GLUT1 mRNA表达影响
HepG2细胞用无血清培养基培养12 h后,分别用10 mg·L-1胰岛素和10 mg·L-1FGF-21培养细胞,正常细胞培养基孵育细胞为对照,培养4、6、8和24 h后收获细胞,Trizol法提取细胞总RNA。以不同处理细胞总RNA为模板,Oligo(dT)15为引物合成cDNA。在HepG2细胞中稳定表达的GAPDH为内参,特异性引物和半定量PCR法检测GLUT1、GLUT2、GLUT3和GLUT4表达。实时荧光定量PCR检测GLUT1 mRNA表达。GAPDH内参基因扩增上游引物为5'GGAAGGTGAAGGTCGGAG TC 3',下游引物为5'ACTCCACGACGTACTCAGC G 3'。GLUT1目的基因扩增上游引物[16]为5'CAT CAATGCCCCCCAGAA 3',下游引物为5'AAGCG GCCCAGGATCAG 3'。按照Thermal Cycler DiceTM Real Time PCR(TaKaRa Code:TP800)使用说明书要求操作。反应体系为2.0 μL cDNA模板,10.0 μL SYBR Premix Ex TaqTM(2×),0.4μL PCR正反引物(10 mol·L-1),0.4 μL ROX Reference Dye II(50×),灭菌三蒸水补足20 μL(内参和目的片段同批扩增)。反应条件为95℃10 s,95℃5 s,60℃31 s,40个循环。每次扩增均设由三蒸水代替模板的空白对照,每个样品至少重复3次。使用相对定量分析方法(2-ΔΔCt法)对目的基因相对定量。
1.2.5 细胞内糖原含量检测
HepG2细胞血清饥饿12 h后,分别用10 mg·L-1胰岛素和10 mg·L-1FGF-21培养细胞,以正常细胞培养基孵育细胞为对照,12 h后收获细胞,PBS重悬,血细胞计数板计数。取密度为每毫升1×105细胞蒽酮法检测细胞内糖原含量[17]。
1.2.6 数据处理
Excel 2007进行统计分析,数据以-x±s表示,两组间计量资料比较采用t检验,多组间比较采用方差分析,两变量间采用相关分析,P<0.05为差异显著有统计学意义。
2 结果与分析
2.1 FGF-21促进HepG2细胞消耗葡萄糖
HepG2细胞是对胰岛素敏感的靶细胞,用不同浓度胰岛素处理HepG2细胞,24 h后经葡萄糖氧化酶-过氧化物酶法检测细胞葡萄糖消耗率,结果显示,胰岛素浓度在0.1 mg·L-1时,细胞的葡萄糖消耗率达61.15%,比对照细胞葡萄糖消耗率(35.79%)增加25%,差异显著(*P<0.01)。高于此浓度,在1~ 100 mg·L-1之间,与对照细胞葡萄糖消耗率相比差异极显著(**P<0.01),但此浓度细胞间葡萄糖消耗率变化不大,与1 mg·L-1相比差异不显著,细胞葡萄糖吸收达到饱和。而浓度低于0.1 mg·L-1时,随胰岛素浓度下降,细胞葡萄糖消耗率也相应下降,呈剂量依赖性关系,结果见图1。葡萄糖氧化酶-过氧化物酶法检测体外培养细胞的糖吸收具有可行性,方法简便、稳定,结果具有可重复性。因此,在后续试验中利用该方法检测经不同处理HepG2细胞对葡萄糖的摄取情况。
不同浓度FGF-21处理HepG2细胞24 h,经微量化GOD-POD法检测培养基中葡萄糖含量,结果显示,HepG2细胞对葡萄糖摄取利用显著增加,残存在培养基中葡萄糖含量明显低于对照组,差异表现为显著或极显著(两样本比较t检验,*P<0.05差异显著,**P<0.01差异极显著)。FGF-21浓度在100 mg·L-1时,细胞葡萄糖消耗率最高为69.2%,比未经FGF-21处理的对照组高出近34%,而FGF-21浓度最低为0.01 mg·L-1时,细胞葡萄糖消耗率也可达53.16%,FGF-21浓度增加,细胞葡萄糖消耗率呈线性显著增加(见图2),存在剂量依赖关系。

图2 FGF-21刺激HepG2细胞葡萄糖吸收Fig.2FGF-21 stimulates glucose uptake by HepG2 cells
本试验所用FGF-21是由原核表达系统制备,尽管纯化后FGF-21蛋白经鲎试剂盒检测所含内毒素(LPS)低于0.5 EU·mL-(10.05~0.1 ng·mL-1),但为排除内毒素对细胞葡萄糖吸收影响,用浓度0.001~10 ng·mL-1LPS处理细胞24 h,细胞葡萄糖消耗率与空白对照组相比差异不显著,可见当LPS浓度在0.001~10 ng·mL-1时对FGF-21促进细胞摄取葡萄糖作用无影响(见图3)。证明FGF-21对HepG2细胞同样具有促进消耗葡萄糖功能,肝细胞可能是FGF-21作用另一靶细胞。HepG2仅作为一种肝细胞模型,FGF-21对正常肝细胞是否具有生物学活性,能否调节肝脏糖代谢有待进一步研究。
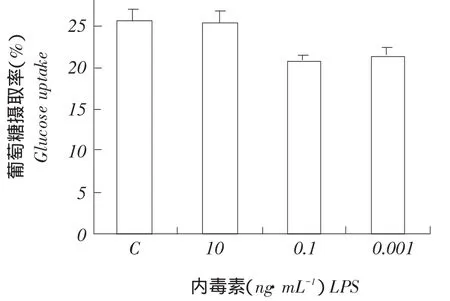
图3 LPS对HepG2细胞葡萄糖吸收影响Fig.3Effect of LPS on glucose uptake by HepG2 cells
2.2 FGF-21与胰岛素具有协同作用
用同时含有10mg·L-1胰岛素和10mg·L-1FGF-21混合培养基共同孵育HepG2细胞,24 h后取培养基检测细胞葡萄糖摄取情况,同时分别以只含等量胰岛素和FGF-21培养基作对照,以未处理HepG2细胞为处理组空白对照。结果见图4,胰岛素和FGF-21均能促进HepG2细胞消耗培养基中葡萄糖,与空白作用组差异显著(*P<0.05),且胰岛素与FGF-21具有一定协同作用,联合作用组细胞葡萄糖消耗率明显高于胰岛素和FGF-21单独作用组,差异极显著(**P<0.01)。

图4 FGF-21与人胰岛素协同作用增加HepG2细胞葡萄糖吸收Fig.4FGF-21 shows a synergistic effect with human recombinant insulin on glucose uptake by HepG2 cells
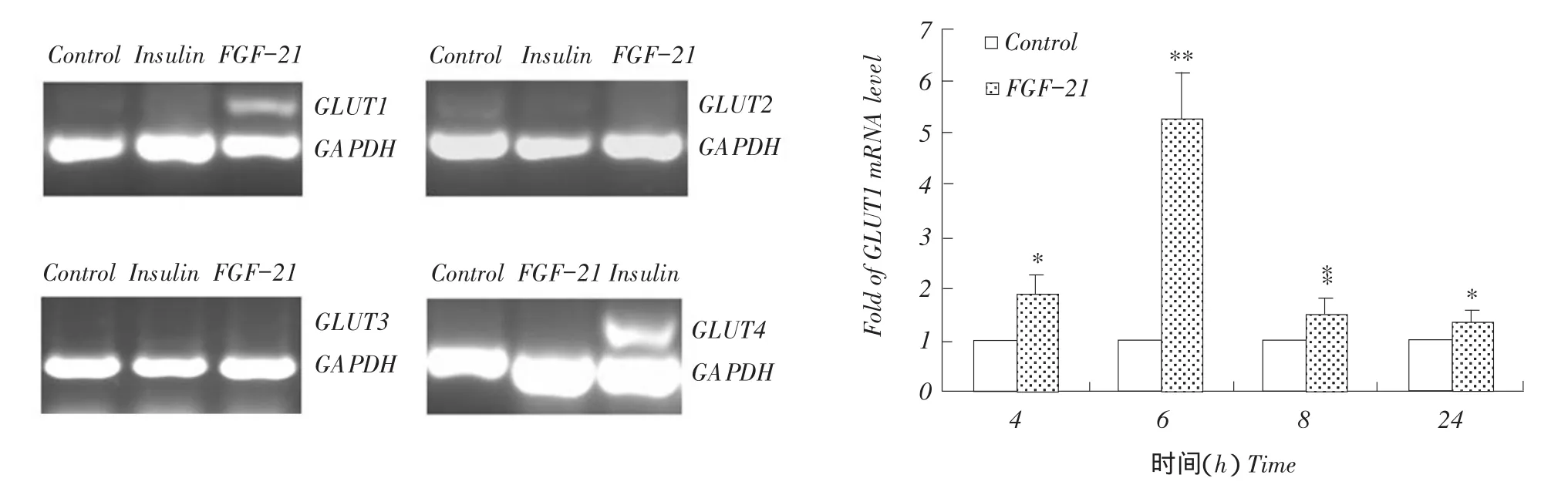
图5 FGF-21上调GLUT1mRNA表达Fig.5FGF-21 enhances GLUT1 mRNA expression
2.3 FGF-21促进GLUT1 mRNA表达21处理细胞6 h后,收获细胞提取细胞总RNA,反转录后半定量PCR检测GLUT1-GLUT4 mRNA表达变化,以胰岛素处理细胞为对照。结果显示,FGF-21作用下HepG2细胞仅GLUT1在核酸水平表达,而GLUT2、GLUT3和GLUT4无表达,胰岛素作用下HepG2细胞的GLUT4在核酸水平表达,GLUT1及其他葡萄糖转运蛋白无表达(见图5)。因此FGF-21促进葡萄糖吸收可能与GLUT1 mRNA表
葡萄糖主要通过协助扩散作用在哺乳动物细胞内外跨膜转运,依赖于葡萄糖转运蛋白(GLUTs)的介导[18-20]。介导利用半定量PCR初步检测在FGF-21作用下,确定葡萄糖在HepG2细胞中转运介导葡萄糖转运蛋白(GLUT1-GLUT4)。10 mg·L-1FGF-达有关。real-time PCR方法进一步确认,结果见图5。
FGF-21可促进HepG2细胞GLUT1 mRNA表达(*P<0.05,**P<0.01),且随时间变化表达量改变,FGF-21处理细胞6 h时,GLUT1 mRNA表达最高,与对照未经FGF-21处理细胞GLUT1表达量增加5.25倍。可见,FGF-21能促进HepG2细胞GLUT1表达,使细胞大量摄取葡萄糖。
2.4 FGF-21促进肝糖原合成
为研究FGF-21作用后细胞内葡萄糖去向,检测经FGF-21处理后HepG2细胞糖原合成量变化,已知胰岛素可以促进肝细胞摄取、利用葡萄糖,合成肝糖原,因此以胰岛素刺激后细胞为对照。含10 mg·L-1FGF-21和等量胰岛素培养基单独处理HepG2细胞12 h后,收获细胞,经蒽酮法检测细胞内糖原含量。结果见图6,FGF-21与胰岛素同样具有促进HepG2细胞合成糖原作用,与对照组细胞相比差异显著(*P<0.05)。

图6 FGF-21刺激肝细胞合成肝糖原Fig.6FGF-21 stimulates glycogen synthesis in liver cells
3 讨论
HepG2细胞是一种表型与肝细胞极为相似的人肝胚胎瘤细胞株,具有肝细胞生物学特性[21-24],作为研究和治疗糖尿病细胞模型应用广泛。因此,本试验以HepG2细胞为模型研究FGF-21对肝细胞糖代谢作用。结果表明,FGF-21可不依赖于胰岛素独立促进HepG2细胞消耗葡萄糖,细胞葡萄糖消耗率与剂量呈正相关性。FGF-21与胰岛素具有协同作用,联合处理HepG2细胞后,可增加葡萄糖摄取率。前人在细胞水平上检测制备FGF-21蛋白生物学活性均以脂肪细胞为检测模型,但体外培养脂肪细胞分化难,分化周期长(至少需要14~ 20 d),检测结果受分化效率影响,批量检测难以进行。本试验发现FGF-21可促进HepG2细胞摄取葡萄糖,以HepG2作为葡萄糖吸收模型,简便易行,无分化时间限制,可同时检测不同批次蛋白,为进一步研究该蛋白体内作用及机制提供依据。
葡萄糖无法自由通过细胞膜脂质双层结构进入细胞,借助结构相近的葡萄糖转运蛋白(GLUTs)协助扩散作用进入细胞内。葡萄糖转运蛋白分布于不同组织,存在各自的生物学功能及调控形式[22-23]。在肌肉和脂肪组织中,GLUT4从细胞质转移至细胞膜辅助葡萄糖由细胞外进入到细胞内的过程受胰岛素特异性调控。GLUT1是分布最为广泛的葡萄糖转运蛋白,与代谢密切相关。GLUT1在HepG2细胞中高表达。因此,为进一步研究FGF-21促进HepG2细胞葡萄糖吸收作用机制,利用实时荧光定量PCR方法检测FGF-21作用后HepG2细胞GLUT1 mRNA表达情况,发现FGF-21处理后细胞GLUT mRNA表达量显著增加。为研究HepG2细胞摄取葡萄糖去路,本试验利用蒽酮法检测细胞内糖原含量,结果发现FGF-21作用后HepG2细胞内糖原合成量显著增加。因此FGF-21促使HepG2细胞摄取葡萄糖将有一部分用于合成糖原。
肝脏是糖代谢重要器官,在机体整个葡萄糖代谢中占重要地位,其代谢紊乱会导致各种代谢疾病发生。肝脏内糖代谢受多种激素和酶的调控,如胰岛素——体内最重要的降糖激素,肝脏是其主要作用靶器官,在肝脏内胰岛素与其受体(InsR)相结合,引发一个复杂的信号传导通路,从而促使细胞对葡萄糖摄取和代谢,稳定血糖浓度[25]。胰岛素通过与其受体及信号作用直接或间接影响肝脏葡萄糖转运和利用[26-27]。FGF-21是体内除胰岛素外又一血糖调节因子,在脂肪细胞中能促进脂肪细胞摄取葡萄糖,并增加GLUT1 mRNA表达,但FGF-21直接作用于肝细胞,促进肝细胞摄取葡萄糖未见报道。试验中,发现FGF-21促进HepG2细胞摄取葡萄糖作用,与胰岛素不同的是FGF-21可调节GLUT1表达。因此,推测在HepG2细胞中,FGF-21不依赖于胰岛素单独通过与其受体结合调节GLUT1表达,介导葡萄糖转运,使HepG2细胞摄取并利用葡萄糖合成糖原。目前,FGF-21治疗糖尿病已经进入临床研究阶段[28-29],分析FGF-21在肝脏中作用可对深入研究FGF-21控制血糖生物学功能提供理论依据。
HepG2仅是一种肝细胞模型,体内肝脏糖代谢是一个复杂过程,受多种激素及酶类调控。因此,未来将在动物体内研究FGF-21对肝糖代谢关键酶类调节,深入探讨FGF-21对肝糖代谢作用。
4 结论
本文以HepG2细胞为模型研究FGF-21对肝细胞糖代谢影响,初步探讨FGF-21对肝细胞糖代谢可能作用机制。研究发现FGF-21通过增加GLUT1表达协助HepG2细胞摄取葡萄糖,并利用其合成糖原。提示FGF-21可以作用于肝脏,通过调节肝脏糖代谢控制血糖,深入研究FGF-21对肝脏代谢调控作用将为FGF-21治疗糖尿病的临床研究提供理论基础。
[1]Nishimura T,Nakatake Y,Konishi M,et al.Identification of a novel FGF,FGF-21,preferentially expressed in the liver[J]. Biochim Biophys Acta,2000,1492(1):203-206.
[2]Kharitonenkov A,Shiyanova T L,Koester A,et al.FGF-21 as a novel metabolic regulator[J].J Clin Invest,2005,115(6):1627-1635.
[3]Kharitonenkov A,Shanafelt A B.Fibroblast growth factor-21 as a therapeutic agent for metabolic diseases[J].Biodrugs,2008,22(1): 37-44.
[4]Seo J A,Kim N H.Fibroblast growth factor 21:A novel metabolic regulator[J].Diabetes Metab J,2012,36(1):26-28.
[5]Wente W,Efanov A M,Brenner M,et al.Fibroblast growth factor-21 improves pancreatic beta-cell function and survival by activation of extracellular signal-regulated kinase 1/2 and Akt signalingpathways[J].Diabetes,2006,55(9):2470-2478.
[6]Huang X Q,Yu C D,Jin C J,et al.Forced expression of hepatocyte-specific fibroblast growth factor 21 delays initiation of chemically induced hepatocarcinogenesis[J].Molecular Carcinogenesis,2006,45(12):934-942.
[7]Kharitonenkov A,Wroblewski V J,Koester A,et al.The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J].Endocrinology,2007,148(2):774-781.
[8]Arner P,Pettersson A,Mitchell P J,et al.FGF-21 attenuates lipolysis in human adipocytes-A possible link to improved insulin sensitivity[J].FEBS Letters,2008,582(12):1725-1730.
[9]Badman M K,Pissios P,Kennedy A D,et al.Hepatic fibroblast growth factor 21 is regulated by PPARα and is a key mediator of hepatic lipid metabolism in ketotic states[J].Cell Metabolism 2007,5(6):405-407.
[10]Xu J,Lloyd D J,Hale C,et al.FGF-21 reverses hepatic steatosis, increases energy expenditure and improves insulin sensitivity in diet-induced obese mice[J].Diabetes,2009,58(1):250-259.
[11]Xu J,Stanislaus S,Chinookoswong N,et al.Acute glucoselowering and insulin-sensitizing action of FGF-21 in insulinresistant mouse models-association with liver and adipose tissue effects[J].Am J Physiol Endocrinol Metab,2009,297(5):E1105-E1114.
[12]Postic C,Dentin R,Girard J.Role of the liver in the control of carbohydrate and lipid homeostasis[J].Diabetes Metab,2004,30 (5):398-408.
[13]Nishimura T,Nakatake Y,Konishi M,et al.Identification of a novel FGF,FGF-21,preferentially expressed in the liver[J]. Biochim Biophys Acta,2000,1492(1):203-206.
[14]DeFronzo R A,Bonadonna R C,Ferrannini E.Pathogenesis of NIDDM.A balanced overview[J].Diabetes Care,1992,15(3):318-368.
[15]Accorsi P A,Gamberon M,Isani G,et al.Leptin does not seem to influence glucose uptake by bovine mammary explants[J].Journal of Physiology and Pharmacology,2005,56(4):689-698.
[16]Ge T F,Law P Y,Wong H Y,et al.Gatifloxacin affects GLUT1 gene expression and disturbs glucose homeostasis in vitro[J].Eur J Pharmacol,2007,573(1-3):70-74.
[17]Chun Y,Yin Z D.Glycogen assay for diagnosis of female genital Chlamydia trachomatis infection[J].J Clin Microbiol,1998,36(4): 1081-1082.
[18]Zhao F Q,Keating A F.Functional properties and genomics of glucose transporters[J].Current Genomics,2007,8(2):113-128.
[19]Kayano T,Burant C F,Fukumoto H,et al.Human facilitative glucose transporters[J].J Biol Chem,1990,265(22):13276-13282.
[20]Bell G I,Kayano T,Bose J B,et al.Molecular biology of mammalian glucose transporters[J].Diabetes Care,1990,13(3): 198-208.
[21]Ciaraldi T P,Goldberg M,Odom R,et al.In vitro effects of amylin on carbohydrate metabolism in liver cells[J].Diabetes,1992,41(8):975-981.
[22]Frittitta L,Sbraccia P,Costanzo B V,et al.High insulin levels do not influence PC-1 gene expression and protein content in human muscle tissue and hepatoma cells[J].Diabetes Metab Res Rev, 2000,16(1):26-32.
[23]Kosaki A,Webster N J.Effect of dexamethasone on the alternative splicing of the insulin receptor mRNA and insulin action in HepG2 hepatoma cells[J].J Biol Chem,1993,268(29):21990-21996.
[24]李德山,曹荣邱,高华山,等.定点突变FGF21提高表达量研究[J].东北农业大学学报,2013,44(3):83-88.
[25]Khan A H,Pessin J E.Insulin regulation of glucose uptake:a complex interplay of intracellular signalling pathways[J].Diabetologia,2002,45(11):1475-1483.
[26]Cherrington A D,Edgerton D,Sindelar D K.The direct and indirect effects of insulin on hepatic glucose production in vivo[J]. Diabetologia,1998,41(9):987-996.
[27]任桂萍,姜媛媛,刘铭瑶,等.SUMO融合系统高效表达可溶性鼠源FGF-21及其活性的研究[J].东北农业大学学报,2009,40 (5):62-67.
[28]Carmen Nevado,Angela M,Valverde,et al.Role of insulin receptorintheregulationofglucoseuptakeinneonatal hepatocytes[J].Endocrinology,2006,147(8):3709-3718.
[29]Zhao Y,Dunbar J D,Kharitoenkov A.FGF21 as a therapeutic reagent[J].Adv Exp Med Biol,2012,728:214-228.
Study on FGF-21 regulates glucose uptake in HepG2 cells
LIU Mingyao1,WANG Wenfei1,HOU Yuting2,REN Guiping1,WU Yunzhou1,LI Deshan1
(1.School of Life Sciences, Northeast Agricultural University,Harbin 150030,China;2.Changchun Weresai Biotic Pharmaceutical Co.Ltd,Changchun 130616,China)
Liver is a metabolic center,plays an important role in regulating glucose and lipid metabolism.FGF-21 is an important candidate drug to treat diabetes;so to study the effect and mechanism of its effects on regulation of the glucose metabolism in liver is very important for drug research.We chose HepG2 cells as a model to study the effects of FGF-21 on glucose uptake in liver and the mechanism of its action.After treated by FGF-21,the glucose uptake by the HepG2 cells was detected by the method of glucose oxidizes·peroxides(GOD-POD);glycogen synthesis was examined by anthrone method,the synergy between insulin and FGF-21 was evaluated.With the purpose to study the mechanism of FGF-21 on glucose uptake,the mRNA expression of GLUTs was detected by semiquantitative PCR and real-time PCR with specific primers.The results showed that FGF-21 stimulated glucose uptake by the HepG2 cells in a does-dependent manner and had a synergistic effectwith insulin.FGF-21 could also increase glycogen synthesis in the HepG2 cells,with the same action as insulin.The result of the semiquantative PCR showed that only GLUT1 mRNA was increased with FGF-21 stimulation.FGF-21 induced a significant increase of GLUT1 mRNA in the HepG2 cells detected by real-time PCR.The fold of GLUT1 mRNA expression was raised most at 6 hours,more than 5-fold was increased.Thus,we concluded that FGF-21 stimulates glucose uptake and glycogen synthesis in HepG2 cells,and enhanced glucose absorption of HepG2 cells probably through GLUT1 activation.
diabetes;glucose metabolism;FGF-21;HepG2 cell line
R575
A
1005-9369(2016)05-0036-08
2015-06-06
国家自然基金项目(J1210069/J0116);东北农业大学博士启动基金(2010RCB52)
刘铭瑶(1984-),女,实验师,硕士,研究方向为生物制药。E-mail:liumingyao_002@163.com
*通讯作者:李德山,教授,博士生导师,研究方向为制药工程。E-mail:deshanli@163.com
时间2016-5-27 10:13:49[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160527.1013.012.html

