基于microRNAs调控的轻度慢性乙型肝炎炎症活动的分子机制研究*
张传涛,黄 群,刘业方,郭尹玲,辜海英,王芳瑜,胡 蓉,扈晓宇△,郑政隆
(1.成都中医药大学附属医院感染科,成都 610072;2.成都中医药大学,成都 610075;3.成都市传染病医院肝病科,成都 610066)
·生物信息学·
基于microRNAs调控的轻度慢性乙型肝炎炎症活动的分子机制研究*
张传涛1,2,黄 群2,刘业方2,郭尹玲2,辜海英1,王芳瑜2,胡 蓉3,扈晓宇1△,郑政隆2
(1.成都中医药大学附属医院感染科,成都 610072;2.成都中医药大学,成都 610075;3.成都市传染病医院肝病科,成都 610066)
目的 研究从microRNAs角度揭示轻度慢性乙型肝炎炎症活动的分子机制。方法 将符合标准的病例分为轻度慢性乙型肝炎组与慢性HBV携带者组,借助Agilent Human microRNA 8×60 k微阵列芯片检测血浆中microRNAs表达谱,求得两组间的差异表达microRNAs谱(P<0.05),借助microRNAs生物信息学分析软件预测其靶基因并对靶基因进行GO功能富集分析和pathway分析。结果 两组间的差异表达microRNAs共65条(P<0.05),38条上调,27条下调;GO分析及pathway分析得到其功能主要涉及细胞增殖、生物黏附、生物合成过程的正/负调控、大分子生物合成过程中的正/负调控、蛋白氨基酸的磷酸化、RNA的生物合成过程、Wnt信号通路、MAPK 信号通路、Notch信号传导途径、Hedgehog信号通路、T细胞受体信号通路、TGF-β信号通路、mTOR信号通路、趋化因子信号通路JAK-STAT信号通路、钙离子信号通路等。结论 轻度慢性乙型肝炎炎症活动受特异性microRNAs调控,其涉及多个生命过程及通路。
轻度慢性乙型肝炎;炎症活动;microRNAs调控
全球约20亿人曾感染乙型肝炎病毒(HBV),其中2.4亿人为慢性HBV感染者[1],每年约有65万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌[2]。2006年全国乙型肝炎血清流行病学调查表明,我国1~59岁一般人群HBsAg携带率为7.18%[3-4]。2014年全国1~29岁人群乙型肝炎血清流行病学调查结果显示:1~4岁、5~14岁和15~29岁人群HBsAg流行率分别为0.32%、0.94%和4.38%。虽然我国HBV感染率明显下降,但是我国仍是肝病高发地区,仍严重影响我国人民健康的疾病,为社会带来巨大的经济负担。微小RNAs(microRNAs,miRNAs)是一类具有单链小分子RNAs,调控人体近1/3基因的功能[5],miRNAs参与HBV感染后病毒与宿主之间的相互作用,能够调控HBV复制、细胞外基质生成及抑癌基因的沉默等过程[6-8]。深入研究miRNAs调控网络有望为进一步丰富HBV感染的发病机制。本研究借助Agilent Human miRNA 8×60 k微阵列芯片技术,从miRNAs调控角度揭示慢性乙型肝炎(简称“慢乙肝”)炎症活动的机制,为今后控制慢乙肝肝脏炎症活动、抗HBV药物研发等提供研究方向。
1 资料与方法
1.1 一般资料 病例均来自成都市传染病医院等中心2012年8月至2013年4月门诊,分为:携带者8例,轻度慢性乙型肝炎8例。纳入标准: (1)符合轻度慢乙肝与慢性HBV携带者诊断;(2)就诊前3个月内未进行过中西医抗病毒及保肝等治疗;(3)患者的HBV-DNA为阳性;(4)年龄20~40岁;(5)同意并签署知情同意书者;只有以上入选标准都满足者,才能纳入本临床研究。轻度慢乙肝与携带者诊断标准:参照中华医学会肝病学分会和中华医学会感染病分会联合制定《病毒性肝炎防治方案》(2000年修订版)拟定轻度慢乙肝诊断标准[9]。参照中华医学会肝病学分会和中华医学会感染病分会联合制定《慢性乙型肝炎防治指南》(2005年版)拟定慢性HBV携带者诊断标准[10]。
1.2 方法
1.2.1 主要仪器及试剂 微阵列扫描仪(安捷伦,批号:P/N G2565BA)、不锈钢杂交室(安捷伦,批号:P/N G2534A)、杂交室垫片幻灯片8微阵列(安捷伦,批号:P/N G2534A)、miRNA的完整标签和HYB套件(安捷伦,批号:P/N 5190-0456)基因表达的洗涤液套装(安捷伦,批号:P/N 5188-5327)、2100生物分析仪(安捷伦,批号:P/N g2938A)、RNA 6000纳米试剂盒(安捷伦,批号:P/N 5067-1511)。
1.2.2 实验方法 用血常规管 (EDTA抗凝)采取符合标准患者肘静脉血10 mL,4 ℃静置30 min,3 000 r/min离心20 min,提取血浆,RNA抽提,质控合格,标记、杂交,Agilent Human miRNA 8×60 k微阵列芯片技术检测,芯片洗涤、扫描,在线SAS系统中的“DiffGene”项目行T检验和SAM筛选,对筛选出来2倍以上表达差异的miRNAs利用miRNA生物信息学分析软件进行靶基因预测,将筛选出来的靶基因行GO功能富集基因的分类和pathway分析。
1.3 统计学处理 差异miRNAs筛选采用在线SAS系统分析(http://www.ebioservice.com)。比较采用配对t检验,miRNAs表达组间比较进行方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 差异表达miRNAs谱 将归一化文件导入SAS系统中,轻度慢乙肝与慢性HBV携带者两组间的差异表达miRNAs共65条(P<0.05),38条上调,27条下调;2倍以上差异表达的miRNAs 30条,19条上调,11条下调。上调的19条为:hsa-miR-1246、hsa-miR-3679-5p、hsa-miR-1275、hsa-miR-1268、hsa-miR-126、hsa-miR-4298、hsa-miR-1225-5p、hsa-miR-4270、hsa-miR-320c、hsa-miR-1207-5p、hsa-miR-223、hsa-miR-1202、hsa-miR-3162、hsa-miR-27a、hsa-miR-1915、hsa-miR-142-3p、hsa-miR-630、hsa-miR-3195、hsa-miR-4281等。下调的11条为:hsa-miR-26a、hsa-miR-29a、hsa-miR-1238、hsa-miR-720、hsa-miR-122、hsa-miR-1228、hsa-miR-1280、hsa-miR-1281、hsa-miR-1234、hsa-miR-191*、hsa-miR-20a等。
2.2 差异miRNAs靶基因GO功能分析 利用miRNA生物信息学分析软件miRDB,microRNA,TarBase等对两组间2倍以上的差异miRNAs进行靶基因预测,利用DAVID在线软件对所预测的靶基因进行GO功能富集分析。
上调的差异miRNAs所对应的靶基因共参与61项显著生物功能(表1),主要包括细胞增殖、生物黏附、细胞黏附、细胞内的信号级联、蛋白质转运、蛋白定位、大分子生物合成过程中的积极调控、大分子代谢过程正调控、氮化合物的代谢过程的正调控、生物合成过程中的正/负调控、细胞凋亡、蛋白氨基酸的磷酸化、细胞周期、细胞迁移等下调的差异miRNAs所对应的靶基因共参与76项显著生物功能(表2),包括转录调控、RNA聚合酶Ⅱ启动子转录调控、基因表达的正/负调控、转录正/负调控、大分子代谢过程正/负调控、RNA代谢过程正调控、氮化合物的代谢过程的正调控、细胞生物合成过程中的积极调控、酶联受体蛋白信号通路、细胞增殖、细胞迁移、蛋白质定位、细胞运动、Wnt受体信号通路、钾离子转运、RNA的生物合成过程及核碱基、核苷、核苷酸和核酸的代谢过程的正调控等。
2.3 差异 miRNAs靶基因调控的Pathway分析 轻度慢乙肝组/慢性HBV携带者组上调差异miRNAs的靶基因参与的显著性信号通路28条(图1),包括黏着、轴突导向、胞吞作用、心脏相关疾病(肥厚性心肌病、扩张型心肌病、致心律失常性右室心肌病等)、肌动蛋白骨架的调节、白细胞跨内皮迁移、Janus激酶(JAK)-信号转导子和转录激活子(STAT)信号传导途径、神经营养因子信号通路、Wnt信号通路、Notch信号传导途径、胰岛素信号通路、转化生长因子-β(TGF-β)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、p53信号通路等。
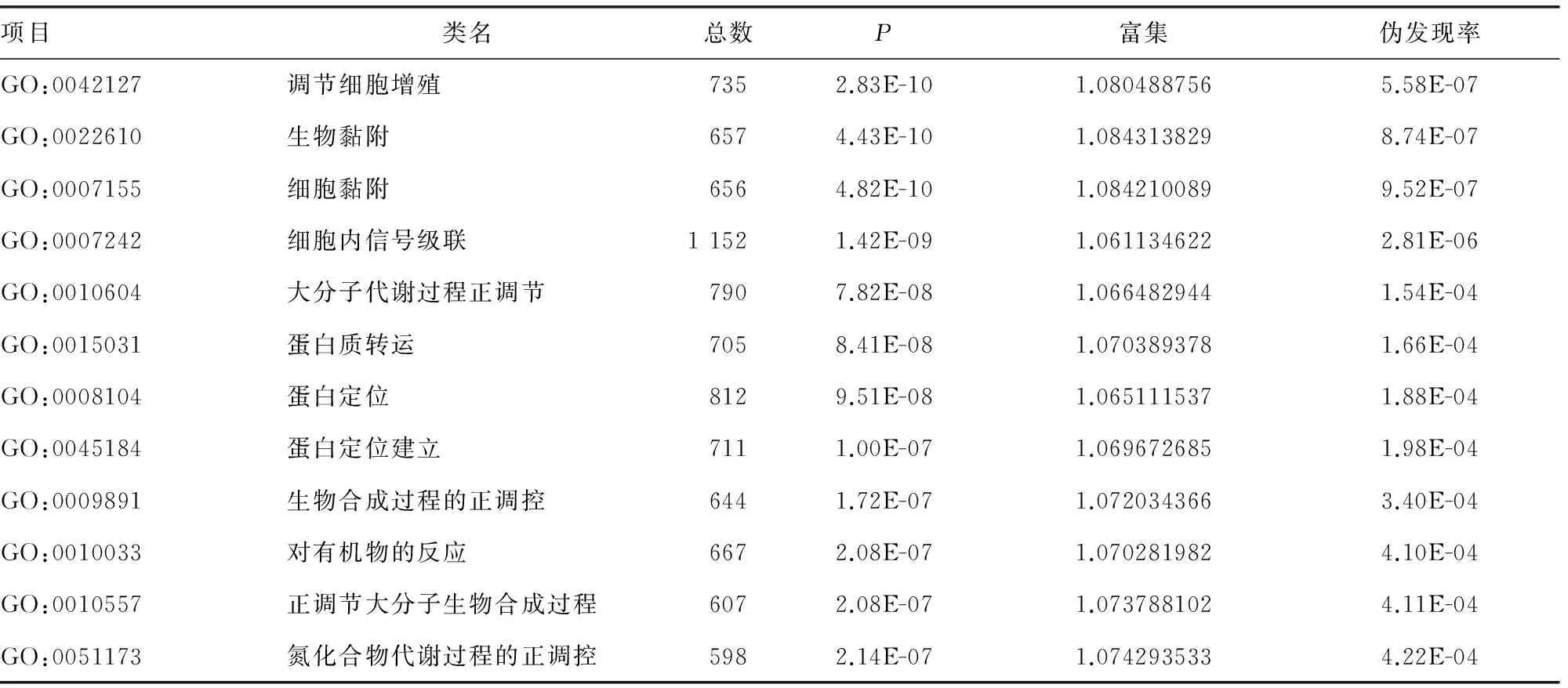
表1 轻度慢乙肝组/慢性HBV携带者组上调差异miRNAs的靶基因GO分析
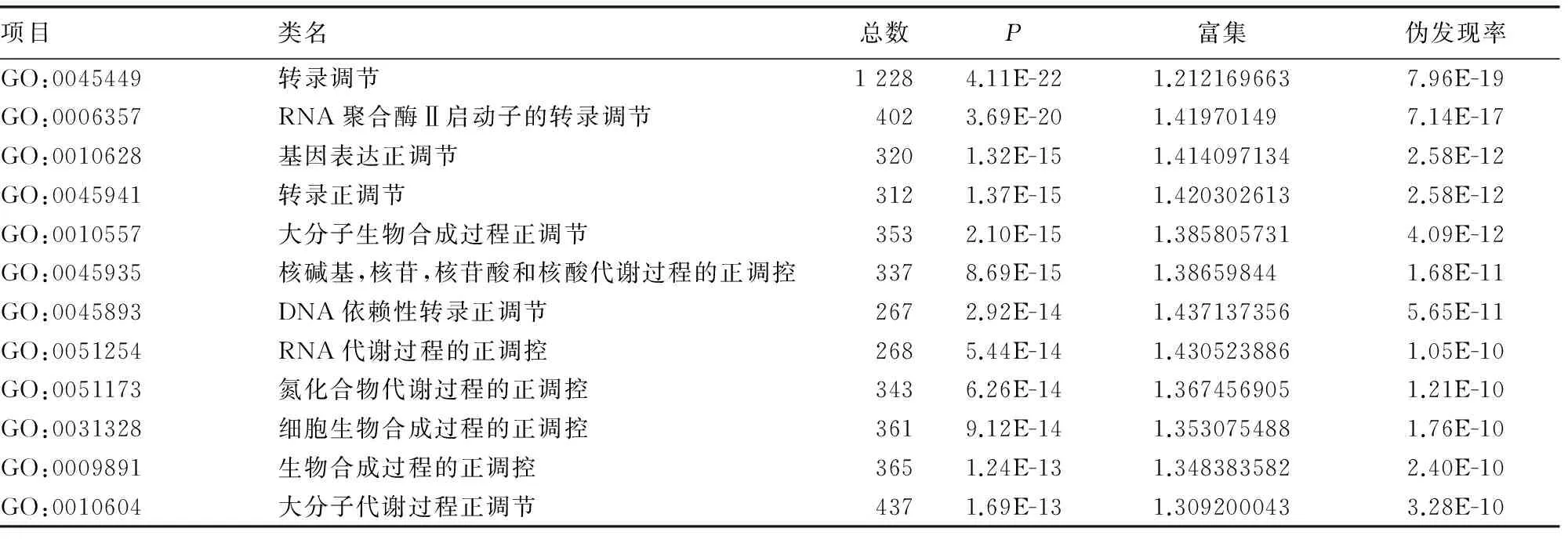
表2 轻度慢乙肝组/慢性HBV携带者组下调差异miRNAs的靶基因GO分析
轻度慢乙肝组/慢性HBV携带者组下调差异miRNAs的靶基因参与的显著性信号通路51条(图2),包括白细胞跨内皮迁移、Hedgehog信号通路、II型糖尿病、脑胶质瘤、促性腺激素释放激素信号传导途径、黑色素生成、肾细胞癌、T细胞受体信号传导途径、卵母细胞减数分裂、钙信号传导途径、肌动蛋白骨架的调节、神经营养因子信号传导途径、扩张型心肌病、胰岛素信号传导途径、慢性髓细胞样白血病、Notch信号传导途径、泛素介导性蛋白酶解、缝隙连接、ErbB信号传导途径、粘着斑、粘着连接、长时程增强、癌症途径、紧密连接、胞吞作用、MAPK信号传导途径、Wnt信号通路、轴突导向、Notch信号通路、mTOR信号通路、p53信号通路、O-聚糖的生物合成、脂肪细胞因子信号通路、趋化因子信号通路、TGF-β信号通路、癌症途径(大肠癌、肾细胞癌、小细胞肺癌等)等。
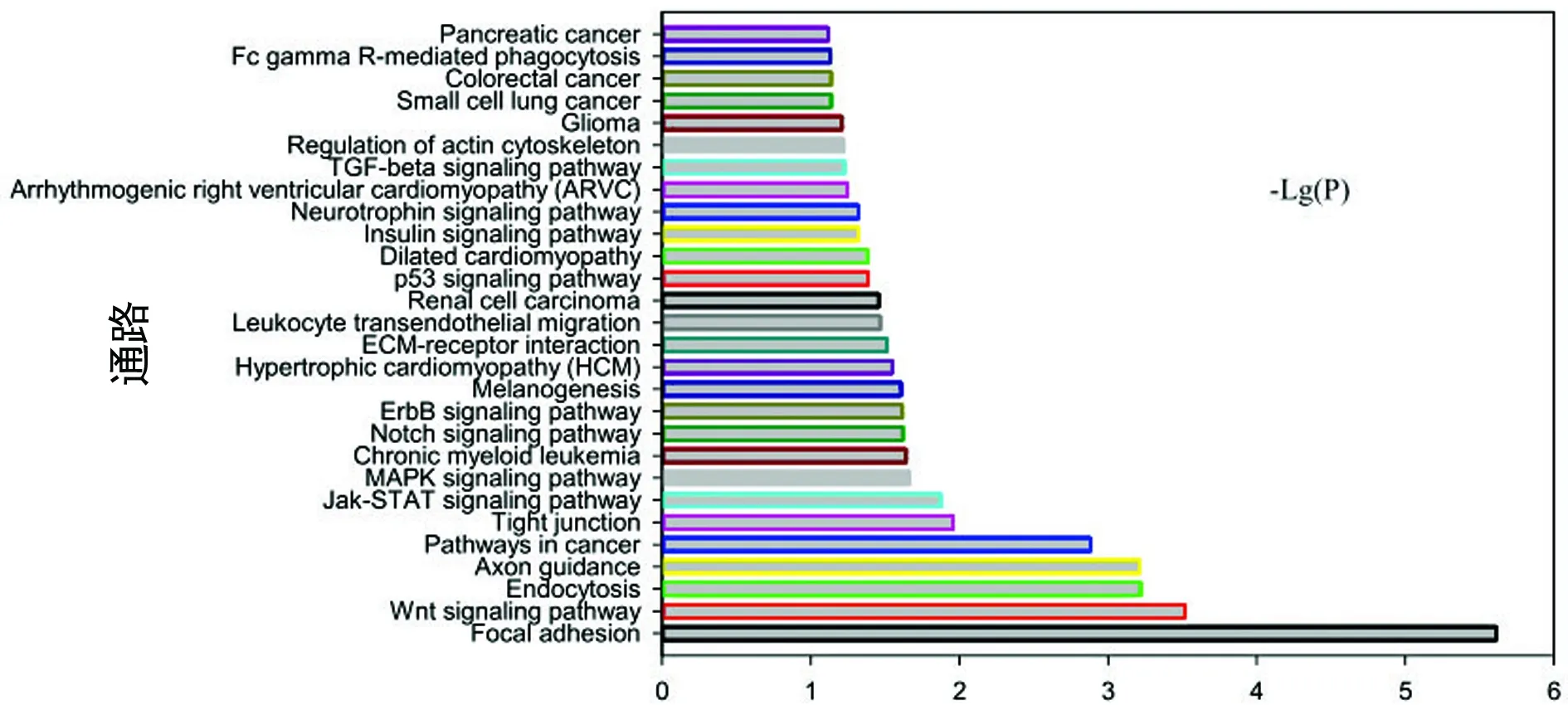
图1 轻度慢乙肝组/慢性HBV携带者组上调差异 miRNAs的靶基因通路
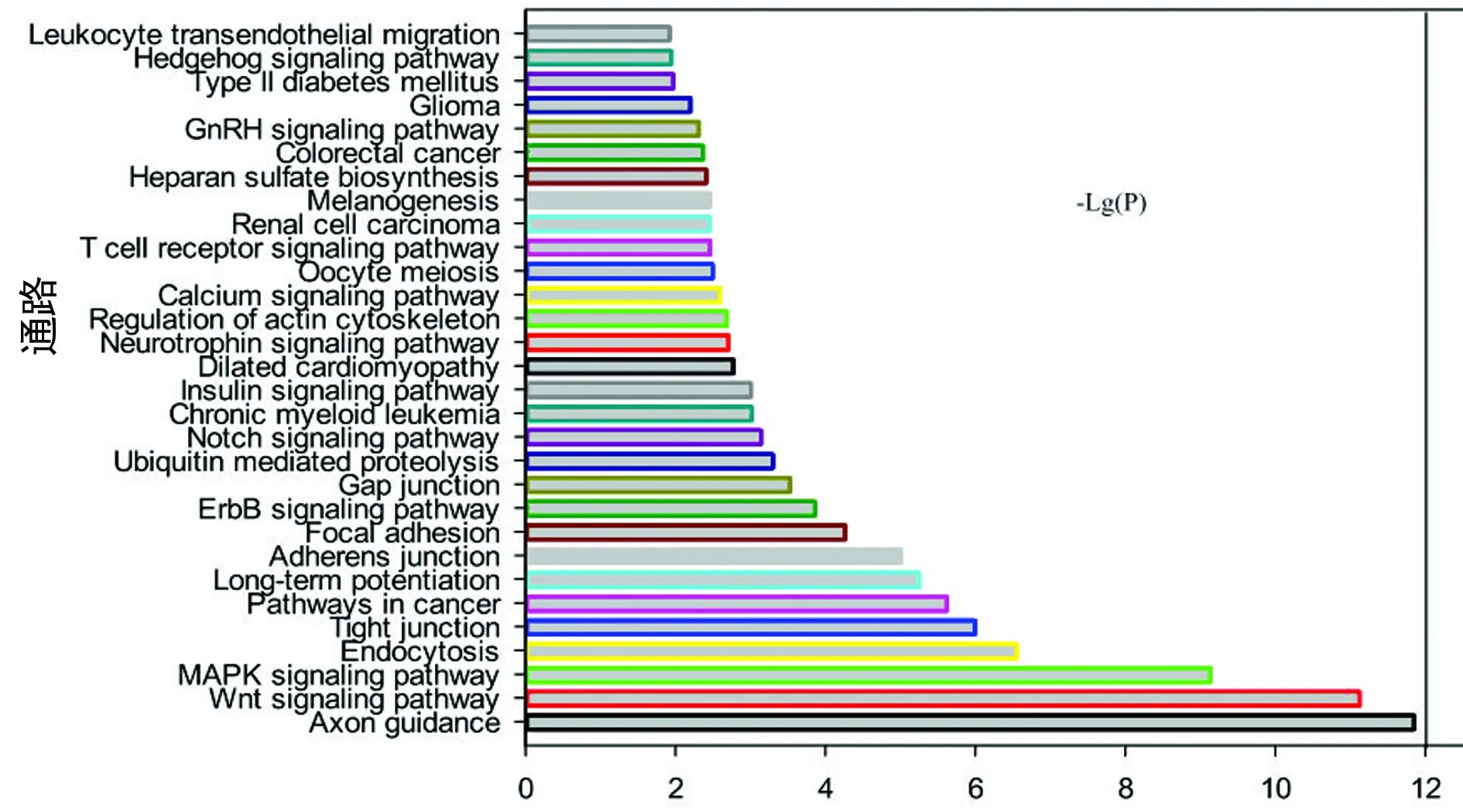
图2 轻度慢乙肝组/慢性HBV携带者组下调差异 miRNAs的靶基因通路
3 讨 论
本研究借助Agilent Human miRNA 8×60 k微阵列芯片技术筛选慢乙肝组与慢性HBV携带者组之间差异miRNAs谱,其中显著性(2倍以上)差异表达30条,19条上调,11条下调。进一步借助miRNA生物信息学分析软件DAVID对差异miRNAs预测靶基因功能进行GO富集分析发现,其功能主要涉及生物黏附、氮化合物的代谢过程的正/负调控、生物合成过程的正/负调控、大分子生物合成过程中的积极调控、细胞生物合成过程中的正/负调控、蛋白氨基酸的磷酸化、基因表达的正/负调控、Wnt受体信号通路、钙离子转运等生命过程。KEGG分析结果提示其主要涉及Notch信号通路、钙信号通路、Hedgehog信号通路、mTOR信号通路、p53信号通路、O-聚糖的生物合成、轴突导向、脂肪细胞因子信号通路、趋化因子信号通路、Wnt信号通路、MAPK信号通路、胰岛素信号通路、神经营养因子信号通路、T细胞受体信号传导途径、TGF-β信号通路等。
本研究发现miRNA可以影响JAK-STAT信号传导途径,HBV及其抗原成分能够选择性地抑制干扰素α(interferon-α)JAK-STAT信号传导途径分子和抗病毒蛋白的表达。IFN-αJAK-STAT信号传导途径分子STAT1的下调表达可能是HBV抑制IFNα抗病毒活性的机制之一[11]。作者推测特异性microRNA可能调控了JAK-STAT信号传导途径增强了IFN-α作用,增强机体免疫,进步引起肝脏炎症活动。本研究发现miR-320c可能参与Wnt信号通路、TGF-β信号通路、细胞周期、MAPK信号通路等,TGF-β1诱导的肝星状细胞细胞及HepG2细胞中Smad3C及Smad3L磷酸化、进而促进Smad2/3/4复合物形成,及其转位入核和靶基因1型纤溶酶原激活物抑制剂(plasminogen activator inhibitor-1,PAI-1)mRNA表达可能是肝纤维化-肝癌发病的重要机制,肝纤维化中MAPK信号通路能够对肝星状细胞活性产生影响[12]。MAPK抑制因子均能明显抑制HSC细胞内TGF-β1诱导的靶基因PAI-l mRNA的表达,MAPK通路参与HSC细胞内TGF-β1信号通路靶基因PAI-1转录活性的调控而影响肝纤维化。作者推测特异性miRNA通过影响MAPK通路调控下经TGF-β1/Smad 信号途径而影响慢乙肝向肝纤维化发展,这为今后开展防治乙肝后肝纤维化提供思路[13]。Th17作为一种新发现的辅助性T细胞(Helper T cells,Th),参与乙型肝炎疾病的病程发展和转归[14-15]。PI3K/AKt/mTOR信号通路参与Th17的增殖、分化[16],此信号通路的过度激活可导致正常细胞的自噬和凋亡紊乱,PI3K/AKt/mTOR信号通路可能激活Th17,促使CHB向肝硬化、肝细胞癌发展,推测特异性miRNA调控mTOR信号通路参与了慢乙肝炎症活动进展为肝硬化、肝癌进程。阻断Notch信号通路可减少慢性乙型肝炎患者外周单个核细胞Foxp3 mRNA的表达,Notch信号通路可能是持续感染的一个因素[17],推测miRNA调控Notch信号通路可能是HBV持续感染的作用机制之一。另外,本研究发现差异microRNA还影响了细胞增殖、生物黏附、细胞粘附、蛋白质转运、建立蛋白定位、大分子生物合成过程中的积极调控、氮化合物的代谢过程的正调控、生物合成过程中的正/负调控、细胞凋亡、蛋白氨基酸的磷酸化、转录调控、基因表达的正/负调控、RNA的生物合成等多个生命过程,这些影响在慢乙肝炎症活动中的作用仍需进一步验证。
总之,本研究得到慢乙肝炎症活动的差异miRNAs谱,初步揭示慢乙肝炎症活动(打破免疫耐受状态)机制,这些差异miRNAs可能作为慢乙肝炎症活动或其他肝脏相关疾病的潜在生物学标志物,但仍需进一步验证研究。
[1]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:New estimates of age-specific HBsAg seroprevalence and endemicity[J].Vaccine,2012,30(12):2212-2219.
[2]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095-2128.
[3]Liang X,Bi S,Yang W,et al.Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2009,27(47):6550-6557.
[4]Liang X,Bi S,Yang W,et al.Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China[J].J Infect Dis,2009,200(1):39-47.
[5]Berezikov E,Guryev V.Van de belt J,et al.Phylogenetic shadowing and computational identification of human microRNA genes[J].Cell,2005,120(1):21-24.
[6]邢同京,徐洪涛,王变,等.慢性乙型肝炎免疫清除相关微RNA分子的筛选及其生物信息学分析[J].中华临床感染病杂志,2014,7(5):441-446.
[7]冯洪玲,李谦.血清miRNA在乙型肝炎诊断和预后中的研究进展[J].胃肠病学和肝病学杂志,2014,23(10):1124-1126.
[8]鱼康康,施光峰,李宁.miRNA在乙型肝炎病毒感染相关肝病中的研究进展[J].中国病毒病杂志,2014,4(2):150-154.
[9]中华医学会传染病与寄生虫病学分会,肝病学分会,病毒性肝炎防治方案[J].中华传染病学杂志,2001,19(1):57-58.
[10] 中华医学会肝病学分会,感染病学分会.慢性乙型肝炎防治指南[J].中华肝脏病杂志,2005,13(12):883.
[11]管世鹤,杨凯,陆蒙吉,等.乙型肝炎病毒及其抗原成分对干扰素信号传导途径分子和抗病毒蛋白表达的影响[J].中华肝脏病杂志,2011,19(6):440-444.
[12]张琴,黄涛,卓强,等.肝纤维化中MAPK信号转导通路对肝星状细胞活性的影响[J].成都医学院学报,2014,9(4):493-496.
[13]谢雷.MAPK通路调控下经TGF-1/Smad 信号途径的肝纤维化-肝癌发病机制研究[D].合肥:安徽医科大学,2014,10.
[14]Zhang JY,Zhang Z,Lin F,et al.Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2010,51(1):81-91
[15]Ye Y,Xie X,Yu J,et al.Involvement of Th17 and Th1 effector responses in patients with Hepatitis B[J].J Clin Immunol,2010,30(4):546-555.
[16]Nagai S,Kurebayashi Y,Koyasu S.Role of PI3K/Akt and mTOR complexes in Th17 cell differentiation[J].Ann N Y Acad Sci,2013,1280(1):30-34.
[17]李小亮,裴金仙,奚敏,等.阻断 Notch1信号通路对慢性乙肝患者外周血Foxp3 mRNA表达的影响[J].胃肠病学和肝病学杂志,2011,20(1):67-70.
Study on molecular mechanism of mild chronic hepatitis inflammatory activity based on microRNAs regulation*
ZhangChuantao1,2,HuangQun2,LiuYefang2,GuoYinling2,GuHaiying1,WangFangyu2,HuRong3,HuXiaoyu1△,ZhengZhenglong2
(1.DepartmentofInfection,AffiliatedHospitalofChengduUniversityofTraditionalChineseMedicine,Chengdu,Sichuan610072,China;2.ChengduUniversityofTraditionalChineseMedicine,Chengdu,Sichuan610075,China;3.DepartmentofLiverDiseases,ChengduInfectiousDiseaseHospital,Chengdu,Sichuan610066,China)
Objective To reveal the molecular mechanism of inflammatory activity of mild chronic hepatitis B from the perspective of microRNAs regulation.Methods The cases conforming to the standard were divided into the mild chronic hepatitis B group and chronic HBV carriers group.The Agilent Human miRNA 8×60 k microarray chip was used to detect the expression profiles of microRNAs in plasma in order to achieve different expression spectrum of microRNAs between the two groups (P<0.05).Then the miRNA bioinformatics analysis software was used to predict the target gene,and did target genes GO functional enrichment analysis and pathway analysis.Results A total of 65 microRNAs bands were differentially expressed between the two groups (P<0.05),38 bands were up-regulated,27 bands were down-regulated.The GO analysis and Pathway analysis showed that the function mainly involved in cell proliferation,bioadhesion,positive/negative regulation of biosynthesis,positive/negative regulation of macromolecular biosynthesis,phosphorylated of protein amino acids,biosynthesis of RNA,Wnt signaling pathway,MAPK signaling pathway,Notch signaling transduction pathway,Hedgehog signaling pathway,T cell receptor signaling pathway,TGF-β signaling pathway,mTOR signaling pathway,chemokine signaling pathway,JAK-STAT signaling pathway,calcium ion signaling pathway,etc.Conclusion The inflammatory activity of mild chronic hepatitis B is regulated by specific microRNAs,involving multiple life processes and pathways.
mild chronic hepatitis B;inflammatory activity;microRNAs regulation
10.3969/j.issn.1671-8348.2016.32.021
国家自然科学基金资助项目(81202624)。 作者简介:张传涛(1981-),副主任医师,博士,从事肝病及感染病研究。△
R512.6+2
A
1671-8348(2016)32-4527-04
2016-05-03
2016-07-29)

