前列腺素E1联合血必净注射液对Ⅳ期糖尿病肾病患者尿蛋白及炎性因子的影响*
刘玉玲
(青海红十字医院肾内科,西宁 810001)
前列腺素E1联合血必净注射液对Ⅳ期糖尿病肾病患者尿蛋白及炎性因子的影响*
刘玉玲
(青海红十字医院肾内科,西宁 810001)
目的 观察并探讨前列腺素E1(PGE1)注射液联合血必净注射液对Ⅳ期糖尿病肾病(DN)患者尿蛋白及炎性因子的影响。方法 将2013年1月至2015年6月入选的132例Ⅳ期DN患者分为观察组(67例)和对照组(65例),两组均予基础治疗,对照组加用血必净注射液,观察组在对照组基础上加用PGE1注射液,疗程均为14 d,比较治疗前后两组肾功能、尿蛋白及炎性因子变化情况。结果 治疗后,两组血清尿素氮(BUN)、血清肌酐(Scr)、24 h尿微量总蛋白(24 h Upro)、24 h尿微量清蛋白(24 h mAlb)、微量尿蛋白排泄率(UAER)均较治疗前显著下降(P<0.05);观察组治疗后BUN、24 h Upro、24 h mAlb、24 h UAER数值显著低于对照组,差异有统计学意义(P<0.05)。两组治疗后肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、C反应蛋白(CRP)水平均较治疗前明显下降(P<0.05),超氧化物歧化酶(SOD)明显上升(P<0.05);观察组治疗后TNF-α、IL-6、CRP数值均明显低于对照组(P<0.05),SOD明显高于对照组(P<0.05)。观察组、对照组治疗期间药物不良反应比较,差异无统计学意义(P>0.05)。结论 PGE1联合血必净注射液治疗Ⅳ期DN可有效减轻肾脏炎症反应、减少尿蛋白、改善肾功能。
糖尿病肾病;前列腺素E1;血必净注射液;尿蛋白;炎性因子;氧化应激
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的微血管并发症,患者一旦出现持续性蛋白尿则病情不可逆转,最终将发展终末期肾病,是糖尿病患者主要死因之一。文献报道[1],2型糖尿病(T2DM)患者15年后罹患DN的概率高达20%~30%。目前DN治疗共识为在控制血糖、血压、血脂基础上予扩管、抗炎、抗凝等综合治疗[2]。血必净注射液具有减少炎性渗出、降低血小板黏附性、改善微循环作用,可保护肾病患者的肾小球、肾小管功能[3]。前列腺素E1(PGE1)是一种血管活性药物,能抑制血管平滑肌细胞游离Ca2+及交感神经末梢释放去甲肾上腺素,舒张血管平滑肌,改善肾血流动力异常,减轻肾小管细胞凋亡,并降低血清尿素氮(BUN)、血清肌酐(Scr)水平与尿蛋白排泄[4]。本文对Ⅳ期DN在常规治疗基础上,加用血必净注射液与PGE1注射液,效果明显,现报道如下。
1 资料与方法
1.1 一般资料 以2013年1月至2015年6月收治的132例Ⅳ期DN患者为研究对象。男76例,女56例,年龄54~77岁,平均(64.7±8.2)岁;DN病程9~20年,平均(14.8±3.4)年;合并高血压87例,血脂异常47例。患者入组后根据电脑随机数字分为观察组(67例)和对照组(65例),两组患者基础临床特征经比较差异无统计学意义(P>0.05),见表1。研究获得医院医学伦理委员会审查批准。纳入标准:年龄,50~<80岁,5年以上T2DM病史,Mogensen DN分期Ⅳ期尿微量清蛋白(mAlb)>300 mg或大于0.5~<2.5 g,Scr<350 μmol/L,血糖控制稳定(糖化血红蛋白小于7.0%),患者知情同意。排除标准:对研究药物有禁忌证者;其他原发性肾脏疾病者;酮症酸中毒者;心功能不全者;肝转氨酶高于正常值上限1.5倍者、肿瘤患者。DN诊断参照《内科学》[5]标准。
1.2 方法
1.2.1 治疗方案
1.2.1.1 基础治疗 低盐、低脂、优质蛋白饮食,适量运动,控制空腹血糖在7.0 mmol/L以下,餐后2 h血糖在11.0 mmol/L以下,高血压病者积极控制血压,在上述基础上口服血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)类药物,若患者血脂异常可口服他汀类药物调脂治疗。
1.2.1.2 对照组 在上述治疗基础上加用血必净注射液(每支10 mL,天津红日药业有限公司,国药准字Z20040033),100 mL血必净注射液加入200 mL 5%葡萄糖液静脉滴注,每日2次,连续14 d。
1.2.1.3 观察组 在对照组基础上加用PGE1注射液(每支10 μg,哈药集团生物工程有限公司,国药准字H20084565),20 μg PGE1加入100 mL生理盐水静脉滴注,每日1次,连续14 d。
1.2.2 检测指标
1.2.2.1 肾功能指标测定 治疗前与治疗14 d后,空腹采肘正中静脉血,分离血清,采用贝克曼库尔特AU5800全自动生化分析仪测定尿素氮(BUN)、血肌酐(Scr)水平;同时间,留取24 h尿液,采用西门子BNTMⅡ全自动蛋白分析仪及配套试剂盒(免疫散射比浊法)测定24 h尿微量总蛋白(Upro)、mAlb,并嘱留尿前24 h内禁高蛋白饮食,据公式:尿清蛋白(μg/mL)×24 h尿量(mL)/(24×60)计算微量尿蛋白排泄率(UAER)。
1.2.2.2 炎性因子指标测定 同期采外周静脉血,前处理后,采用美国贝克曼流式细胞仪及配套试剂盒(双抗体夹心ELISA法)测定肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6);采用贝克曼库尔特AU5800全自动生化分析仪及配套试剂盒(散射比浊法)测定C反应蛋白(CPR);采用芬兰Wallac1210化学发光仪(黄嘌呤氧化酶法)测定超氧化物歧化酶(SOD),试剂盒购自上海信裕生物科技有限公司。

2 结 果
2.1 肾功能比较 治疗14d后,两组BUN、Scr、24hUpro、24hmAlb、24hUAER均较治疗前显著下降(P<0.05)。观察组治疗后BUN、24hUpro、24mAlb、UAER数值显著低于对照组,差异有统计学意义(P<0.05),见表2。
2.2 炎性因子比较 治疗14d后,两组TNF-α、IL-6、CRP水平均较治疗前明显下降,SOD明显上升,治疗前后差异有统计学意义(P<0.05)。观察组治疗后TNF-α、IL-6、CRP数值均明显低于对照组,SOD明显高于对照组,两组治疗后上述数值差异有统计学意义(P<0.05),见表3。
2.3 药物不良反应比较 观察组、对照组治疗期间分别有6例(9.0%)、5例(7.7%)出现肝转氨酶轻度升高(χ2=0.069,P=0.793);观察组有4例(6.0%)在滴注PGE1过程中注射部位出现胀痛、红肿,局部予硫酸镁溶液湿敷后减轻(P=0.119)。
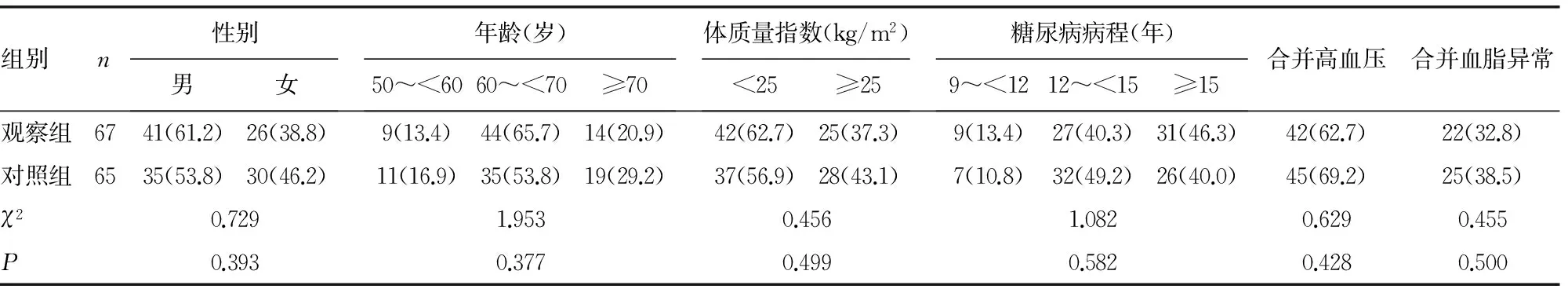
表1 两组DN患者一般临床特征比较[n(%)]

表2 两组DN患者治疗前后肾功能比较
a:P<0.05,与同组治疗前比较;b:P<0.05,与对照组治疗后比较。

表3 两组DN患者治疗前后血清炎性因子比较
a:P<0.05,与同组治疗前比较;b:P<0.05,与对照组治疗后比较。
3 讨 论
DN主要病理变化过程为:肾皮质过氧化反应致使肾小球滤过屏障足细胞受损与基底膜的裸露,肾小球组织形态学发生变化引起蛋白尿的产生[6]。DN早期肾血流量及肾小球滤过率增加,随后出现微量蛋白尿,炎性反应随之加重,肾脏微血管发生病变,继而出现大量蛋白尿,肾小球滤过率明显下降直至肾功能衰竭。目前认为,多元醇旁路激活、活性氧簇(ROS)导致的氧化应激反应、肾脏血流动力异常、凝血纤溶异常及糖、脂、蛋白质代谢紊乱等因素是DN病变的独立危险因素和病理基础[7]。现代医学公认的治疗Ⅳ期DN的有效方法有降压、降糖、调脂、抗炎、抗凝等综合措施,以减少蛋白尿的产生,改善肾功能。
祖国传统医学认为DN属于“血瘀”“水肿”“尿浊”“劳淋”范畴,病机为元气亏虚、脾气不升,气化无力而不能助血,血行受阻,久则必瘀。血必净注射液为红花、川芎、当归、赤芍、丹参等提取物,红花、川芎、当归具有活血祛瘀、疏风止痛之功,赤芍清热凉血,丹参祛淤消痈,诸药合用发挥清热凉血、疏通脉络、化瘀止痛的功效。现代药理学表明,血必净注射液中的活性成分能抑制内源性炎性介质的失控性释放,并具有抑制血小板聚集、改善微循环与组织灌注的功效[8]。临床研究报道,血必净注射液可显著降低高血压肾病患者的炎性介质及纤维蛋白原水平,保护血管内皮细胞,并可减轻血液高凝状态,改善肾组织缺血缺氧[3]。PGE1是人体内的重要生物活性物质,既往研究表明:PGE1可抑制血管平滑肌细胞游离Ca2+及交感神经末梢释放去甲肾上腺素,舒张血管平滑肌,改善血液动力学;能降低患者血液黏度、红细胞聚集指数及血栓烷素A2的生成及纤维蛋白原水平,改善血液高凝状态[9];同时可激活脂蛋白酶及促进三酰甘油水解,降低血液黏稠度及血脂水平[10];此外,还可刺激血管内皮细胞产生组织型纤溶酶原激活物(t-PA),有一定溶栓作用[11]。P38丝裂原蛋白激酶信号通路激活能促进炎性因子生成,可促进系膜细胞增殖和肾小管纤维化,是DN的重要发病机制之一[12]。近年来,动物实验表明[13],PGE1注射液抑制肾P38丝裂原蛋白激酶信号通路及金属机制蛋白酶-9、环氧化酶-2、TNF-α的表达,发挥肾保护作用;PGE1可刺激肾脏内皮祖细胞的生成,间接完成内皮细胞的修复,进而保护肾小球滤过膜的生理完整性[14]。因此,PGE1上述功效理论上能增加肾内血流量,改善肾小球高压、高灌注、高滤过状态,有助于DN的临床治疗。
24hUpro及24hUAER是评估DN病情和治疗效果的重要指标。本研究中,观察组在对照组使用血必净注射的基础上加用PGE1注射液,治疗14d后观察组BUN、24hUpro、24hmAlb、24hUAER数值均显著低于对照组,充分说明加用PGE1后,观察组DN的病情延缓程度优于对照组。另有报道,DN患者给予前列腺素E1间歇性疗法(每次10μg,每日2次,每月7d,连续 3个月),尿蛋白定量和肾小球滤过率较未使用PGE1者明显改善[15],主要结论与本文一致。考虑到炎性因子生成增多、氧化应激、反应增强、血管内皮受损是肾细胞损伤的重要病理基础,本文对联合用药后外周血炎性因子与SOD变化情况进行了观察。TNF-α是炎性反应的最初启动者,具有诱导肾小球血管内皮细胞表达轴附因子,增强内皮细胞促凝血因子、纤溶酶原激活抑制因子表达的作用,能促进肾小球系膜细胞增殖;IL-6是二级炎性反应介质的主要成分,活化补体,加重免疫损伤;CRP是急性时相非特异性蛋白,可激活补体,产生大量炎症介质并释放氧自由基,加剧炎性反应;SOD是对抗氧自由基的第一道防线,SOD水平下降反应机体抗氧化酶系统的不断削弱。本研究结果中,观察组加用PGE1 14d后,TNF-α、IL-6、CRP水平均明显低于对照组,SOD水平明显高于对照组,说明PGE1具有明显的抑制炎性因子生成的作用,可减轻肾脏炎性反应,降低体内氧化应激反应水平,改善血管内皮功能,保护肾脏功能。
综上所述,Ⅳ期DN在常规治疗基础上,联合使用PGE1注射液与血必净注射液,除可改善局部微循环、减轻肾组织细胞缺血再灌注损伤外,尚能有效发挥抑制炎性因子生成,降低机体氧化应激反应的功效,进而实现保护肾组织内皮功能、延缓微血管病变、降低尿蛋白排泄的功效,改善肾功能。
[1]杨华杰,赵军玉,邵丽辉.前列腺素E1 10μg/d与20μg/d治疗糖尿病肾病疗效比较[J/CD].中华临床医师杂志(电子版),2014,8(24):4379-4382.
[2]柳张化.前列腺素E1治疗糖尿病肾病患者的疗效及其对血浆纤维蛋白原的影响[J].实用临床医药杂志,2014,18(33):97-99.
[3]崔玉玲,张晓波,裴晶.老年高血压肾病患者常规治疗加血必净注射液的治疗效果[J].实用医药杂志,2015,31(7):312-313.
[4]牟亚汝,周颖,张钟文,等.前列腺素E1对糖尿病肾病大鼠肾功能及肾组织细胞凋亡的影响[J].山东医药,2012,52(6):26-28.
[5]叶任高,陆再英.内科学[M].6版.北京:人民卫生出版社,2000,798-802.
[6]LiL,EmmettN,MannD,etal.Fenofibrateattenuatestubulointerstitialfibrosisandinflammationthroughsuppressionofnuclearfactor-KBandtransforminggrowthfactorβ1/Smad3indiabeticnephropathy[J].ExpBiolMed(Maywood),2010,235(3):383-391.
[7]ReddyMA,ParkJT,NatarajanR.Epigeneticmodificationsanddiabeticnephropathy[J].KidneyResClinPract,2012,31(3):139-150.
[8]冀兰盒,黄浩,姜民等.HPLC测定血必净注射液内11种主要成分[J].中国中药杂志,2010,35(18):2395-2398.
[9]丁红,王宗谦,闵睿.脂微球前列腺素E1对老年糖尿病肾病患者血液流变学的影响[J].中国老年学杂志,2011,31(5):1770-1771.
[10]朱炜丹,陈丽华,陈江华.前列腺素E1对早期糖尿病肾病患者UAER和内皮细胞功能vWF水平的影响[J].浙江医学,2014,36(19):1638-1639.
[11]王珊珊,常宝成,单春艳,等.前列地尔序贯疗法治疗老年临床糖尿病肾病期患者的疗效观察[J].中华老年医学杂志,2014,33(2):154-158.
[12]ZhangX,LaiD,BaoS,etal.Triamcinoloneacetonideinhibitsp38MAPKactivationandneuronalapoptosisinearlydiabeticretinopathy[J].CurrMolMed,2013,13(6):946-958.
[13]彭丽,王扬天,李洁,等.贝前列腺素钠对2型糖尿病大鼠肾P38丝裂原蛋白激酶信号通路的影响[J].医学研究生学报,2012,25(5):481-484.
[14]陈浩,黄炫赓,何玉玲.前列腺素E1治疗糖尿病肾病I期临床疗效观察[J].中国临床新医学,2012,5(3):222-224.
[15]郭炜,许敏,陆学胜,等.前列腺素E1间歇性疗法治疗糖尿病肾病临床疗效[J].临床荟萃,2013,28(12):1340-1342.
Effects of prostaglandin E1 combined with Xuebijing Injection on urine protein and inflammatory factors in patients with stage Ⅳ diabetic nephropathy
LiuYuling
(DepartmentofNephrology,QinghaiRedCrossHospital,Xining,Qinghai810001,China)
Objective To observe and explore the effects of prostaglandin E1(PGE1)injection combined with Xuebijing Injection on urinary protein and inflammatory factor of the patients with stage Ⅳ diabetic nephropathy(DN).Methods The selected 132 patients with stage Ⅳ DN from January 2013 to June 2015 were randomly divided into the observation group(67 cases)and control group(65 cases).The two groups were given the basic treatment.The control group was added with Xuebijing Injection,based on which the observation group was added with PGE1 injection.Treatment course lasted for 14 d.The changes of renal function,urinary protein and inflammatory factors before and after treatment were compared between the two groups.Results Serum BUN,Scr,24 h Upro,24 h mAlb and 24 h UAER after treatment in the two groups were decreased significantly compared with before treatment(P<0.05);BUN,24 h Upro,24 h mAlb and 24 h UAER after treatment in the observation group were significantly lower than those in the control group,the differences were statistically significant(P<0.05).The levels of TNF-α,IL-6 and CRP after treatment in the two groups were significantly decreased compared with before treatment(P<0.05),SOD increased significantly(P<0.05);the levels of TNF-α,IL-6 and CRP after treatment in the observation group were significantly lower than those in the control group(P<0.05),while the SOD level was significantly higher than that in the control group(P<0.05).The adverse drug reactions during treatment process had no statistical differences between the observation group and control group(P>0.05).Conclusion PGE1 injection combined with Xuebijing Injection in treatment of stage Ⅳ DN can effectively reduce renal inflammation reaction,decreases urinary protein and improves renal function.
diabetic nephropathy;prostaglandin E1;Xuebijing Injection;urinary protein;inflammatory factor;oxidative stress
刘玉玲(1972-),副主任医师,本科,主要从事肾病内科临床及血液透析方面的工作。
论著·临床研究
10.3969/j.issn.1671-8348.2016.32.018
R692.9
A
1671-8348(2016)32-4517-03
2016-04-09
2016-05-22)

