老年晚期非小细胞肺癌患者循环肿瘤细胞与EGFR-TKI疗效的相关性研究*
何文杰,江 波△,金从国,涂长玲,朱 颖,陈晓群
(昆明医科大学第三附属医院:1.干部医疗科;2.肿瘤研究所,昆明 650118)
论著·临床研究
老年晚期非小细胞肺癌患者循环肿瘤细胞与EGFR-TKI疗效的相关性研究*
何文杰1,江 波1△,金从国2,涂长玲1,朱 颖1,陈晓群2
(昆明医科大学第三附属医院:1.干部医疗科;2.肿瘤研究所,昆明 650118)
目的 探讨老年晚期非小细胞肺癌患者循环肿瘤细胞(CTC)的表达与表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)疗效相关性。方法 66例老年晚期非小细胞肺癌的患者,以全部患者CTC表达数值的中位数为分界点,高于中位数的为高表达组,低于中位数的为低表达组均予EGFR-TKI类药物治疗,对其疗效及预后进行对比。生存分析采用Kaplan-Meier法,Logrank法检验及Cox多因素回归分析。结果 疗效方面CTC低表达组有效率为53.3%(16/30);CTC高表达组有效率为27.8%(10/36),两组差异有统计学意义(P<0.05)。预后方面CTC低表达组和CTC高表达组,中位总生存时间分别为22.8个月(95%CI:18.9~26.8个月)和18.3月(95%CI:14.8~21.9个月),中位无进展生存时间分别为11.5个月(95%CI:15.0~8.1个月)和5.6个月(95%CI:2.9~8.2个月),两组比较差异有统计学意义(P<0.05)。结论CTC表达水平的变化与EGFR-TKI治疗的疗效及预后呈负相关,可作为老年晚期非小细胞肺癌患者EGFR-TKI治疗的疗效及预后的预测指标。
癌,非小细胞肺;循环肿瘤细胞;表皮生长因子受体-酪氨酸激酶抑制剂
非小细胞肺癌(non-small cell lung cancer,NSCLC)已成为导致人口死亡的重要疾病之一。局部肿瘤的进展及血行转移是导致患者死亡的主要原因。而肿瘤远处转移的前提是肿瘤细胞能够进入外周血中形成循环肿瘤细胞(circulating tumor cell,CTC)[1]。老年NSCLC患者初诊时多已属晚期,且其心肺功能差,并发疾病多,往往失去了手术及化放疗的机会。表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)已成为具有EGFR突变的晚期NSCLC患者一线治疗。但耐药性的发生限制了EGFR-TKI的使用。如何在治疗过程中适时评估EGFR-TKI疗效及预后是一个难题。多项临床研究均显示CTC表达水平的变化与肺癌患者的疗效及预后密切相关[2-4]。因此本文以老年晚期NSCLC患者为研究对象,旨在探讨外周血CTC与EGFR-TKI疗效及预后之间的相关性。
1 资料与方法
1.1 一般资料 筛选本院干部医疗科2012年10月至2014年5月收治且经病理组织学诊断的老年晚期NSCLC患者66例,纳入标准:(1)年龄超过70岁;(2)经病理或脱落细胞学诊断确诊为NSCLC;(3)经影像检查为Ⅲb~Ⅳ期患者;(4)预计生存时间大于3个月;(5)既往未行化疗或放射治疗。排除标准:(1)缺乏肺癌病理学诊断;(2)已接受化疗及放射治疗;(3)依从性较差。其中男40例,女26例,男女比例为1.82∶1.00,年龄70~84岁,平均年龄76岁,病理类型:腺癌58例,鳞癌8例。TNM分期:ⅢB期4例,Ⅳ期62例,功能状态(PS)评分0~1分44例,≥2分22例。治疗前后均行胸腹部CT、彩超、颅脑MRI、心电图,血常规、血生化及肿瘤标志物检查。依据本实验数据,根据统计学的方法,以全部患者CTC表达数值的中位数68.5为分界点,高于中位数的为CTC高表达组,低于中位数的为CTC低表达组。本研究已获本院伦理委员会批准。
1.2 方法
1.2.1 治疗方法 根据医生经验从以下3种EGFR-TKI类药物中任选一种。吉非替尼片(阿斯利康公司生产)使用剂量为每次250 mg,口服,每天1次;厄洛替尼片(美国罗氏公司生产)使用剂量为每次150 mg,口服,每天1次;盐酸埃可替尼片(浙江贝达药业公司生产)使用剂量为每次125 mg,口服,每天3次。无论选择何种药物均至少服用1个月。
1.2.2 实验方法
1.2.2.1 标本采集 所有患者在治疗前先从肘正中静脉中抽血1 mL,加入肝素抗凝混匀,并在采集后2 h内进行检测。
1.2.2.2 抗体及试剂 CD45-PC5、CK18-FITC、EGFR-PE、NH4CL溶血素,均购于美国Beckman coulter公司。流式细胞仪EPICS XL(美国Beckman coulter公司)。小鼠抗人cytokeratin 18(CK18/PE)&小鼠(Isotype Control/PE)kit;小鼠抗人CD45(Leuko-cyte Common Antigen)/PE-Cy5和小鼠Isotype Control;小鼠抗人EGFR/FIT&小鼠 Isotype Control/FITC;FACSTM Permeabilizing Solution2(Perm2)破膜通透液(10×);淋巴细胞分离液。均购于美国Beckman coulter公司。
1.2.2.3 CTC的检测 取试管加入20 μL CD45-PC5、20 μL EGFR-PE和20 μL CK18-FITC,加入肝素抗凝的全血100 μL,摇匀后避光室温保存30 min。然后加入NH4CL溶血素2 mL溶血,15 min后上机检测,表达CD45-CK18+的细胞为患者外周血残留的肿瘤细胞(CTC)。取患者肝素抗凝血5 mL混匀。用磷酸盐缓冲液(PBS)或生理盐水将血液1∶1稀释。用15 mL离心管先加入Ficoll淋巴细胞分离液5 mL,再加入稀释后的血液10 mL,延管壁缓缓加入到Ficoll上层。2 300 r/min离心30 min,收集单核细胞层界面细胞,加入2 mL PBS,轻轻混匀,1 000 r/min离心5 min,弃上清液。分别取100 μL于两只流式反应管中,实验管加入20 μL CD45/PE-Cy5和20 μL CK18/PE,对照管加入同型对照IgG-PC5、IgG-PE,室温避光静置反应30 min,加入2 mL PBS,轻轻混匀,1 000 r/min离心5 min,弃上清液。两管中分别加入1%多聚甲醛500 μL,室温避光反应10 min,PBS漂洗离心去上清液。两管中分别加入破膜通透液500 μL,室温避光反应10 min,PBS漂洗离心去上清液。
1.2.3 疗效评价 疗效按WHO实体瘤评价标准分为:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD),疾病进展(PD),CR+PR为有效,CR+PR+SD为控制。无进展生存期(progression free survival,PFS)指自治疗首日至病变进展日;总生存期(overall survival,OS)为自治疗首日至死亡日或失访日,均以月计算。
1.3 统计学处理 应用SPSS16.0统计软件进行分析,非正态性分布数据用M(P25,P75)表示,采用配对秩和检验进行分析;生存分析采用Kaplan-Meier法,Log rank法检验及Cox多因素回归分析;以P<0.05为差异有统计学意义。
2 结 果
2.1 CTC与临床因素的关系 在66例患者中,CTC表达在不同性别、年龄、病理类型、分化程度、临床分期、PS评分间差异无统计学意义(P>0.05),见表1。
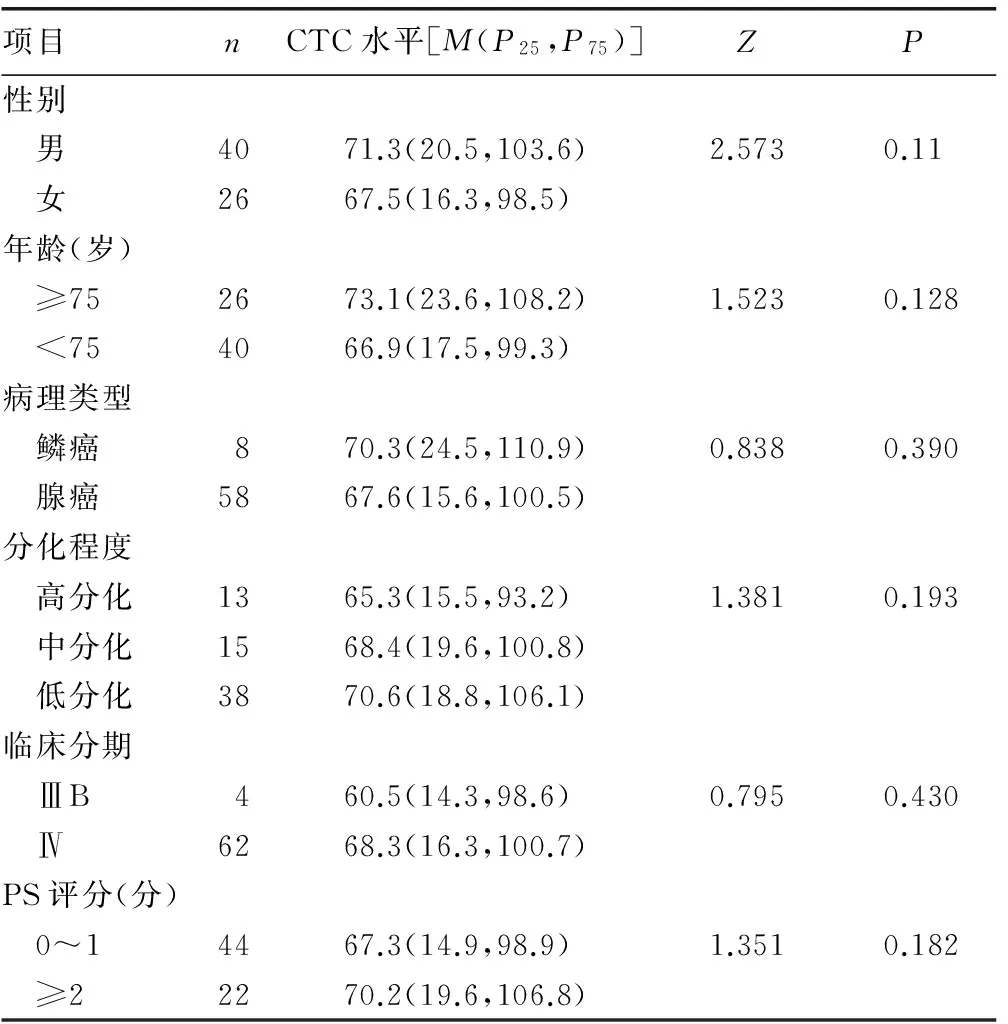
表1 晚期非小细胞肺癌CTC表达水平与临床因素的关系
2.2 CTC与EGFR-TKI疗效的关系 本组66例患者中,总有效率为39.4%(26/66),疾病控制率为60.6%(40/66)。CTC低表达组有效率为53.3%(16/30),疾病控制率为80.0%(24/30);CTC高表达组有效率为27.8%(10/36),疾病控制率为44.4%(16/36),两组差异有统计学意义(P<0.05),见表2。

表2 CTC表达水平与EGFR-TKI疗效的关系
2.3 EGFR-TKI治疗前后CTC表达水平的变化 本组66例患者中,治疗有效的40例患者CTC表达水平治疗前后变化的差异有统计学意义(P<0.05);治疗无效的26例患者CTC表达水平治疗前后变化的差异无统计学意义(P>0.05),见表3。
2.4 CTC表达水平与生存期的关系 本组病例中位OS为20.6个月(95%CI:17.9~23.4个月),1年生存率为61.8%,3年生存率为13.5%。CTC低表达组和高表达组,中位OS分别为22.8个月(95%CI:18.9~26.8个月)和18.3个月(95%CI:14.8~21.9个月),1年生存率分别为64.7%和56.2%;3年生存率分别为20.6%和6.2%。经Log rank检验,两组比较差异有统计学意义(P=0.01),见图1。本组病例中位无进展生存期(PFS)为8.6个月(95%CI:6.3~10.9个月)。CTC低表达组和高表达组,中位PFS分别为11.5个月(95%CI:8.1~15个月)和5.6月(95%CI:2.9~8.2个月);经Log rank检验,两组比较差异有统计学意义(P=0.005),见图2。
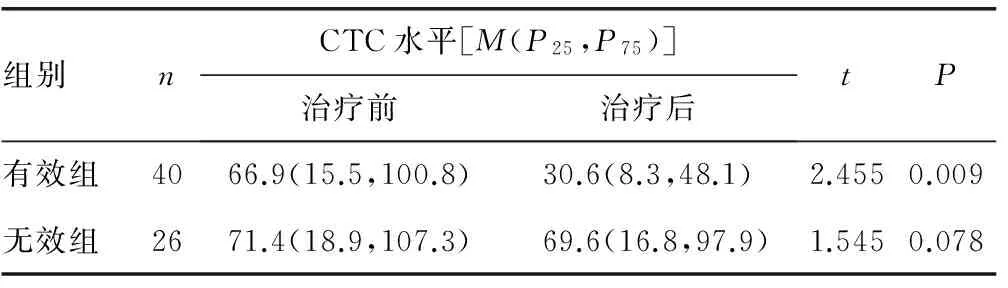
表3 治疗前后CTC表达水平的变化
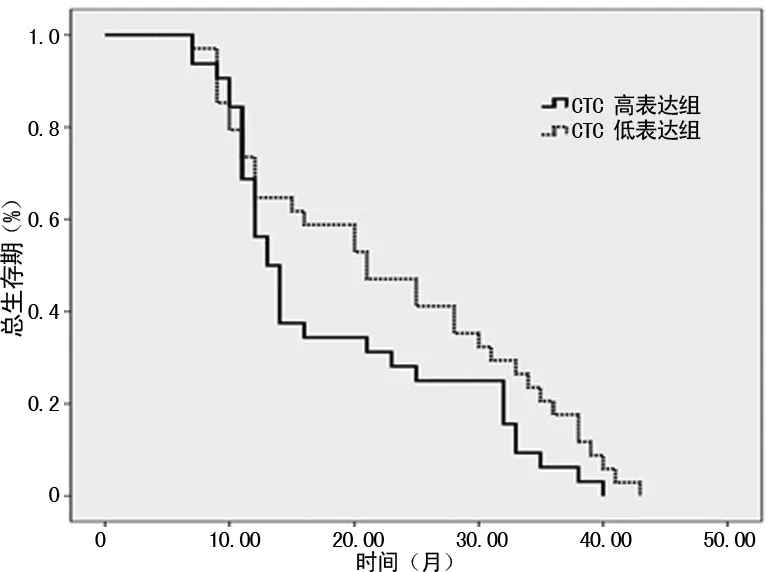
图1 晚期非小细胞肺癌CTC表达水平与生存期的关系
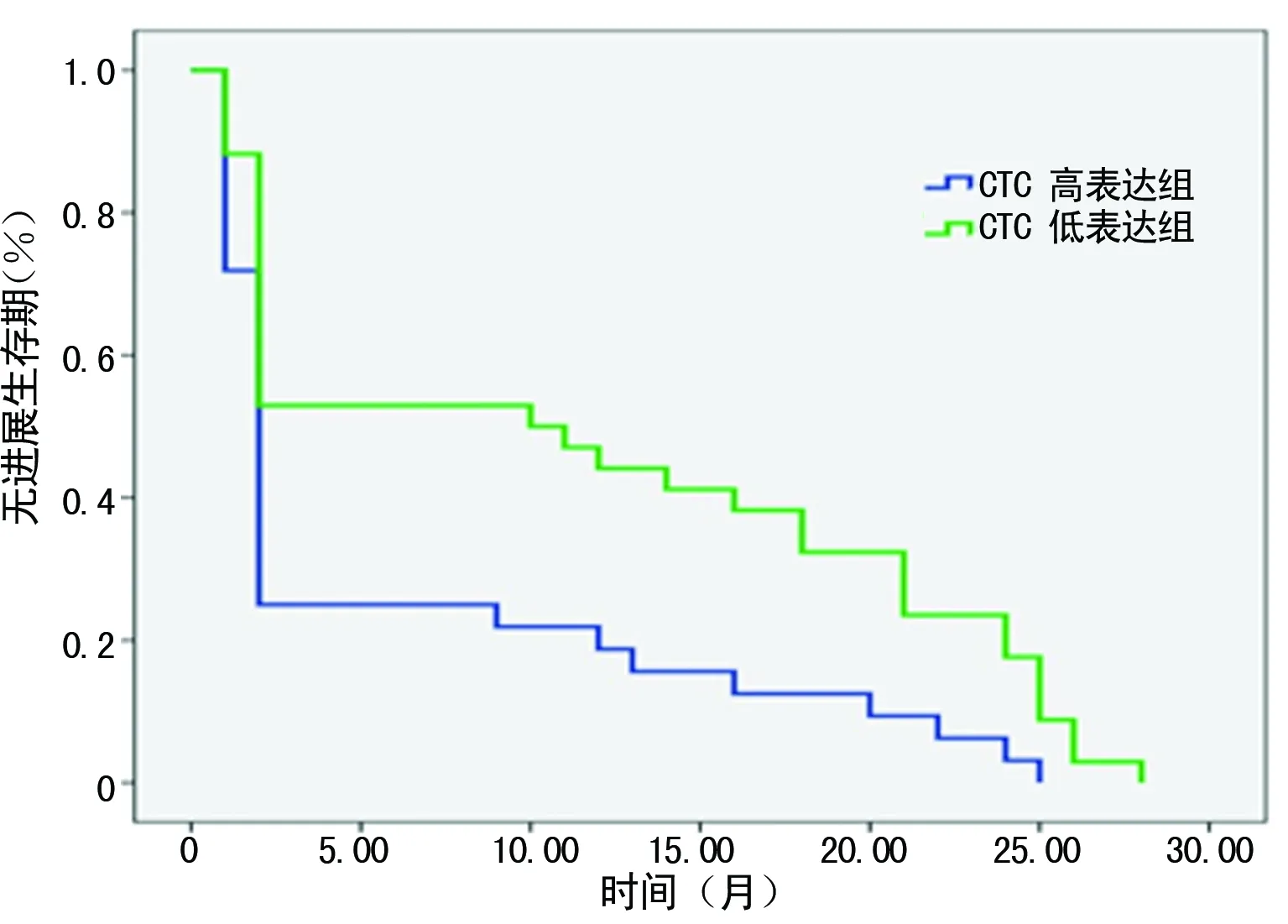
图2 晚期非小细胞肺癌CTC表达水平 与无进展生存期的关系
3 讨 论
1869年,Ashworth因在癌症死亡的患者外周血中发现了类似肿瘤的细胞,提出了CTC的概念[5]。CTC定义为因内在或外在原因,由原发灶或转移灶释放进入血循环的肿瘤细胞[6]。恶性肿瘤在增殖、发展过程中不断有肿瘤细胞脱落,部分脱落的肿瘤细胞可通过上皮间质转化(EMT)过程,在DNA水平、蛋白质修饰及细胞表型上发生改变而具有侵袭性,从而能够进入外周血循环系统,成为具有转移能力的CTC[7]。
晚期NSCLC的治疗目前仍以化疗为主,相关性研究显示CTC表达水平的变化与肺癌化疗的疗效呈负相关[5]。对于晚期初治、化疗失败的NSCLC患者而言,口服分子靶向药物酪氨酸激酶抑制剂(EGFR-TKI)是可选治疗方案之一。肿瘤细胞可通过调控EGFR的突变异常或过度表达,使肿瘤细胞生长调节失控,从而抑制肿瘤细胞的凋亡,促进其不断增殖[8]。EGFR-TKI通过阻断酪氨酸激酶的自身磷酸化,抑制EGFR的过度表达,促进细胞的凋亡,从而抑制肿瘤细胞的增殖[9]。EGFR突变阳性的患者使用EGFR-TKI治疗后可获得PFS及OS的获益,目前已经成为晚期NSCLC具有EGFR突变患者的一线治疗方案。但在临床中EGFR-TKI的应用往往受限于随后发生的耐药,其T790M、MET扩增等是诱发耐药的主要原因[10]。如何在治疗前和治疗过程中采用相对微创方法来评估EGFR-TKI类药物的疗效及预后是一个难题。
近几年来,以外周血为载体进行循环肿瘤细胞的检测及相关基因的表达越来越受到人们的重视。外周血、体液、胸腹腔积液等均可负载肿瘤细胞,具有肿瘤相关基因或蛋白的表达,理论上可成为组织的替代物。但对CTC行基因检测是否可以取代实体瘤基因检测,仍存在争议。Elizabeth等[11]发现接受EGFR-TKI治疗的NSCLC患者的CTC携带的基因信息与肿瘤组织具有高度一致性。Yamamoto等[12]研究表明在CTC中存在EGFR、MET、T790M等基因突变,可通过对CTC行基因检测来评估疗效及预后。
NSCLC患者外周血中的CTC数量较少,即使对晚期患者仍难以检测。由于这个原因,建立一种精确、可靠、可重复的技术方法从外周血检测CTC尤为重要。目前CTC检测常用方法主要有流式细胞仪、反转录聚合酶链反应(PCR,RT-PCR),Cell SearchTM系统法[12]。这些技术方法可明显提高CTC的检出率。其中,流式细胞仪是一种高速细胞分析与分选技术。它可以执行相同的细胞,主要利用荧光抗体染色,对细胞的化学和物理特性进行多参数分析[13]。因为其简单,可靠,快速的特性,已成为目前检测CTC的主要技术。
本项研究以晚期NSCLC患者的外周血为载体,利用流式细胞技术进行CTC表达水平的检测。本研究结果显示:晚期NSCLC患者口服EGFR-TKI后CTC低表达组有效率为53.3%,疾病控制率为80.0%;CTC高表达组有效率为27.8%,疾病控制率为44.4%,两组差异有统计学意义(P<0.05)。EGFR-TKI治疗有效的患者,治疗前后CTC的表达水平变化明显,治疗后比治疗前明显下降;而EGFR-TKI治疗无效的患者,治疗前后CTC的表达水平变化不明显;说明CTC表达水平的变化与EGFR-TKI的疗效呈负相关,CTC表达水平的变化可以作为晚期NSCLC患者EGFR-TKI疗效的预测指标。这与Maheswaran等[14]和Nagrath等[15]研究显示的在EGFR-TKI治疗过程中监测发现CTC表达的改变可以反映患者病情的变化趋势和治疗疗效的结果是一致的。
本研究结果还显示:CTC低表达组和高表达组,中位OS分别为22.8个月(95%CI:18.9~26.8个月)和18.3个月(95%CI:14.8~21.9个月),1年生存率分别为64.7%和56.2%;3年生存率分别为20.6%和6.2%,两组比较差异有统计学意义(P=0.01)。中位PFS分别为11.5个月(95%CI:8.1~15.0个月)和5.6个月(95%CI:2.9~8.2个月);两组比较差异有统计学意义(P=0.005)。这可能是因为CTC低表达组相比CTC高表达组具有更好的EGFR-TKI疗效及疾病控制率,从而为患者带来了更好的OS及PFS。说明CTC的表达水平与EGFR-TKI治疗的预后呈负相关,CTC低表达者较高表达者有更长的总生存期和无疾病进展生存期,CTC表达水平的变化可以作为晚期NSCLC患者EGFR-TKI治疗预后的预测指标。
目前多数研究认为,CTC表达水平的变化可以作为预测肿瘤患者疗效及预后的指标。通过本试验研究显示,CTC表达水平的变化与EGFR-TKI治疗的疗效及预后呈负相关,可以作为老年晚期NSCLC患者EGFR-TKI治疗的疗效及预后的预测指标。
[1]Yamamoto O,Takahashi H,Hirasawa M,et al.Surfactant protein gene expressions for detection of lung carcinoma cells in peripheral blood[J].Respir Med,2013,99(9):1164-1174.
[2]Hou JM,Greystoke A,Lancashire L,et al.Evaluation of circulating tumor cells and serological cell death biomarkers in small cell lung cancer patients undergoing chemotherapy[J].Am J Pathol,2012,175(2):808-816.
[3]Hofman V,Hie MI,Hofman P,et al.Detection of circulating tumor cells as a prognostic factor in patients undergoing radical surgery for non-small cell lung carcinoma:comparison of efficacy of the Cell Search AssayTMand the isolation by size of epithelial tumor cell method[J].Int J cancer,2013,129(7):1651-1660.
[4]Krebs MG,Sloane R,Pirest L,et al.Evaluation and prognostic significance of circulating tumor cells in patinets with non-small cell lung cancer[J].J Clin Oncol,2011,29(12):1556-1563.
[5]Racila E,Euhus D,Weiss AJ,et al.Detection and characterization of carcinoma cells in the blood[J].Proc Natl Acad Sci USA,2010,95(8):4589-4594.
[6]Siegel R,Naishadham D,Jemal A.Cance statistics 2013[J].CA Cancer J Clin,2013,63(1):11-30.
[7]Langley RR,Fidler IJ.The seed and soil hypothesis revisited-the role of tumor-stroma interactions in metastasisi to different organs[J].Int J Cancer,2013,128(110):2527-2535.
[8]Ragusa M,Vannucci J,Ludovini V,et al.Impact of epidermal growth factor receptor and KARS mutations on clinical outcome in resected non-small-cell lung cancer atients[J].Am J Clin Oncol,2013,24(1):485-488.
[9]Tamura K,Okamoto I,Kashii T,et al.Multicentrep rospective phase Ⅱ trial of gefitinib for advanced non-small celllung cancer with epidermal growth factor receptor mutations:results of the West Japan Thoracic Oncology Group trial(WJ TOG0403)[J].Br J Cancer,2008,198(18):1558-1563.
[10]Nguyen KS,Kobayashi S,Costa DB.Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancers dependent on the epidermal growth factor receptor path way[J].Clin Lung Cancer,2012,10(3):281-289.
[11]Punnoose EA,Atwal S,Liu W,et al.Evaluation of circulating tumor cells and circulating tumor DNA in non-small cell lung cancer:association with clinical endpoints in a phase Ⅱ clinial trial of pertuzumab and erlotinib [J].Clin Cancer Res,2012,18(9):2391-2401.
[12]Yamamoto O,Takahashi H,Hirasawa M,et al.Surfactant protein gene expressions for detection of lung carcinoma cells in peripheral blood[J].Respir Med,2014,99(9):1164-1174.
[13]Watanabe M,Serizawa M,Sawada T,et al.A novel flow cytometry based cell capture platform for the detection,capture and molecular characterization of rare tumor cells in blood[J].J Transl Med,2014,12(2):143.
[14]Maheswaran S,Sequist LV,Nagrath S,et al.Detection of mutations in EGFR in circulating lung-cancer cells[J].N Engl J Med,2013,359(4):366-377.
[15]Nagrath S,Sequist LV,Maheswaran S,et al.Isolation of rare circulating tumour cells in cancer patients by microchip technology[J].Nature,2011,450(7173):1235-1239.
Study on relationship between efficacy of EGFR-TKI and circulating tumor cell in elderly patient with advanced non-small cell lung cancer*
HeWenjie1,JiangBo1△,JinCongguo2,TuChangling1,ZhuYing1,ChenXiaoqun2
(1.DepartmentofCadres′MedicalTreatment;2.TumorResearchInstitute,ThirdAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650118,China)
Objective To investigate the association between the efficacy with epdidermal growth factor receptor-tyrosine kinase inhibitor(EGFR-TKI) and the expression of circulating tumor cells(CTC)in elderly patient with advanced non-small cell lung cancer(NSCLC).Methods Sixty-six elderly patients with advanced NSCLC were included.The median of expression number of CTC in all cases served as the cut-off point.The patients were divided into the CTC high expression group and CTC low expression group according to whether being higher or lower than the median.The two groups were given EGFR-TKKI medication therapy.The effects and prognosis were compared between the two groups.The survival analysis adopted the Kaplan-Meier method,Logrank test and Cox multivariate regression analysis.Results The efficacy rate of the CTC low expression group was 53.3%(16/30),whereas which of the CTC high expression group was 27.8%(10/36),the difference was statistically significant(P<0.05).The median overall survival time in the CTC low expression group and CTC high expression group were 22.8 months(95%CI:18.9-26.8 months)and 18.3 months(95%CI:14.8-21.9 months)respectively.The median progression-free survival time was 11.5 months(95%CI:15.0-8.1 months)and 5.6 months(95%CI:2.9-8.2 months)respectively,the difference between the two groups was statistically significant(P<0.05).Conclusion The change of CTC expression level is negatively correlated with the efficacy and prognosis of EGFR-TKI therapy and can serve as the predictive indexes of efficacy and prognosis in elderly patients with advanced NSCLC.
cancer,non-small cell lung;circulating tumor cell;epdidermal growth factor receptor-tyrosine kinase inhibitor
10.3969/j.issn.1671-8348.2016.32.015
云南省科技厅应用基础研究面上项目(2012FB164)。 作者简介:何文杰(1979-),主治医师,博士,主要从事肺癌的内科治疗及研究。△
E-mail:jiang-bo@csco.org.cn。
R
A
1671-8348(2016)32-4507-04
2016-04-08
2016-05-21)

