叉头盒转录因子O1基因多态性与中国重庆汉族人2型糖尿病相关性研究
龚莉琳,李 蓉,任 伟,王增产,白晓苏,4,张闻宇,5,汪志红,秧茂盛,张素华
(1.重庆医科大学附属第一医院内分泌科 400016;2.重庆医科大学公共卫生学院疾病基因研究室 400016;3.重庆医科大学感染性疾病分子生物学教育部重点实验室 400016;4.广东省深圳市龙华新区人民医院内分泌科 518000;5.河南省郑州市人民医院内分泌科 450003;6.吉首大学医学院药理教研室与疾病基因研究室,湖南吉首 416000)
论著·临床研究
叉头盒转录因子O1基因多态性与中国重庆汉族人2型糖尿病相关性研究
龚莉琳1,李 蓉1,任 伟1,王增产2,3,白晓苏1,4,张闻宇1,5,汪志红1,秧茂盛2,6,张素华1
(1.重庆医科大学附属第一医院内分泌科 400016;2.重庆医科大学公共卫生学院疾病基因研究室 400016;3.重庆医科大学感染性疾病分子生物学教育部重点实验室 400016;4.广东省深圳市龙华新区人民医院内分泌科 518000;5.河南省郑州市人民医院内分泌科 450003;6.吉首大学医学院药理教研室与疾病基因研究室,湖南吉首 416000)
目的 探讨叉头盒转录因子O1(FOXO1)基因单核苷酸多态性(SNPs)与中国重庆汉族人2型糖尿病(T2DM)的相关性。方法 (1)在无血缘关系的105名中国重庆汉族人中,采用PCR-RFLP和基因测序法,对FOXO1基因编码区和非编码区的15个SNPs进行筛查,连锁不平衡(LD)分析,构建单倍型。(2)选择重庆地区704名汉族人(414名T2DM患者,290名健康人)进行病例对照研究,对位于同一单倍域的5个SNPs进行基因型鉴定,分析SNPs及单倍型与T2DM的关联。结果 (1)共筛查到12个SNPs;外显子Thr488Asn在该人群中未发现多态现象。LD分析提示rs17592236、rs9577066、rs7986407、rs4581585和rs4325426位于同一单倍域内(D′>0.7)。(2)rs7986407、rs4581585与T2DM发病相关:rs7986407位点AA基因型个体T2DM患病风险是GG基因型的1.42倍(additive模式OR=1.420,95%CI:0.783~2.577,P=0.011);rs4581585位点CC基因型个体T2DM患病风险是TT基因型的2.57倍(additive模式OR=2.571,95%CI:1.404~4.695,P=0.002)。年龄、体质量指数、血糖、血脂、胰岛素、Homa-IR和Homa-β等在不同基因型间差异无统计学意义(P>0.05)。结论FOXO1基因可能是中国重庆汉族人T2DM的易感基因。
2型糖尿病;叉头盒转录因子O1;单核苷酸多态性;关联分析
2型糖尿病(type 2 diabetes mellitus,T2DM)是严重危害人类健康的常见病和多发病,它属于多基因遗传病,有明显的遗传易感性。寻找T2DM易感基因有助于尽早发现易感人群,积极干预可延缓或防止T2DM的发生[1]。
胰岛素抵抗(insulin resistance,IR)和胰岛β细胞功能障碍是T2DM的两大发病机制。研究表明叉头转录因子O1(forkhead box O1,FOXO1)与T2DM的两大发病机制密切相关:(1)细胞水平实验发现,FOXO1活化后可通过调节靶基因的转录,使肝脏糖异生增加、肝糖输出增多,脂肪细胞分化成熟障碍,肌肉细胞脂质沉积,导致IR;同时还使胰岛β细胞增殖减少、对IR的代偿能力下降,导致β细胞功能障碍[2-4]。(2)动物研究显示,IR或β细胞功能紊乱小鼠模型(InsR+/-或IRS2+/-小鼠)若同时杂合敲除FOXO1,可改善胰岛素敏感性和β细胞功能,防止糖尿病发生;而FOXO1表达增加的小鼠表现为空腹血糖升高,IR和β细胞功能障碍[4-5]。由此可见,FOXO1同时参与T2DM两大发病机制,其基因变异可能影响T2DM易感风险。
既往FOXO1基因多态性与T2DM相关性的研究不多,结果不一致[6-8]。其原因可能与人种差异及单核苷酸多态性(single-nucleotide polymorphisms,SNPs)位点的选择方式有关。因此,本研究首先选取FOXO1基因启动子、外显子、内含子及3′-非编码区的15个SNPs在中国重庆汉族人中进行筛查,连锁不平衡(linkage disequilibrium,LD)分析,构建单倍型;再选择位于同一单倍域的5个SNPs进行病例对照研究,分析FOXO1基因SNPs及其单倍型与中国重庆汉族人T2DM的关联。
1 资料与方法
1.1 研究对象 收集无血缘关系的中国重庆汉族人共704名(414名T2DM患者,290名健康对照)用于病例对照研究。从中选取105例(57名T2DM患者,48名健康人)进行FOXO1基因SNPs筛查,糖尿病诊断采用1999年WHO标准。
1.2 方法
1.2.1 病史询问和生化指标测定 研究方案经重庆医科大学附属第一医院伦理委员会批准,受试者签署书面知情同意书。按统一表格进行病史询问,测量人体学指标和血压。研究对象行75 g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),留取空腹和服糖后2 h血样用于提取基因组DNA及生化指标测定。采用葡萄糖氧化酶法测定血糖,放射免疫法测定胰岛素,自动生化分析仪检测血脂。
1.2.2 SNPs位点选择 根据NCBI公共SNP数据库,选择FOXO1基因外显子错义突变以及启动子、内含子和3′-非编码区杂合度高(杂合度大于0.1)的SNPs共15个。SNPs位点分布见图1。
1.2.3 SNPs基因型鉴定 采用酚-氯仿法提取基因组DNA,根据SNP数据库或相关文献,设计合成引物。采用聚合酶链反应-限制性酶切长度多态性分析(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法对SNPs基因型进行鉴定。每种酶切基因型选取1个PCR产物进行基因测序。各个SNPs位点的PCR引物、反应条件及限制性内切酶等见表1。

Exon:外显子;Intron:内含子;*:构建单倍型的SNPs位点。
图1 FOXO1基因SNPs筛查位点分布示意图
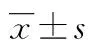
2 结 果
2.1FOXO1基因SNPs位点筛查及单倍型构建
2.1.1FOXO1基因SNPs筛查 共筛查到12个SNPs,启动子1个(rs9577097),3′-非编码区2个(rs9577066、rs17592236),内含子9个(rs2297627、rs9549244、rs4325426、rs4581585、rs7335520、rs7986407、rs6563840、rs2721069、rs2755209)。SNP数据库中报道位于启动子的rs4943803、rs12877859和外显子Thr488Asn在本人群中未发现多态现象。进一步在259个样本中(146名T2DM患者,113名健康人)对外显子Thr488Asn进行筛查,仍未发现多态现象。
2.1.2LD分析和单倍型构建 12个SNPs基因型分布均符合Hardy-Weinberg平衡(P>0.05)。LD分析显示绝大多数位点间D′ > 0.7,提示FOXO1基因内存在LD,可构建单倍型。rs9577066与rs9577097、rs7986407与rs9549244及rs7986407与rs2297627之间r2=1,提示两两间完全关联,可相互指示。于是进一步选取3′-非编码区rs17592236、rs9577066和内含子rs7986407、rs4581585、rs4325426共5个SNPs,对所有研究对象(704人)进行基因型鉴定。再次LD分析提示5个SNPs位于同一单倍域(表2)。共可构成21种单倍型,其中H1、H3、H6和H16常见,频率分别为4.2%、29.9%、21.1%和31.4%,共可解释86.6%的单倍型。
2.2FOXO1基因与T2DM的关联分析
2.2.1 研究对象一般情况 对上述位于同一单倍域的5个SNPs进行病例对照研究,研究人群临床资料见表3。校正年龄和体质量指数(bodymassindex,BMI)后,与健康对照组比较,T2DM组的血糖、血压、三酰甘油、低密度脂蛋白和胰岛素水平明显增高(P<0.01),且具有胰岛素抵抗和β细胞功能减退。

表2 FOXO1基因5个SNPs的LD分析(D′)

表3 研究对象的一般资料比较

续表3 研究对象的一般资料比较
*:P<0.01,与健康对照组比较。稳态模型胰岛素抵抗指数(Homa-IR)= [空腹血糖(FPG) × 空腹胰岛素(FINS)] / 22.5;胰岛β细胞功能评估:Homa-β= 20 ×FINS/ (FPG-3.5)。
2.2.2FOXO1基因SNPs与T2DM的关联rs17592236、rs9577066、rs7986407、rs4581585和rs4325426位点的少见等位基因分别为T、A、A、C和C,频率分别为37.3%、1.4%、28.3%、34.2%和27.6%。T2DM患者rs7986407位点的A等位基因频率明显高于健康人(31.2% vs.24.2%,χ2=7.798,P=0.005)。其余位点等位基因频率在两组间比较差异无统计学意义(P>0.05)。rs7986407和rs4581585基因型分布在两组差异有统计学意义。T2DM组rs7986407位点AA基因型频率(12.0% vs.7.4%,χ2=7.070,P=0.029)、rs4581585位点CC基因型频率(14.1% vs.6.5%,χ2=9.679,P=0.008)均明显高于对照组。其余位点基因型分布在两组间差异无统计学意义(P>0.05)。非条件Logistic回归分析显示rs7986407、rs4581585与T2DM显著相关(表4)。rs7986407位点AG或AA基因型个体对T2DM的易感性明显增加,AA基因型个体的患病风险是GG基因型的1.42倍。rs4581585位点CT或CC基因型个体对T2DM的易感性显著增加,CC基因型个体的患病风险是TT基因型的2.57倍。其余位点与T2DM无关联(P>0.05)。
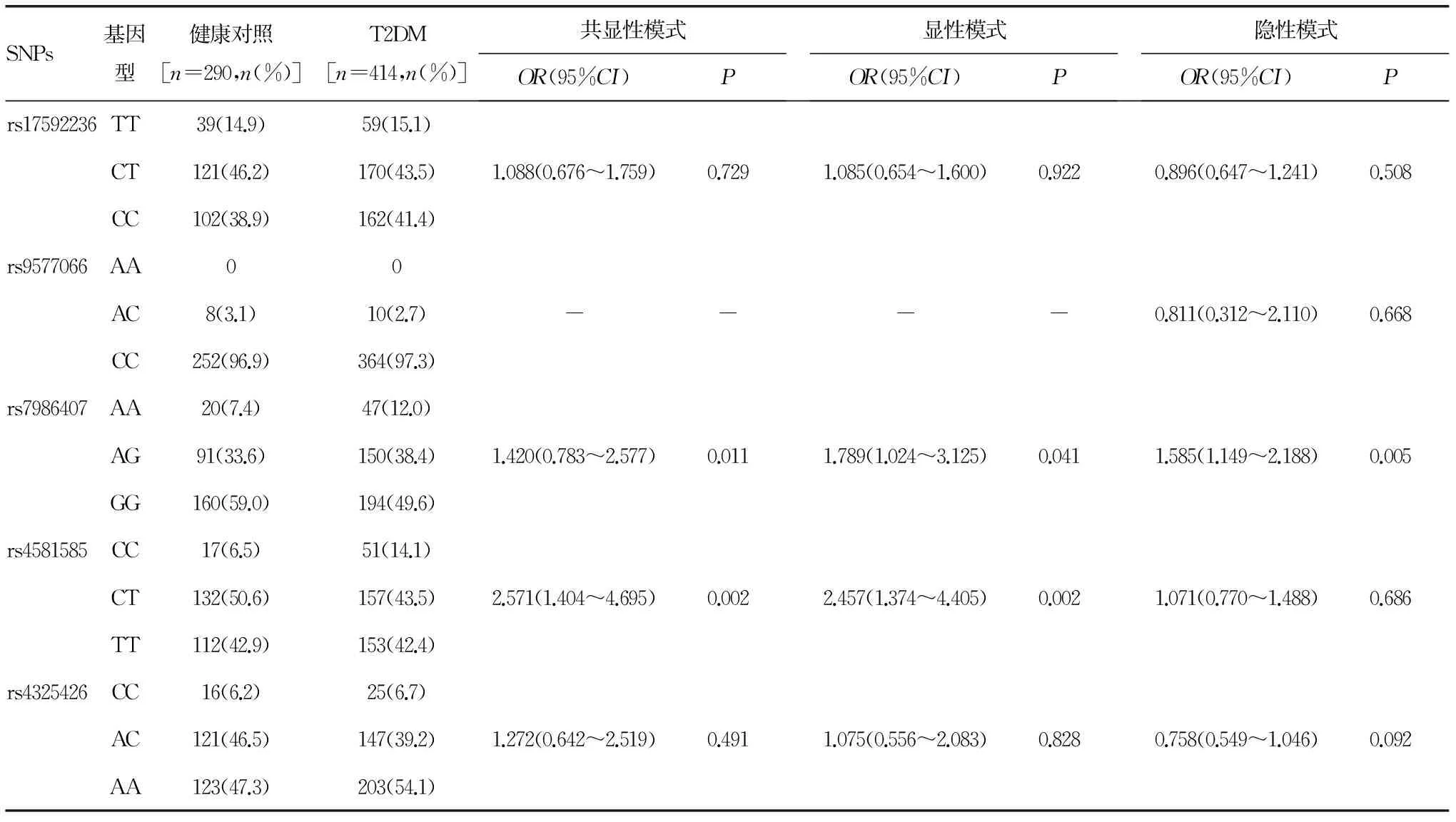
表4 FOXO1基因SNPs与T2DM的关联分析
2.2.3FOXO1基因单倍型与T2DM关联 分析4个常见单倍型H1、H3、H6、H16与T2DM的关联(表5)。T2DM组H6单倍型频率显著高于对照组(P<0.05),其余3个单倍型与T2DM无关联(P>0.05)。
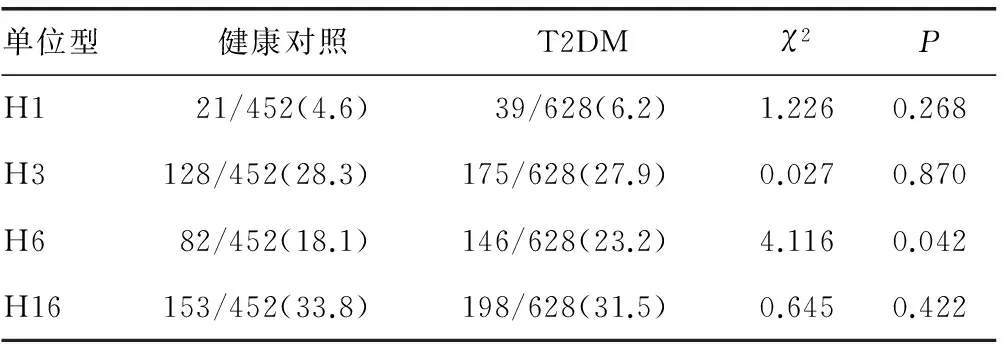
表5 FOXO1基因常见单倍型与T2DM的
2.2.4FOXO1基因SNPs不同基因型间临床指标比较 健康对照组和T2DM组,年龄、BMI、血压、血脂、血糖、胰岛素水平、Homa-IR和Homa-β等临床指标在rs7986407和rs4581585位点的不同基因型间差异均无统计学意义(P>0.05)。
3 讨 论
本研究在105名中国重庆汉族人中,对SNP库中报道的FOXO1基因编码区和非编码区15个SNPs进行筛查。结果在启动子、3′-非编码区和内含子共发现了12个SNPs。而位于启动子的rs4943803、rs12877859和外显子Thr488Asn未发现多态现象。尽管扩大样本量,共对364名受试者进行了Thr488Asn位点筛查,仍未发现多态现象。提示中国重庆汉族人rs4943803、rs12877859和Thr488Asn位点不存在多态性。
LD分析提示FOXO1基因12个SNPs存在LD,可能位于同一单倍型域内。rs9577066与rs9577097间、rs7986407、rs9549244与rs2297627间完全关联,可以相互指示。因此,本研究从中选取rs9577066和rs7986407,还同时选取了位于对基因表达可能有调控作用的3′-非编码区[9]的rs17592236及位于内含子的rs4581585和rs4325426共5个SNPs,在大样本中构建单倍型并进行关联分析。
5个SNPs两两间呈高度LD,可构成21个单倍型。比较4个常见单倍型在健康对照组和T2DM组的分布频率,可见T2DM组H6单倍型频率显著高于对照组,提示FOXO1基因H6单倍型与T2DM相关。
5个SNPs与T2DM的关联分析结果显示,T2DM患者rs7986407的A等位基因频率和AA基因型频率、rs4581585的CC基因型频率均明显高于健康人,提示rs7986407位点AA或rs4581585位点CC基因型者可能易感T2DM。进一步非条件Logistic回归分析也表明rs7986407位点AA基因型和rs4581585位点CC基因型个体T2DM患病风险显著增加。提示FOXO1基因变异与中国重庆汉族人群T2DM相关。既往在高加索人和非裔美国人中未发现FOXO1基因变异与T2DM相关[6],而在德国和芬兰人中的研究提示该基因变异与T2DM患病风险增加有关[7]。这些研究结论的不一致可能与人种差异有关。然而,Li等[8]研究提示FOXO1基因多态性与中国汉族人T2DM不相关。本研究所选择基本覆盖整个FOXO1基因的SNPs中,除rs17592236外,其余SNPs与Li等[8]所选不同,所得结论不一致可能与SNPs的选择有关。此外,本研究人群与Li等[8]的研究对象来自中国不同地域,且样本量都较小,也可能是造成彼此结论不一致的原因。因此,FOXO1基因变异与中国汉族人T2DM的关系尚需进一步多中心、大样本的研究来验证。
本研究提示FOXO1基因SNPs与T2DM患病相关,然而,这些基因变异是否可引起其功能改变从而导致T2DM呢?通常导致疾病的是外显子或启动子SNPs变异,它们可通过改变蛋白的表达和结构进而影响其功能,导致疾病发生[10]。由于本课题未在研究人群中筛查到FOXO1基因外显子Thr488Asn多态性,故未对其外显子进行研究。而本结果提示与T2DM阳性关联的2个SNPs位于内含子的中间区域。目前认为内含子也可自我剪切及调控基因表达,位于中间区域的变异可通过激活隐性剪切位点影响mRNA剪切而导致疾病[11]。因此,推测rs7986407和rs4581585可能通过激活隐性剪切位点,使FOXO1基因剪切发生改变,从而影响其功能。但这尚需进一步功能基因组学研究来证实。
尽管基础研究表明FOXO1可能通过参与胰岛素抵抗和β细胞功能减退从而促使T2DM发生。但本研究分别在T2DM阳性关联位点rs7986407和rs4581585的不同基因型间,对年龄、BMI、血压、血脂、血糖、胰岛素水平、Homa-IR和Homa-β等临床指标进行比较,结果未找到FOXO1基因与胰岛素抵抗或β细胞功能减退相关联的证据。
综上所述,本研究表明FOXO1基因rs7986407、rs4581585位点基因型分布和H6单倍型频率,在中国重庆汉族健康人和T2DM患者中存在明显差异;FX1A+60936位点AA基因型和FX1A+36829位点CC基因型可能增加T2DM患病风险。提示FOXO1基因与中国重庆汉族人T2DM相关,可能是其易感基因。
[1]BrunettiA,ChiefariE,FotiD.Recentadvancesinthemoleculargeneticsoftype2diabetesmellitus[J].WorldJDiabetes,2014,5(2):128-140.
[2]HaeuslerRA,HartilK,VaitheesvaranB,etal.IntegratedcontrolofhepaticlipogenesisversusglucoseproductionrequiresFoxOtranscriptionfactors[J].NatCommun,2014(5):5190.
[3]KitamuraT.TheroleofFOXO1inbeta-cellfailureandtype2diabetesmellitus[J].NatRevEndocrinol,2013,9(10):615-623.
[4]NakaeJ,BiggsWH,KitamuraT,etal.Regulationofinsulinactionandpancreaticbeta-cellfunctionbymutatedallelesofthegeneencodingforkheadtranscriptionfactorFoxo1[J].NatGenet,2002,32(2):245-253.
[5]KitamuraT,NakaeJ,KitamuraY,etal.TheforkheadtranscriptionfactorFoxO1linksinsulinsignalingtoPdx1regulationofpancreaticbetacellgrowth[J].JClinInvest,2002,110(12):1839-1847.
[6]KarimM,CraigRL,WangX,etal.AnalysisofFOXO1Aasacandidategenefortype2diabetes[J].MolGenetMetab,2006,88(2):171-177.
[7]MussigK,StaigerH,MachicaoF,etal.AssociationofcommongeneticvariationintheFOXO1genewithbeta-Celldysfunction,impairedglucosetolerance,andtype2diabetes[J].JClinEndocrinolMeta,2009,94(4):1353-1360.
[8]LiTJ,WuXP,ZhuXL,etal.AssociationanalysesbetweenthegeneticpolymorphismsofHNF4AandFOXO1genesandChineseHanpatientswithtype2diabetes[J].MolCellBiochem,2011,353(1/2):259-265.
[9]NewburySF.ControlofmRNAstabilityineukaryotes[J].BiochemSocTrans,2006,34(1):30-34.
[10]BrunhamLR,HaydenMR.Huntinghumandiseasegenes:lessonsfromthepast,challengesforthefuture[J].HumGenet,2013,132(6):603-617.
[11]JianXE,BoerwinkleE,LiuXM.Insilicotoolsforsplicingdefectprediction:asurveyfromtheviewpointofendusers[J].GeneMed,2014,16(7):497-503.
Correlation between FOXO1 genetic polymorphisms with type 2 diabetes in Chinese Han population from Chongqing*
GongLilin1,LiRong1,RenWei1,WangZengchan2,3,BaiXiaosu1,4,ZhangWenyu1,5,WangZhihong1,YangMaosheng2,6,ZhangSuhua1
(1.DepartmentofEndocrinology,FirstAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400016,China;2.LaboratoryofDisordersGenes,CollegeofPublicHealthandManagement,ChongqingMedicalUniversity,Chongqing400016,China;3.KeyLaboratoryofMolecularBiologyforInfectiousDiseasesofMinistryofEducation,ChongqingMedicalUniversity,Chongqing400016,China;4.DepartmentofEndocrinology,People′sHospitalofLonghuaNewDistrict,Shenzhen,Guangdong518000,China;5.DepartmentofEndocrinology,ZhengzhouMunicipalPeople′sHospital,Zhengzhou,Henan450003,China;6.LaboratoryofDisordersGenesand>DepartmentofPharmacology,MedicineSchoolofJishouUniversity,Jishou,Hunan416000,China)
Objective To investigate the correlation between the polymorphisms of forkhead box O1 (FOXO1) gene and type 2 diabetes (T2DM) in Chinese Han people from Chongqing.Methods (1) Among 105 unrelated Chinese Chongqing Han people,the PCR-RFLP and gene sequencing method were adopted to conducting the screening of 15 SNPs at FOXO1 gene coding region and non-coding region,linkage disequilibrium (LD) analysis and haplotype construction.(2)Seven hundreds and four Han people in Chongqing area(414 cases of T2DM and 290 healthy people) were performed the case control study.Five SNPs at the same haplotype block were performed the genotype identification.The association between SNPs and haplotype with T2DM was analyzed.Results (1) Twelve SNPs were screened out;the polymorphism phenomenon of Thr488Asn in exon was not found in this population.The LD analysis suggested that rs17592236,rs9577066,rs7986407,rs4581585 and rs4325426 belonged to the same haplotype block (D′>0.7).(2) rs7986407 and rs4581585 were associated with T2DM onset.The risk of T2DM in the subjects with AA genotype of rs7986407 was 1.42 times of those with GG genotype (additive modeOR=1.420,95%CI:0.783-2.577,P=0.01).And the subjects with CC genotype of rs4581585 had the 2.57 times risk suffering from T2DM of those with TT genotype (OR=2.571,95%CI:1.404-4.695,P=0.002).However,there was no statistically significant difference of age,body mass index,plasma glucose,lipid profile,serum insulin,Homa-IR and Homa-β between different genotypes (P>0.05).Conclusion FOXO1 gene may be the susceptibility gene of T2DM in Chinese Han population from Chongqing.
type 2 diabetes mellitus;forkhead box O1;single nuclear polymorphism;association analysis
10.3969/j.issn.1671-8348.2016.31.007
国家临床重点专科建设项目([2011]170);重庆市卫生局中医药科技课题(2010-2-134)。
龚莉琳(1979-),博士,主治医师,主要从事2型糖尿病分子遗传学研究。
R
A
1671-8348(2016)31-4340-05
2016-03-13
2016-04-27)

