苯磺酸氨氯地平抑制高糖诱导的H9C2细胞凋亡研究
徐小红,阮骆阳,田小华,潘凤娟,杨彩兰
(广东省农垦中心医院:1.儿科;2.麻醉科,广东湛江 524002)
论著·基础研究
苯磺酸氨氯地平抑制高糖诱导的H9C2细胞凋亡研究
徐小红1,阮骆阳2,田小华1,潘凤娟1,杨彩兰1
(广东省农垦中心医院:1.儿科;2.麻醉科,广东湛江 524002)
目的 利用细胞实验探讨高糖培养对H9C2细胞凋亡的影响,并探讨苯磺酸氨氯地平的保护作用。方法 体外培养大鼠心肌细胞H9C2,分为5 mmol/L糖培养组(G1)、25 mmol/L糖培养组(G2)、50 mmol/L糖培养组(G3)和25 mmol/L糖培养组加钙离子通道抑制剂络活喜保护组(G2+N)、50 mmol/L糖培养组加络活喜保护组(G3+N)5组,每组分设48 h(a)、72 h(b)培养两个亚组共10组。AnnexinV/PI结合流式细胞仪检测细胞凋亡率,荧光染色观察[Ca2+]i。结果 细胞凋亡率随着高糖刺激时间和高糖浓度的增加而逐渐增高,加络活喜组细胞的凋亡率显著降低(P<0.05)。G2、G3组单细胞平均[Ca2+]i活性测定荧光值均较G1组升高(P<0.05);G2+N、G3+N组单细胞平均[Ca2+]i活性测定荧光值分别较G2、G3组降低(P<0.05)。各a、b亚组间单细胞平均[Ca2+]i活性测定荧光值差异无统计学意义(P>0.05)。结论 高糖培养H9C2细胞可增加[Ca2+]i从而导致细胞凋亡,苯磺酸氨氯地平可抑制Ca2+内流从而抑制细胞凋亡。
糖尿病,妊娠;心肌细胞肥大;苯磺酸氨氯地平
妊娠期糖尿病(gestational diabetes mellitus,GDM)是临床上最常见的妊娠期间糖代谢异常类型,约占糖尿病孕妇的80%以上[1]。近年GDM呈上升趋势,其对胎儿影响巨大,GDM伴空腹血糖增高者胎儿畸形发生率为6.1%,尤以心血管系统及神经系统畸形最为常见。心脏比神经管更容易受到母体糖尿病的影响,GDM胎儿心脏畸形发生率是一般孕妇的6~8倍[2]。目前针对GDM致胎儿心脏发育异常方面尚缺乏有效的治疗策略,因此阐明GDM致胎儿心脏畸形发育之病理过程中可能存在的发病机制,可为临床防治此种疾病提供新的靶点。
1 材料与方法
1.1 材料 H9C2细胞购自中国科学院上海生命科学研究院细胞资源中心;D-葡萄糖购自广州化学试剂公司;络活喜购自Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒购自碧云天公司;胎牛血清购自Hyclone公司;DMEM培养基购自Gibco公司。钙离子荧光探针(Fluo-3 AM)购自碧云天公司。
1.2 方法
1.2.1 细胞培养 细胞解冻后,5%CO2培养箱、饱和湿度、37 ℃培养在含10%胎牛血清的DMEM培养液中。
1.2.2 实验分组 G1组:含10%胎牛血清的DMEM常规培养基(糖浓度5 mmol/L);G2组:含10%胎牛血清的DMEM高糖培养基(糖浓度25 mmol/L);G3组:含10%胎牛血清的DMEM高糖培养基(糖浓度50 mmol/L);G2+N组:含10%胎牛血清的DMEM高糖培养基(糖浓度25 mmol/L)加苯磺酸氨氯地平即络活喜(25 nmol/L);G3+N组:含10%胎牛血清的DMEM高糖培养基(糖浓度50 mmol/L)加络活喜(25 nmol/L);每组均分为a、b两亚组,a亚组培养48 h, b亚组培养72 h。
1.2.3 流式细胞仪检测 按Annexin V-FITC 细胞凋亡检测试剂盒(碧云天,C1062)操作说明操作。
1.2.4 各组细胞内[Ca2+]i活性测定 无血清DMEM培养基稀释Fluo-3至2 μmol/L;弃去细胞旧培养基,PBS洗涤细胞1次,2 μmol/L的Fluo-3孵育1 h(37 ℃,5%CO2);弃去Fluo-3,PBS洗涤细胞2次,2 μmol/L的Fluo-3孵育30 min(37 ℃,5%CO2);弃去Fluo-3,PBS洗涤细胞2次,加适量培养基后用荧光显微镜观察,并使用Image-Pro Plus 6.0软件进行图像分析。
1.3 统计学处理 采用Graph Pad Prism 5进行统计分析,多组均数间的比较采用方差分析,采用t检验比较样本均数,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度葡萄糖培养对细胞凋亡的影响 各组分别培养后,G2a 组细胞早期凋亡率较G1a组升高但低于G3a组,差异有统计学意义(P<0.05)。G2b 组细胞早期凋亡率较G1b组升高,差异有统计学意义(P<0.05),但G2b与G3b组培养细胞早期凋亡率差异无统计学意义(P>0.05)。G2+N、G3+N组凋亡率明显低于G2、G3组(P<0.05)。a、b亚组间比较G1b、G2b、G3b、(G3+N)b组早期凋亡率均对应高于G1a、G2a、G3a、(G3+N)a组(P<0.05),而(G2+N)a、b亚组间细胞早期凋亡率差异无统计学意义(P>0.05),见图1。
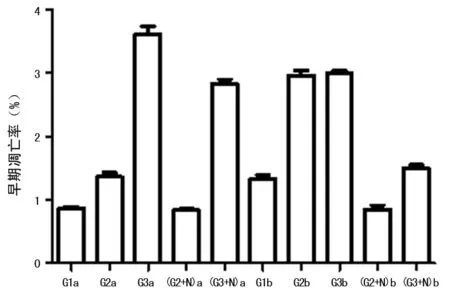
图1 流式细胞仪检测细胞凋亡率
2.2 各组细胞内[Ca2+]i活性测定结果 a、b亚组内单细胞平均[Ca2+]i活性测定荧光值在G1、G2、G3组均呈阶梯上升,G3组达到最高点(P<0.05),而G2+N、G3+N组分别低于G2、G3组(P<0.05)。各对应a、b亚组间单细胞平均[Ca2+]i活性测定荧光值差异无统计学意义(P>0.05),见图2。
3 讨 论
细胞凋亡主要是参与去除异常发育的细胞、清除多余的细胞,最终有效地维持机体细胞数量与功能的动态平衡,进而促进器官、组织的正常发育。研究表明凋亡途径主要包括内源性、外源性,最终引起caspase激活[3]。细胞凋亡除了与启动凋亡程序引起凋亡外,还与细胞内的存活机制有关。高血糖刺激胎儿体内的氧化应激过程及诱导过多的细胞凋亡发生均对胚胎心肌细胞构成严重影响[4-5],妊娠期糖尿病的病理性内环境可诱发心肌细胞过度凋亡,促使心脏发育畸形。
H9C2细胞源于胚胎期大鼠心脏,保持很多心肌细胞的特征,可用于高糖的体外研究。本实验发现各组不同糖浓度分别培养H9C2细胞48、72 h后, G2a组细胞早期凋亡率较G1a组升高但低于G3a组,差异有统计学意义。G2b 组细胞早期凋亡率较G1b组升高,差异有统计学意义,但G2b与G3b组培养细胞早期凋亡率差异无统计学意义。G2+N、G3+N组凋亡率明显低于G2、G3组。a、b亚组间比较G1b、G2b、G3b、(G3+N)b组早期凋亡率均对应高于G1a、G2a、G3a、(G3+N)a组,而(G2+N)a、b亚组间细胞早期凋亡率差异无统计学意义。提示随着糖浓度的增加,细胞凋亡率也明显升高,高糖作用48 h内凋亡率随糖浓度呈阶梯式上升。随着时间延长,培养糖浓度的提高,细胞损伤加重,加入钙通道阻滞剂后细胞凋亡减少,提示络活喜可保护心肌免于或减少受高糖损伤。Lee等[6]的研究结果也表明,临床剂量胰岛素和二甲双胍均能降低血糖峰值。二甲双胍可能会保护心肌细胞。暴露在胰岛素和二甲双胍24 h和48 h甚至72 h后细胞形态学均发生变化,两组均出现细胞损伤。
在新生大鼠心肌细胞及H9C2细胞培养48 h中,高糖(25 mmol/L)导致心肌细胞肥大和凋亡[7]。在线粒体功能障碍方面有研究发现高糖(35 mmol/L的葡萄糖)培养 H9C2细胞24 h不仅显著诱导包括细胞毒性,细胞凋亡,活性氧(ROS) 过剩和线粒体膜电位(MMP)的降低在内的损伤,还上调(p)-p38 MAPK和p-ERK1/2磷酸化水平,N-acetylcysteine (NAC) 通过抑制H9c2细胞线粒体氧化应激损伤来对抗由葡萄糖及葡萄糖氧化物所致氧化和凋亡活动[8]。多项研究均证实,高糖可通过多种途径导致H9C2细胞凋亡,本研究的结果也支持该结论。
心脏是个极其复杂的器官,当其发挥功能时需要大量的各种离子,其中Ca2+被认为是最重要的一种。 [Ca2+]i浓度升高是心肌细胞因外界刺激或/和内在功能缺陷而发生肥大的中心环节[9]。在患糖尿病心肌病的大鼠心肌中高表达内质网Ca2+泵,改善心肌中Ca2+的处置,可以使糖尿病心肌病大鼠的心脏功能恢复正常[10]。Kumar等[11]通过研究高糖条件下细胞内钙内移到线粒体,进一步了解了高血糖的条件下的心肌细胞凋亡。他们的研究显示,高糖导致凋亡依赖或不依赖线粒体通路,均伴随着细胞内钙升高。所以本研究立足于此,验证了Ca2+是否在高糖培养的心肌细胞中发生明显变化,并拟进一步研究其通过何种途径引起心肌细胞的变化。
本研究发现,a、b亚组内单细胞平均[Ca2+]i活性测定荧光值在G1、G2、G3组均呈阶梯上升,G3组达到最高点,而G2+N、G3+N组分别低于G2、G3组。各对应a、b亚组间单细胞平均[Ca2+]i活性测定荧光值差异无统计学意义。提示高糖可引起H9C2细胞内Ca2+明显增加,Ca2+可能参与了高糖致H9C2细胞的肥大、凋亡过程。钙离子通过钙离子通道进入心肌细胞,作为一种重要的第二信使,心肌细胞的收缩是由胞外的钙离子内流而引起的,在心肌中,L型钙离子通道是钙离子进入细胞内的主要途径。加入L型钙离子通道抑制剂络活喜后单细胞平均[Ca2+]i活性测定荧光值较相同条件不加络活喜者降低,高糖导致的细胞内Ca2+增加可被L型钙离子通道抑制剂所抑制,支持Ca2+通过L型钙离子通道进入细胞内调节下游信号通路,参与H9C2细胞的凋亡、肥大的假设。本研究还比较了同浓度同药物培养不同时长对应组间单细胞平均[Ca2+]i活性测定荧光值差异无统计学意义,提示[Ca2+]i可能为瞬时改变,故培养时长对其影响不大。
根据本研究的结果,有理由认为高糖培养H9C2细胞可增加[Ca2+]i从而导致细胞凋亡,苯磺酸氨氯地平可抑制Ca2+内流从而抑制细胞凋亡。
[1]乐杰.妇产科学[M].北京:人民卫生出版社,2008:150.
[2]Hrabovski I,Milasnovic L,Grujic Z,et al.Influence of glucose homeostasis on maturation and ontogenesis of fetus[J].Med Pregl,2012,64(11/12):552-556.
[3]Peter G,Mike H,Maryline MC.IAPs inhibit a cryptic CD95-induced cell death by limiting RIP1 kinase recruitment[J].Cell Biol,2009,187(7):1037-1054.
[4]邹燕,丁依玲.孕鼠体内高血糖对胎鼠心肌细胞的影响[J].中南大学学报(医学版),2009,34(2):139-147.
[5]刘欣,赵秀兰,康毅.糖尿病大鼠心肌细胞凋亡及凋亡相关蛋白表达研究[J].中国心血管杂志,2005,10(1):4-7.
[6]Lee L,Tucci MA,Benghuzzi HA.Effects of metformin and insulin on h9c2 rat cardiomyocytes in cell culture with elevated glucose levels[J].Biomed Sci Instrum,2014(50):367-374.
[7]Xu J,Li H,Irwin MG et al.Propofol a meliorates hyperglycemia-induced cardiac hypertrophy and dysfunction via heme oxygenase-1/signal transducer and activator of transcription 3 signaling pathway in rats[J].Crit Care Med,2014,42(8):e583-594.
[8]Kumar S,Sitasawad SL.N-acetylcysteine prevents glucose/glucose oxidase-induced oxidative stress,mitochondrial damage and apoptosis in H9c2 cells[J].Life Sci,2009,84(11/12):328-336.
[9]万智军,李端阳,邓树勋.运动性心肌肥大的信号转导通路[J].体育学刊,2004,11(4):52-55.
[10]Trost SU,Belke DD,Bluhm WF,et al.Overexpression of the sarcoplasmic reticulum Ca(2+)-ATPase improves myocardial contractility in diabetic cardiomyopathy[J].Diabetes,2002,51(4):1166-1171.
[11]Kumar S,Kain V,Sitasawad SL,et al.High glucose-induced Ca2+overload and oxidative stress contribute to apoptosis of cardiac cells through mitochondrial dependent and independent pathways[J].Biochim Biophys Acta,2012,1820(7):907-920.
Amlodipine besylate for suppressing H9C2 cells apoptosis induced by high glucose*
XuXiaohong1,RuanLuoyang2,TianXiaohua1,PanFengjuan1,YangCailan1
(1.Departmentofpaediatrics;2.DepartmentofAneshesiology,GuangdongProvincialAgricuturalReclamationCentralHospital,Zhanjiang,Guangdong524002,China)
Objective To study the influence of high glucose concentration culture on H9C2 apoptosis by using the cell experiment and to investigate the protective effect of amlodipine besylate.Methods The in vitro cutured rat cardiomyocytes H9C2 were divided into 5 groups:5 mmol/L sugar culture group (G1),25 mmol/L sugar culture group(G2),50 mmol/L sugar culture group(G3) and 25 mmol/L sugar culture group plus calcium ion channel inhibitor amlodipine besylate protection group(G2+N) and 50 mmol/L sugar culture group plus amlodipine besylate protection group(G3+N).Each group was re-divided into the 48 h culture subgroup (a) and 72 h culture subgroup(b),10 groups in total.The cellular apoptosis rate was detected by AnnexinV/PI combined with flow cytometer.Ca2+was observed by the fluorescence staining.Results The cellular apoptosis rate was gradually increased with the high sugar stimulation time increase and high sugar concentration increase,which in the adding amlodipine besylate group was significantly decreased(P<0.05).The mean fluorescence value of [Ca2+]i of single cell in the group G2 and G3 was increased compared with the group G1 (P<0.05).The mean fluorescence value of [Ca2+]i activity of single cell in the group G2+N and G3+N was decreased compared with the group G2 and G3(P<0.05).But the mean fluorescence value of [Ca2+]i activity of single cell had no statistically significant difference between various subgroup a and b (P>0.05).Conclusion Higher glucose culture of H9C2 cells can increase[Ca2+]i,thus causes the cellular apoptosis,amlodipine besylate can inhibit the Ca2+internal flow,thus inhibits the cellular apoptosis.
diabetes,gestational;cardiomyocyte hypertrophy;amlodipine
10.3969/j.issn.1671-8348.2016.31.002
广东省湛江市政资金科技专项竞争性分配项目(2015A01037)。
徐小红(1977-),硕士,副主任医师,主要从事器官保护方面的研究。
R329.2
A
1671-8348(2016)31-4324-03
2016-02-22
2016-06-10)

