洗涤方式对高通量酶联免疫吸附试验检测系统检测结核抗体的影响
张淑英,裴景亮,张玉芝,伊正君△
(1.山东省潍坊市第二人民医院检验科 261041;2.潍坊医学院附属医院检验科,山东潍坊 261031)
论著·临床研究
洗涤方式对高通量酶联免疫吸附试验检测系统检测结核抗体的影响
张淑英1,裴景亮2,张玉芝2,伊正君2△
(1.山东省潍坊市第二人民医院检验科 261041;2.潍坊医学院附属医院检验科,山东潍坊 261031)
目的 评价不同的洗涤参数对高通量酶联免疫吸附试验(ELISA)酶免仪检测结核抗体的影响,通过洗涤液的标准化研究解决ELISA实验准确性和重复性差的问题。方法 仪器采用烟台Addcare ELISA500全自动酶免仪,试剂采用商品化的结核抗体检测试剂,选择不同体积洗液量,不同洗涤次数,不同振荡时间及不同的浸泡时间,进行结核抗体的ELISA检测,观察对检测结果的影响。采用SPSS21.0进行统计学分析,分别计算不同的洗涤方式的诊断效能。结果 采用300 μL洗液量,洗涤5次,振荡30 s,浸泡40 s可以获得最佳的诊断效能,此时灵敏度为86.67%,特异性为85.71%,阳性预测值为81.25%,阴性预测值为90.00%,阳性似然比率4.33(95%CI:4.11~4.52),阴性似然比率0.11(95%CI:0.08~0.14),约登指数为0.72(95%CI:0.68~0.76)。结论 建立的洗涤液系统的标准化程序可以提高检测方法的灵敏度、特异性和准确性。
高通量分析;酶联免疫吸附试验;结核抗体
结核病已成为全球备受关注的重大公共卫生问题,WHO的报告指出,在2012年全球大约有860万新发结核病例,约130万人死于结核病[1]。WHO对全球2013年结核分枝杆菌(MTB)的感染发生率进行了评估,我国仍然是高发病率国家。传统的结核抗体的酶联免疫吸附试验(ELISA)检测具有操作简便的特点,但它的结果受实验过程中多种因素的干扰,普遍存在准确性和重复性差的问题,其灵敏度、特异性也存在争议[2-3]。本文研究高通量ELISA检测系统检测结核抗体试验过程中洗涤方式对结核抗体检测结果的影响,现报道如下。
1 资料与方法
1.1 一般资料 收集山东省潍坊市第二人民医院和潍坊医学院附属医院2013年5月至2014年2月结核科门诊及住院的结核病例120例,均符合2001年中华医学会结核病学分会制定的肺结核诊断标准。168例健康成人(健康体检人员)作为对照组,两组之间性别、年龄、卡介苗接种史等差异无统计学意义,所有病例乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)感染指标均为阴性,亦无并发其他急性感染性疾病。
1.2 仪器与试剂 烟台Addcare ELISA500全自动酶免仪,试剂采用荣盛公司的结核抗体检测试剂,批号为20130824,实验前对检测系统的特异性、敏感性和cut off值的重复性进行了验证。除研究因素外,其余步骤及操作要素严格按照试剂说明书,每次检测重复3次。
1.3 方法 清晨采集空腹肘静脉血4 mL,3 000 r/min离心10 min分离血清,血清分装后-80 ℃保存,备用。选择100、200、300 μL等不同体积洗液量,4、5、6次不同洗涤次数,10、30、60 s不同清洗震荡时间,20、30、40、50、60 s不同浸泡时间,进行结核抗体的ELISA检测,观察对最终检测结果(阴、阳性结果)的影响,评价不同因素对灵敏度、特异性、阳性预测值(PPV)、阴性预测值(NPV)、阳性似然比率(PLR)、阴性似然比率(NLR)、约登指数(YI)等的影响。
1.4 统计学处理 采用SPSS21.0软件进行数据处理,计数资料以百分率表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不同体积洗液量对结核抗体检测的影响 其余参数选择:洗涤5次,振荡30 s,浸泡30 s。结果显示:洗涤液量为300 μL时方法的灵敏度、PPV、NPV、PLR、NLR、YI等检验效能明显高于其他两组(P<0.05),特异性在200 μL和300 μL方法中差异无统计学意义(P>0.05),见表1。
2.2 不同洗涤次数对结核抗体检测的影响 其余参数选择:洗涤液300 μL,振荡30 s,浸泡30 s。结果显示:洗涤次数不同时,不同方法间的灵敏度、特异性、PPV、NPV、NLR差异无统计学意义(P>0.05)。洗涤5次时PLR和YI高于洗涤次数为4次的方法(P<0.05);与洗涤次数为6次比较,差异无统计学意义(P>0.05),见表2。
2.3 不同振荡时间对结核抗体检测的影响 其余参数选择:洗涤液300 μL,洗涤5次,浸泡30 s。结果显示:振荡30 s的方法在灵敏度、特异性、PPV、NPV、PLR、NLR、YI方面的诊断效能高于振荡10 s的方法(P<0.05);在灵敏度、特异性、NPV、NLR、YI方面的诊断效能与振荡60 s的方法比较差异无统计学意义(P>0.05),在PPV和PLR的诊断效能方面高于振荡60 s的方法(P<0.05),见表3。
2.4 不同浸泡时间对结核抗体检测的影响 其余参数选择:洗涤液300 μL,洗涤5次,振荡时间30 s。结果显示:浸泡40 s的方法在灵敏度、NPV、PLR、NLR、YI方面的诊断效能高于浸泡时间(P<0.05);在特异性方面浸泡30 s和40 s差异无统计学意义(P>0.05),均高于其他浸泡时间(P<0.05);在PPV诊断效能方面浸泡60 s时诊断效能最高,浸泡40 s和50 s差异无统计学意义(P>0.05),均高于其他浸泡20 s和30 s(P<0.05),见表4、图1。
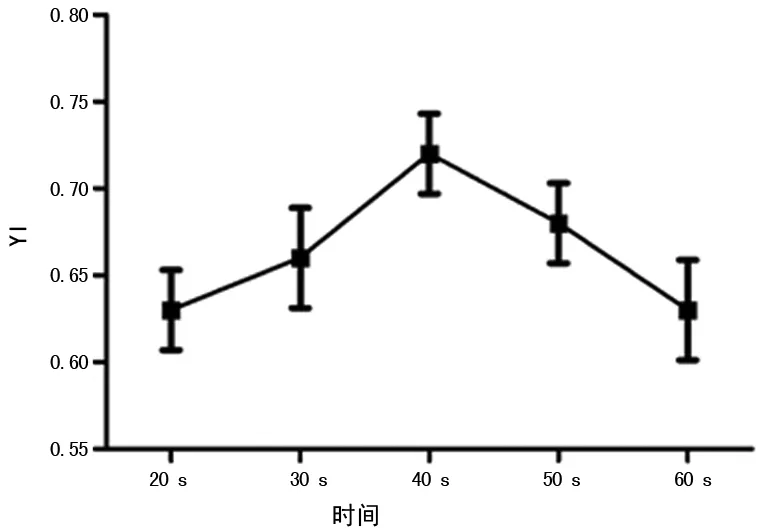
图1 不同浸泡时间对YI指数的影响
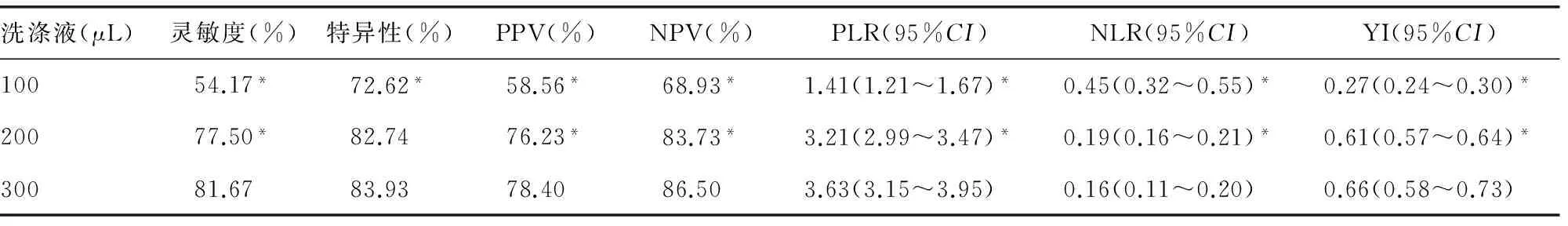
洗涤液(μL)灵敏度(%)特异性(%)PPV(%)NPV(%)PLR(95%CI)NLR(95%CI)YI(95%CI)10054.17*72.62*58.56*68.93*1.41(1.21~1.67)*0.45(0.32~0.55)*0.27(0.24~0.30)*20077.50*82.7476.23*83.73*3.21(2.99~3.47)*0.19(0.16~0.21)*0.61(0.57~0.64)*30081.6783.9378.4086.503.63(3.15~3.95)0.16(0.11~0.20)0.66(0.58~0.73)
*:P<0.05,与300 μL洗液的诊断效能比较。

表2 不同洗涤次数对检验效能的影响
*:P<0.05,与洗涤效数5次的诊断效能比较。

表3 不同振荡时间对结核抗体检测的影响
*:P<0.05,与振荡30 s的诊断效能比较。

表4 不同浸泡时间对结核抗体检测的影响
*:P<0.05,与浸泡40 s的诊断效能比较。
3 讨 论
目前,结核病控制面临的挑战是多方面的,包括:艾滋病与结核病的双重感染,缺乏有效的疫苗,不断出现的耐多药结核分枝杆菌,结核病的药物治疗比目前已知的其他细菌的治疗疗程更长、更复杂[4],其在机体内的代谢机制也尚未明确[5];其中最重要的一点是没有特异性的生物标志物,无法早期特异性地诊断结核病。现有的诊断方法普遍存在特异性和灵敏度不高的特点[6-7],寻找一种快速、准确、低廉的诊断方法对于结核病的早期诊断、早期干预及防止耐药菌的产生和传播具有重要的意义。有研究证实:结核分枝杆菌的特异性分泌蛋白的抗体检测对结核病的诊断具有重要意义,利用基因工程技术将结核分枝杆菌的多种分泌蛋白制成融合蛋白,利用ELISA技术检测血清中对应的抗体可用于不同类型结核病的诊断[8]。
ELISA是临床实验室最基本、最常用的实验方法之一,洗板是ELISA实验的关键步骤,洗板的目的是清除非特异性的干扰物质,洗板效果决定着整个实验的成败,有研究表明人为改变洗板因素会影响检测结果的特异性和灵敏度[9]。国内研究显示洗板不彻底会出现非特异性显色,导致结果出现假阳性;过度洗板会使得低值阳性标本出现假阴性[10]。洗涤因素对结核抗体ELISA检测结果的影响在国内尚无系统的研究和报道,为了明确这些因素对检测结果的影响,笔者对高通量ELISA检测系统的洗涤液及洗涤方式进行标准化研究以解决结核抗体ELISA试验中准确性和重复性差的问题。
本研究中笔者采用上海荣盛公司的结核抗体检测试剂,试剂盒将7种特异抗原优势肽段分别制备成多表位融合抗原,用以检测患者外周血的结核抗体。300 μL洗液,震荡30 s,洗板4次,浸泡30 s为试剂盒说明书中给出的洗板参数。笔者以此为对照,依次对洗涤液体积、洗板次数、振荡时间、浸泡4个影响因素进行了评价。结果显示按照说明书规定浸泡30 s的300 μL洗液,震荡30 s,洗板5次时诊断效能最高;在评价浸泡时间因素的影响时,笔者发现此因素较复杂,对结果的灵敏度、特异性影响较大。因此本研究中使用了更多的时间参数,并以YI作为评价标准;结果显示浸泡40 s时,YI最高,与其他浸泡时间相比差异有统计学意义(P<0.05)。为筛选浸泡40 s时洗涤液体积、洗板次数、振荡时间的最佳参数,笔者重新对这3个因素进行了评价,结果分别为300 μL、5次、30 s,与浸泡30 s时参数相同(数据未展示)。
最终研究结果显示:不同的洗涤液体积、洗板次数、振荡时间、浸泡时间对检验诊断效能都有影响,与李金龙等[11]的研究结果一致。本检测系统洗板的最佳参数为洗液300 μL,震荡时间30 s,浸泡时间40 s,洗板5次,此时灵敏度为86.67%,特异性为85.71%,PPV为81.25%,NPV为90.00%,PLR为4.33(95%CI:4.11~4.52),NLR为0.11(95%CI:0.08~0.14),YI为0.72(95%CI:0.68~0.76)。在所有的洗涤参数组合中,笔者建立的体系约登指数最高,与其他组合相比,差异有统计学意义(P<0.05)。本研究结果同时显示高通量的ELISA的自动化检测能够提高检测结果的重复性,特别是cut off值,与相关报道一致[12]。
标准化、自动化是医学实验室的发展趋势,高通量ELISA分析系统洗涤程序的标准化可以排除潜在的影响因素,提高实验的灵敏度、特异性和准确性。基因工程技术制成的致病结核分枝杆菌的融合抗原试剂与自动化、标准化的酶免疫联合应用是一种简便、快捷、准确性高的实验方法[13],可以为结核病的临床诊断与防治提供科学的依据。
[1]Zumla A,Raviglione M,Hafner R,et al.Tuberculosis[J].N Engl J Med,2013,368(8):745-755.
[2]Passiu G,Erre GL,Pirina P,et al.Clinical utility of anti-lipoarabinomannan antibodies testing for the diagnosis of tuberculous arthritis[J].Springerplus,2015,4(63):63.
[3]周爱凤,赵自云,陈娟,等.高通量ELISA测定血清癌胚抗原的应用评价[J].青岛大学医学院学报,2015,51(6):659-661.
[4]Nathan C,Gold B,Lin G,et al.A philosophy of anti-infectives as a guide in the search for new drugs for tuberculosis[J].Tuberculosis (Edinb),2008,88(Suppl 1):S25-S33.
[5]Eoh H,Rhee KY.Multifunctional essentiality of succinate metabolism in adaptation to hypoxia in Mycobacterium tuberculosis[J].Proc Natl Acad Sci U S A,2013,110(16):6554-6559.
[6]Cox JA,Lukande RL,Lucas S,et al.Autopsy causes of death in HIV-positive individuals in sub-Saharan Africa and correlation with clinical diagnoses[J].AIDS Rev,2010,12(4):183-194.
[7]Peter JG,Theron G,Van Zyl-Smit R,et al.Diagnostic accuracy of a urine lipoarabinomannan strip-test for TB detection in HIV-infected hospitalised patients[J].Eur Respir J,2012,40(5):1211-1220.
[8]Zhu C,Liu J,Ling Y,et al.Evaluation of the clinical value of ELISA based on MPT64 antibody aptamer for serological diagnosis of pulmonary tuberculosis[J].BMC Infect Dis,2012,12(7):96.
[9]闫朝春.洗板次数与浸泡时间对ELISA 法 HBsAg检测结果的影响[J].国际检验医学杂志,2015,36(21):3173-3175.
[10]张春艳.酶联免疫吸附试验检测结果的影响因素和应对措施[J].中国医药指南,2014,12(29):393-394.
[11]李金龙,谈国蕾,王念跃,等.手工洗板和机洗板对ELISA法检测HIV抗体结果的比较[J].中国性科学,2014,23(2):71-73.
[12]Whitworth WC,Goodwin DJ,Racster L,et al.Variability of the quanti feronr-TB gold in-tube test using automated and manual methods[J].PLoS One,2014,9(1):e86721.
[13]Leng SX,Mcelhaney JE,Walston JD,et al.ELISA and multiplex technologies for cytokine measurement in inflammation and aging research[J].J Gerontol A Biol Sci Med Sci,2008,63(8):879-884.
Impact of washing mode on detecting tuberculosis antibody by high-throughput ELISA detection system*
ZhangShuying1,PeiJingliang2,ZhangYuzhi2,YiZhengjun2△
(1.DepartmentofClinicalLaboratoryWeifangMunicipalSecondPeople′sHospital,Weifang,Shandong261041,China;2.DepartmentofClinicalLaboratoryAffiliatedHospitalofWeifangMedicalCollege,Weifang,Shandong261031,China)
Objective To evaluate the impact of different washing parameters on detecting tuberculosis(TB) antibody by high-throughput ELISA detection system,and to solve the poor accuracy and poor repeatability problem of ELISA through the standardization of cleaning solution.Methods The Addcare ELISA500 automatic enzyme immunoassay instrument was adopted.The reagent adopted the commercial TB antibody reagent kit.The ELISA detection was performed by selecting different volumes of washing solution,different washing time,different oscillation time and different soaking time.The impact on the detection results was observed.The software SPSS21.0 was used for conducting statistical analysis.The diagnostic efficiencies of different washing modes were respectively calculated.Results The best diagnostic efficiency was obtained by 300 μL of washing solution,washing for 5 times,oscillating for 30 s and soaking for 40 s,the sensitivity,specificity,positive predictive value,negative predictive value,positive likelihood ratio,negative likelihood ratio and Youden index were 86.67%,85.71%,81.25%,90.00%,4.33 (95%CI:4.11-4.52),0.11(95%CI:0.08-0.14) and 0.72 (95%CI:0.68-0.76) respectively.Conclusion The established standardization procedure of washing solution system can increase the sensitivity,specificity and accuracy of detection method.
high-throughput screening assays;enzyme-linked immunosorbent assay;antibodies,tuberculosis
10.3969/j.issn.1671-8348.2016.31.015
卫生部医药卫生科技发展研究中心专项课题(28-10-5)。
张淑英(1979-),硕士,主管技师,主要从事结核病的临床诊断。△
,E-mail:13505360413@163.com。
R446
A
1671-8348(2016)31-4366-03
2016-03-07
2016-06-21)

