钙盐混凝法处理含氟特种废水
◇ 山东 庞景元(学生)
钙盐混凝法处理含氟特种废水
◇ 山东 庞景元(学生)
在学习卤素性质时,老师曾讲到饮用水中如果含有一定量氟的话,会使我们的牙齿和骨骼受损,引起氟斑牙或是氟骨病.那么如何除去水中的氟呢?化学课本中提到一个有效方法,加入钙盐,可以形成氟化钙沉淀以除去水中的氟.沿着这个思路,笔者查阅了大量的科学文献,了解了水体中氟的来源和危害,尝试了各种去除氟的有效措施.本文在分析水体中氟的来源和去除原理的基础上,动手搭建了简易的混凝除氟实验装置,改变不同的药剂投加量和不同pH条件下进行混凝除氟实验,得到了有意义的实验结果.
1 含氟特种废水来源
随着现代化工业的发展,含氟矿物的开采加工,氟化物的合成、金属冶炼、铝电解、玻璃、电镀、化肥、农药、化工等领域,特别是近些年,高纯度多晶硅生产过程中,侵蚀清洗废水中都含有高浓度的氟离子,干法氟化铝生产过程中产生大量含氟酸性废水.现行的光伏电池,是一种新型的依靠太阳能进行能量转换的光电器件,可以有效地将太阳能转换成电能,属于应用前景广阔的清洁能源之一,但是,其特殊的生产工艺中尤其是硅料清洗和电池制备过程中会用到HF等含氟物质,决定了该项目中存在一定量的氟对环境的污染.蓬勃发展的电子工业如彩色显像管、集成电路工厂等的大量建设,含氟废水的排放总量每年以成万吨计的趋势急剧增加,氟污染越来越严重.因此含氟废水的治理也越来越受到人们的关注.
2 实验原理以及实验器材
目前,国内外有关含氟废水的处理方法较多,从成本、工艺成熟度和处理效果来讲,吸附法、离子交换法、电渗析法、反渗透法等多用于对含氟废水的深度处理.化学沉淀法应用相对广泛,其反应机制是将适当的化学品投入到含氟的废水中,使其与氟反应生成氟化物沉淀,再经过滤等方法将氟化物沉淀与废水分离,从而达到除氟的目的.
本实验的主要实验原理为钙盐与氟离子结合形成氟化钙沉淀的形式除去水中的氟.CaF2是白色的细小固体,常温下难溶于水,20℃时其溶度积常数Ksp=4×10-11,水中的溶解度为16.3mg·L-1,按氟离子计为7.9mol·L-1,因此当离子积大于溶度积时会形成氟化钙沉淀物.
主要实验装置包含定时变速搅拌机、磁力搅拌器、酸度计、氟离子选择性电极、参比电极等;实验试剂包含氟化钠、无水氯化钙、柠檬酸三钠、氯化钠、冰醋酸、醋酸钠、氢氧化钠、盐酸等.
3 实验过程
3.1 试剂的配制以及实验设备
人工配制含氟水样,含氟量为1500mg·L-1.
试剂的配置:CaCl2溶液(1mol·L-1),氟标准液(0.1mol·l-1),NaOH溶液(10%),HCl溶液(体积比为1∶1),总离子强度调节剂(TISAB).
TISAB的配制:氯化钠(NaCl),0.10mol·L-1;醋酸(HAc),0.25mol·L-1;醋酸钠(NaAc),0.75 mol·L-1;柠檬酸三钠,0.001mol·L-1.pH=5.0.
设备:氟离子选择性电极1个,电位计1台,饱和甘汞电极1个,磁力搅拌器1台,测量用100mL烧杯1个,搅拌磁子1个,镊子1个,3L大废液缸1个,过滤装置1套,500mL烧杯5个,15mL刻度移液管1支,带胶头滴管的试剂瓶2个.
3.2 氟标准曲线的测定
1)吸取10mL0.1mol·L-1的氟标准液至100 mL容量瓶中,加入10mL总离子强度调节剂(TISAB)后用蒸馏水定容到刻度线;2)采用逐级稀释法,配成浓度为10-3、10-4、10-5及10-6mol·L-1氟离子溶液(逐级加入9mLTISAB即可);3)将标准溶液按浓度由低到高依次倒入烧杯中,插入氟离子选择电极和参比电极,使用电磁搅拌器搅拌3min,静置30s后开始读数,30s一次,直至3min内数值不变停止读数.
3.3 实验方法
1)在已编号的500mL烧杯中放入200mL废水水样;2)根据实验目的在不同pH(4、5.5、7、8.5、10)下将CaCl2溶液投加在每个烧杯中;3)开动搅拌器,以相同的转速进行搅拌;4)搅拌结束后,把搅拌桨从水样中提出来,取下烧杯,每隔一定时间取滤液进行分析.
3.4 用氯化钙作为沉淀剂处理水样
取5个已经编号的烧杯,分别加入200mL废水水样,分别用10%NaOH溶液和体积比为1∶1的HCl溶液将pH分别调至4、5.5、7、8.5、10,1mol·L-1的CaCl2溶液投加量(按照沉淀200mL,1500mol·L-1的F-所需的物质的量计算)分别为100%(8.1mL,即正好完全反应)、150%(12.15mL,即过量50%)、200%(16.2mL,即过量100%)、250%(20.25mL,即过量150%),快速搅拌20min,结束后,提起搅拌桨,静置,分别取0、30、60、90、120min时的滤液进行F-含量的测定分析.
4 实验结果与分析
4.1 标准曲线的制作
首先将氟离子浓度按照pF=-lg(cF/(mol· L-1))进行计算,为了使标准曲线呈直线状态,以pF作为横坐标;不同氟离子浓度下测得的电位数值(mV)作为纵坐标,做出氟标准曲线(图1),测定数据见表1.
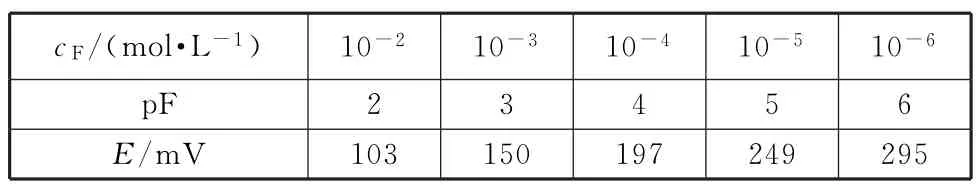
表1 氟标准曲线
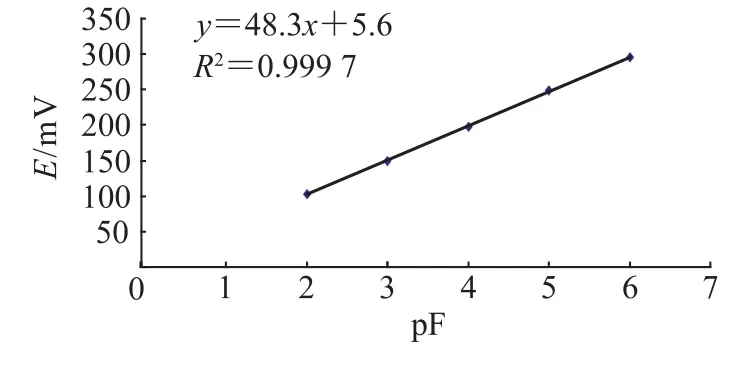
图1
由标准曲线的直线方程y=48.3x+5.6和相关系数R2=0.9997可以看出,标准曲线的线性相关性很高,可以进行后续实验结果的测定,并根据直线方程计算溶液中氟离子的含量.
4.2 含氟水样的混凝处理结果
以CaCl2作为沉淀剂,在pH分别为4、5.5、7、8.5、10的条件下,再分别以100%、150%、200%和250%的投加量进行实验.
根据实验测得的电位数值在氟标准曲线上查出pF,然后根据pF=-lg(cF/(mol·L-1))计算出处理后溶液中氟离子的浓度,从而获得不同处理条件下溶液中所剩氟离子的含量.
在不同投加比下,以pH为横坐标、以F-浓度为纵坐标,分别作出静置0、30、60、90、120min时所测得的溶液中F-的含量,得到如下实验结果.
1)图2为CaCl2的投加比为100%的实验结果.
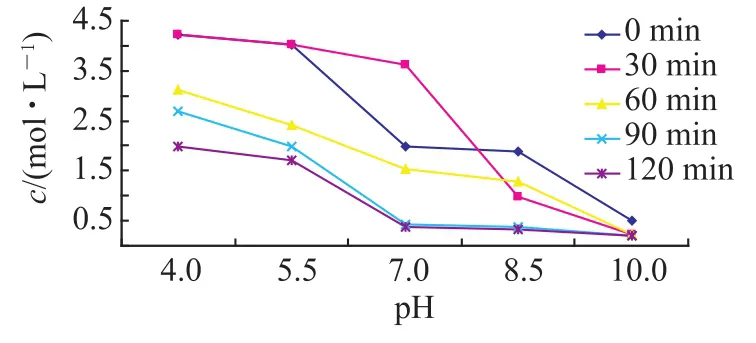
图2
由图2可以发现,在CaCl2的投加比为100%时,随着沉降时间和pH的增大,F-的含量逐渐减小.从时间上来看,沉降120min的处理效果较好;从酸度条件来看pH=10时处理效果较好,且沉淀处理后含氟量小于0.5mol·L-1.
2)图3为CaCl2的投加比为150%的实验结果.

图3
从总趋势上来讲,随着沉降时间的增加和pH的增大,F-的含量呈减少趋势.从时间上看,沉降60min的处理效果最佳;从酸度条件看,pH=10的处理效果较好,混凝处理后含氟量小于0.5mol·L-1.
3)图4为CaCl2的投加比为200%的实验结果.
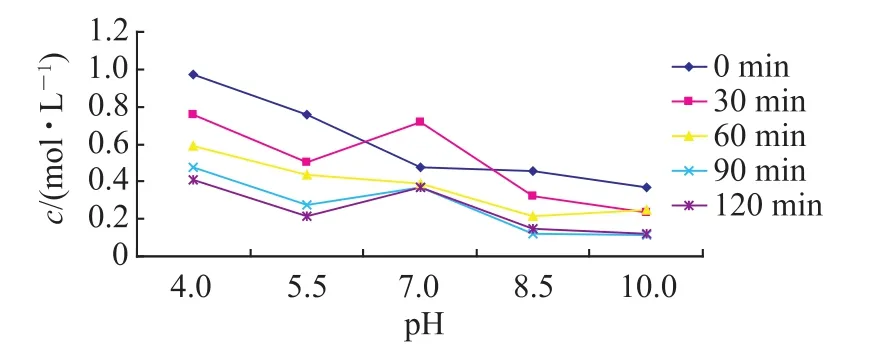
图4
4)图5为CaCl2的投加比为250%实验结果.
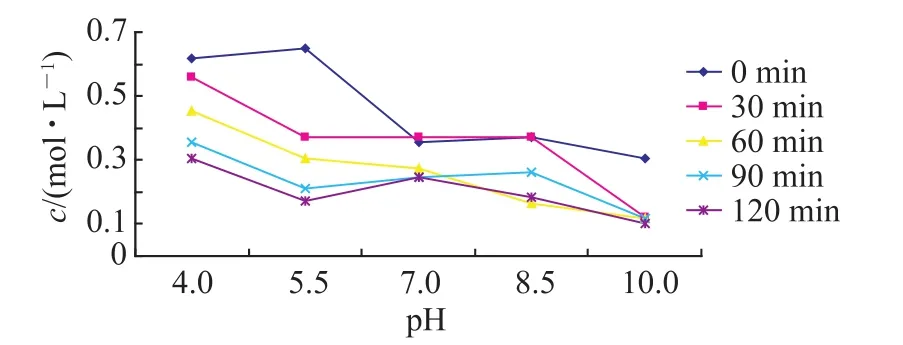
图5
从总趋势上来讲,随着沉降时间的延长和pH的增大,F-含量呈减少趋势.从时间上看,沉降120min的处理效果最佳,但在沉降时间为60min时,F-含量亦可降到0.5mol·L-1以下;从酸度方面看,pH=10的处理效果最好,混凝处理后含氟量在0.1mol·L-1.
5 结论
由实验结果可发现,随着CaCl2投加量和碱度的增加,水中含氟量大为减少,且远远低于工业废水的排放标准.根据实验结果不难推测,pH的控制条件为中性或碱性(pH≥7),CaCl2的投加比越大,沉降处理效果越好,但是试剂用量会加大,处理成本也将大大提高,比较经济实用的条件是投加比为150%,沉降时间60min以上,即可获得较好的处理效果.
本实验研究了高浓度含氟废水的实验室混凝处理方法,有助于拓展和深化中学生对元素化学性质的认识,更加深了中学生的环保理念.本实验中所用的简单实验原理使学生深刻体会到自己所学最基本理论的实际应用性和可操作性,同时对于拓展中学生动手能力和解决实际问题的能力大有裨益.
致谢:本文中的实验器材由青岛理工大学环境学院化学实验室提供;本文得到了青岛理工大学孙好芬老师的大力支持与辅导.在此表示衷心感谢!
(作者单位:山东省青岛市第十六中学)

