基于“有故无殒”思想的雷公藤肾毒性研究*
张 琴,欧阳林旗,胡炜航,左亚杰,李健和
(1.中南大学湘雅二医院药学部,湖南 长沙 410011; 2.湖南省中医药大学第一附属医院制剂中心,湖南 长沙 410000)
基于“有故无殒”思想的雷公藤肾毒性研究*
张琴1,2,欧阳林旗2,胡炜航2,左亚杰2,李健和1
(1.中南大学湘雅二医院药学部,湖南 长沙410011;2.湖南省中医药大学第一附属医院制剂中心,湖南 长沙410000)
目的 研究雷公藤对正常和肾小管S1段损伤急性肾功能衰竭模型大鼠肾毒性的差异。方法 观察雷公藤提取物(TWHF)对生理和病理状态大鼠的一般生长状态、肾脏脏器指数、血清生化指标的影响,并通过病理切片观察大鼠肾脏组织损伤情况。结果 TWHF呈剂量依赖增高的正常大鼠血清尿素氮(BUN)、血清肌酐(CREA)、血清高K+和低Na+水平,与其一般生长状态、脏器指数和肾功能损伤病理检查结果相符;低剂量TWHF在模型大鼠上表现出改善BUN、CREA、血清高K+和低Na+水平的肾功能保护作用,病理损伤程度也有一定减轻,但高剂量时反而加重模型组大鼠肾功能损伤。结论 雷公藤对正常大鼠有剂量相关的肾毒性,但在一定剂量范围内对肾功能损伤病理状态有保护作用,为雷公藤“有故无殒”的安全用药提供了依据。
有故无殒;雷公藤;肾功能保护;肾脏毒性;毒性差异
雷公藤 Tripterygium wilfordii Hook.f.是卫矛科雷公藤属雷公藤的干燥根及根茎,具有祛风除湿、活血化瘀、舒经通络、消肿止痛、杀虫止血、清热解毒等功效[1],临床常用于治疗各种原发性和继发性肾炎,包括慢性肾小球肾炎、肾病综合征、过敏性紫癜肾炎、狼疮性肾炎等疾病,疗效显著[2-4]。但其肾毒性也明显,已引起国内外研究者对其安全性的疑虑[1,5]。该药的临床应用与中医《内经》中的“有故无殒”思想相吻合。雷公藤的主要毒性成分也是其主要药效成分[6],需要正确理解雷公藤的这种保护和损伤的“双向作用”,认识其“量-效(毒)关系”,以指导临床合理用药。目前,对于雷公藤肾毒性的研究,多集中在其毒性成分、毒理机制及对以正常动物为研究对象的毒性评价[7],未能较好地解释其临床应用中体现的“有故无殒”思想内涵。因此,雷公藤肾毒性评价不能仅限于在正常动物评价其毒性大小,更重要的是应在疾病模型动物上模拟临床实际情况研究其合理用药减毒的途径和机制[8]。本研究中拟基于“有故无殒”思想,以正常和急性肾小管损伤大鼠为研究对象,从肾功能和肾组织形态等方面探讨雷公藤提取物(TWHF)对正常和肾小管损伤急性肾功能衰竭大鼠的效/毒作用差异,客观评价雷公藤的肾毒性和肾保护“双向作用”,为科学评价雷公藤对肾脏的量-效/毒关系和指导临床合理、安全用药提供依据。
1 资料与方法
1.1仪器、动物与试药
仪器:BS-300型全自动生化分析仪(迈瑞公司);TDZ4-WS型台式低速离心机(长沙湘仪离心机仪器有限公司);TP1020型自动脱水机,RM2135型石蜡切片机,DM1000型光学显微镜(德国Leica公司);CS-VI型摊片烤片机(湖北孝感宏业医用仪器有限公司);Tissue-Tek TEL组织包埋机(日本Sakura公司);隔水式电热恒温培养箱(上海市跃进医疗器械厂);微波炉(TCL有限公司);MiniSee图像采集系统。
动物:雄性SD大鼠80只,SPF级,6~8周龄,体质量(180±30)g,购于长沙市天勤生物技术公司,动物合格证号为SCXK(湘)2015-0003。分笼饲养于湖南中医药大学实验动物中心,自由进食及饮水,实验室温度(22±2)℃,相对湿度60%~80%,人工光照约12 h明暗周期,定期消毒。
试药:雷公藤(湖南省松龄堂中药饮片有限公司,批号为SL16041501),经湖南中医药大学张志国教授鉴定为卫矛科雷公藤属雷公藤 Tripterygium wilfordii Hook.f.的根及根茎。雷公藤提取物(取一定量雷公藤,加6倍量90%乙醇,加热蒸馏提取3次,每次1 h;取醇提残渣,加10倍量水,加热提取1 h;合并滤液,冷冻干燥制成粉末,保存备用)。重铬酸钾(北京嘉世玉禾化工技术研究院,批号为S50744);羧甲基纤维素钠(CMC-Na,上海山浦化工有限公司,批号为20121222);水合氯醛(上海沪试化工有限公司,批号为20151217)。
1.2方法
分组:参考文献和临床常用剂量等比设定4个TWHF剂量组(每1 kg含3.13,6.25,13.5,27.0 g生药)。大鼠预养1周后,按体质量随机分为10组,每组8只,即空白组(N),模型组(M),空白组+1倍剂量TWHF组(ND1),空白组+2倍剂量TWHF组(ND2),空白组+4倍剂量TWHF组(ND3),空白组+8倍剂量TWHF组(ND4),模型组+1倍剂量TWHF组(MD1),模型组+2倍剂量TWHF组(MD2),模型组+4倍剂量TWHF组(MD3),模型组+8倍剂量TWHF组(MD4)。
造模:重铬酸钾溶于去离子水中,造模剂量为20 mg/(kg·d),模型组于给药第4天皮下注射1次,造肾小管S1段损伤的急性肾功能衰竭模型。
给药:将TWHF溶于5%的CMC-Na溶液,按拟订剂量灌胃给药,空白组灌以同体积的5%CMC-Na溶液,每天给药1次,持续7 d。
常规指标观察:给药后,观察大鼠毛色、饮食及行为活动等一般状况,分别于给药前及给药后第1,3,5,7天称大鼠体质量,并在给药前、造模后、处死前将大鼠放于代谢笼中,接取尿液,记录24 h尿量。
肾组织器官脏器系数:记录大鼠死亡数量,将大鼠解剖后,摘取两肾,用滤纸吸干,称取质量。脏器系数=器官湿质量/体质量×100%。
生化指标测定:试验第8天,取大鼠股动脉血,室温放置2 h后离心(3 000 r/min)10 min,得血清样本,进行生化检测,检测内容主要有血清尿素氮(BUN),血清肌酐(CREA),Ca2+,Na+,K+,Cl-。
肾脏病理组织形态学检查:试验结束后处死动物,解剖后用冰生理盐水洗血迹,滤纸吸尽表面水分,精确称质量,将摘取的一侧肾脏立即固定于10%福尔马林常规脱水,石蜡包埋,切片,HE常规染色,并于光镜下观察组织病理变化情况。
1.3统计学处理
采用SPSS 19.0统计软件进行分析。各组定量检测数据以X±s表示,两组间比较采用 t检验,多组间比较采用单因素方差分析(One-Way ANOVA),多组间比较采用 LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1大鼠一般情况变化
各健康动物中,空白组大鼠精神状态良好,行动灵活,毛发光泽,大小便正常;给予TWHF后,大鼠出现精神不振,被毛脏乱,偶见稀便。给药期间,各组健康大鼠体质量总体呈增长趋势,但随着给药时间的延长,体质量呈现较缓慢的增长状态,高剂量(4倍、8倍剂量)组大鼠体质量增长抑制趋势高于低剂量组及空白组,详见表1。随着给药时间的延长和剂量的增大,有不同程度的尿量减少,呈剂量相关性,高剂量组严重者尿液颜色加深,呈红棕色。试验过程中,8倍剂量组大鼠死亡1只。详见表2。
模型组大鼠以重铬酸钾造肾小管S1段损伤的急性肾功能衰竭模型,造模后大鼠表现出毛色无光泽,眼神黯淡,萎靡少动,饮食量减少。造模前,大鼠体质量整体水平呈增长趋势;造模后,体重增长缓慢甚至下降;与模型组比较,给药1倍和2倍剂量TWHF后,大鼠体质量稍有增长,而4倍和8倍剂量组体重增长抑制作用明显,详见表1。与空白组比较,模型组大鼠尿量减少明显,1倍和2倍剂量组尿量减少较高剂量组缓慢,高剂量组随着给药时间的延长,其尿量进一步下降,各组大鼠尿液出现红棕色,甚至血尿,部分动物出现死亡现象,尤以高剂量明显,4倍和8倍剂量大鼠各死亡2只,详见表2。
2.2大鼠肾脏脏器指数
正常大鼠给予不同剂量TWHF后,与空白组相比,给药组肾脏脏器指数均有所增高,高剂量组(4倍和8倍剂量)的差异有统计学意义(P<0.05)。重铬酸钾造模后,与空白组大鼠相比,肾脏脏器指数显著升高(P<0.01);给予不同剂量TWHF后,与模型组相比,1倍和2倍剂量组肾脏脏器指数有下降趋势,但未达到显著性,4倍和8倍剂量组肾脏脏器指数进一步升高。
2.3大鼠肾脏功能生化指标
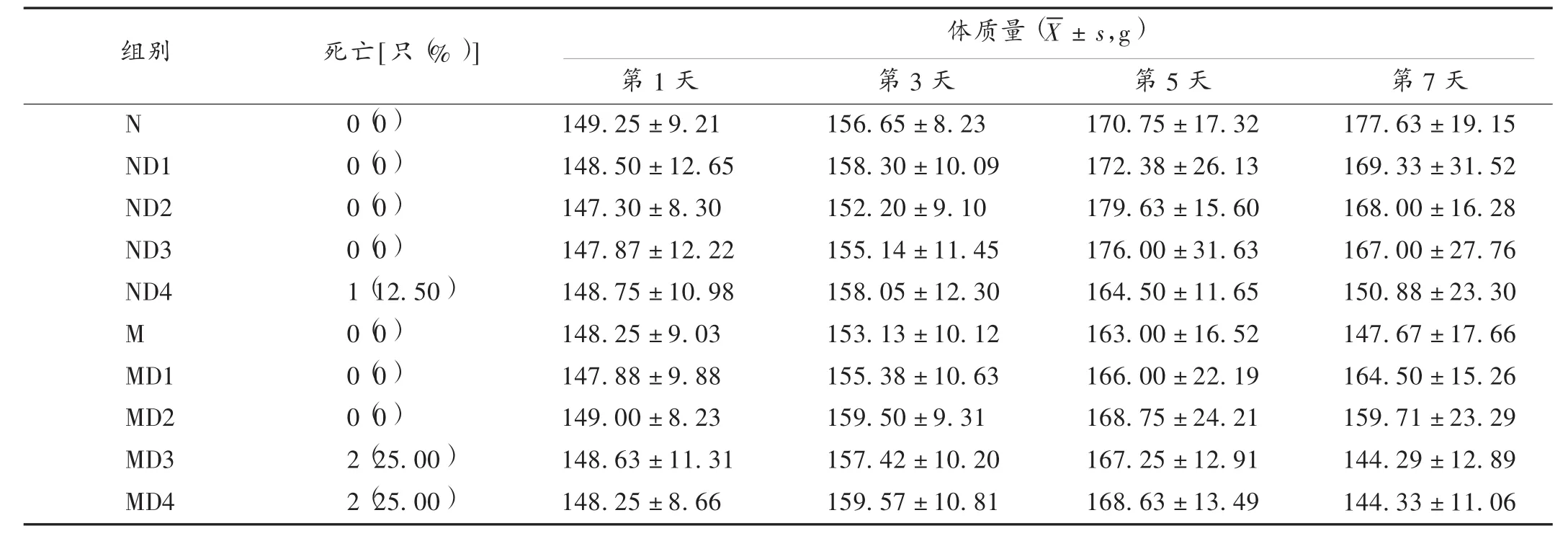
表1 各组大鼠给药前后体质量变化情况(n=8)
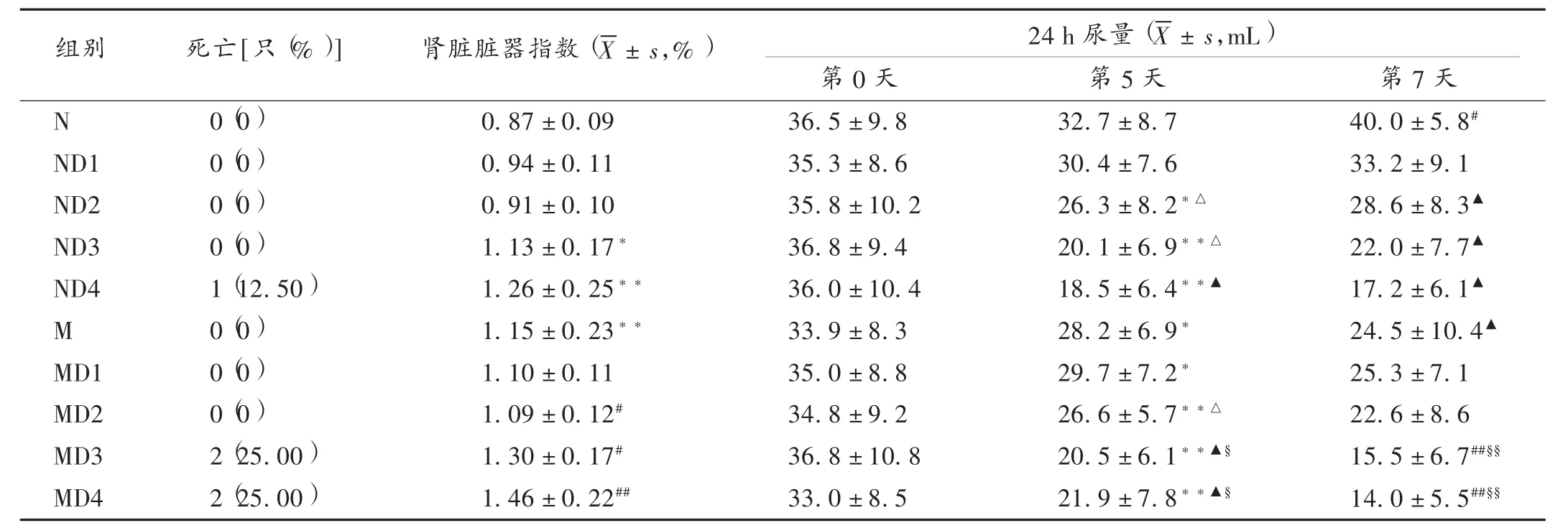
表2 各组大鼠给药后肾脏脏器指数与24 h尿量变化情况(n=8)
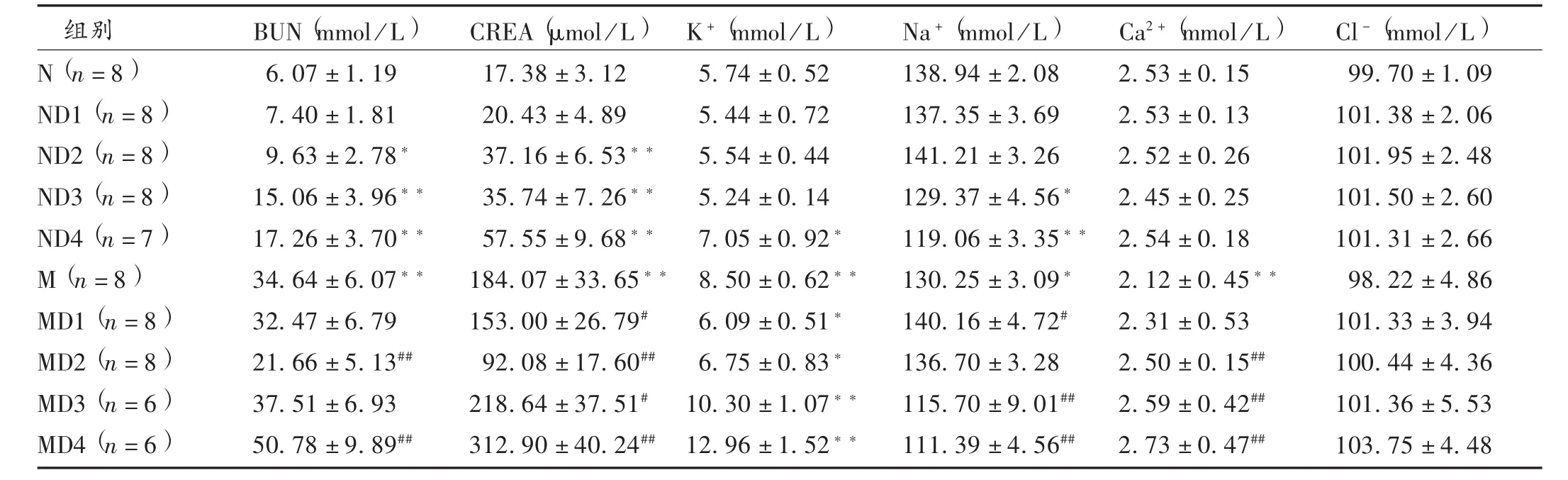
表3 TWHF对健康及肾损伤模型大鼠肾功能指标的影响(X±s)
不同试验组大鼠肾脏生化指标变化见表3。正常大鼠给予不同剂量TWHF后,与空白组相比,2,4,8倍剂量组大鼠BUN和CREA水平显著增高,且呈一定的量-效关系;8倍剂量组大鼠K+浓度增高,4倍和8倍剂量组大鼠Na+浓度降低;Ca2+和Cl-浓度无明显变化。重铬酸钾造模后,与空白组大鼠相比,模型组大鼠BUN,CREA水平和K+浓度显著增高,Ca2+和Na+浓度明显降低;模型组大鼠给予不同剂量TWHF后,1倍剂量组大鼠BUN,CREA水平和K+浓度降低,Na+浓度升高;2倍剂量组大鼠K+浓度降低,BUN和CREA水平显著降低,Ca2+浓度显著升高;4倍和8倍剂量组大鼠BUN,CREA水平和K+,Ca2+浓度进一步增高,Na+浓度明显降低。提示雷公藤在正常大鼠表现出剂量相关性的肾功能损伤,在肾小管S1段损伤的急性肾功能衰竭模型大鼠,低剂量表现出保护作用,高剂量表现出加重肾功能损伤作用。
2.4大鼠肾脏组织病理形态学
空白组大鼠肾脏组织结构基本正常,无明显病理变化;重铬酸钾造模后,模型组大鼠肾脏组织结构镜下可见肾小管细胞明显水肿,细胞颗粒样变性,肾小管坏死,肾小球囊性扩张,部分系膜基质增生,肾小管内水肿,液体潴留,较多管型等病理改变。与空白组比较,不同TWHF剂量组肾组织有不同程度的肾小管细胞水肿,肾小管细胞颗粒样变性,肾小球囊性扩张、系膜基质增生,严重者出现间质改变和肾小管坏死,呈一定剂量相关性。与模型组比较,1倍和2倍剂量组肾脏组织损伤有一定程度减轻,4倍和8倍剂量组肾功能损伤进一步加重,严重者肾间质少量钙化,皮质区肾小球坏死、钙化,近皮质区域肾小球、肾小管坏死严重,髓质水肿。详见图1。可见,雷公藤对正常大鼠表现出肾功能损伤,低剂量在模型大鼠表现出保护作用,高剂量表现出损伤作用。
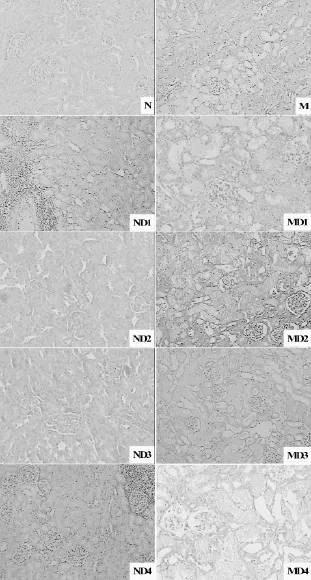
图1 TWHF对健康和肾功能损伤模型大鼠肾脏组织HE染色结果的影响(×200)
3 ? 讨论
雷公藤并非传统剧毒药物,其不同部位短期给药产生的肾脏毒性不明显,但长期使用雷公藤治疗慢性疾病,特别是在长期或大量用于肾脏相关疾病治疗时,其潜在肾毒性不容忽视[9]。本研究中在较大剂量范围考察了雷公藤毒效关系,从大鼠给药后的一般状况、脏器指数、血液生化指标和肾脏病理组织改变结果可以看出,在正常生理状态下与肾功能损伤病理状态下的大鼠,给予不同剂量TWHF所表现出来的毒性结果存在差异。正常大鼠给予TWHF后,随着剂量的增加,大鼠体质量增长抑制,高剂量组肾脏脏器指数增加,与肾功能损伤有关的BUN,CREA,血清高K+和低Na+状态呈剂量相关的增高趋势,肾脏病理切片显示最高剂量组MD4大鼠出现严重的肾小球、肾间质改变和肾小管坏死。模型组大鼠体质量增长明显抑制,甚至出现体质量减轻,肾脏脏器指数显著增加,而雷公藤作用于模型组大鼠,在较低剂量(1倍和2倍剂量TWHF)表现出改善BUN,CREA水平和血清高K+、低Na+状态的保护作用,肾脏组织病理损伤程度也有一定减轻,但高剂量时反而加重了模型组大鼠的肾功能损伤。提示在使用对症、剂量恰当的情况下,雷公藤可安全用于肾脏相关疾病的治疗。
很多研究证实,中药“有故无殒”的现象是客观存在的,其思想的实质是研究中药与特定证候或机体状态之间的对应关系及其内在的变化规律[8,10-11]。现代研究对雷公藤肾毒性的研究多关注其物质基础与作用机制对毒效关系的影响,而忽略了药物对不同状态机体产生的毒性差异。雷公藤多苷对正常和关节炎模型大鼠的肝功能生化指标的影响也存在差异,研究结果显示,对模型大鼠的影响小于正常大鼠[12]。本研究结果证实,雷公藤肾毒性的量-效/毒关系具有类似规律,体现了“有故无殒”的思想。雷公藤引起肾毒性的成分为雷公藤多苷、雷公藤甲素[13],而肾脏具有保护作用的成分主要为雷公藤多苷、雷公藤甲素、雷公藤内酯醇[14-15]。这种肾脏保护活性成分与肾毒性成分的重叠,是肾毒性差异的物质基础,提示雷公藤存在明显的药效与毒性“双向”作用,在临床应用时剂量范围的重要性不容忽视。
综上所述,雷公藤对于肾脏组织损伤病理状态有比正常生理状态下较低的肾毒性,在一定剂量范围内表现“有故无殒”,安全用于临床治疗的前提是“对症”,把握不同病理状态的量-效/毒差异。后续试验将研究不同肾功能损伤病理状态下的量-效/毒差异与特点,为雷公藤的安全、有效应用提供科学依据。
[1]李德平,翟华强,曹炜,等.雷公藤的药性文献回顾及其作用机制研究进展[J].中国实验方剂学杂志,2012,18(13):299-303.
[2]范为民,王小琴.雷公藤制剂在肾脏病中的应用进展[J].临床肾脏病杂志,2013,13(8):380-381.
[3]刘珊,刘伦志,覃智慧,等.雷公藤多甙对老年大鼠肾小球肾炎的疗效及炎症指标的影响[J].中国免疫学杂志,2014,30(5):627-629.
[4]庞洁,盛梅笑.雷公藤治疗慢性肾小球肾炎临床疗效的Meta分析[J].南京中医药大学学报,2011,27(6):527-530.
[5]孙萍萍,张天娇,许可嘉,等.雷公藤及其制剂临床不良反应分布特点随机对照试验的系统评价[J].世界科学技术-中医药现代化,2015,17(9):1 899-1 905.
[6]Li XX,Du FY,Liu HX,et al.Investigation of the active components in Tripterygium wilfordii leading to its acute hepatotoxicty and nephrotoxicity[J].J Ethnopharmacol,2015,162:238-243.
[7]昊霞,王忠震,林兵,等.雷公藤毒性作用机制研究进展[J].中国医院药学杂志,2015,35(16):1 519-1 523.
[8]王艳辉,赵海平,王伽伯,等.基于“有故无殒”思想的熟大黄对肝脏量-毒/效关系研究[J].中国中药杂志,2014,39(15):2 918-2 923.
[9]冯群,栾永福,孙蓉,等.基于功效和物质基础的雷公藤毒性研究进展[J].中国药物警戒,2013,10(2):88-92.
[10]曹亮亮,王文晓,张丽,等.基于“有故无殒”思想的醋甘遂毒性研究[J].中国中药杂志,2015,40(16):3249-3255.
[11]马骁,何璇,刘甜甜,等.浅析“有故无殒,亦无殒”思想的科学内涵[J].中药与临床,2014,5(6):40-42.
[12]吕永恒,吕诚,谭勇,等.雷公藤多苷对佐剂性关节炎大鼠血液生化指标的影响[J].中国中医基础医学杂志,2009,15(3):212-214.
[13]Sun L,Li H,Huang X,et al.Triptolide alters barrier function in renal proximal tubular cells in rats[J].Toxicology Letters,2013,223(1):96-102.
[14]厉莉,赵然,李春君,等.雷公藤多苷对糖尿病大鼠肾脏的保护作用[J].中国糖尿病杂志,2016,24(5):459-464.
[15]夏璁,何灵芝.雷公藤制剂治疗糖尿病肾病研究进展[J].江西中医药大学学报,2015,27(1):121-124.
Study on the Renal Toxicity ofTripterygium Wilfordii Hook.f.on the Basis of Symptom-Based Prescription Theory
Zhang Qin1,2,Ouyang Linqi2,Hu Weihang2,Zuo Yajie2,Li Jianhe1
(1.Department of Pharmacy,The Second Xiangya Hospital of Central South University,Changsha,Hunan,China410011;2.Preparation Center,The First Hospital of Hunan University of Chinese Medicine,Changsha,Hunan,China410000)
ObjectiveTo study the differences in the renal toxicity of Tripterygium wilfordii Hook.f.(TWHF)on normal and acute renal failure model rats with tubular S1 damaged.MethodsThe general growth status,organ/body coefficients and serum biochemical indexes were used to investigate the influence of the TWHF on physiological and pathological state.Pathological sections were prepared to observe the damage in renal tissue.ResultsTWHF increased BUN,CREA,and serum high K+and low Na+levels of normal rats in a dose dependent,which was consistent with its general growth state,organ/body coefficients,and kidney damage pathological examination results.Low doses of TWHF improved the state of BUN,CREA,serum high K+and low Na+levels,and reduced the renal pathological damage in a certain degree,which showed protection effect in model rats.However,high doses of TWHF aggravated kidney injury of model rats.ConclusionAlthough TWHF has dose related renal toxicity to normal rats,it also has a protective effect on kidney injury pathological status in certain dose range,which provided a basis for clinical safe application of TWHF based on symptom-based prescription theory.
symptom-based prescription theory;Tripterygium wilfordii Hook.f.;renal protection;renal toxicity;differences in toxicity
R285.5;R282.71
A
1006-4931(2016)20-0025-05
*湖南省教育厅科学研究项目优秀青年基金项目,项目编号:14B132。
张琴(1981-),女,汉族,湖南长沙人,大学本科,主管药师,研究方向为中药制剂、中药药理学,(电话)0731-85600466(电子信箱)dboyzq1@163.com;李健和,男,汉族,硕士研究生,副主任药师,硕士研究生导师,研究方向为新药开发,本文通讯作者,(电话)0731-85292093(电子信箱)lijianhexy@126.com。
(2016-06-13;
2016-06-30)

