右美托咪定联合舒芬太尼预防老年男性患者导尿管相关膀胱刺激征的效果
陈祖萍, 咸 峰, 程崇学, 李 鑫, 沈 江
(江苏省常州市第一人民医院 麻醉科, 江苏 常州, 213003)
右美托咪定联合舒芬太尼预防老年男性患者导尿管相关膀胱刺激征的效果
陈祖萍, 咸 峰, 程崇学, 李 鑫, 沈 江
(江苏省常州市第一人民医院 麻醉科, 江苏 常州, 213003)
右美托咪定; 舒芬太尼; 老年; 男性; 导尿管相关膀胱刺激征
麻醉手术期间常需留置导尿管,留置导尿管术后易发生导尿相关的膀胱刺激症(CRBD)。有研究[1]表明男性患者术后CRBD发生率高达71%。CRBD引起患者焦虑,术后疼痛加剧,影响了患者术后康复[2]。对于心脏储备功能差的患者,严重的CRBD容易引起心动过速、高血压以及心律失常等心血管事件。老年患者心血管呈退行性改变,心血管调节能力差,器官储备功能下降, CRBD增加了心血管事件发生的风险。研究[3]表明手术结束前30 min预注舒芬太尼0.1 μg/kg可减少CRBD的发生率,然而其CRBD发生率仍然高达34%。右美托咪定是一种高选择性α2肾上腺素能受体激动剂,具有镇痛、镇静、中枢性抗交感和抗焦虑作用[4]。本研究评价小剂量右美托咪定联合舒芬太尼对老年男性患者导尿管相关膀胱刺激征的影响,现报告如下。
1 资料与方法
1.1 一般资料
本研究已获本院医学伦理委员会批准,所有患者均签署知情同意书。择期全麻下拟行胃癌根治术的老年男性患者120例,年龄65~85岁,ASAⅡ、Ⅲ级。排除有明显的心、肺、肝功能障碍、泌尿系统疾病史、中枢神经系统疾病史、病态肥胖、哮喘、心动过缓和病窦综合征患者、使用慢性镇痛药的患者。采用随机数字表法分为S组、D组和DS组,每组40例。
1.2 麻醉方法
所有患者均不用术前药。入室常规监测ECG、NIBP、HR和SpO2, 开放上肢静脉通路,静脉输注复方乳酸钠林格氏注射液4~6 mL/(kg·h)。麻醉诱导:依次静脉注射依托咪酯0.3 mg/kg、顺式阿曲库铵0.2 mg/kg和舒芬太尼0.5 μg/kg麻醉诱导, 4 min后气管插管行机械通气,维持呼气末CO235~45mmHg。插入16F Foley′S导尿管,将10 mL注射用水注入尿管气囊然后固定。麻醉维持:吸入0.5~1%的七氟醚,泵注丙泊酚2.0~5.0 mg/(kg·h), 视情况追加舒芬太尼,静脉泵注瑞芬太尼0.02~0.2 μg/(kg·min), 顺式阿曲库铵1~2 μg/(kg·min), 维持MAP波动范围不超过基础值的20%, BIS值40~60。手术结束前30 min停止吸入七氟醚和停用顺式阿曲库铵, S组和DS静脉注射0.1 μg/kg的舒芬太尼, D组给予等量的生理盐水,然后S组使用微量输液泵输入20 mL生理盐水, D组和DS组使用微量输液泵输入含0.25 μg/kg的DEX的20 mL生理盐水, 3组均于10 min内泵完。手术结束前5 min停止输注丙泊酚和瑞芬太尼。
1.3 观察指标
手术结束入麻醉恢复室,符合气管拔管指征拔除气管导管,于拔管后10 min (T1)、1 h (T2)、2 h (T3)和6 h (T4)时记录CRBD发生情况和程度(1级:仅在被询问时诉尿路不适; 2级:自诉尿急、尿痛和下腹憋胀感; 3级:除2级的临床表现外并伴有强烈的烦躁不安,试图拔除尿管)。记录苏醒时间(术毕至呼唤睁眼的时间)和拔管时间(术毕至拔除气管导管的时间);记录拔管后6 h内以及心动过缓、低血压和呼吸抑制的发生情况。
1.4 统计学方法
采用SPSS 22.0统计学软件进行分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析;计数资料以率表示,计数资料比较采用χ2检验或Fisher检验,等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结 果
S组ASAⅡ级30例, Ⅲ级10例,年龄71.7±5.1岁,体质量63.5±7.2 kg, 术中舒芬太尼用量44.2±7.5 μg, 手术时间163.7±12.7 min; D组ASAⅡ级29例, Ⅲ级11例,年龄71.5±4.7岁,体质量62.9±6.3 kg, 术中舒芬太尼用量43.2±7.4 μg, 手术时间162.5±12.5 min; DS组ASAⅡ级28例, Ⅲ级12例,年龄71.6±4.9岁,体质量63.8±6.0 kg, 术中舒芬太尼用量43.1±7.1 μg, 手术时间164.2±14.2 min。3组患者ASA分级构成比、年龄、体质量、舒芬太尼用量及手术时间差异无统计学意义(P>0.05)。与DS组比较, S组和D组术后T1、T2和T3CRBD的程度显著升高 (P<0.05); 与S组比较, D组和DS组T4时间点CRBD的程度显著降低(P<0.05)。见表1。2组患者苏醒时间、气管拔管时间和呼吸抑制、心动过缓、低血压发生率比较,差异无统计学意义(P>0.05)。见表2。
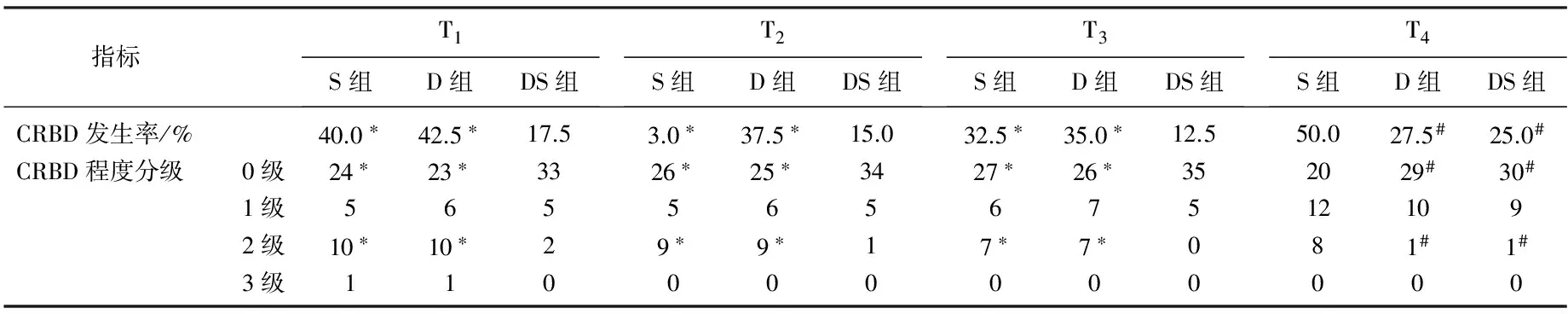
表1 3组患者不同时间点CRBD发生率及程度的比较
与DS组比较, *P<0.05; 与S组比较, #P<0.05。
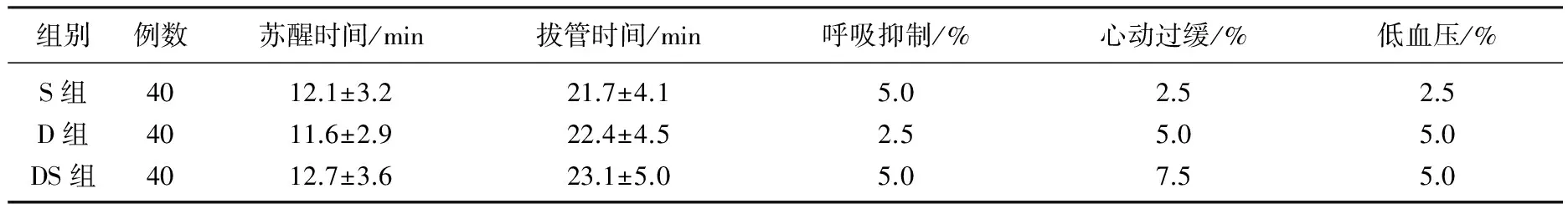
表2 3组患者苏醒时间、拔管时间及并发症比较
3 讨 论
男性患者由于其尿道解剖特点,清醒导尿可导致患者紧张、疼痛而引起血压升高、心率加快,心血管不良事件增加,对于老年人而言更易导致心血管意外事件发生。另外,清醒导尿也不符合舒适化医疗的要求。作者对于老年男性患者需留置导尿管时,均采取了全麻诱导后导尿的方式,但有研究[5]表明全麻诱导后导尿导致CRBD的发生率增加,因而如何降低全麻患者术后CRBD的发生率值得临床研究。性别是CRBD发生的独立因素[6],男性患者更易发生CRBD,另外伤害性刺激不同的手术以及膀胱附近的手术操作可能影响CRBD的发生率。因此作者选择了接受胃癌根治术的老年男性患者作为研究对象。
CRBD是由于导尿管刺激尿道黏膜、膀胱而引起的尿道灼热感伴尿急及耻骨上区不适感[7]。与其他术后疼痛不同,CRBD对常规用于缓解术后疼痛的阿片类药物有一定的抵抗性,这是因为CRBD表现为类似于膀胱过度活动的表现,而膀胱不随意收缩是由于激活的胆碱能神经释放的乙酰胆碱作用于毒蕈碱型受体而介导的[8]。研究[9]表明右美托咪定明显抑制蟾蜍卵母细胞毒蕈碱型受体3的表达;另外尿道由丰富的神经系统支配,其中交感神经和副交感神经分布于整个尿道,而交感神经负责传递疼痛、温觉及触觉,导尿管的对尿道的刺激兴奋交感神经而产生CRBD,而右美托咪定具有中枢抗交感作用,这2个因素可能是DS组较S组T1、T2和T3能降低CRBD的发生率和程度降低的原因。D组与DS组比较, D组T1、T2和T3这3个时间点CRBD的发生率和程度升高,说明单纯使用右美托咪定并不能较好的抑制CRBD的发生,提示引起CRBD还有其他原因。在全身麻醉诱导后,留置导尿管虽然避免了清醒导尿引起的不良事件,但由于患者已处于无意识的麻醉状态,对导尿操作的刺激反应较小,术后不能产生良好的耐受性,当进入全麻苏醒期时,虽然患者已苏醒,但意识还未完全复原,造成任何不良刺激如疼痛、导尿管引起的不适感等均可以引起反射性抵抗(如牵拉导尿管甚至试图拔掉导尿管),这可能是产生CRBD的原因之一,因而良好的镇痛能减轻CRBD的症状,这可能也是一些镇痛药[3]也能降低CRBD发生率的原因。本研究中持续泵注了瑞芬太尼,有学者[10]研究表明瑞芬太尼使用后出现痛觉高敏,可能是其使用后通过一条含μ受体的调节通路来激活N-甲基-D-门冬氨酸受体来实现的,因此要处理瑞芬太尼使用后的疼痛高敏问题可能仍然需要阿片类药物,这可能是单纯使用右美托咪定不能较好的降低CRBD的发生率和程度的原因。与S组比较,D组和DS组T4时间点CRBD的程度降低。这可能与舒芬太尼和右美托咪定有效作用时间不同有关。舒芬太尼的消除半衰期为2.5 h左右,而有学者[11]研究表明右美托咪定抗毒蕈碱型受体作用时间可延长至6 h。
低血压和心动过缓是右美托咪定常见的并发症,而呼吸抑制是舒芬太尼较常见的并发症,本研究表明3组呼吸抑制、心动过缓及低血压的发生率均较低。这可能与右美托咪定和舒芬太尼的用量均较小有关。其他的毒蕈碱型受体阻断药如托特罗定也能明显降低CRBD的发生,然而有59%的患者会有口干的副作用[7]。本研究中D组和DS组仅5%的患者出现口干。虽然右美托咪定有镇静效应,然而3组苏醒时间和拔管时间差异无统计学意义,这可能与其清醒镇静效应及用量较小有关。在选择合适的药物来降低老年全麻患者术后CRBD的发生率时,理想的药物应该效果确切,副作用少,有利于老年患者的康复。老年患者随年龄的增长,免疫系统的衰退非常明显,麻醉、手术以及术后疼痛均可抑制患者细胞免疫功能,导致患者术后感染和肿瘤复发的概率增加[12]。研究[13]表明右美托咪定可改善老年胃肠肿瘤根治术患者的细胞免疫功能。此外,右美托咪定对心、肾和脑等器官功能可能具有一定的保护特性,可使全麻患者苏醒更平稳,减轻老年患者术后谵妄的临床症状[4]。右美托咪定和舒芬太尼作为不同机制的镇痛和镇静药物,分别阻断产生CRBD的不同机制,二者联合使用产生相加或协同效应,因而只需小剂量即有效地降低了接受胃癌根治术的老年男性CRBD的发生率和程度,同时副作用不增加。总之,手术结束前30 min泵注0.25 μg/kg右美托咪定联合0.1 μg/kg舒芬太尼能有效防治老年男性患者CRBD发生。
[1] Ryu J H, Hwang J W, Lee J W, et al. Efficacy of butylscopolamine for the treatment of catheter-related bladder discomfort:a prospective, randomized, placebo-controlled, double-blind study[J]. Br J Anaesth, 2013, 111(6): 932-937.
[2] Tauzin-FinP, Sesay M, Svartz L, et al. Sublingual oxybutynin reduces postoperative pain related to indwelling bladder catheter after radical retropubic postatectomy[J]. Br J Anaesth, 2007, 99: (4)572-575.
[3] 刘洋 黄惠莲 潘甜, 等. 羟考酮预防全麻患者麻醉恢复期导尿管相关膀胱刺激征的效果[J]. 中华麻醉学杂志, 2015, 35(10): 1178-1181.
[4] 中华医学会麻醉学分会. 右美托咪定临床应用指导意见[J]. 中华医学杂志2013, 93(35): 2775-2777.
[5] 秦承伟, 张励才, 宋蕾. 全麻诱导后置导尿管增加中老年患者麻醉苏醒期躁动[J]. 徐州医学院学报, 2006, 26(2): 129-131.
[6] Binhas M, Motamed C, Hawajri N, et al. Predictors of catheter-related bladder discomfort in the post-anaesthesia care unit[J]. Ann Fr Anesth Reanim, 2011, 30(2): 122-125.
[7] garwal A, Raza M, Singhal V, et al. The efficacy of tolterodine for prevention of catheter-related bladder discomfort: a prospective, randomized, placebo-controlled, double-blind study[J]. Anesth Analg, 2005, 101(4): 1065-1067.
[8] Yamanishi T, Chapple C R, Chess-Williams R. Which muscarinic receptor is important in the bladder[J] World J Urol, 2001, 19(5): 299-306.
[9] Takizuka A, Minami K, Uezono Y, et al. Dexmedetomidine inhibits muscarinic type 3 receptors expressed in Xenopus oocytes and muscarine-induced intracellular Ca2+elevation in cultured rat dorsal root ganglia cells[J]. Naunyn Schmiedebergs Arch Pharmacol, 2007, 375(5): 293-301.
[10] Guntz E, Dumont H, Roussel C, et al. Effects of remifentanil on N-methyl-D-aspartate receptor: an electrophysiologic study in rat spinal cord [J]. Anesthesiology, 2005, 102(6): 1235-1241.
[11] Hyun-Chang Kim, Yong-Hun Lee, Young-Tae Jeon, et al. The effect of intraoperative dexmedetomidine on postoperative catheter-related bladder discomfort in patients undergoing transurethral bladder tumour resection[J]. Eur J Anaesthesiol, 2015, 32(9): 596-601.
[12] Milasiene V, Stratilatovas E, Norkiene V. The importance of T-lymphocyte subsets on overall survival of colorectal and gastric cancer patients[J]. Medicina (Kaunas), 2007, 43(7): 548-554.
[13] 刘丽, 徐威, 陈亚萍. 右美托咪定对老年胃肠肿瘤根治术患者围术期细胞免疫功能的影响[J]. 中华麻醉学杂志, 2013, 33(10): 1171-1173.
2016-10-13
咸 峰, E-mail: m13861122667@sina.com
R 694
A
1672-2353(2016)23-169-03
10.7619/jcmp.201623063

