改良超长方案对多囊卵巢综合征不孕患者子宫内膜容受性的改善作用研究
尹家瑶, 杨 滢
(陕西省汉中市三二零一医院 妇产科, 陕西 汉中, 723000)
改良超长方案对多囊卵巢综合征不孕患者子宫内膜容受性的改善作用研究
尹家瑶, 杨 滢
(陕西省汉中市三二零一医院 妇产科, 陕西 汉中, 723000)
目的 探讨改良超长方案对多囊卵巢综合症(PCOS)不孕患者子宫内膜容受性的影响。方法 选择PCOS不孕患者100例,根据随机数字表法分为改良组和对照组,每组50例。改良组给予改良超长方案,对照组给予标准长效长方案。经阴道超声检查观察排卵情况及治疗前后子宫内膜变化情况;着床窗口期对内膜间质和腺体分别进行整合素αv、β3及雌激素受体(ER)、孕激素受体(PR)、雄激素受体(AR)的免疫组织化学染色;治疗后对治疗总有效率进行Salle评分。结果 改良组排卵周期数明显多于对照组,排卵率明显高于对照组(P<0.01); 改良组、对照组治疗后子宫内膜厚度均较治疗前明显变厚(P<0.01), 改良组治疗后子宫内膜厚度明显厚于对照组(P<0.01)。各组治疗后内膜血流量均有增加趋势,改良组治疗后内膜血流量高于对照组(P<0.05)。改良组治疗后Salle评分明显低于对照组(P<0.01)。结论 改良超长方案可有效提高PCOS患者排卵率、改善子宫内膜容受性,值得临床推广。
多囊卵巢综合症; 子宫内膜容受性; 排卵; 不孕
多囊卵巢综合症(PCOS)是引起孕龄妇女月经失调和不孕的常见病因,主要临床特征是排卵障碍、月经不调、多毛、肥胖及不孕等[1]。多数生殖中心采用长效长方案,以获得高质量卵子和助孕成功率。但经药物纠正PCOS患者排卵后,仍存在低妊娠率、高流产率的现象,原因之一是PCOS患者存在的内分泌及代谢异常导致子宫内膜容受性下降[2-3]。本研究对PCOS不孕患者采用改良超长方案,探讨其对子宫内膜容受性改善的影响。
1 资料与方法
1.1 一般资料
选取2013年5月—2015年9月收治的PCOS不孕患者100例,纳入标准: PCOS诊断标准[4];无心、肝、肾、肺等重要脏器器质性病变;患者及家属均同意本次研究内容,并书面签署知情同意书。排除标准:有重要脏器严重病变者; 3个月内进行心脏、肾脏手术者;有意识障碍者。根据随机数字表法分为改良组和对照组,每组50例。改良组年龄23~41岁,平均(33.4±3.1)岁;主要临床症状为月经异常25例,多毛20例,不孕50例,肥胖44例。对照组年龄22~42岁,平均(35.6±3.5)岁,主要临床症状为月经异常24例,多毛21例,不孕50例,肥胖43例。2组一般资料比较无显著差异,具有可比性(P>0.05)。
1.2 治疗方法
所有患者均在治疗前1个月经周期第3天口服达英-35, 每片含醋酸环丙孕酮2mg, 炔雌醇0.035 mg, 1片/d, 连续21 d; 服用第18片时皮下注射促性腺激素释放激素类似物达菲林, 1.500~1.875 mg。在此基础上,改良组给予改良超长方案,对照组给予标准长效长方案。
1.2.1 改良组给予改良超长方案:首次注射达菲林后,第2个月经周期的第21天注射相同剂量达菲林,末次注射后13~20 d时经检测血中激素水平达到降调节标准后,肌注hMG(75 IU/支,丽珠制药),起始用量为75~150 IU/d, 使用4~5d。
1.2.2 对照组给予标准长效长方案:黄体中期1次垂体降调节后,月经第4~7天达到降调节标准后给予果纳芬(rFSH, 75 IU/安培),起始用量为75~150 IU/d, 使用4~5 d。
1.3 观察指标
① 各组治疗前后,经阴道超声检查观察排卵情况及子宫内膜变化情况。② 各组均在排卵后7 d排除妊娠后,采取子宫内膜,对内膜间质和腺体分别进行整合素αv、β3及雌激素受体(ER)、孕激素受体(PR)、雄激素受体(AR)的免疫组织化学染色。兔抗人ER、PR抗体,鼠抗人AR抗体均购自北京中杉金桥生物技术有限公司,兔抗人整合素αv、β3抗体购自博士德公司,检测步骤严格按照产品说明书进行。ER、PR、AR阳性染色位于细胞核,整合素αv、β3阳性染色位于细胞膜。染色后光镜下观察染色结果,采用H-score法进行半定量分析,对间质和腺体细胞染色结果分别进行计数。③ 治疗后对治疗总有效率进行Salle评分,评分主要涉及子宫内膜厚度、分层、肌层回声、子宫动脉、血流量等方面,分数越高表明PCOS病情越重。
1.4 统计学分析
实验数据应用SAS 9.0软件分析,计量资料用表示,行方差齐性分析,方差齐者采用t检验,方差不齐者采用秩和检验。四格表资料采用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 排卵情况
2组均行62个观察周期,改良组排卵周期数显著多于对照组,排卵率显著高于对照组(P<0.01)。见表1。

表1 2组治疗后排卵情况比较
与对照组比较, *P<0.05, **P<0.01。
2.2 子宫内膜变化情况
改良组、对照组治疗后子宫内膜厚度均较治疗前显著变厚(P<0.01), 改良组治疗后子宫内膜厚度显著厚于对照组(P<0.01)。2组治疗后子宫内膜多层率均有下降趋势,改良组治疗后较对照组下降的更加明显,但无显著差异(P>0.05)。各组治疗后内膜血流量均有增加趋势,改良组治疗后内膜血流量显著高于对照组(P<0.05)。见表2。
2.3 2组着床窗口期子宫内膜整合素αv、β3及
ER、PR、AR表达情况
改良组子宫内膜间质及腺体的整合素αv、β3表达均显著高于对照组(P<0.01); 改良组子宫内膜间质及腺体的ER、PR、AR表达均显著低于对照组(P<0.01)。见表3。
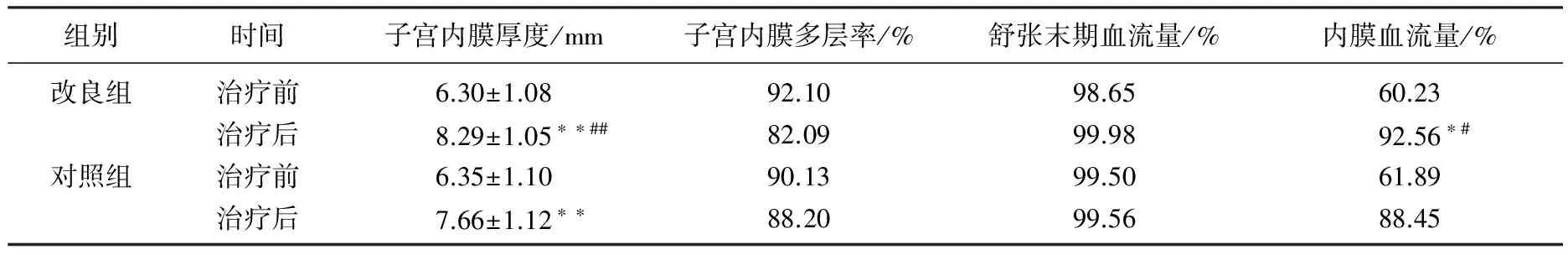
表2 2组治疗前后子宫内膜变化情况
与治疗前比较, *P<0.05, **P<0.01; 与对照组比较, #P<0.05, ##P<0.01。
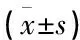
表3 2组着床窗口期子宫内膜整合素αv、β3及ER、PR、AR表达比较
与对照组比较, *P<0.05, **P<0.01。
2.4 2组治疗后Salle评分比较
改良组治疗后Salle评分为(13.25±1.56)分,对照组治疗后Salle评分为(17.02±1.54)分;改良组治疗后Salle评分显著低于对照组(P<0.01)。
3 讨 论
受无孕酮对抗的雌激素影响, 35%的PCOS患者可能会发生子宫内膜增殖症,进而对子宫内膜容受性产生一定影响[5]。此时,子宫内膜局部氧化应激增加,过多的氧自由基对早期胚胎发育及子宫内膜均有细胞毒作用,对构成细胞膜的脂类、蛋白等进行修饰后形成新的抗原成分,导致子宫内膜环境异常,对胚胎的容受性下降[6-7]。子宫血流动力学参数、子宫内膜厚度等常用于评价子宫内膜的容受性,研究[8]提示,未经药物治疗的PCOS患者,子宫血流减少,子宫内膜薄且多层率较高。本研究结果显示,经改良超长方案治疗后, PCOS患者的子宫内膜厚度及血流量均明显增加,治疗效果明显优于标准长效长方案。本研究还发现,改良超长方案治疗的PCOS患者的排卵周期数明显多于对照组,排卵率、总有效率、Salle评分均明显高于标准长效长方案。研究中, 2组治疗后子宫内膜多层率均有下降趋势,改良超长方案治疗组治疗后较对照组下降的更加明显,但经比较差异无统计学意义,考虑为入组例数较少的原因。
整合素主要存在于细胞表面的跨膜糖蛋白,是由α和β两个亚单位构成的异二聚体分子,其可通过介导细胞与细胞、细胞外基质间的相互作用,参与胚胎发育及免疫应答、肿瘤转移等病理生理过程[9-10]。整合素的表达异常可导致子宫内膜容受性下降,引起不孕。目前,整合素已成为评价子宫内膜容受性的重要指标[11]。研究[12]表明, PCOS患者着床窗子宫内膜整合素αv、β3表达减少是降低患者生育能力的重要原因;除此以外, PCOS患者子宫内膜PR、ER的表达增加,也可间接导致整合素αv、β3表达减少,从而影响子宫内膜容受性。本研究中,改良超长方案治疗组着床窗口期的子宫内膜间质及腺体中整合素αv、β3的表达均明显高于对照组,可见改良超长方案可更加明显的通过增加整合素的表达而增加子宫内膜的容受性。
甾体激素受体的表达可随机体激素水平变化而发生周期性变化。随着孕激素的分泌, ER的表达受到抑制,这种降调节被认为是内膜着床窗口期的标志[13]。PR同ER一样,在分泌期受孕激素的作用而下调。AR的表达从增殖早期到分泌中期呈稳定下降趋势[14-15]。本研究中,改良超长方案治疗组着床窗口期的子宫内膜间质及腺体中ER、PR、AR表达均低于对照组,推测其原因可能为改良超长方案能够更显著的降低PCOS患者血清雄激素,诱发孕激素正常分泌,恢复孕激素对其受体的降调节,使子宫内膜容受性得到明显改善。
[1] 刘亚琼, 李元, 蔡素芬, 等. HCG注射前雌二醇水平下降是否影响PCOS患者IVF/ICSI结局[J]. 生殖医学杂志, 2016, 25(2): 123-128.
[2] Dravecká I. Clinical implications of polycystic ovary syndrome[J]. Vnitr Lek, 2016, 62(5): 392-397.
[3] Dahan M H, Zhang L, Chen H Y, et al. Early Short Stimulation Modified Natural Cycle IVF With GnRH Agonist Trigger and In Vitro Maturation in a Woman with Polycystic Ovary Syndrome: A Case Report[J]. J Obstet Gynaecol Can, 2016, 38(5): 465-469.
[4] 胥玉梅, 董云玲. 多囊卵巢综合征的诊断标准[J]. 中国计划生育学杂志, 2005, 13(4): 254-256.
[5] 李洁, 杨菁, 徐望明, 等. PCOS患者GnRH-ant方案超促排卵过程中雌二醇水平下降的临床对策[J]. 生殖医学杂志, 2016, 25(1): 5-10.
[6] Sanchez N, Jones H. "Less Than A Wife": A Study of Polycystic Ovary Syndrome Content in Teen and Women′s Digital Magazines[J]. J Med Internet Res, 2016, 18(6): e89.
[7] Barber T M, Dimitriadis G K, Andreou A, et al. Polycystic ovary syndrome: insight into pathogenesis and a common association with insulin resistance[J]. Clin Med (Lond), 2016, 16(3): 262-266.
[8] 陈东思, 刘建新, 祁秀娟, 等. IRS-1、ERK2蛋白表达及其丝氨酸磷酸化程度与PCOS患者胰岛素抵抗的关系[J]. 中华妇产科杂志, 2016, 51(4): 293-295.
[9] Laisk-Podar T, Lindgren C M, Peters M, et al. Ovarian Physiology and GWAS: Biobanks, Biology, and Beyond[J]. Trends Endocrinol Metab, 2016, 27(7): 516-528.
[10] 王佩玉, 赵军招, 金聪聪, 等. IVM技术在PCOS与非PCOS患者促排卵与未刺激周期中的临床应用比较[J]. 中华妇产科杂志, 2014, 49(12): 903-908.
[11] Jesintha Mary M, Vetrivel U, Munuswamy D, et al. PCOSDB: PolyCystic Ovary Syndrome Database for manually curated disease associated genes[J]. Bioinformation, 2016, 12(1): 4-8.
[12] 王俊燕, 林金芳. 高雄激素血症诱发多囊卵巢综合征慢性轻度炎症的分子机制研究进展[J]. 中华妇产科杂志, 2011, 46(8): 633-635.
[13] I Al-Gareeb A, Abd Al-Amieer W S, M Alkuraishy H, et al. Effect of body weight on serum homocysteine level in patients with polycystic ovarian syndrome: A case control study[J]. Int J Reprod Biomed (Yazd), 2016, 14(2): 81-88.
[14] Erbag G, Eroglu M, Turkon H, et al. Relationship between betatrophin levels and metabolic parameters in patients with polycystic ovary syndrome[J]. Cell Mol Biol (Noisy-le-grand). 2016, 62(5): 20-24.
[15] Jalilian N, Haghnazari L, Rasolinia S. Leptin and body mass index in polycystic ovary syndrome[J]. Indian J Endocrinol Metab, 2016, 20(3): 324-328.
Study on modified ultra-long protocol in improving endometrial receptivity in infertile patients with polycystic ovary syndrome
YIN Jiayao, YANG Ying
(DepartmentofGynecologyandObstetrics,The3201stHospitalofHanzhong,Hanzhong,Shaanxi, 723000)
Objective To explore the influence of modified ultra-long protocol on endometrial receptivity in infertile patients with polycystic ovary syndrome (PCOS). Methods A total of 100 infertile patients with PCOS were randomly divided into modified group and control group by random number table method, with 50 cases for each group. Modified group was given modified ultra-long protocol while control group was given standard long-acting protocol. Ovulation conditions and endometrial changes before and after treatment were observed by transvaginal ultrasonography. In implantation window period, immunohistochemical staining of integrinαvand β3as well as estrogen receptor (ER), progesterone receptor (PR) androgen receptor (AR) in endometrial stromal and glands were conducted respectively. Therapeutic total response rate (RR) was evaluated using Salle score after treatment. Results Modified group was evidently larger in the number of ovulation cycles and apparently higher in ovulation rate than control group (P<0.01). Endometrial thickness was obviously thicker in both groups after treatment than treatment before (P<0.01), which was notably thicker in modified group than that in control group (P<0.01). Endometrial hemorrhagic volume had an increasing tendency in both groups after treatment, which was prominently higher in modified group than that in control group (P<0.05). Meanwhile, modified group was significantly lower in Salle score than control group (P<0.01). Conclusion Modified ultra-long protocol can effectively promote the ovulation rate and improve the endometrial receptivity in patients with PCOS, deserving to be widely used in clinic.
polycystic ovary syndrome; endometrial receptivity; ovulation; infertility
2016-10-05
杨滢, E-mail: zhaoyaojielai@sina.com
R 711.75
A
1672-2353(2016)23-075-03
10.7619/jcmp.201623022

