低补体C3血症及肾组织补体C3沉积在乙肝相关性肾病中的意义
王 荣, 刘昌华, 徐道亮, 伍 刚, 孔亚玲, 周 刚,
牟洪宾, 何大锋, 高 波
(扬州大学临床医学院 江苏省苏北人民医院 肾科,江苏 扬州,225001)
低补体C3血症及肾组织补体C3沉积在乙肝相关性肾病中的意义
王 荣, 刘昌华, 徐道亮, 伍 刚, 孔亚玲, 周 刚,
牟洪宾, 何大锋, 高 波
(扬州大学临床医学院 江苏省苏北人民医院 肾科,江苏 扬州,225001)
目的 探讨补体活化在乙肝相关性肾病中的意义。方法 回顾性分析29例乙肝相关性肾病患者临床资料。低补体C3血症的定义为血清补体C3<85 mg/dL, 根据血清C3水平分为正常补体C3组和低补体C3组,比较2组病理及临床指标的差异。根据免疫荧光下补体C3在肾组织沉积情况,分为阴性组、阳性组,比较2组病理及临床指标的差异。结果 29例患者中,正常补体C3组18例(62.07%), 低补体C3组患者11例(37.93%), 与正常C3组相比,低C3组患者的血肌酐较高, eGFR水平较低(P<0.05); 低补体C3组的系膜增生、肾间质纤维化病理指标平均积分显著高于正常C3组(P<0.05)。肾组织C3沉积阴性组共9例(31.03%), 阳性组共20例(68.97%), 随肾组织补体C3沉积加重,患者胆固醇、血清IgG水平升高,血白蛋白、血清补体C3和eGFR降低(P<0.05); 肾组织C3沉积阳性组肾小球硬化、肾间质炎性细胞浸润、肾小管萎缩、肾间质纤维化程度显著高于阴性组(P<0.05)。结论 乙肝相关性肾病患者常伴随不同程度的补体系统活化,肾脏局部与全身补体活化明显的患者肾脏损伤更为严重,提示补体活化参与乙肝相关性肾病的发生发展过程。
补体C3; 补体激活; 乙肝相关性肾病
乙型肝炎相关性肾病是指由慢性乙型肝炎病毒直接或间接感染诱发的免疫复合物性肾小球疾病。由于乙型肝炎病毒在中国属于高发流行,因此乙型肝炎相关性肾病也是中国主要继发性肾小球疾病之一。补体作为免疫系统的核心组成成分,其参与了多种肾脏疾病的发生、发展[1-3]。补体C3是3条补体激活途径共同作用的蛋白,因此检测血清C3水平及局部组织C3水平,可一定程度上反映补体系统活化的情况。乙肝相关性肾病患者肾组织多存在IgG和补体成分的沉积,其中补体C3较为常见,提示补体在乙肝相关性肾病发生发展过程中起重要作用。本研究对本院近6年乙肝相关性肾病患者的临床及病理资料进行分析,探讨血清C3水平与补体C3在肾组织中的沉积与乙肝相关性肾病的病理及临床表现的关系,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析本科2010年1月—2016年1月收治的乙肝相关性肾病患者29例,所有患者均符合以下标准: ① 血清乙肝病毒标志物阳性; ② 患肾小球肾炎并除外狼疮肾炎等继发性肾小球疾病; ③ 肾组织切片中找到乙肝病毒抗原或乙型肝炎病毒DNA; ④ 肾组织病理为膜性肾病。排除罹患肝硬化、酒精性肝病、药物性肝损及其他急性感染性疾病患者。
1.2 研究方法
记录患者基线人口统计学指标,包括性别、年龄、体质量、身高等。临床观察指标包括eGFR、血尿素氮、血肌酐、血尿酸、血白蛋白、胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶、血清IgG、血清IgA、血清补体C3、血清补体C4、血沉、血红蛋白、24 h尿蛋白定量、尿红细胞计数、二氧化碳结合力、视黄醇结合蛋白、胱抑素C等。患者肾脏病理检测均行经皮肾穿刺活检术。肾组织标本常规行光镜(HE、PAS、Masson和银染色)、免疫荧光(IgA、IgG、IgM、C3、C4、Clq、Fn)及电镜检测。由不参与该研究的肾脏病理医师按病变严重程度对肾小球硬化、系膜增生、内皮细胞增生、肾间质炎性细胞浸润、肾小管萎缩、肾间质纤维化、血管硬化等病理指标进行半定量分析并积分,无=0分,可疑=1分,轻度=2分,中度=3分,重度=4分。依据血清补体C3水平,将患者分为正常血清补体C3组(血清C3≥85 mg/dL)和低血清补体C3组(血清C3<85 mg/dL); 根据免疫荧光下补体C3在肾组织沉积情况,分为阴性、阳性2组;分别比较2组在病理及临床指标之间的差异。
1.3 统计学方法
使用SPSS 16.0统计软件进行统计分析。正态检验采用目测法(直方图、P-P图及Q-Q图)。计量资料采用均数±标准差(正态分布)或M(全距)(非正态分布)来表示,两样本均数的比较则分别采用两独立样本t检验或秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 按血清C3水平分组的临床、病理指标比较
本研究共纳入29例患者,其中男16例,女13例,平均50.1岁。根据血清C3水平分组显示,低补体C3组患者11例(37.93%), 正常C3组18例(62.07%), 2组性别、年龄、BMI、血尿素氮、血尿酸、血白蛋白、胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶、血清IgG、血清IgA、血清IgM、血清补体C4、血沉、血红蛋白、24 h尿蛋白定量、尿红细胞计数、二氧化碳结合力、视黄醇结合蛋白、胱抑素C差异无统计学意义;与正常C3组(血C3≥85 mg/dL)相比,低C3组(C3<85 mg/dL)患者的血肌酐较高, eGFR水平较低,见表1。对乙肝相关性肾病患者病理损伤严重程度进行半定量分析,结果显示低补体C3组的系膜增生、肾间质纤维化病理指标的平均积分明显高于正常C3组,2组肾小球硬化、内皮细胞增生、肾间质炎性细胞浸润、肾小管萎缩、血管硬化差异无统计学意义,见表2。
2.2 按肾组织C3沉积强度分组的临床、病理
指标比较
根据肾组织C3沉积强度不同,分为阴性组、阳性组,2组患者分别为9例(31.03%)和20例(68.97%), 2组性别、年龄、BMI、血尿素氮、血肌酐、血尿酸、甘油三酯、谷丙转氨酶、谷草转氨酶、血清IgA、血清IgM、血清补体C4、血沉、血红蛋白、24 h尿蛋白定量、尿红细胞计数、二氧化碳结合力、视黄醇结合蛋白、胱抑素C差异无统计学意义;随着肾组织补体C3沉积的加重,患者胆固醇、血清IgG水平升高,血白蛋白、血清补体C3和eGFR降低,见表3。肾组织C3沉积阳性组肾小球硬化、肾间质炎性细胞浸润、肾小管萎缩、肾间质纤维化程度明显高于阴性组,而2组间系膜增生、内皮细胞增生和血管硬化的差异无统计学意义,见表4。

表1 2组不同血清C3水平的患者临床参数比较
与低补体C3组比较, *P<0.05。
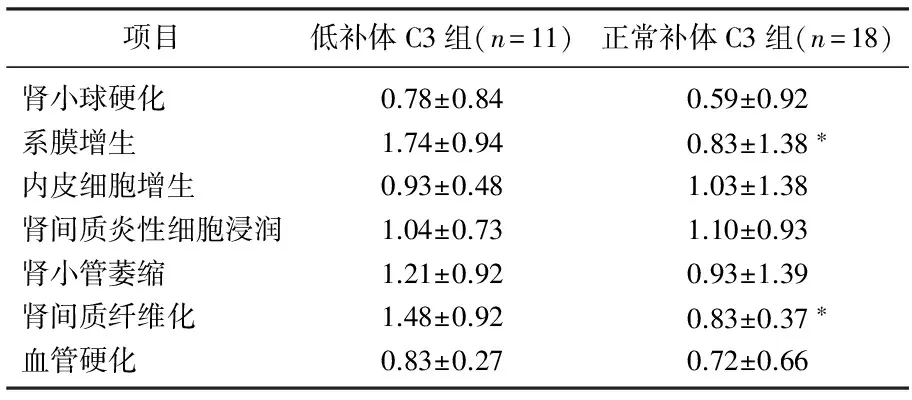
表2 2组血清C3水平不同患者肾组织病理损伤比较
与低补体C3组比较, *P<0.05。
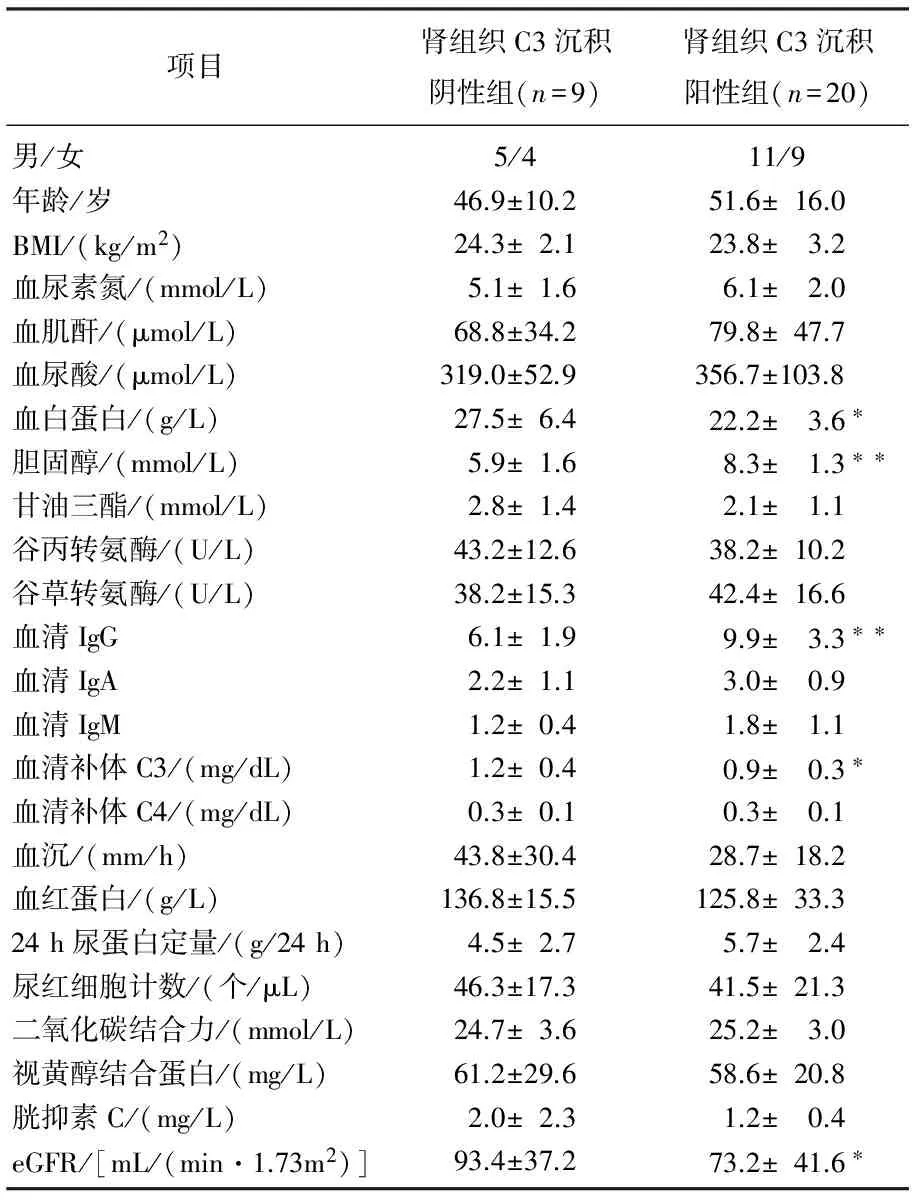
表3 肾组织C3阴性组、阳性组患者临床参数比较
与肾组织C3沉积阴性组比较, *P<0.05, **P<0.01。

表4 肾组织补体C3沉积强度不同患者的组织病理损伤比较
与肾组织C3沉积阴性组比较, *P<0.05。
3 讨 论
乙型肝炎相关性肾病是指由慢性乙型肝炎病毒直接或间接感染诱发的免疫复合物性肾小球疾病,其病理类型多样,可表现为膜型肾病、膜增生性肾炎、系膜增生性病变、局灶节段性肾小球硬化、新月体形成等,其中膜性肾病较为常见,是终末期肾病的重要原因之一[4-7]。迄今为止,对乙肝相关性肾病的研究取得了不少进展,但确切的病因和发病机制仍然不清楚,有研究[8-11]表明乙肝相关性肾病的发生与免疫复合物沉积、乙型肝炎病毒直接侵犯肾组织、基因易感性及补体系统异常活化有关。
补体作为免疫系统的核心组成成分,其参与了多种肾脏疾病的发生发展[3, 12-15]。生理情况下,补体攻击外来病原、清除免疫复合物;病理情况下,补体异常活化,反作用于自身,导致炎性反应和组织损伤。补体激活途径有3种:经典激活途径、旁路途径和植物凝集素途径,这些途径最终都形成复合酶剪切C3。因此,检测血清C3水平及局部组织C3水平,可一定程度上反映补体系统活化的情况。
临床工作中,作者发现乙肝相关性肾病患者肾组织多存在IgG和补体成分的沉积,其中补体C3较为常见。Dan Li等[11]报道血清补体活化水平与乙肝相关性肾病病理严重程度存在正相关,提示补体可能在乙肝相关性肾病中起重要作用。本研究发现,血清C3水平随着肾组织C3沉积强度增强有一定的下降趋势,提示补体局部与全身激活之间可能存在联系,伴随血清C3降低或肾组织C3沉积的患者,其血肌酐较正常C3组患者升高, eGFR较正常C3组患者降低,且肾组织C3沉积阳性的患者病理中肾小球硬化、肾间质炎性细胞浸润、肾小管萎缩、肾间质纤维化程度更为严重,提示肾组织C3沉积患者肾脏损伤更为严重、预后可能不佳。另一个值得注意的是,肾组织C3沉积阳性组患者的血清IgG水平较阴性组增高,血清白蛋白水平降低,提示阳性组患者免疫系统活化明显,推测肾组织的免疫复合物沉积随血清IgG增加而增加,进一步加重肾脏损伤,虽然2组间24 h尿蛋白水平并无明显差异,但肾组织C3沉积阳性组患者尿蛋白定量有一定的增加趋势,2组血清白蛋白水平的差异从另一侧面可以佐证肾组织C3沉积阳性组肾组织损伤程度更为严重。本研究的不足之处有:回顾性研究,缺乏血清C3水平的随访数据,无法得知其在随访过程中是否存在波动性以及与疾病预后情况的关联性。另外,对于肾组织C3沉积强度的评判亦为回顾性评分,可能会造成评判结果的偏倚。
综上所述,乙肝相关性肾病患者常伴随不同程度血清C3降低和肾组织C3沉积,提示存在补体系统活化,肾脏局部与全身补体活化明显的患者肾脏损伤更为严重,提示补体活化参与乙肝相关性肾病患者的病情进展过程,血清补体C3水平及肾组织C3沉积可能预测乙肝相关性肾病病理改变的严重程度和预后,但是还需要对乙肝相关性肾病发病机制的深入研究以及大样本的人群进行随访来确定。
[1] Li X, Ding F, Zhang X, et al. The Expression Profile of Complement Components in Podocytes[J]. Int J Mol Sci, 2016, 17(4): 471.
[2] Floege J, Amann K. Primary glomerulonephritides[J]. Lancet, 2016, 387(10032): 2036-2048.
[3] De Vriese A S, Sethi S, Van Praet J, et al. Kidney Disease Caused by Dysregulation of the Complement Alternative Pathway: An Etiologic Approach[J]. J Am Soc Nephrol, 2015, 26(12): 2917-2929.
[4] Khaira A, Upadhyay BK, Sharma A, et al. Hepatitis B virus associated focal and segmental glomerular sclerosis: report of two cases and review of literature[J]. Clin Exp Nephrol, 2009, 13(4): 373-377.
[5] Li P, Wei R B, Tang L, et al. Clinical and pathological analysis of hepatitis B virus-related membranous nephropathy and idiopathic membranous nephropathy[J]. Clin Nephrol, 2012, 78(6): 456-464.
[6] Wei R B, Li P, Wu J, et al. Clinicopathological analysis on hepatitis B virus-associated glomerulonephritis in 205 patients[J]. Chinese journal of experimental and clinical virology, 2010, 24(6): 464-467.
[7] Gupta A, Quigg R J. Glomerular Diseases Associated With Hepatitis B and C[J]. Adv Chronic Kidney Dis, 2015, 22(5): 343-351.
[8] Wang L, Ye Z, Xu L, et al. Diagnostic value of urine HBV DNA for hepatitis B virus-associated glomerulonephritis[J]. Journal of Southern Medical University, 2014, 34(11): 1705-1705-Insidebackcover.
[9] Hui D, Yan X, Wei J, et al. Significance of mutations in hepatitis B virus X gene for the pathogenesis of HB-associated glomerulonephritis[J]. Acta Virol, 2014, 58(3): 278-281. DOI: 10. 4149/av_2014_03_278.
[10] Zhen J, Zhang L, Pan J, et al. AIM2 mediates inflammation-associated renal damage in hepatitis B virus-associated glomerulonephritis by regulating caspase-1, IL-1β, and IL-18[J]. Mediators Inflamm, 2014, 2014: 190860.
[11] Li D, Gao G, Jiang H, et al. Hepatitis B virus-associated glomerulonephritis in HBsAg serological-negative patients[J]. Eur J Gastroenterol Hepatol, 2015, 27(1): 65-69.
[12] Sethi S, Smith R J, Dillon J J, et al. C3 glomerulonephritis associated with complement factor B mutation[J]. Am J Kidney Dis, 2015, 65(3): 520-521.
[13] Danobeitia J S, Djamali A, Fernandez L A. The role of complement in the pathogenesis of renal ischemia-reperfusion injury and fibrosis[J]. Fibrogenesis & Tissue Repair, 2014, 7(1): 16.
[14] Zhu L, Zhai Y L, Wang F M, et al. Variants in Complement Factor H and Complement Factor H-Related Protein Genes, CFHR3 and CFHR1, Affect Complement Activation in IgA Nephropathy[J]. J Am Soc Nephrol, 2015, 26(5): 1195-1204.
[15] Noris M, Remuzzi G. Glomerular Diseases Dependent on Complement Activation, Including Atypical Hemolytic Uremic Syndrome, Membranoproliferative Glomerulonephritis, and C3 Glomerulopathy: Core Curriculum 2015[J]. Am J Kidney Dis, 2015, 66(2): 359-375.
Significance of decreased serum C3 level and C3 deposition in the kidney in patients with HBV related glomerulonephritis
WANG Rong, LIU Changhua, XU Daoliang, WU Gang, KONG Yaling, ZHOU Gang, MOU Hongbin, HE Dafeng, GAO bo
(SubeiPeople′sHospital,MedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
Objective To explore the clinical significance of complement activation in patients with HBV related glomerulonephritis (HBV-GN). Methods Biopsy-proven HBV-GN patients were retrospectively recruited. Decreased serum C3 level was defined as C3<85 mg/dL. According to the serum C3 levels, the patients were divided into decreased serum C3 group and normal serum C3 group, and the pathological and clinical differences between two groups were compared. According to the intensity of C3 deposition in the kidney, patients were divided into negative and positive groups, the pathological and clinical differences were compared. Results In this study, 29 HBV-GN patients were recruited. There were 18 patients (62.07%) in the normal serum C3 group and 11 patients (37.93%) in the decreased serum C3 group. Compared with the patients with normal serum C3 level, patients with decreased serum C3 level had higher serum creatinine level, lower eGFR level, severer mesangial proliferation and renal interstitial fibrosis (P<0.05). There were 9 patients (31.03%) with negative C3 deposition in the kidney, and 20 patients (68.97%) with positive C3 deposition. Higher cholesterol, higher IgG levels, lower serum albumin, serum C3 levels, lower eGFR level, severer glomerular sclerosis, inflammatory cell infiltration in renal interstitial, renal tubular (P<0.05).Conclusion There are different levels of complement activation in patients with
complement C3; complement activation; HBV related glomerulonephritis
2016-10-09
扬州大学临床医学院 江苏省苏北人民医院院级课题基金
高波, E-mail: gaoboyz@163.com
R 512.6
A
1672-2353(2016)23-043-04
10.7619/jcmp.201623013
HBV-GN. Local and systemic complement activation is associatatrophy, and renal interstitial fibrosis were associated with a higher grade of C3 deposition in the kidney ed with decreased renal function. Complement activation may be involved in the progression of HBV-GN.

