人参多糖联合化疗对中晚期消化道肿瘤患者疗效和免疫功能指标的影响
周奕阳, 李树芳
(上海市中医医院 肿瘤科, 上海, 200071)
人参多糖联合化疗对中晚期消化道肿瘤患者疗效和免疫功能指标的影响
周奕阳, 李树芳
(上海市中医医院 肿瘤科, 上海, 200071)
目的 观察人参多糖联合化疗治疗中晚期消化道肿瘤的临床疗效及安全性,研究其对患者免疫功能的影响。方法 60例中晚期消化道肿瘤患者随机分为治疗组和对照组,每组30例,均采用XELOX化疗方案,治疗组在化疗前2天给予人参多糖注射液。评估2组化疗前及化疗2周期后近期疗效,记录体力状况(KPS评分)及体质量变化情况,记录化疗后毒副反应发生情况,流式细胞仪检测各组血中T淋巴细胞抗原(CD3、CD4、CD8)、B淋巴细胞抗原(CD19、CD20)、自然杀伤细胞表面抗原(CD16、CD56)。结果 2组近期疗效及毒副反应发生情况无显著差异(P>0.05); 化疗后, 2组KPS评分、体质量均较化疗前明显降低(P<0.01); 治疗组KPS评分明显高于对照组(P<0.01); 2组血CD3、CD4、CD16、CD56百分比均较化疗前明显升高, CD8百分比较化疗前明显降低(P<0.05或P<0.01); 治疗组较对照组升高/降低的更加明显(P<0.01)。结论 人参多糖可以在一定程度上提高患者免疫功能,并改善患者一般状况,临床应用安全有效。
人参多糖; 免疫功能; 化疗; T淋巴细胞抗原; B淋巴细胞抗原; 自然杀伤细胞表面抗原
据统计,消化道肿瘤发病率在所有恶性肿瘤中居全球第3位,发病率和死亡率呈逐年上升趋势[1]。手术虽是根治性的治疗方法,但由于风险较大或发现疾病时已失去最佳手术机会,患者依从性较差。化疗不仅能为无手术机会的患者提供治疗,也是术后防止复发的有效手段。化疗过程中,常导致患者免疫功能降低,而免疫缺陷与肿瘤的发生发展密切相关[2]。因此,在中晚期消化道肿瘤的化疗过程中,对机体免疫功能的保护尤为重要。人参多糖是人参的活性成分,在调节机体免疫功能方面具有突出的药理作用[3], 本研究结合临床观察,选取人参多糖联合化疗治疗中晚期消化道肿瘤,探讨其在预防化疗所致免疫功能低下方面的功效和机制。
1 资料与方法
1.1 一般资料
选取2011年8月—2015年8月收治的中晚期消化道肿瘤患者60例。其中男38例,女22例;年龄42~77岁,平均(58.5±4.5)岁。60例患者随机分为治疗组和对照组,每组30例。治疗组男19例,女11例;平均年龄(59.6±5.0)岁;原发病灶:胃9例,大肠19例,食管2例;肿瘤分期: ⅢA 9例, ⅢB 11例, Ⅳ 10例; KPS评分(83.6±8.5)分。对照组男19例,女11例;平均年龄(57.3±4.3)分;原发病灶:胃7例,大肠19例,食管4例;肿瘤分期: ⅢA 10例, ⅢB 9例, Ⅳ 11例; KPS评分(84.2±7.5)分。纳入标准: ① 首次经临床、内窥镜检查、影像学和病理确诊的消化道肿瘤患者,且TNM分期为ⅢA、ⅢB、Ⅳ期; ② 体力状况评分(KPS评分)>60分; ③ 预计生存期>6个月; ④ 放、化疗已停止至少2个月; ⑤ 无自身免疫性疾病,且停止服用免疫抑制剂1年以上。排除标准: ① 合并心、肝、肾、造血系统疾病的患者; ② 患有精神病等有严重智力或认知功能障碍的患者; ③ 妊娠或哺乳期妇女。2组年龄、性别构成比、原发病灶、肿瘤分期、KPS评分等一般资料差异无统计学意义(P>0.05), 具有可比性。
1.2 方法
2组化疗前30 min静脉滴注盐酸托烷司琼5 mg, 预防呕吐。2组化疗方案均为XELOX方案:草酸铂(L-OHP), 130 mg/m2, 静脉滴注2 h, 第1天; 卡培他滨(CPB), 1 000 mg/m2, 2次/d, 第1~14天。以上化疗方案每周期为21 d, 持续化疗2个周期。治疗组在化疗前2 d给予人参多糖注射液, 4 mL, 肌注, 2次/d, 共持续10 d。
1.3 观察指标
各组化疗前及化疗2周期后: ① 进行MR、CT等相关检查,评估近期疗效。② 记录体力状况(KPS评分)及体质量变化情况; ③ 记录化疗后毒副反应发生情况; ④ 采集外周静脉血10 mL, 流式细胞仪检测各组血中T淋巴细胞抗原(CD3、CD4、CD8)、B淋巴细胞抗原(CD19、CD20)、自然杀伤细胞表面抗原(CD16、CD56)。
近期疗效评估标准:完全缓解(CR), 病灶晚期消失,并维持4周以上;部分缓解(PR), 病灶最大径×最垂直直径减少50%以上,并维持4周以上;稳定(SD), 病灶最大径×最垂直直径缩小25%以上,但<50%,无新病灶出现;无效(PD), 病灶无变化或未达到上述标准。有效率=[(CR+PR)/总例数]×100%。
1.4 统计学分析
2 结 果
2.1 2组化疗患者近期疗效比较
经近期临床疗效评估,治疗组CR 0例, PR 12例, SD 14例, PD 4例,有效率为40.0%(12/30)。对照组CR 0例, PR 13例, SD 9例, PD 8例,有效率为43.3%(13/30)。2组有效率无显著差异(P>0.05)。
2.2 2组化疗前后体力状况、体质量变化
2组化疗后KPS评分、体质量均较化疗前显著降低(P<0.01)。治疗组化疗后KPS评分显著高于对照组化疗后(P<0.01)。2组化疗后体质量无显著差异(P>0.05)。见表1。
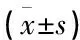
表1 2组化疗前后体力、体质量变化情况
与化疗前比较, **P<0.01; 与对照组比较, ##P<0.01。
2.3 2组化疗后毒副反应发生情况
治疗组发生胃肠道反应2例(6.67%), 神经毒性1例(3.33%), 血液毒性3例(10.0%), 肝肾毒性8例(26.67%); 对照组发生胃肠道反应3例(10.00%), 神经毒性2例(6.67%), 血液毒性4例(13.33%), 肝肾毒性11例(36.67%), 2组毒副反应发生率比较无显著差异(P>0.05)。
2.4 2组治疗前后免疫功能指标变化情况
化疗前,2组血中各免疫功能指标水平无显著差异(P>0.05); 化疗后, 2组血CD3、CD4百分比均较化疗前明显升高, CD8百分比较化疗前明显降低(P<0.05或P<0.01); 治疗组血中CD3、CD4百分比明显高于对照组, CD8百分比明显低于对照组(P<0.01); 各组化疗前后血中CD19、CD20百分比变化无显著差异(P>0.05); 2组治疗后血中CD16、CD56百分比均较治疗前明显升高(P<0.01), 治疗组较对照组升高的更加明显(P<0.01)。见表2。
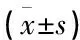
表2 2组治疗前后静脉血中免疫功能指标变化情况 %
与化疗前比较, *P<0.05, **P<0.01; 与对照组比较, ##P<0.01。
3 讨 论
现代医学认为,消化道肿瘤发生机制复杂,涉及遗传、致癌物质、免疫缺陷等诸多因素。相关研究[4]证实,免疫机制在肿瘤的发生发展中发挥重要作用,生物免疫治疗已成为肿瘤治疗的主要治疗措施。免疫机制缺陷的患者,胃癌、肠癌、淋巴瘤、肺癌等疾病的发生率大大增加[5]。Huhta等[6]研究发现,胃肠肿瘤患者的免疫功能较正常人群明显下降,微卫星遗传不稳定性(MSI)指标的阳性率高达60%~81%。中晚期消化道肿瘤发生时,癌细胞分泌相关细胞因子抑制了机体正常的免疫机制,无论是体液免疫、细胞免疫和非特异性免疫。① 体液免疫:近年来国外学者Abdelfatah[7]通过研究发现,大肠癌患者体内存在红细胞免疫功能明显下降的现象,提示大肠癌患者体内存在红细胞体系的改变,这种改变与大肠癌的发生发展有关。也有学者[8]通过检测胃肠癌患者血液中IgM发现,术后IgM指标较术前明显上升。② 细胞免疫:相关研究[9]表明,中晚期消化道肿瘤患者血中IFN、IL-2、TNF水平明显低于正常人群,这些免疫指标均说明中晚期消化道肿瘤患者体内存在免疫机制被破坏的情况。③ 非特异性免疫:与体液免疫、细胞免疫相比较,非特异性免疫同样在抗肿瘤中发挥重要作用。NK细胞激活后,通过释放相关细胞因子可发挥类似杀伤性T细胞作用,最终杀伤肿瘤细胞。研究[10]表明,大肠癌患者分期越晚,NK细胞活性越低,抗肿瘤能力越弱。
人参多糖是人参的重要活性成分,具有多种功能,主要涉及免疫调节、抗肿瘤等方面的药理作用。人参多糖能够增强机体特异性免疫和非特异性免疫功能,应用人参多糖的小鼠,免疫器官重量明显增加,提示免疫系统活性增加[11]。同时,人参多糖还可促进淋巴细胞数量的增长,促进多种免疫细胞因子的分泌和产生,加强吞噬细胞的吞噬作用。在抑制肿瘤发生发展方面,也得到了很多相关研究的证实。实验研究[12-14]表明,人参多糖能够明显抑制小鼠体内移植瘤的生长;人参多糖还具有增强某些化疗药物抗肿瘤的疗效。人参多糖不仅可以激活T淋巴细胞、B淋巴细胞、NK细胞等免疫细胞,还能促进相关细胞因子的生成,具有很好的生物免疫活性,对机体免疫功能具有很好的调节作用[15-18]。
相关研究[19-21]表明,可能由于肿瘤患者体内的肿瘤细胞具有分泌相关细胞因子的能力,导致肿瘤患者体内淋巴细胞亚群会发生相应变化。本研究发现, 2组化疗后血中CD3、CD4、CD16、CD56百分比均较化疗前明显升高, CD8百分比较化疗前明显降低,治疗组较对照组升高/降低的更加明显;治疗组化疗后KPS评分明显高于对照组化疗后。2组在临床疗效及毒副反应发生方面无明显差异,说明人参多糖能够增强中晚期消化道肿瘤患者的机体免疫功能,改善患者生活质量。
[1] Motoo Y. How Long Should Cancer Chemotherapy Be Continued-From the Viewpoint of Duration of Efficacy of Molecular Targeting Drugs[J]. Gan To Kagaku Ryoho, 2016, 43(7): 819-823.
[2] 宁忠华, 杨璟, 蒋敬庭. 细胞因子诱导的杀伤细胞治疗消化道肿瘤的基础与临床研究[J]. 中华消化杂志, 2014, 34(12): 864-866.
[3] Jiao R, Liu Y, Gao H, et al. The Anti-Oxidant and Antitumor Properties of Plant Polysaccharides[J]. Am J Chin Med, 2016, 44(3): 463-488.
[4] 雷晓斐, 董卫国, 范楷. 粒细胞集落刺激因子-1在结直肠癌中的表达及临床意义[J]. 中华消化杂志, 2010, 30(8): 568-569.
[5] Ma Z, Bao X, Gu J. Effects of laparoscopic radical gastrectomy and the influence on immune function and inflammatory factors[J]. Exp Ther Med, 2016, 12(2): 983-986.
[6] Huhta H, Helminen O, Kauppila J H, et al. The Expression of Toll-like Receptors in Normal Human and Murine Gastrointestinal Organs and the Effect of Microbiome and Cancer[J]. J Histochem Cytochem, 2016, 64(8): 470-482.
[7] Abdelfatah E, Kerner Z, Nanda N, et al. Epigenetic therapy in gastrointestinal cancer: the right combination[J]. Therap Adv Gastroenterol, 2016, 9(4): 560-579.
[8] Jordan K, Luetkens T, Gog C, et al. Intraperitoneal bevacizumab for control of malignant ascites due to advanced-stage gastrointestinal cancers: A multicentre double-blind, placebo-controlled phase Ⅱ study - AIO SUP-0108[J]. Eur J Cancer, 2016, 12(63): 127-134.
[9] 罗云秀, 罗仁峰, 何安兵, 等. CIK细胞免疫治疗晚期消化系统恶性肿瘤的临床疗效评价[J]. 现代肿瘤医学, 2016, 24(8): 1246-1248.
[10] Tada K, Kitano S, Shoji H, et al. Pretreatment Immune Status Correlates with Progression-Free Survival in Chemotherapy-Treated Metastatic Colorectal Cancer Patients[J]. Cancer Immunol Res, 2016, 4(7): 592-599.
[11] Yang T, Zhang S, Wang R, et al. Polysaccharides from Rhizoma Panacis Majoris and its anti-oxidant activity[J]. Int J Biol Macromol, 2016, 20(86): 756-763.
[12] Seo J Y, Lee C W, Choi D J, et al. Ginseng marc-derived low-molecular weight oligosaccharide inhibits the growth of skin melanoma cells via activation of RAW264. 7 cells[J]. Int Immunopharmacol, 2015, 29(2): 344-353.
[13] Hoang V A, Kim Y J, Nguyen N L, et al. Microbacterium rhizomatis sp. nov. , a β-glucosidase-producing bacterium isolated from rhizome of Korean mountain ginseng[J]. Int J Syst Evol Microbiol, 2015, 65(9): 3196-3202.
[14] van Unen V, Li N, Molendijk I, et al. Mass Cytometry of the Human Mucosal Immune System Identifies Tissue- and Disease-Associated Immune Subsets[J]. Immunity, 2016, 44(5): 1227-1239.
[15] Subramaniam R, Mizoguchi A, Mizoguchi E. Mechanistic roles of epithelial and immune cell signaling during the development of colitis-associated cancer[J]. Cancer Res Front, 2016, 2(1): 1-21.
[16] 张玉, 陈娟, 钱小伟, 等. 血清前白蛋白检测在消化道恶性肿瘤中的诊断价值[J]. 实用临床医药杂志, 2015, 19(13): 149-149.
[17] 张财富. ROC曲线评价血清同型半胱氨酸在消化道肿瘤诊断中的价值[J]. 中华全科医学, 2016, 14(10): 1726-1728.
[18] 张弢, 周玲善, 王新生. 消化道肿瘤术后早期肠内营养支持的临床疗效评估[J]. 华南国防医学杂志, 2013(9): 634-636.
[19] 胡婷, 王子安. TFF家族与胃肠道肿瘤关系的研究现状[J]. 中华全科医学, 2013, 11(10): 1612-1613.
[20] 钟铁刚, 程俊波. 复合VitB联合转移因子治疗消化道肿瘤化疗后口腔溃疡疗效观察[J]. 华南国防医学杂志, 2013(12): 926-927.
[21] 鲁竞, 熊桂林. 硬膜外辅助全麻与静吸全麻下100例消化道肿瘤患者的麻醉可行性对比[J]. 实用临床医药杂志, 2012, 16(19): 148-149.
Clinical efficacy of ginseng polysaccharides combined with chemotherapy in treatment of patients with moderate and advanced gastrointestinal cancer and its influence on immunological functional indexes
ZHOU Yiyang, LI Shufang
(DepartmentofOncology,ShanghaiMunicipalHospitalofTraditionalChineseMedicine,Shanghai, 200071)
Objective To observe the clinical efficacy and safety of ginseng polysaccharides combined with chemotherapy in patients with moderate and advanced gastrointestinal cancer, and to study its influence on patients′immunological function. Methods A total of 60 patients with moderate and advanced gastrointestinal cancer were randomly divided into treatment group and control group, with 30 cases per group. Both groups received XELOX chemotherapeutic protocol, and treatment group was added with ginseng polysaccharides injection 2 d before chemotherapy. Short-term clinical efficacy before and 2 weeks after chemotherapy was evaluated, Karnofsky performance status (KPS) score and change of body weight as well as post-chemotherapeutic adverse and toxic reactions were recorded, and flow cytometry was used to detect the T lymphocyte antigens (CD3, CD4and CD8), B lymphocyte antigens (CD19and CD20) and natural killer cell surface antigens (CD16and CD56). Results There was no significant difference between two groups in short-term clinical efficacy and adverse and toxic reactions (P>0.05). After chemotherapy, KPS score and body weight decreased evidently in both groups (P<0.01), and KPS score was markedly higher in treatment group than that in control group (P<0.01). The percentages of blood CD3, CD4, CD16and CD56increased notably whereas percentage of CD8decreased after chemotherapy than chemotherapy before (P<0.05 orP<0.01), which changed more significantly in treatment group than those in control group(P<0.01). Conclusion Ginseng polysaccharides can promote the immunological function
ginseng polysaccharides; immunological function; chemotherapy; T lymphocyte antigen; Blymphocyte antigen; surface antigen of natural killer cells
2016-10-11
中国高校医学期刊临床专项资金(11528634)
李树芳, E-mail: 0443@szy.sh.cn
R 735
A
1672-2353(2016)23-036-04
10.7619/jcmp.201623011
and improve the general conditions of patients with moderate andadvanced gastrointestinal cancer to some extent, and is safe and effective in clinical application.

