培美曲赛单药治疗老年晚期非小细胞肺癌的疗效和安全性分析
江联萍, 李安琪, 吴海霞, 成少华, 谭 越
(复旦大学附属肿瘤医院闵行分院 肿瘤内科, 上海, 200240)
培美曲赛单药治疗老年晚期非小细胞肺癌的疗效和安全性分析
江联萍, 李安琪, 吴海霞, 成少华, 谭 越
(复旦大学附属肿瘤医院闵行分院 肿瘤内科, 上海, 200240)
目的 观察培美曲赛单药治疗老年晚期非小细胞肺癌(NSCLC)的临床疗效和安全性。 方法 选取40例局部晚期或转移性NSCLC老年患者为研究对象,给予培美曲赛单药二线或三线化疗,评价客观疗效。观察患者生存时间、无疾病进展生存时间和不良反应发生情况。结果 37例患者可评价客观疗效,有效率为18.92%(7/37),疾病控制率83.78%(31/37)。至随访结束,患者中位生存期10.6个月,中位无疾病进展生存时间4.9个月。常见不良反应包括乏力、贫血和肝功能异常,Ⅲ度不良反应包括贫血2例和乏力4例。结论 培美曲赛单药治疗晚期NSCLC老年患者,疾病控制率较好,患者耐受性好。
培美曲赛; 晚期非小细胞肺癌; 老年患者; 客观疗效; 不良反应
肺癌是世界上发病率、死亡率最高的恶性肿瘤。根据病理类型肺癌分为小细胞肺癌和非小细胞肺癌(NSCLC), NSCLC约占80%, 且局部晚期病例约占确诊病例的40%[1-2]。据统计,约65% NSCLC患者为老年患者,因生理机能衰退并伴有多种基础疾病,临床化疗时常常会降低剂量,可能导致治疗强度不够。多西他赛是治疗晚期NSCLC的标准二线化疗药物,临床疗效佳,但不良反应较大。已有研究[3]证明,培美曲赛二线治疗晚期NSCLC不良反应低,且客观疗效与多西他赛无明显差异。本研究使用培美曲赛单药二线或三线治疗老年晚期NSCLC患者,观察其客观疗效和安全性,现报告如下。
1 资料与方法
1.1 一般资料
选取2013年1月—2014年6月复旦大学附属肿瘤医院闵行分院收治的局部晚期或转移性NSCLC老年患者40例为研究对象,均经细胞和组织学证明为NSCLC, 且至少有1处可测量病灶。排除标准: ① 存在未控制的中枢神经系统转移; ② 合并严重的心肺基础疾病; ③ 肝、肾、骨髓功能异常。入组前患者均接受过1~2次含铂类方案的化疗,且呈疾病进展。男18例,女22例;年龄65~83岁,平均(68.9±3.7)岁;体力状况(PS)评分0~2分;临床分期: ⅢA患者1例⑧, Ⅳ期患者39例。
1.2 方法
患者首次用药前2周口服叶酸并持续至化疗结束后3周,化疗前5 d肌肉注射维生素B12。每21天给予患者培美曲赛单药500 mg/m2, 加入至0.9%氯化钠溶液100 mL中静脉滴注,持续接受化疗直至不可耐受或任何原因导致的中断治疗。化疗期间患者定期血常规、肝肾功能检查,每2周期后均采用影像学方法进行评估客观疗效,并记录化疗期间不良反应性质和程度。治疗后每3个月随访一次直至随访结束或死亡。
1.3 观察指标
按照实体瘤疗效评价标准(RECIST)[4]评价客观疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。总有效率=(CR+PR)/例数×100%, 疾病控制率=(CR+PR+SD)/例数×100%。记录患者生存时间和无疾病进展生存时间,其中无疾病进展生存时间定义为从治疗第1 天至病灶出现进展的时间。依据NCI常见化疗药物毒性分级标准(CTC 3.0)评价药物不良反应。
2 结 果
2.1 客观疗效评价
40例患者中37例可评价疗效,其中完全缓解0例(0.00%), 部分缓解7例(18.92%), 疾病稳定24例(64.86%), 疾病进展6例(16.22%), 总有效率为18.92%(7/37), 疾病控制率为83.78%(31/37)。 至随访结束,患者总生存期0.7~25.0个月,中位生存期10.6个月,中位无疾病进展生存时间4.9个月。见图1。
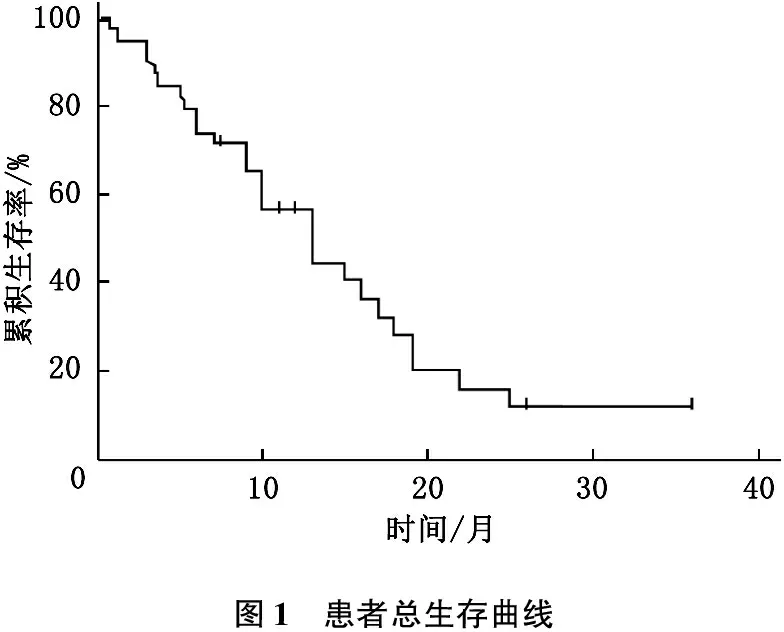
图1 患者总生存曲线
2.2 不良反应
患者均完成所有周期的培美曲赛二线化疗方案。主要不良反应为贫血、乏力和肝功能异常等。其中Ⅲ度不良反应包括贫2例和乏力4例,见表1。上述患者给予人重组粒细胞集落刺激因子、保肝等对症处理后均恢复正常。
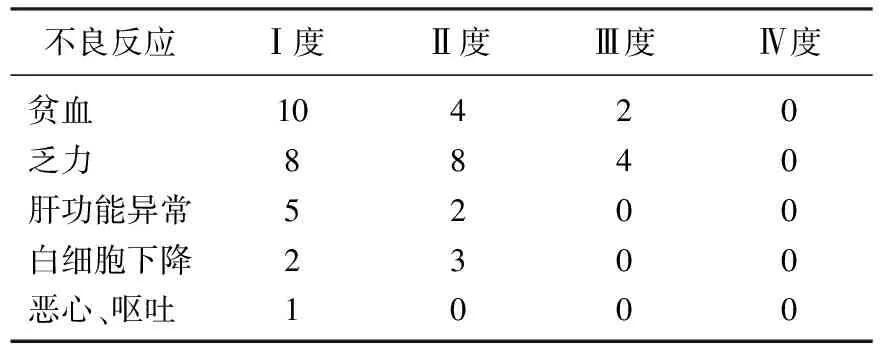
表1 不良反应发生情况
3 讨 论
老年肺癌患者人群因器官储备功能和药物代谢功能都较差,通常伴有其他疾病,加大了化疗的风险[5]。如何使老年患者在治疗中延长生存时间、获得较好的生活质量是临床工作者关注的重点。研究[6-7]报道,在晚期 NSCLC中, ≥65岁患者约占 50% 以上, ≥70 岁占30%~40%。约2/3肺癌老年患者死于化疗合并症和脏器衰竭,对化疗药物的耐受性极差[8]。老年患者在二、三线化疗中通常已无法耐受二药联合化疗,因此希望选择效果好、不良反应作相对较轻的单药治疗方案进化疗。
培美曲赛是一种多靶点叶酸拮抗剂,具广谱抗肿瘤活性,可通过抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰胺核苷酸甲酰转移酶活性而破坏细胞内叶酸依赖性生长过程,抑制细胞复制,从而抑制肿瘤生长。Hanna等[9]等发表了著名的JMEI研究,奠定了培美曲赛在治疗进展期NSCLC的地位。该项Ⅲ期随机临床试验将571例接受过含铂类方案治疗的晚期非小细胞肺癌患者随机分为培美曲塞(500 mg/m2, 第1天, 每3周1次)和多西他赛(75 mg/m2, 第1天, 每3周1次),结果显示2组中位生存期近似,但多西他赛组血液系统不良反应和脱发更严重。Weiss等[10]进一步针对JMEI研究的老年亚组进行回顾性分析,发现培美曲塞组的中位生存期为9.5个月,疾病进展时间为4.6个月,多西他赛组中位生存期7.2个月,疾病进展时间为2.9个月,培美曲赛组的生存获益相对更长,但差异无统计学意义。培美曲塞组老年患者中性粒细胞缺乏性发热发生率为2.5%, 而多西他赛组则达19%(P=0.025), 且多西他赛组还报告了1例不良反应相关性死亡。Pujol等[11]也指出JMEI研究中的无3或4级不良反应患者的生存时间,培美曲赛组是多西他赛组的3倍,差异有统计学意义,显示出培美曲赛安全性上的优势。Scagliotti等[12]针对JMEI研究中的非鳞癌亚组进行分析,培美曲塞组的中位生存期9.3个月,较多西他赛组延长1.3个月,死亡风险降低了22%, 差异有统计学意义,提示培美曲赛在非鳞癌组织学类型上的优势。本研究中,培美曲赛的治疗有效率为18.92%, 疾病控制率为83.78%, 与多西他赛相似[13]。但培美曲赛的不良反应,尤其在血液毒性方面更轻,患者耐受性更好。Kulkarni等[14]集成分析了3个Ⅲ期临床试验中的271例老年患者(≥65岁),显示培美曲赛对老年患者的疗效与年轻患者近似,且不良反应小。本研究中,培美曲赛单药二线治疗老年患者的疗效、不良反应与国内外研究[15-16]结果基本一致。培美曲赛中位生存期10.6个月, MPFS为4.9月,与Brahmer等[17]和Fiala等[18]研究结果相似。不良反应以乏力和贫血为主,但多为Ⅰ和Ⅱ度,进一步提示培美曲赛不良反应较轻。
[1] 路逵, 柯军, 李阳, 等. 国产与进口培美曲塞治疗晚期非小细胞肺癌疗效比较[J]. 中国实用医刊, 2013, 40(8): 72-73.
[2] Rezaei M K, Nolan N J, Schwartz A M. Surgical pathology of lung cancer[J]. Semin Respir Crit Care Med, 2013, 34(6): 770-786.
[3] 马耀先, 王绍义. 比较不同含铂治疗方案在晚期非小细胞肺癌患者中的应用效果[J]. 中国实用医刊, 2015, 42(10): 41-43.
[4] Nishino M, Jackman D M, Hatabu H, et al. New Response Evaluation Criteria in Solid Tumors (RECIST) Guidelines for Advanced Non-Small Cell Lung Cancer: Comparison With Original RECIST and Impact on Assessment of Tumor Response to Targeted Therapy[J]. AJR Am J Roentgenol, 2010, 195(3): W221-228.
[5] 吕 洋, 苗立云. 非小细胞肺癌分子靶向药物耐药机制的研究进展[J]. 中华肺部疾病杂志: 电子版, 2015, 8(1): 74-76.
[6] Sun Y, Wu Y L, Zhou C C, et al. Second-line pemetrexed versus docetaxel in Chinese patients with locally advanced or metastatic non-small cell lung cancer: a randomized, open-label study[J]. Lung Cancer, 2013, 79(2): 143-150.
[7] 郑积华, 林金容, 谢波, 等. 培美曲塞与多西他赛二线随机分组治疗晚期非小细胞肺癌对比分析[J]. 中华肿瘤防治杂志, 2013, 20(5): 368-370.
[8] Kauffmann M, Kruger T, Aebert H. Surgery on extracorporeal circulation in early and advanced non-small cell lung cancer [J]. Thorac Cardiovasc Surg, 2013, 61(2): 103-108.
[9] Hanna N, Bunn P A, Langer C, et al. Randomized phase Ⅲ trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J]. J Clin Oncol, 2006, 24(13): 2038-2043.
[10] Weiss G J, Langer C, Rosell R, et al. Elderly patients benefit from second-line cytotoxic chemotherapy: a subset analysis of a randomized phase III trial of pemetrexed compared with docetaxel in patients with previously treated advanced non-small-cell lung?cancer[J]. J Clin Oncol, 2006, 24(27): 4405-4411.
[11] Pujol J L, Paul S, Chouaki N, et al. Survival without common toxicity criteria grade 3/4 toxicity for pemetrexed compared with docetaxel in previously treated patients with advanced non-small cell lung cancer (NSCLC): a risk-benefit analysis[J]. J Thorac Oncol, 2007, 2(5): 397-401.
[12] Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase Ⅲ studies[J]. Oncologist, 2009, 14(3): 253-263.
[13] 牛晓青. 培美曲塞和多西他赛单药二线治疗晚期非小细胞肺癌的疗效及安全性分析[J]. 河北医药, 2014, 36(4): 513-515.
[14] Kulkarni P M, Chen R, Anand T, et al. Efficacy and safety of pemetrexed in elderly cancer patients results of an integrated analysis[J]. Crit Rev Oncol Hematol, 2008, 67(1): 64-70.
[15] 石远凯, 郏博. 晚期非小细胞肺癌治疗的新趋势[J]. 中国新药杂志, 2012, 21(17): 1985-1991.
[16] Gerber D E, Dahlberg S E, Sandler A B, et al. Baseline tumour measurements predict survival in advanced non-small cell lung cancer[J]. Br J Cancer, 2013, 109(6): 1476-1481.
[17] Brahmer J, Reckamp K L, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2015, 373(2): 123-135.
[18] Fiala O, Pesek M, Finek J, et al. Pemetrexed Versus Erlotinib in the Second-line treatment of patients with advanced-stage non-squamous NSCLC harboring wild-type EGFR gene[J]. Anticancer Res, 2016, 36(1): 447-453.
The clinical efficacy and safety of pemetrexed as monotherapy for elderly patients with advanced non-small cell lung cancer
JIANG Lianping, LI Anqi, WU Haixia, CHENG Shaohua, TAN Yue
(DepartmentofOncology,MinhangDivisionofShanghaiCancerHospitalAffiliatedtoFudanUniversity,Shanghai, 200240)
Objective To observe the clinical efficacy and safety of pemetrexed as monotherapy fo elderly patients with advanced non-small cell lung cancer (NSCLC). Methods A total of 40 patients with advanced local or metastatic NSCLC were included in this study and received pemetrexed monotherapy as second or third line treatment. The response rate of treatment was evaluated, and the survival time, progression-free survival time and adverse reactions were observed. Results Of 40 cases, 37 cases were available for efficacy evaluation. The overall response rate was 18.92%(7/37) and disease control rate was 83.78%(31/37). The median suvival of all patients was 10.6 months and median progression-free survival time was 4.9 months. The main adverse effects included fatigue, anemia and liver dysfunction. There were 6 cases with 3 grade adverse effects, inclduing 4 cases with fatigue and 2 cases with anemia. Conclusion Findings suggest pemetrexed as monotherapy is potentially well-tolerated and beneficial for elderly patients with advanced NSCLC.
pemetrexed; advanced non-small cell lung cancer; elderly patients; objective response; adverse effects
2016-09-18
中国高校医学期刊临床专项资金(11525990)
R 734.2
A
1672-2353(2016)23-023-03
10.7619/jcmp.201623007

