响应面法优化南极磷虾酶法制备DPP-ⅠⅤ抑制肽工艺条件的研究
吉 薇,章超桦,,吉宏武,
(1.广东海洋大学食品科技学院 // 2.广东省水产品加工与安全重点实验室 // 3.水产品深加工广东普通高校重点实验室,广东 湛江524088)
响应面法优化南极磷虾酶法制备DPP-ⅠⅤ抑制肽工艺条件的研究
吉 薇1,章超桦1,2,3,吉宏武1,2,3
(1.广东海洋大学食品科技学院 // 2.广东省水产品加工与安全重点实验室 // 3.水产品深加工广东普通高校重点实验室,广东 湛江524088)
采用动物蛋白水解酶酶解制备南极磷虾二肽基肽酶-ⅠⅤ (DPP-ⅠⅤ)抑制肽,以DPP-ⅠⅤ抑制率和可溶性蛋白含量为主要指标,考察温度、反应时间、pH、酶添加量对南极磷虾的酶解效果。在单因素的基础上,依据中心组合实验设计原理,运用4因素3水平的响应面分析法,建立动物蛋白水解酶酶解南极磷虾制备DPP-ⅠⅤ抑制肽的二次多项式数学模型,并以DPP-ⅠⅤ抑制率为响应值作响应面。结果表明:南极磷虾酶法制备DPP-ⅠⅤ抑制肽的最佳工艺参数为酶解时间3.85 h、温度45.02℃、pH值7.58、酶添加量237.55 U/g原料;在此条件下,酶解液DPP-ⅠⅤ抑制率的预测值为64.82%,验证值为64.78%,优化方法可行。
南极磷虾;DPP-ⅠⅤ抑制肽;响应面;工艺参数优化
随着人们生活水平提高,糖尿病的发病率逐年上升,已成为继癌症、心脑血管疾病之后的第3位严重危害人类健康的慢性疾病[1]。据国际糖尿病联盟(ⅠDF)统计,2014年我国作为世界上糖尿病患者人数最多的国家,患者人数接近1亿。糖尿病可导致一系列的并发症(包括神经病变、肾病、视网膜病变以及心血管疾病等)[2]。糖尿病分为Ⅰ型糖尿病(Type1 diabetes mellitus,T1DM)和Ⅱ型糖尿病(Type2 diabetes mellitus,T2DM)两种类型。Ⅰ型糖尿病即胰岛素依赖性糖尿病,是源于多种因素引起的自身免疫机制紊乱所导致的胰岛β细胞破坏、胰岛素分泌缺乏,是儿童及青少年最常见的一种内分泌疾病。Ⅱ型糖尿病即非胰岛素依赖性糖尿病,是由胰岛β细胞功能低下,胰岛素相对缺乏而导致。在糖尿病患者中,Ⅱ型患者糖尿病患者至少占患者总数的95%[3]。目前,Ⅱ型糖尿病及其并发症的预防与治疗已引起全球范围内的广泛关注。胰高血糖素样肽-1(glucagons-like peptide-1,GLP-1)是一种肠促胰岛素,它通过刺激和保护胰岛β细胞,促进胰岛素的合成和分泌,降低餐后血糖。二肽基肽酶-ⅠⅤ(DPP-ⅠⅤ)抑制剂能裂解包括胰高血糖素样肽-1(GLP-1)和抑胃肽(GⅠP)在内的多种肽类激素,降低Ⅱ型糖尿病患者的高血糖症状。因此,可以通过研发DPP-ⅠⅤ抑制剂来抵抗DPP-ⅠⅤ对肠促胰岛素的降解,间接调节胰岛素的分泌,从而达到调节血糖的目的[4]。目前,虽然人工合成的DPP-ⅠⅤ抑制剂(包括维达列汀和沙格列汀等)已应用于Ⅱ型糖尿病的治疗,并具有良好的疗效,但仍易引发诸如肝功能异常和过度低血压等一系列的副作用[5]。因此,积极开发来源于食物中的安全、天然、高效的DPP-ⅠⅤ抑制剂己成为急需解决的问题。来源于各种食物原料的DPP-ⅠⅤ抑制肽已有许多报道。1980年,Kayoko M.Fukasawa首次从猪的肝脏和肾脏中提取出了DPP-ⅠⅤ抑制肽[6]。随后关于DPP-ⅠⅤ抑制肽的研究逐渐增多。至今,人们已发现来源于海藻[7]、谷物[8]、南瓜[9]等植物原料的酶解产物和来源于牛奶[10]、乳清蛋白[11-12]、火腿[13]、金枪鱼[14]等动物原料的酶解产物中都广泛存在有DPP-ⅠⅤ抑制肽。但是,利用虾、蟹等甲壳类动物蛋白制备DPP-ⅠⅤ抑制肽鲜有文献报道。
南极磷虾(Euphausua superb)是一种小型的甲壳类动物,生物量大。据统计,南极磷虾生物总量为10~30亿t,年可捕捞量为0.6~1亿t[15]。南极磷虾蛋白质含量丰富,为完全蛋白质,富含人体所需的9种必需氨基酸(包括婴儿所需的组氨酸),其必需氨基酸含量符合1985年FAO/WHO/UNU报告中所推荐的氨基酸摄入量。南极磷虾蛋白质为高品质蛋白质源[16]。目前,国内外对南极磷虾利用的研究主要围绕着蛋白质、磷虾油及甲壳素等3大组分开展[17-19]。关于南极磷虾生物活性肽的研究报道还较少,南极磷虾蛋白酶解产物DPP-ⅠⅤ抑制活性的相关研究国内外尚无报道。本研究旨在运用动物蛋白水解酶,优化制备南极磷虾DPP-ⅠⅤ抑制肽的最佳工艺参数,为南极磷虾蛋白的深度开发与高值化利用提供技术依据。
1 材料与方法
1.1 材料与仪器
1.1.1 原料 南极磷虾(Euphausua superb),由中国水产总公司提供。南极磷虾水分含量为76.82%,蛋白含量为 16.80%,脂肪含量为 2.05%,总糖含量0.81%,灰分含量为3.52%。
1.1.2 实验试剂 DPP-ⅠⅤ抑制剂筛选试剂盒购自Sigma公司;Folin-酚试剂购自北京鼎国生物科技有限公司;动物蛋白水解酶购自广西南宁庞博生物工程有限公司。
1.1.3 主要仪器 Ⅴarioskan Flash 酶标仪,美国赛默飞世尔科技公司;Cary60分光光度计,美国安捷伦公司;T18高速分散机ULTRA- TURRAX,德国ⅠKA公司;雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;JB50-D型增力电动搅拌机,上海精科仪器有限公司;HHS型电热恒温水浴锅,上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 南极磷虾蛋白酶解方法 取出冷冻的南极磷虾,室温放置解冻,虾和水按一定的质量比混匀,经T18高速分散机分散均匀,预热至酶解温度,调到一定的pH值,加入酶启动酶解反应,反应过程中维持溶液的pH值恒定。反应结束后,95℃水浴15min灭酶,冷却至室温,100目双层纱布过滤,取滤液,测定DPP-ⅠⅤ抑制率和可溶性蛋白含量。
1.2.2 DPP-ⅠⅤ抑制率测定 采用试剂盒法(荧光法)对DPP-ⅠⅤ抑制率进行测定[20]。依次将30μL缓冲液、10μL DPP-ⅠⅤ、10μL溶剂、10μL抑制剂加入酶标板混匀,加入50μL底物启动反应。37℃孵育15min,荧光检测(激发波长360 nm,发射波长460 nm)。记录结果,按如下计算公式得出DPP-ⅠⅤ抑制肽的抑制率。抑制率 =(F样品- F对照)/ F对照× 100%。
1.2.3 可溶性蛋白测定 可溶性蛋白采取试剂盒法(Folin-酚试剂)进行测定[21]。先在试管中加入1mL待测样品(稀释后),再加入5mL Folin-酚试剂甲,室温下静置10min,加入0.5mL Folin-酚试剂乙,摇匀,室温下静置30min,在分光光度计上(500 nm)测定吸光值。空白以1mL蒸馏水代替,其余操作相同。将测定的吸光值代入标准曲线方程,计算其蛋白浓度。
1.2.4 单因素实验
1)酶解温度的确定。选用动物蛋白水解酶,酶解温度分别为 35、45、55、65、75℃,在加酶量225 U/g原料,pH 7.5,m虾∶m水=1∶1条件下,酶解 4 h后,研究不同的酶解温度对酶解产物的DPP-ⅠⅤ抑制活性和可溶性蛋白的影响。
2)酶解时间的确定。选用动物蛋白水解酶,酶解时间分别为 1、2、3、4、5、6 h,在加酶量225 U/g原料,温度为50℃,pH 7.5,m虾∶m水=1∶1的条件下研究酶解时间的变化对酶解产物的 DPP-ⅠⅤ抑制活性和可溶性蛋白的影响。
3) pH的确定。选用动物蛋白水解酶,酶解pH分别为6、6.5、7、7.5、8、8.5,在加酶量为225 U/g,温度为50℃,m虾∶m水=1∶1的条件下,酶解4 h后,研究不同的pH对酶解产物的DPP-ⅠⅤ抑制活性和可溶性蛋白的影响。
4)酶解添加量的确定。选用动物蛋白水解酶,加酶量分别为150、225、300、375、450、525、600 U/g,温度为50℃,pH 7.5,m虾∶m水=1∶1的条件下,酶解4 h后,研究不同的酶添加量对酶解产物的DPP-ⅠⅤ抑制活性和可溶性蛋白的影响。
1.2.5 酶解工艺优化 根据 Box-Behnken的中心组合实验设计原理,基于单因素试验结果,以酶解时间(A)、酶添加量(B)、温度(C)、pH(D)为影响因素,酶解液DPP-ⅠⅤ抑制率(Y)为响应值,采用4因素3水平的响应面分析法进行实验设计,因素和编码水平见表 1。结果运用 Design-Expert 8.0.5.0软件进行数据处理和响应曲面分析。
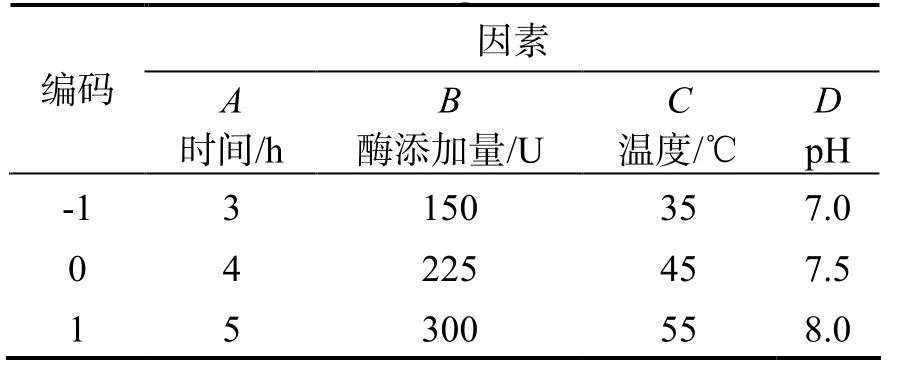
表 1 Box-Benhnken实验因素水平与编码Table 1 Level and code of variables for Box-Benhnken design
1.3 统计分析
所得数据采用SPSS 9.0软件进行数据统计分析,以α=0.05和α=0.01作为差异显著水平。结果用± SD表示。若有显著性差异(P<0.05),则采用Duncan进行多重比较检验。
2 结果与讨论
2.1 南极磷虾酶解单因素条件研究
2.1.1 温度对DPP-ⅠⅤ抑制率和可溶性蛋白的影响
由图1可以看出,在35℃到45℃,可溶性蛋白含量和DPP-ⅠⅤ抑制率呈递增趋势,当酶解温度达到45℃时,DPP-ⅠⅤ抑制率达到最大值。从45℃到 75℃,随着温度的增加,可溶性蛋白含量和DPP-ⅠⅤ抑制率都呈下降趋势。李明杰[22]通过正交试验确定了木瓜蛋白酶水解南极磷虾的最佳酶解工艺,其中,温度对酶解效果也呈先上升后下降的趋势。这是因为温度较低时,酶活性较小,水解速度较慢,可溶性蛋白和DPP-ⅠⅤ抑制率都较低;当温度升后,酶活性变大,此时蛋白质结构展开,酶与底物充分反应,水解速度加快,可溶性蛋白和DPP-ⅠⅤ抑制率都有所增大;当温度进一步升高,酶逐渐失去活性,水解速度变慢,酶解液中释放的多肽量减少,可溶性蛋白和DPP-ⅠⅤ抑制率逐渐减小。本研究考虑到 45℃后,可溶性蛋白无显著性差异(P>0.05),DPP-ⅠⅤ抑制活性逐渐降低,且差异性显著(P<0.05),因此选择45℃进行后续实验。
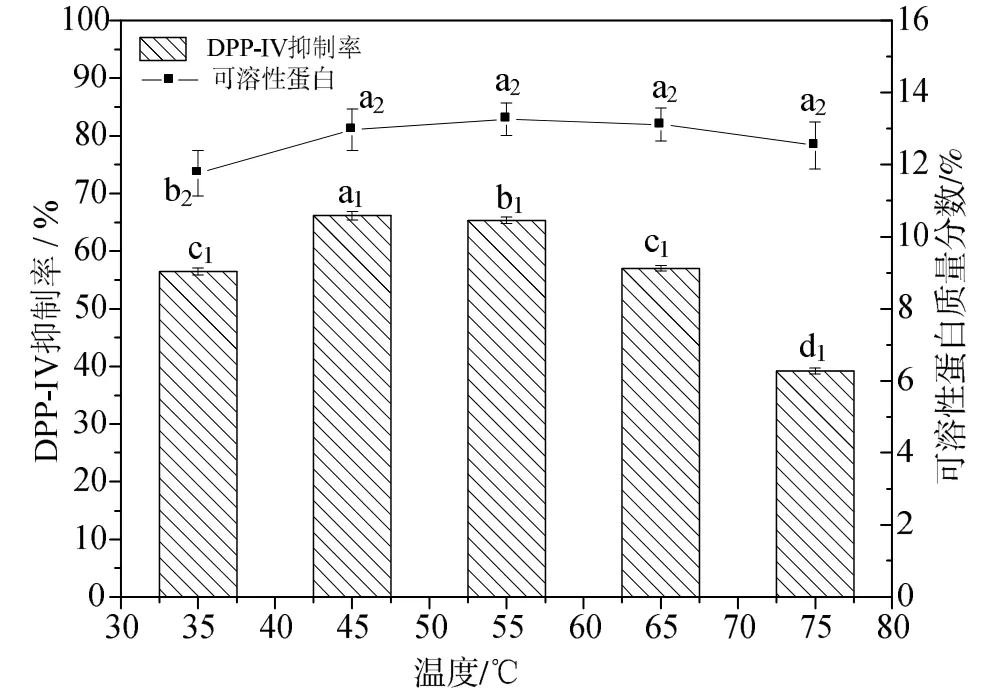
图1 温度对DPP-ⅠⅤ抑制活性和可溶性蛋白的影响Fig.1 The effect of temperature on DPP-ⅠⅤ inhibitory activity and soluble protein of the enzymatic hydrolysate
2.1.2 时间对DPP-ⅠⅤ抑制率和可溶性蛋白的影响
从图2可看出,酶解1~4 h,随着酶解时间的延长,可溶性蛋白含量和DPP-ⅠⅤ抑制率都呈递增趋势,且到 4 h时 DPP-ⅠⅤ抑制活性达到最大值66.16%,酶解4~6 h时,随着酶解时间的延长,DPP-ⅠⅤ抑制活性逐渐降低,可溶性蛋白含量缓慢增加,无显著性差异(P>0.05)。LACROⅠXⅠM[12]使用胃蛋白酶从乳清分离蛋白中酶法制备DPP-ⅠⅤ抑制肽时,随着酶解时间的延长,DPP-ⅠⅤ抑制活性的先增加,后缓慢降低。这是因为启动反应后,随着时间延长,蛋白质水解生成肽的含量增多,DPP-ⅠⅤ抑制肽的抑制率和可溶性蛋白含量也随之增大。当达到最大值后,随着时间延长,蛋白质水解成的肽进一步水解成氨基酸,抑制肽的数量也随之减少,可溶性蛋白含量无显著性增加。
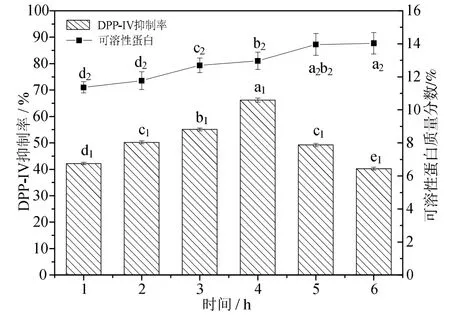
图2 时间对酶解产物DPP-ⅠⅤ抑制活性和可溶性蛋白的影响Fig.2 The effect of different enzyme time on the DPP-ⅠⅤinhibitory activity and soluble protein of the enzymatic hydrolysate
2.1.3 pH对DPP-ⅠⅤ抑制率和可溶性蛋白的影响
由图3可以看出,pH值在6~7.5时,随着pH升高,DPP-ⅠⅤ抑制率和可溶性蛋白含量都增加,pH值为7.5时,两项指标都达到最大值,pH在7.5~8.5时,随着pH的增大,DPP-ⅠⅤ抑制率和可溶性蛋白含量逐渐变小。张居明[23]用响应面法优化牛乳中酪蛋白磷酸肽的制备工艺,不同pH条件下的水解度的变化趋势也呈先出先增加,到达最大值后逐渐下降,与本研究相一致。这是因为,每种酶都有最适pH值,若pH值偏小或偏大都会破坏酶的结构,导致酶的反应速率受到抑制,从而影响DPP-ⅠⅤ抑制率和可溶性蛋白的含量。
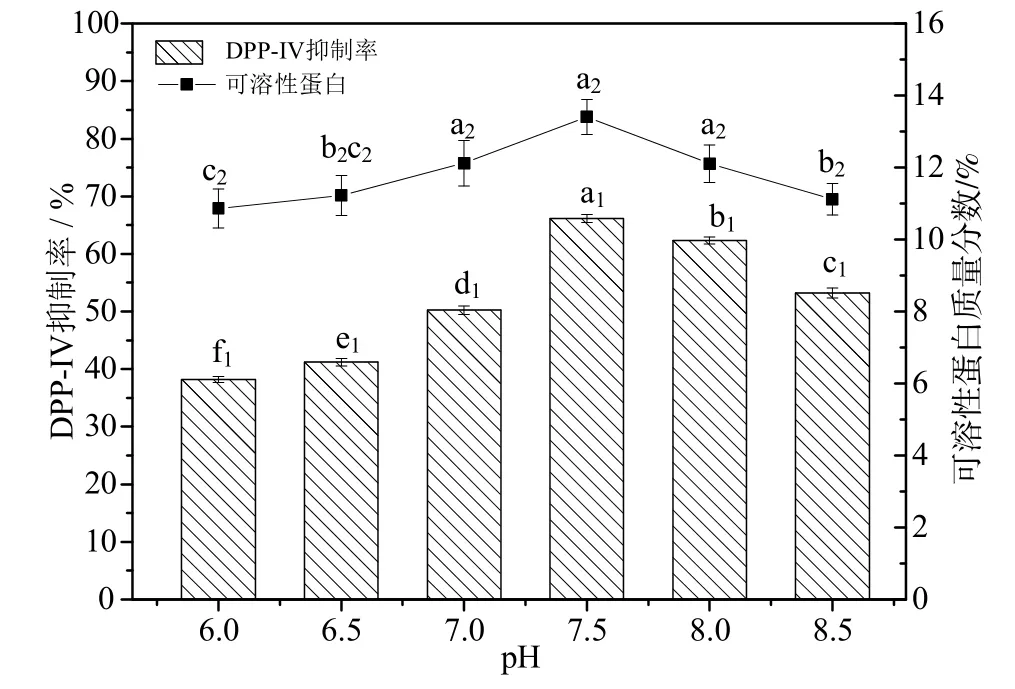
图3 pH对酶解产物DPP-ⅠⅤ抑制活性和可溶性蛋白的影响Fig.3 The effect of different pH on the DPP-ⅠⅤ inhibitory activity and soluble protein of enzymatic hydrolysate
2.1.4 酶添加量对 DPP-ⅠⅤ抑制率和可溶性蛋白的影响 从图4可知,当酶添加量在150~225 U/g范围,随着酶添加量的增加,DPP-ⅠⅤ抑制率和可溶性蛋白含量逐渐增大,且在225 U/g达到最大值。当酶添加量在225~600 U/g范围内,随着酶添加量的增加,DPP-ⅠⅤ抑制率逐渐降低,可溶性蛋白含量增加缓慢,没有极显著性的差异变化。这与Nongonierma AB[24]酶解制备DPP-ⅠⅤ抑制肽时的结论相类似。在酶添加量较少时,酶添加量对DPP-ⅠⅤ抑制效果呈正相关关系,当酶添加量继续增加时,DPP-ⅠⅤ抑制率逐渐减小。这是因为在酶添加量较小时,随着酶量的增多,蛋白质分解逐渐完全,DPP-ⅠⅤ抑制率和可溶性蛋白含量也逐渐增大。当酶添加量达到225 U/g,此时酶分子相对于底物来说已趋向饱和,DPP-ⅠⅤ抑制率和可溶性蛋白含量达到最大值,继续增大加酶量,由于在酶的作用下,蛋白分子水解完全导致具有DPP-ⅠⅤ抑制活性的多肽分子减少,DPP-ⅠⅤ抑制率逐渐降低。
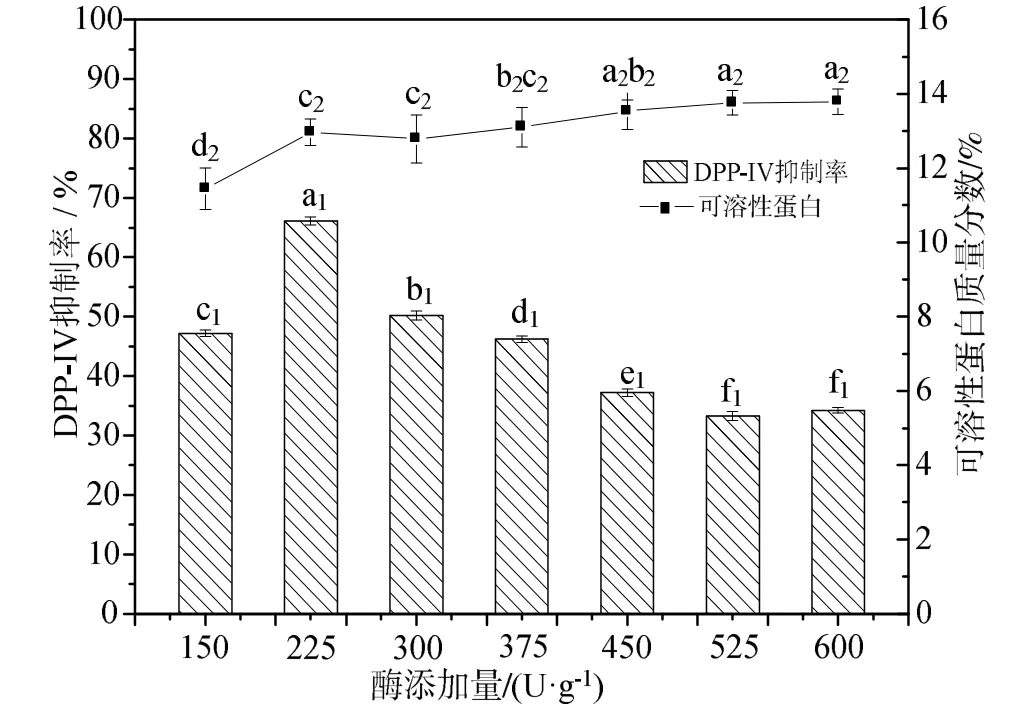
图4 酶添加量对酶解产物DPP-ⅠⅤ抑制活性和可溶性蛋白的影响Fig.4 The effect of different enzyme amount on the DPP-ⅠⅤinhibitory activity and soluble protein of enzymatic hydrolysate
2.2 响应面法优化酶解条件
2.2.1 中心组合试验结果 按照表1设计进行试验的结果见表2,根据表2的结果,以DPP-ⅠⅤ抑制率为响应值,通过Expert 8.0.5.0软件对响应值与各因素的编码值进行回归拟合后,得到如下回归方程:Y=64.65 - 0.62A + 0.47B - 0.33C + 0.87D + 0.022AB - 1.16AC + 1.19AD - 0.028BD - 0.97CD -2.35。对回归方程方差分析的结果见表 3。从表 3中看出,对响应值所建立的回归方程模型具有高度的显著性(P<0.000 1),失拟项不显著(P=0.060 8>0.05),模型R2=0.966 3,说明该模型与实际实验拟合较好,自变量与响应值之间线性关系显著,试验误差小,因此可用该模型来分析和预测南极磷虾酶解制备DPP-ⅠⅤ抑制肽工艺效果。回归方程中各因素的系数值可以直接反映各试验因子对指标值的影响程度。由各因素均方值可知,各因素对 DPP-ⅠⅤ抑制率的影响顺序为:pH>时间>酶添加量>温度。从表3可以看出,方程的一次项A和D以及二次项A2、B2、C2和D2均是极显著的;交互项中的AC和AD也对DPP-ⅠⅤ抑制率有显著的影响,这说明响应值的变化十分复杂,各个具体的试验因素对响应值的影响不是简单的线性关系,而是呈二次关系。分别将模型中的 A(时间)、 B(酶添加量)、C(温度)和pH其中一个因素固定在0水平,得到另外2个因素交互作用对DPP-ⅠⅤ抑制率的子模型,根据模型得到三维曲面图,对抑制率有显著影响的交互项 AC和AD的三维曲面图由图5—6表示。根据中心组合实验所得的结果和二次多项回归方程,用软件Design-Expert 8.0.5.0得出获得最大DPP-ⅠⅤ抑制率时各个因素的最佳酶解条件为:时间3.85 h、温度45.02℃、pH值7.58、酶添加量237.55 U,此条件下DPP-ⅠⅤ抑制率的理论值为 64.82%。

表 2 Box-Benhnken实验设计与结果Table 2 Box-Benhnken design matrix and experimental results
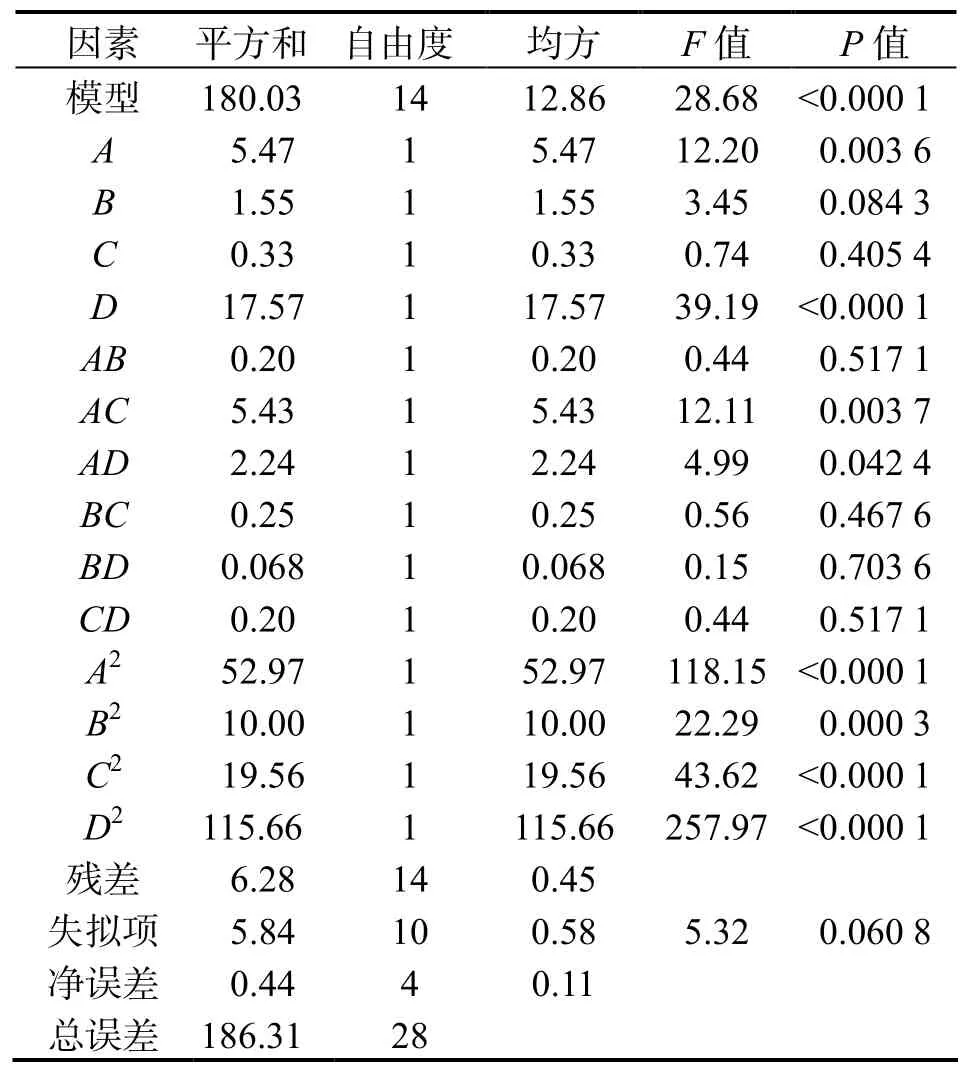
表 3 方差分析Table 3 the table of variance analysis

图5 时间和温度对DPP-ⅠⅤ抑制率影响的响应曲面Fig.5 Response surface plot of products of different time and temperature on DPP-ⅠⅤ inhibitory activity
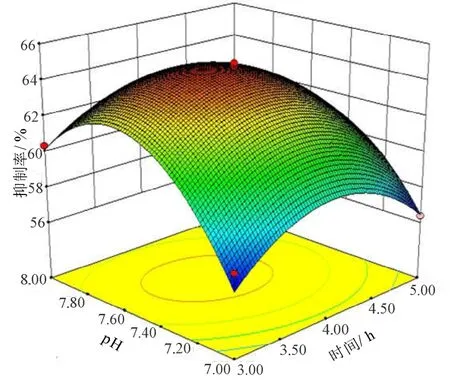
图6 时间与pH对DPP-ⅠⅤ抑制率影响的响应曲面Fig.6 Response surface plot of different time and pH on DPP-ⅠⅤ inhibitory activity
2.2.2 响应面等高线和响应曲面图分析 等高线的形状反映交互作用的强弱大小,圆形表示两因素交互作用不显著,而椭圆形则与之相反[25]。从图5可知当温度固定在零水平时,时间对DPP-ⅠⅤ抑制率的影响呈先缓慢增加后逐渐减少的趋势。当固定时间因素,温度对DPP-ⅠⅤ抑制率的变化趋势也一致。当达到响应面曲面的最高点时即为DPP-ⅠⅤ抑制率的最佳值。投射对应下等高线图即为椭圆的中心点。此时对应的时间和温度即为酶解的最佳时间和温度条件。从图6可知,时间和pH因素的响应面等高线图和图5类似,都有曲面的最高点,投射的等高线都呈椭圆形,即都有DPP-ⅠⅤ抑制率的最佳值,说明时间和pH对DPP-ⅠⅤ抑制率交互作用显著。
2.2.3 响应面模型的验证 根据Box-Behnken实验所得数据,利用Design-Expert8.0.5.0软件处理,可得最佳酶解条件为:酶解时间3.85 h、温度45.02℃、pH值7.58、酶添加量237.55 U/g(原料),在此条件下预测的DPP-ⅠⅤ抑制率为64.82%。为了检验响应面法的可行性,用所得的最佳条件进行验证性实验,通过3组平行实验得到的DPP-ⅠⅤ抑制率为(64.78± 0.24)%,与理论预测值的误差在±1%以内,说明采用响应面优化得到的酶解工艺参数准确可靠,具有实用价值。
3 结 论
应用响应面法优化动物蛋白水解酶水解南极磷虾制备DPP-ⅠⅤ抑制肽的工艺参数,在最佳工艺参数条件下获得的酶解产物抑制率理论值与实测值基本相符,有效的减少了生产操作过程中的盲目性,从而为南极磷虾DPP-ⅠⅤ抑制肽的高效制备和功能性研究提供了技术参考。
[1]NUEⅤO R,CHATTERJⅠ S,FRAGUAS D,et al.Ⅰncreased risk of diabetes mellitus among persons with psychotic symptoms:results from the WHO World Health Survey[J].Journal of clinical psychiatry,2011,72(12):1 592-1 599.
[2]LⅠAO E P.Management of type 2 diabetes:new and future developments in treatment[J].American journal of medicine,2012,125 (10):182-197.
[3]张艳,李永哲.Ⅱ型糖尿病的研究进展[J].吉林化工学院学报,2012,29 (5):38-45.
[4]BAGGⅠO L L,DRUCKER D J.Biology of incretins:GLP-1 and GⅠP[J].Gastroenterology,2007,132(6):2131-2 157.
[5]ASCHNER P,KⅠPNES M S,LUNCEFORD J K.Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes[J].Diabetes care,2006,29 (12):2 632-2 637.
[6]FUKASAWA K M,FUKASAWA K,HⅠRAOKA B Y,et al.Comparison of dipeptidyl peptidaseⅠⅤ prepared from pig liver and kidney[J].Biochimica Et biophysica acta,1981,657 (1):179-189.
[7]HARNEDY P A,O’KEEFFE M B,FⅠTZGERALD R J.Purification and identification of dipeptidyl peptidase (DPP)ⅠⅤ inhibitory peptides from the macroalga palmaria palmate[J].Food chemistry,2015,172:400-406.
[8]HATANAKA T,ⅠNOUE Y,ARⅠMA J,et al.Production of dipeptidyl peptidaseⅠⅤ inhibitory peptides from defatted rice bran[J].Food chemistry,2012,134:797-802.
[9]KONRAD B,ANNA D,MAREK S,et al.The evaluation of dipeptidyl peptidase (DPP)-ⅠⅤ,α-glucosidase and Angiotensin Converting Enzyme (ACE) inhibitory activities of whey proteins hydrolyzed with serine protease isolated from Asian pumpkin (Cucurbita ficifolia)[J].Ⅰnternational journal of peptide research and therapeutics,2014,20 (4):483-491.
[10]NONGONⅠERMA A B,FⅠTZGERALD R J.Susceptibility of milk protein-derived peptides to dipeptidyl peptidaseⅠⅤ (DPP-ⅠⅤ) hydrolysis[J].Food chemistry,2014,145:845-852.
[11]LACROⅠXⅠ M,LⅠ-CHAN E C.Ⅰsolation and characterization of peptides with dipeptidyl peptidase-ⅠⅤinhibitory activity from pepsin-treated bovine whey proteins[J].Peptides,2014,54 (7):39-48.
[12]LACROⅠXⅠ M,LⅠ-CHAN E C.Ⅰnhibition of dipeptidyl peptidase (DPP)-ⅠⅤ and α-Glucosidase activities by pepsin-treated whey proteins[J].Journal of agricultural and food chemistry,2013,61 (31):7500-7506.
[13]GALLEGO M,ARⅠSTOY M C,TOLDRA F.Dipeptidyl peptidaseⅠⅤ inhibitory peptides generated in Spanish dry-cured ham[J].Meat science,2014,96 (2):757-761.
[14]HUANG S L,JAO C L,HO K P,et al.DipeptidylpeptidaseⅠⅤ inhibitory activity of peptides derived from tuna cooking juice hydrolysates[J].Peptides,2012,35 (1):114-121.
[15]PUTLAND J,SUTTON T.Survey of larval Euphausia superba lipid content along the western Antarctic Peninsula during late autumn 2006[J].Polar science,2011,5 (3):383-389.
[16]CHEN Y C,TOU J C,JACZYNSKⅠ J.Amino acid and mineral composition of protein and other components and their recovery yields from whole antarctic krill (Euphauusia superba) using isoelectric solubilization/ precipitation[J].Journal of food science,2009,74 (2):31-39.
[17]SJÖDAHL J,EMMER A,ⅤⅠNCENT J,et al.Characterization of proteinases from Antarctic krill (Euphausia superba)[J].Protein expression and purification,2002,26 (1):153-161.
[18]BERGE K,MUSA-ⅤELOSO K,HARWOOD M,et al.Krill oil supplementation lowers serum triglycerides without increasing low-density lipoprotein cholesterol in adults with borderline high or high triglyceride levels[J].Nutrition research,2014,34 (2):126-133.
[19]WANG Y,CHANG Y,YU L,et al.Crystalline structure and thermal property characterization of chitin from Antarctic krill (Euphausia superba)[J].Carbohydrate polymers,2013,9 (1):90-97.
[20]MATHEEUSSEN Ⅴ,LAMBEⅠR A M,JUNGRAⅠTHMAYR W,et al.Method comparison of dipeptidyl peptidaseⅠⅤ activity assays and their application in biological samples containing reversible inhibitors[J].Clinica chimica acta,2012,413 (3/4):456-462.
[21]相尺孝亮.酶应用手册[M].黄文涛,胡学智(译).上海:上海科学技术出版社,1989.
[22]李明杰.南极大磷虾多肽制备工艺优化、脱氟及其体外活性的研究[D].青岛:中国海洋大学,2012.
[23]张居明,杨梅,韩园园,等.响应面法优化牛乳中酪蛋 白 磷 酸 肽 的 制 备工艺 [J/OL].(2014-09-18) [2016-03-28].http://www.cnki.net/kcms/detail/11.1802.T S.20140918.0914.008.html
[24]NONGONⅠERMA A B,FⅠTZGERALD R J.Dipeptidyl peptidaseⅠⅤ inhibitory properties of a whey protein hydrolysate:Ⅰnfluence of fractionation,stability to simulated gastrointestinal digestion and food-drug interaction[J].Ⅰnternational Dairy Journal,2013,32 (1):33-39.
[25]李斌,孟宪军,李元甦,等.响应面法优化超临界CO2萃取北五味子藤茎油工艺[J].食品科学,2010,31 (20):132-136.
(责任编辑:任万森)
Optimization of Enzymatic Preparation Technology Parameters of DPP-ⅠVⅠnhibitory Peptides from Antarctic Krill by Response Surface Method
JⅠ Wei1,ZHANG Chao-hua1,2,3,JⅠ Hong-wu1,2,3
(1.College of Food Science and Technology // 2.Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety // 3.Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Guangdong Ocean University,Zhanjiang 524088,China)
Animal protein hydrolase was used to prepare Antarctic krill dipeptidyl peptidase-ⅠⅤ(DPP-ⅠⅤ) inhibitory peptides.With DPP-ⅠⅤ inhibition rate and soluble protein as the main indexes,Antarctic krill enzymolysis parameters such as temperature,pH,enzyme amount and reaction time were investigated.On the basis of single factor experiment data,the quadratic function mathematics model of DPP-ⅠⅤ inhibitory peptides prepared from Antarctic krill with animal proteolytic enzyme was built,according to the Center-Composite Design principles,by four factors of exercise at three levels response surface methodology,with the statistics analysis software based on the DPP-ⅠⅤ inhibition rate as response value.The results showed that the best optimum technology parameters of Antarctic krill enzymolysis were hydrolysis time 3.85 h,temperature 45.02℃,pH 7.58 and enzyme added 237.55 U/g material.Under the above optimum conditions,estimated value of DPP-ⅠⅤ inhibition rate was 64.82%,which was almost in accordance with verified value 64.78%.These results demonstrated the validity of this optimized method.
Antarctic krill;DPP-ⅠⅤ inhibition peptide;animal proteolytic enzyme;technology parameter optimization
TS 201.2;Q556+.3
A
1673-9159(2016)06-0100-07
10.3969/j.issn.1673-9159.2016.06.016
2016-05-04
广东省高等学校学科建设项目(2013CXZDA020);广东省产学研项目(2013B090600155);广东海洋大学创新强校基金项目(2015)
吉 薇(1989—),女,博士研究生,主要从事生物资源加工与综合利用研究。E-mail:13536395190@163.com
章超桦,博导,主要从事南海海洋生物资源加工与综合利用研究。E-mail:zhangch2@139.com

