菊芋渣的组分分析及其酶解糖化条件研究
任海伟,邢军梅,刘晓风,李雪雁,李志忠,范文广
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
菊芋渣的组分分析及其酶解糖化条件研究
任海伟,邢军梅,刘晓风,李雪雁,李志忠,范文广
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
探索了菊芋渣酶解糖化制备可发酵糖的工艺条件。详细考查了纤维素酶、木聚糖酶和淀粉酶以不同组合形式(单一或复合酶水解)进行酶解对其酶解得率的影响,并结合扫描电镜(SEM)和X-衍射(XRD)技术考察酶解前后的菊芋渣结构变化,筛选适宜的酶解方案。结果表明,菊芋渣中纤维素、半纤维素和淀粉含量分别为22.54%、18.00%、20.49%,总碳水化合物含量高达61%以上,是制备葡萄糖等可发酵糖的良好原料。酶解实验结果表明,依次添加纤维素酶、淀粉酶和木聚糖酶(方案Ⅰ)的分步水解法酶解得率最高为75.33%,3种酶添加量分别为7200、12000和10000 U/g,酶解时间依次为3.5、3.5和3.0 h。SEM和XRD表征结果发现,原先致密的菊芋渣表面微观结构经酶解作用后出现许多孔洞和裂痕,沟壑明显,且方案Ⅰ的酶解残渣相对结晶指数最高,说明纤维素结晶区也发生了降解。总之,菊芋渣中碳水化合物含量丰富,复合酶解后能制得微生物可发酵糖,为下游乙醇发酵奠定物质基础。
菊芋渣,组分分析,酶解,糖化
菊芋(Jerusalemartichoke)为菊科向日葵属植物,俗称鬼子姜、洋姜等,是一种以块茎繁殖,耐低温、贫瘠和盐碱,产量较高的可食用作物和能源植物[1]。菊芋块茎中富含菊糖(也称菊粉),质量分数为菊芋湿重的10%~20%,干重的80%左右,是加工生产菊粉、低聚果糖和超高果糖浆等多功能食品配料的首选原料[2]。目前国内菊芋原料主要被用来制作酱菜或泡菜、菊粉加工。与此同时,菊芋作为能源植物进行生物乙醇的开发利用也日益受到人们关注。国内外开展了大量菊芋块茎菊糖制乙醇的工作,如先将菊糖酸解或酶解,然后利用酵母或细菌等具有发酵能力的菌株进行发酵,或者利用产菊糖酶能力较高的微生物如黑曲霉或脆壁克鲁维酵母与酿酒酵母混合发酵[3-4]。然而,相对于菊芋块茎或菊粉直接生产乙醇而言,将菊芋优先用于食品加工(如菊粉提取)、再利用菊粉提取残渣(菊芋渣)进行生物乙醇开发,既能充分体现菊芋原料的食用价值和能源价值,又符合“不与人争粮、不与人争地”的中国国情,也有利于菊芋产业的可持续发展。
菊芋渣(Jerusalemartichokeresidue)是菊粉加工提取后的副产物,1 t菊芋块茎加工后可得菊芋渣650 kg(水分含量约为83%),若不进行有效利用会造成严重的环境污染和资源浪费。菊芋渣富含纤维素、半纤维素和淀粉等碳水化合物,与菊芋秸秆相似[5],是一种廉价易得的木质纤维类生物质原料,若能将菊芋渣中所含的碳水化合物组分糖化制成富含可发酵糖的碳源基质,并最终用于生物乙醇发酵,将是有别于菊芋块茎或菊粉直接生产生物乙醇的一种方法。目前,菊芋渣研究主要集中在动物饲料[6]、蛋白提取和抗氧化肽制备[7-8]、果胶提取[9]等方面,本课题组也对菊芋渣中的膳食纤维、残糖和蛋白等组分进行了提取,并分析了蛋白质的氨基酸组成和功能特性[10]。但有关菊芋渣糖化制备可发酵糖的研究还未见报道。
鉴此,本文以菊芋渣为原料,以其酶解糖化获得可发酵糖为目标,着重研究纤维素酶、木聚糖酶和淀粉酶等碳水化合物酶对菊芋渣进行酶解糖化的方案优化,并利用扫描电镜(SEM)和X-衍射(XRD)技术比较菊芋渣酶解前后的结构特征,以期为菊芋渣的糖化和后续乙醇发酵奠定技术基础。

表1 三种酶组合的酶解方案Table 1 The combination methods of three enzymes
1 材料与方法
1.1 材料与仪器
菊芋渣 甘肃白银熙瑞生物工程有限公司提供,自然风干后粉碎过40目筛,备用。
纤维素酶(滤纸酶活1.2×105U/g,厂家推荐最适温度50 ℃,最适pH4.8)和木聚糖酶(酶活2.0×105U/g,厂家推荐最适温度50 ℃,最适pH5.0) 宁夏和氏璧生物技术有限公司;淀粉酶(酶活2.0×105U/g,厂家推荐最适温度60 ℃,最适pH6.0) 江苏锐阳生物科技有限公司;其余试剂均为分析纯。
TDL-5-A离心机 上海安亭科学仪器厂;UV-9200紫外可见分光光度计 北京瑞利分析仪器公司;Z-5000火焰原子吸收分光光度计 日本Hitachi;JSM5600LV扫描电子显微镜 日本JEOL公司;D/MAX-2004粉末X射线衍射仪 日本理学公司。
1.2 实验方法
1.2.1 理化成分的测定 水分测定参照GB 50093-2010;灰分测定参照GB 50094-2010;蛋白质测定参照GB 50095-2010;淀粉测定参照GB/T 5009.9-2008;中性洗涤纤维(NDF)测定参照GB/T 20806-2006;酸性洗涤纤维(ADF)测定参照NYT 1459-2007;酸性洗涤木质素(ADL)测定参照GB/T 20805-2006。纤维素(CL)和半纤维素(HC)由公式计算而得:CL=ADF-ADL;HC=NDF-ADF[11]。
1.2.2 单种酶的酶解糖化实验 准确称取3.00 g菊芋渣样品三份,以1∶10 (g/mL)料液比加入蒸馏水,调节至厂家提供酶的最适温度和pH,分别加入纤维素酶、淀粉酶和木聚糖酶进行酶解糖化反应。酶解反应结束后,沸水浴灭酶10 min并快速冷却,然后4000 r/min离心10 min,收集上清液定容至100 mL,分析其总糖浓度并计算酶解得率。总糖以还原糖计,采用3,5-二硝基水杨酸(DNS)法测定。每组实验进行3次重复。通过动态分析酶解得率变化确定3种酶的适宜酶解时间和加酶量。酶解得率按公式(1)计算:
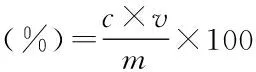
式(1)
式中:c-总糖浓度(g/mL);v-酶解上清液体积(mL);m-菊芋渣试样质量(g)。
1.2.2.1 纤维素酶的酶解糖化实验 在50 ℃,pH4.8条件下,分别研究加酶量(1200、2400、3600、4800、6000、7200U/g,加酶量以原料质量为基准,下同)和酶解时间(1、1.5、2、2.5、3和3.5h)对纤维素酶酶解菊芋渣的酶解得率影响。
1.2.2.2 木聚糖酶的酶解糖化实验 在50 ℃,pH5.0条件下,分别研究加酶量(2000、4000、6000、8000、10000、12000U/g)和酶解时间(1、1.5、2、2.5、3和3.5h)对木聚糖酶酶解菊芋渣的酶解得率影响。
1.2.2.3 淀粉酶的酶解糖化实验 在60 ℃,pH6.0条件下,分别研究加酶量(2000、4000、6000、8000、10000、12000U/g)和酶解时间(1、1.5、2、2.5、3和3.5h)对淀粉酶酶解菊芋渣的酶解得率影响。
1.2.3 复合酶解方案的筛选 按照1.2.2确定的3种酶最佳酶解时间和加酶量,如表1所示进行多酶组合酶解实验,方法同1.2.2。准确称取3.00g菊芋渣样品,以1∶10 (g/mL)料液比加入蒸馏水,添加酶Ⅰ在相应条件下反应,酶解结束后沸水浴灭酶,冷却并调至酶Ⅱ的最适条件继续反应。酶Ⅱ反应结束后灭酶再进行酶Ⅲ作用,方法同前。比较不同方案的酶解得率,筛选适宜的酶解组合顺序。

表2 菊芋渣主要组分分析(以干基计,%)Table 2 Components analysis of Jerusalem artichoke residue(%)
1.3 结构特性分析
1.3.1 扫描电镜分析 原料和酶解残渣粉碎后过200目筛,取筛上物用导电胶带固定在铜台上,采用JSM5600LV扫描电子显微镜(SEM)进行观察照相,分析其表观结构变化。
1.3.2 结晶度分析 用D/MAX-2004粉末X射线衍射仪对样品进行X-衍射(XRD)分析。X光管为铜靶,扫描范围5°~90°,取样间隔为0.02°。采用Segal公式计算相对结晶指数,按公式(2)计算:
式(2)
式中:CrI-相对结晶指数;I002-主结晶峰002面(2θ=22°)晶格衍射强度;Iam-2θ=18°时的衍射强度[12]。
2 结果与讨论
2.1 菊芋渣的主要组分分析
由表2可知,菊芋渣中淀粉和纤维素含量均高于20%,半纤维素含量约18%,这三种碳水化合物组分的含量之和高达61%。淀粉是葡萄糖的高聚体;纤维素是由多个葡萄糖分子组成的大分子多糖,二者完全水解后能得到葡萄糖;半纤维素主要由几种不同类型的五碳糖(β-D-木糖、α-L-阿拉伯糖)、六碳糖(β-D-葡萄糖、β-D-甘露糖、α-D-半乳糖等)和糠醛酸以糖苷键连接形成。根据酶的专一特性,这些碳水化合物组分经相应酶降解后能够得到含有葡萄糖和木糖等单糖的可发酵糖液,并用作乙醇等生化产品的发酵基质。
2.2 单一种类酶的酶解效果比较
2.2.1 加酶量对酶解得率的影响 由图1可知,3种酶的酶解得率均随着加酶量增加呈快速增加趋势,达到一定量后酶解得率增度放缓并趋于恒定。因为当加酶量较少时原料与酶的接触机率较小,使各种酶的酶解得率较低;当加酶量逐渐增加时,酶与底物充分接触反应,酶解作用增强。纤维素酶、淀粉酶和木聚糖酶的加酶量分别为7200、12000、10000 U/g时,酶解得率达到各自最高值,分别为29.51%、18.49%和13.01%。另一方面,纤维素酶的酶解得率始终高于淀粉酶和木聚糖酶,木聚糖的酶解得率最低。因为实验所用纤维素酶本身是一种由蛋白酶、淀粉酶、果胶酶和纤维素酶等组成的多酶复合物,在这种酶复合体系中一种酶的产物可以成为另一种酶的底物[13],所以纤维素酶的酶解得率较高。而木聚糖酶主要作用于半纤维素,但原料中半纤维素含量相对较少,且半纤维素的完全水解需要多种酶的协同作用[14-15],半纤维素自身网络结构也会影响其酶解效率。淀粉酶专一水解淀粉,菊芋渣中的纤维素骨架对淀粉的降解形成了一定的阻碍作用,使其酶解得率偏低。因此,3种酶的酶解得率高低顺序依次为纤维素酶、淀粉酶和木聚糖酶,适宜添加量分别为7200、12000和10000 U/g。
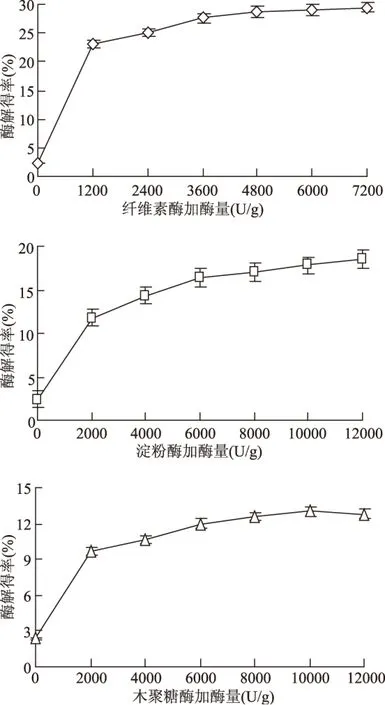
图1 加酶量对菊芋渣酶解得率的影响Fig.1 Effect of enzyme concentration on enzymolysis yield of Jerusalem artichoke residue
2.2.2 时间对酶解得率的影响 由图2可知,随着时间的延长,3种酶的酶解得率逐渐增加,显著高于酶解前菊芋渣原料中的总糖含量(1.9%),一段时间后3种酶的酶解得率变化均趋于平缓。纤维素酶、淀粉酶和木聚糖酶分别作用3.5、3.5、3.0 h时达到各自酶解得率的最高值,分别为28.65%、16.81%和11.61%,较作用1 h时的酶解得率分别升高了10.33%、4.49%和3.05%。因为反应初期,酶与底物接触充分,反应速度较快,底物被不断分解;随着反应进行,底物浓度逐渐下降,且水解产物也存在反馈抑制作用,导致酶解反应放缓。故确定纤维素酶、淀粉酶和木聚糖酶的酶解作用时间分别为3.5、3.5、3.0 h。
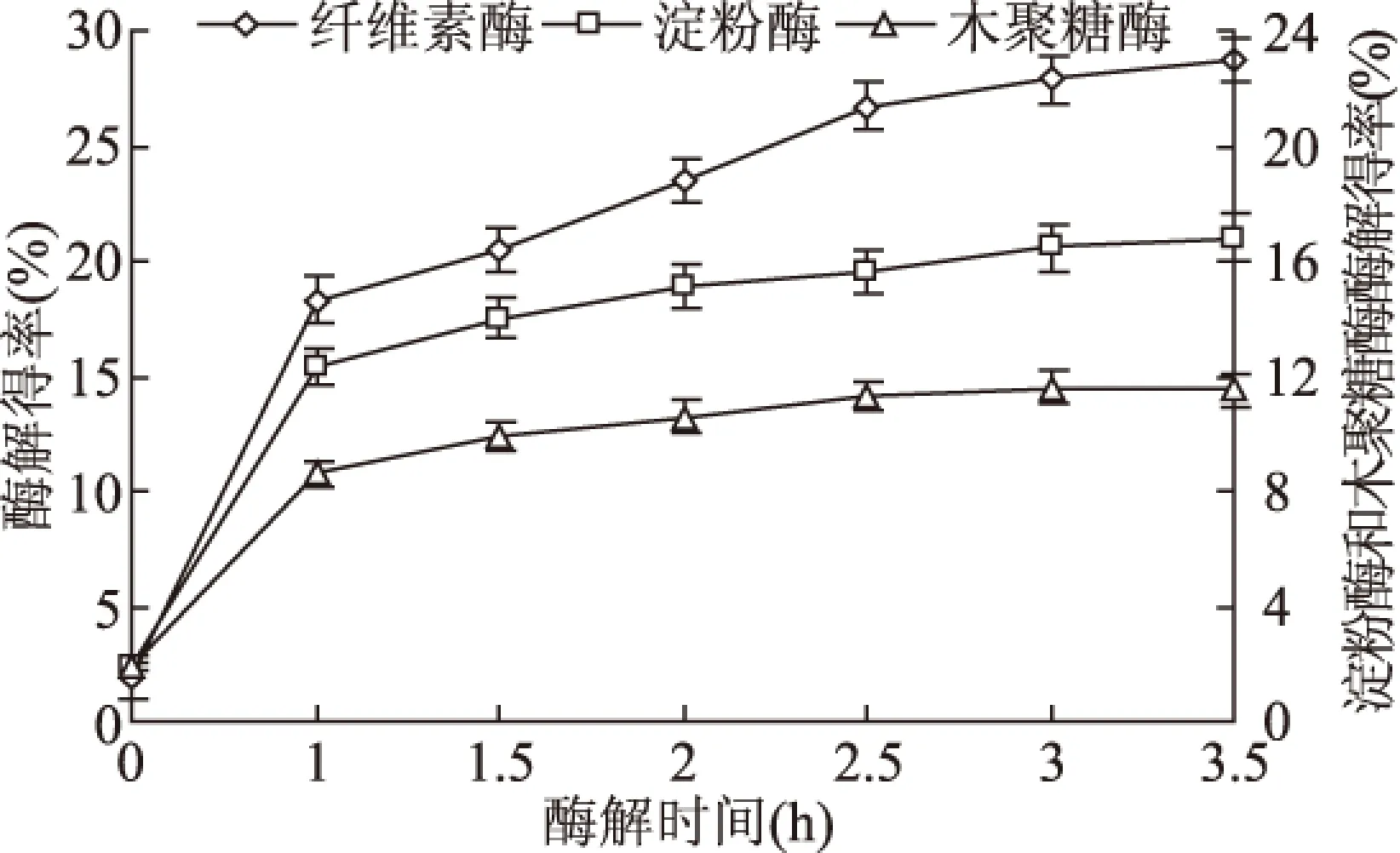
图2 时间对菊芋渣酶解得率的影响Fig.2 Effect of time on enzymolysis yield of Jerusalem artichoke residue
2.3 三种酶不同组合方式对酶解得率的影响
在筛选获得单一酶适宜添加量和酶解时间的基础上进行多酶复合酶解实验。由图3可知,3种酶组合水解的酶解得率明显高于单种酶作用效果,分别为单一种类酶最大酶解得率的2.55倍(纤维素酶)、4.07倍(淀粉酶)和5.79倍(木聚糖酶),可见纤维素酶、淀粉酶和木聚糖酶3种酶表现出极强的协同组合效应。其中,方案Ⅰ的酶解得率最高(75.33%),方案Ⅱ和Ⅳ次之,方案Ⅲ和Ⅴ之间差异不显著(p>0.05),3种酶同时添加效果最差。方案Ⅰ的酶解得率显著高于其他方案(p<0.05),为最适合底物结构的酶系组成。说明纤维素酶先于木聚糖酶作用于原料底物更有利于酶解得率的提高和总糖获得。在木质纤维素原料中,纤维素组成微细纤维,构成纤维细胞壁的网状骨架,而半纤维素则填充在纤维和微细纤维之间[16]。首先添加纤维素酶,可以在分解纤维素的同时进一步破坏难降解的木质纤维骨架,增加原料与酶的接触面积,有利于后续2种酶对目标组分的作用;而且木聚糖酶的后续添加降解了底物中的半纤维素,减少了空间位阻,使得纤维素酶更容易吸附作用于纤维素组分[17]。
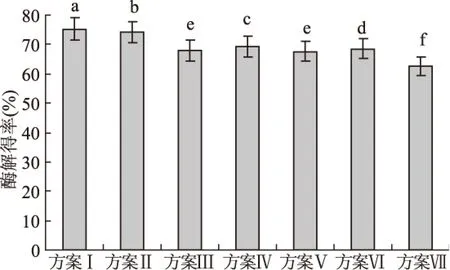
图3 三种酶不同组合方案的酶解得率Fig.3 Enzymolysis yield of three enzymazes in different protocols
2.4 菊芋渣在酶解前后扫描电镜观察
扫描电镜是一种常用的木质纤维素基质表面结构特征显微观察的重要技术手段,具有原位分析样品的能力,是表面形貌研究上的有力工具,能够有效提供酶解前后菊芋渣的表面结构信息[18-20]。由图4可知,菊芋渣原料结构紧密(图4a),酶解作用后表观结构发生了不同程度的变化。其中,Ⅰ法酶解时,菊芋渣表面沟壑最明显,且出现许多孔洞和裂痕(图4b),Ⅱ法酶解后断面开裂,呈光滑薄片状(图4c),Ⅲ法酶解后纤维束断裂面明显且呈现不规则沟壑(图4d),Ⅳ法酶解后结构松散,出现少量大的孔洞(图4e),Ⅴ法酶解后边缘呈齿状(图4f),Ⅵ法酶解后表面凸起呈絮状(图4g),Ⅶ法酶解后纤维束之间的结合变松弛,呈层层剥离状(图4h)。其中,首先加入纤维素酶的方案Ⅰ和Ⅱ破坏程度最大,这可能是因为纤维素酶首先破坏了木质纤维紧密结构,使淀粉酶和木聚糖酶能更好地与底物中目标组分接触反应[21-22]。

图4 菊芋渣酶解前后扫描电镜图(×2000倍)Fig.4 SEM micrograph of Jerusalem artichoke residue before and after enzymatic hydrolysis(×2000)
2.5 X-衍射分析
纤维素分子内及分子间的强大氢键网络使纤维素分子具有高度规则的结晶结构,酶解前后的XRD结果如图5所示,菊芋渣纤维素在2θ=22°左右有衍射峰,酶解后的晶型结构也未发生改变,仅峰尖形和峰强度出现不同程度地改变。7种酶解方案对应的CrI也差异明显。由表3可知,方案Ⅰ、Ⅱ和Ⅵ酶解残渣的CrI均有提高,且方案Ⅰ提高幅度最大,而方案Ⅲ、Ⅳ、Ⅴ和Ⅶ酶解后的CrI显著降低。由于方案Ⅰ酶解得率最高,使得纤维素无定形区及结晶区表面溶出降解,其无定形区酶解更充分,将结晶区核心部位暴露,使其吸收强度增大。而方案Ⅲ、Ⅳ和Ⅴ的酶解效率较低,还有大量无定形区未被降解,导致纤维素结晶区未能充分暴露。酶解过程中,结晶区向无定形区的转化也会使CrI减小[23]。

表3 菊芋渣纤维素在酶解前后的相对结晶指数变化Table 3 Changes of crystallinity index(CrI)before and after enzymatic hydrolysis
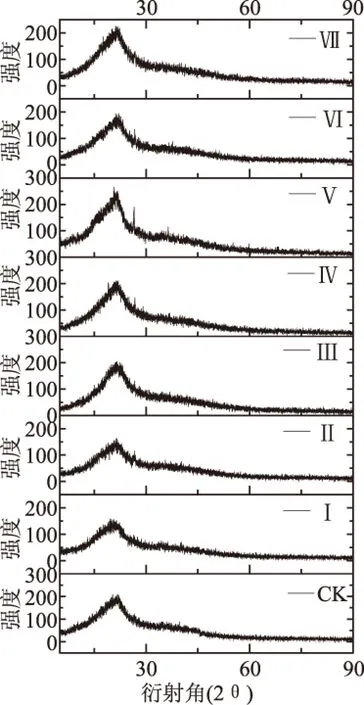
图5 菊芋渣酶解前后的X射线衍射图Fig.5 XRD map analysis of Jerusalem artichoke residue before and after enzymatic hydrolysis
3 结论
菊芋渣富含纤维素、半纤维素和淀粉等组分,碳水化合物组分含量丰富,含量高达61%左右。采用依次添加纤维素酶、淀粉酶、木聚糖酶(方案Ⅰ)的多酶组合分步水解法,能获得较高的酶解得率(75.33%)。SEM结果显示酶解前后的菊芋渣表观结构变化明显,菊芋渣经酶解作用后出现许多孔洞和裂痕。XRD谱图和CrI说明方案Ⅰ中的纤维素组分被充分降解。因此,推荐方案Ⅰ作为菊芋渣酶解糖化制备可发酵糖的酶解条件。
[1]罗腾,张宝善,崔田田,等. 菊芋酒酿酒酵母的选择及发酵工艺[J]. 食品与生物技术学报,2016(2):211-218.
[2]张宏志,马艳弘,黄开红,等. 菊芋菊糖的提取、聚合度分布及抗氧化活性的研究[J]. 食品与生物技术学报,2015,34(10):1069-1077.
[3]李丽丽,侯英敏,郭小宇,等. 菊糖酶提高酿酒酵母利用菊糖产乙醇能力的研究进展[J]. 食品工业科技,2016,37(11):367-371.
[4]刘祖昕,谢光辉. 菊芋作为能源植物的研究进展[J]. 中国农业大学学报,2012,17(6):122-132.
[5]王卿,邱婧雯,李阳,等. 热碱预处理对菊芋茎秆组成和酶水解影响[J]. 生物工程学报,2015,31(10):1459-1467.
[6]王水旺. 菊芋粕对绵羊的营养价值评定[D]. 兰州:甘肃农业大学,2013.
[7]范三红,胡雅喃,何亚. 响应面法优化菊芋渣酶解制备抗氧化肽工艺[J]. 食品科学,2015,136(8):49-53.
[8]胡雅喃,范三红,张晓丽. 菊芋渣蛋白的提取及功能性质研究[J]. 食品工业科技,2015,36(10):288-292.
[9]刘胜一,史雪洁,徐兰兰,等. 响应面法优化菊芋渣中果胶的提取工艺及产品性质分析[J].食品科学,2014,35(24):29-34.
[10]张维. 菊芋渣中可利用成分的提取及特性研究[D]. 兰州:兰州理工大学,2012.
[11]Sluiter A,Hames B,Ruiz R,et al. Determination of structural carbohydrates and lignin in biomass. NREL/TP-510-42618[R]. Golden,USA:National Renewable Energy Laboratory,2008.
[12]Qiu Z H,Aita G M,Walker M S. Effect of ionic liquid pretreatment on the chemical composition,structure and enzymatic hydrolysis of energy cane bagasse[J]. Bioresource Technology,2012,117(9):251-256.
[13]窦烨,王清路,李俏俏. 纤维素酶的应用现状[J]. 中国酿造,2008,189(12):15-17.
[14]杨淑蕙. 植物纤维化学[M]. 北京:中国轻工业出版社,2011.
[15]Zou S Y,Xiao K J,Shao Y Y,et al. Enzymatic saccharification of alkali pretreated rice straw[J]. Modern Food Science & Technology,2009,25(4):411-415,427.
[16]袁同琦. 三倍体毛白杨组分定量表征及均相改性研究[D]. 北京:北京林业大学,2012.
[17]邢玲,江华. 木聚糖酶对玉米芯酶水解过程的影响[J]. 食品工业科技,2010,31(11):228-231.
[18]孙付保,王亮,谭玲,等. 木质纤维素糖平台基质组成结构的分析表征技术研究进展[J]. 化工进展,2014,33(4):883-890.
[19]王琰,金永灿. 显微技术在木质纤维素生物质预处理研究中的应用进展[J]. 南京林业大学学报,2016,40(1):155-161.
[20]向佳晴,唐冰,彭政,等. 乳化剪切作用对菠萝叶纤维在离子液体中溶解的影响[J].食品工业科技,2016,37(9):240-244.
[21]Correia J A C,Júnior J E M,Gonçalves L R B,et al. Alkaline hydrogen peroxide pretreatment of cashew apple bagasse for ethanol production:Study of parameters[J]. Bioresource Technology,2013,139(8):249-256.
[22]Carvalheiro F,Duarte L C,Gírio F M,et al. Hemicellulose biorefineries:a review on biomass pretreatments[J]. Journal of Scientific & Industrial Research,2008,67(11):849-864.
[23]马欢,刘伟伟,刘萍,等. 微波预处理对水稻秸秆糖化率与成分和结构的影响[J].农业机械学报,2014,45(10):180-186.
Composition analysis and enzymatic hydrolysis saccharification ofJerusalemartichokeresidues
REN Hai-wei,XING Jun-mei,LIU Xiao-feng,LI Xue-yan,LI Zhi-zhong,FAN Wen-guang
(School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
TheenzymaticsaccharificationconditionsoffermentablesugarsproductionwerestudiedtoutilizetheJerusalem artichokeresidues(JAR)effectively.Theeffectsofcombiningformsforcellulase,amylaseandxylanaseonenzymolysisyieldwerestudiedonthebasisofcomponentsanalysis,andtheoptimumenzymaticconditionswereselected.Thestructuralcharacteristicschangeswerestudiedbyscanningelectronmicroscopy(SEM)andX-diffraction(XRD).Theresultsshowedthatthecontentofcellulose,hemicellulose,andstarchwere22.54%,18.00%and20.49%,respectively.Thetotalcarbohydratescontentwerereachedupto61%inJAR,whichbeneficialtopreparethefermentablesugarsuchasglucose.Theresultsofenzymatichydrolysisshowedthattheenzymolysisyieldofmultipleenzymehydrolysis(cellulose,amylaseandxylanase,successively)werehigherthansoleenzymehydrolysis.Thedosageofthreeenzymeswas7200U/g,12000U/gand10000U/g,respectively.Theenzymolysistimeofthreeenzymeswas3.5h,3.5hand3.0h,respectively.Underthiscondition,theenzymolysisyieldwasreachedto75.33%.TheresultsofSEMandXRDindicatedthattheoriginalcompactstructureofJARwaschangedtoporousafterenzymolysis,andtheravinesonsurfacewereobvious.TherelativecrystallizationindexofsechemeⅠwasthehighestandthecrystalstructureofcellulosewasdegradedsufficiently,comparedwiththeothersechemes(Ⅱ~Ⅶ).Inconclusion,thetotalcarbohydratescontentwererichinJAR,andfermentablesugarscanbeobtainedafterenzymecompositehydrolysis,whichwouldlaythefoundationfortheethanolfermentation.
Jerusalem artichokeresidues(JAR);componentsanalysis;enzymatichydrolysis;saccharification
2016-05-10
任海伟(1983-),男,博士,副教授,研究方向:食品加工副产物转化利用,E-mail:rhw52571119@163.com。
国家自然科学基金(51366009,51666010);甘肃省自然科学基金(1506RJYA106,1508RJYA097);甘肃省高等学校科研项目(2014A-030);兰州市科技局项目(2014-2-20);兰州理工大学红柳青年教师培养计划项目(Q201207)。
TS249.9
A
1002-0306(2016)21-0139-05
10.13386/j.issn1002-0306.2016.21.019

