海洋真菌Schizochytrium sp.DP-16发酵产DHA油脂过程的优化
徐 涛, 董 天 飞, 陈 明, 范 胜 男, 史 超
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.赤峰工业职业技术学院, 内蒙古 赤峰 024005 )
海洋真菌Schizochytriumsp.DP-16发酵产DHA油脂过程的优化
徐 涛1, 董 天 飞2, 陈 明1, 范 胜 男1, 史 超1
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.赤峰工业职业技术学院, 内蒙古 赤峰 024005 )
利用一株海洋真菌Schizochytriumsp. DP-16发酵产DHA,对其发酵过程进行了优化,并利用气质联用(GC-MS)对其脂肪酸组成进行了分析。通过单因素试验确定了发酵培养基配方和培养条件,在优化条件下培养120 h,细胞生物量达65.0 g/L,油脂产量达30.7 g/L,DHA达8.9 g/L。GC-MS分析表明Schizochytriumsp. DP-16细胞中共检出8种脂肪酸,主要含有C14:0 和C16:0两种饱和脂肪酸,不饱和脂肪酸主要包括DPA和DHA,其中DHA质量分数达28.784%。
海洋真菌;裂殖壶菌;DHA;发酵优化;气质联用
0 引 言
二十二碳六烯酸(Docosahexaenoic acid,DHA)是一种重要的ω-3多不饱和脂肪酸,具有降血脂、增强视力、促进脑细胞发育等生理功效[1],广泛用于食品医药行业,被誉为新一代功能因子,人体自身难以合成,必须从外界摄取。传统的DHA主要来源于深海鱼油,但品质与产量难以满足商业化发展需求,而微生物来源DHA具有含量高、质量好、过程可控、产量稳定等优点,成为目前的研究热点[2]。
裂殖壶菌(Schizochytrium)是一种富含DHA的海洋真菌,具有生长快、易培养、细胞内油脂和DHA含量高等优点,是商业化生产DHA的理想生产菌之一[3]。近年来国内外围绕裂殖壶菌产DHA的菌种选育、DHA合成途径、油脂积累机制、油脂提取等方面进行研究,取得了一些研究成果,而如何提高DHA产量一直是裂殖壶菌发酵产DHA的重点内容[4-6]。本实验利用一株裂殖壶菌Schizochytriumsp. DP-16发酵产DHA,对其发酵过程进行了优化,并利用气质联用(GC-MS)对其油脂的脂肪酸组成进行了分析。
1 材料与方法
1.1 材 料
1.1.1 菌 种
Schizochytriumsp. DP-16,本实验室保藏。
1.1.2 培养基
种子培养基(g/L):葡萄糖30,酵母浸粉10,蛋白胨2,海水晶15,pH 6.0。
基础发酵培养基(g/L):葡萄糖70,酵母浸粉10,蛋白胨10,海水晶15,MgSO4·7H2O 2,KH2PO4·H2O 4,pH 6.0。
1.1.3 试剂与仪器
BF3-甲醇溶液、DHA甲酯,上海安谱科学仪器有限公司,甲醇、氯仿、正己烷等均为分析纯。
7890型气相色谱-5975型质谱联用仪,Agilent Technologies。
1.2 方 法
1.2.1 种子液的制备
将菌种转接于斜面,25 ℃培养3 d后,挑取2~3环接入装有40 mL种子培养基的250 mL三角瓶中,25 ℃、200 r/min振荡培养2 d。
1.2.2 摇瓶发酵
按10%接种量将种子液接入装有40 mL发酵培养基的250 mL三角瓶中,25 ℃、200 r/min振荡培养4 d,测定菌体生物量及油脂产量。
1.2.3 发酵条件优化
利用单因素试验,依次对碳源种类和浓度、氮源种类和浓度、无机盐浓度、接种量、摇瓶装液量、发酵时间进行优化。
1.2.4 生物量测定
取2 mL发酵液,10 000 r/min离心15 min,弃上清,菌体沉淀置于80 ℃干燥至恒重,称量。
1.2.5 葡萄糖含量测定
采用DNS法测定葡萄糖含量[7]。
1.2.6 油脂含量测定
取发酵液5 mL,离心后弃上清,加入5 mL 4 mol/L HCl,置于沸水浴中10 min,加入10 mL体积比2∶1氯仿-甲醇混匀,离心后取氯仿层,加等体积的0.1% NaCl溶液,振荡混匀,取氯仿层至干燥的试管中,70 ℃干燥至恒重,称量。
1.2.7 油脂脂肪酸组成的GC-MS分析
脂肪酸的甲酯化按文献[8]进行。取2 mL发酵液,加3 mL水,4 000 r/min离心5 min,弃上清。将沉淀用7 mL 1 mol/L NaOH-甲醇溶液分两次转入100 mL磨口瓶中,加塞,置70 ℃ 水浴下皂化30 min,加入7 mL 14% BF3-甲醇溶液,70 ℃水浴下甲酯化反应30 min。冷却,加入10 mL饱和NaCl溶液及3 mL正己烷,振荡混匀,静置,取上层有机相于4 000 r/min离心5 min,吸取上层有机相用于GC-MS分析。
气相色谱条件:HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为260 ℃;载气为高纯度氦气,体积流量为1 mL/min,进样量1 μL,分流比1∶10;柱温采取程序升温:初始温度140 ℃,维持5 min,以4 ℃/min升温至240 ℃,240 ℃维持15 min。质谱条件:离子源温度230 ℃;接口温度280 ℃;质量扫描范围35~450 u,scan全扫描方式。
2 结果与讨论
2.1 培养基的优化
2.1.1 碳源种类的影响
分别选用果糖、葡萄糖、木糖、半乳糖、麦芽糖、乳糖和菊糖为发酵培养基碳源,质量浓度均为70 g/L,菌体利用不同碳源产DHA的结果如图1所示。结果表明,7种碳源均可被菌体利用,其中以葡萄糖为碳源时菌体生物量和油脂产量最高,果糖和半乳糖次之,木糖、乳糖、麦芽糖和菊糖较差,因此选择葡萄糖为碳源。
2.1.2 碳源质量浓度的影响
改变发酵培养基中初始葡萄糖浓度,考察葡萄糖浓度对DHA油脂发酵的影响。如图2所示,在葡萄糖质量浓度70~100 g/L,生物量和油脂产量随葡萄糖质量浓度的增大而略有增加。当葡萄糖质量浓度为110 g/L时,生物量和油脂产量达到最大,分别为16.8和4.2 g/L,进一步增加葡萄糖质量浓度,生物量和油脂产量均降低,可能是由于葡萄糖质量浓度过高对菌体生长产生了一定程度的抑制。因此选择初始葡萄糖质量浓度为110 g/L。

图1 碳源种类对菌体生物量和油脂产量的影响

图2 初始葡萄糖质量浓度对菌体生物量和油脂产量的影响
Fig.2 Effects of initial glucose concentrations on the biomass and lipid yields of the strain
2.1.3 氮源种类的影响
氮源包括有机氮源和无机氮源,有机氮源有利于产油脂微生物细胞生长,尤以酵母浸粉能较好地促进DHA油脂积累[9-10]。以酵母浸粉为基础氮源,考察添加其他氮源(10g/L)对DHA油脂发酵的影响,结果见图3。结果表明,添加谷氨酸钠能够有效促进菌体生长和油脂积累,因此,选择酵母浸粉和谷氨酸钠组成的复合氮源。
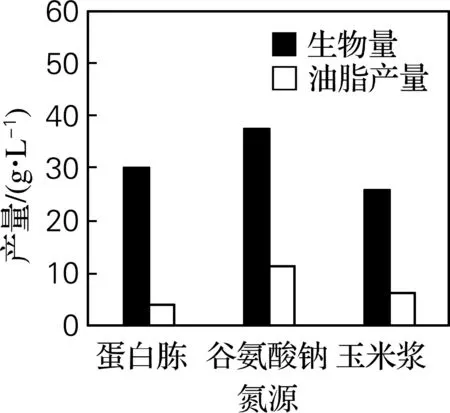
图3 氮源种类对菌体生物量和油脂产量的影响
2.1.4 氮源添加量的影响
改变发酵培养基中谷氨酸钠添加量,考察谷氨酸钠浓度对菌体发酵产DHA油脂的影响,结果见图4。在谷氨酸钠添加量为5~50g/L,谷氨酸钠添加量对生物量和油脂产量的影响不大,当谷氨酸钠添加量为10g/L时,生物量和油脂产量达到最大值,所以选择谷氨酸钠质量浓度为10g/L。

图4 谷氨酸钠添加量对菌体生物量和油脂产量的影响
Fig.4 Effects of monosodium glutamate amounts on biomass and lipid yields of the strain
2.1.5 无机盐质量浓度的影响
无机盐对微生物的生长和代谢具有重要作用,如磷酸盐是微生物生长所必需的,K+与细胞渗透压和透性有关,Mg2+是多种酶的激活剂,能够促进糖代谢[11]。
在优化培养基中添加MgSO4·7H2O质量浓度分别为2、5、8g/L,KH2PO4·H2O质量浓度分别为1、4、7g/L,采用不同组合方式考察无机盐质量浓度对Schizochytriumsp.DP-16发酵产DHA油脂影响,结果如表1所示。结果表明,当MgSO4·7H2O为5g/L、KH2PO4·H2O为7g/L时,细胞生物量和油脂产量达到最大。
2.2培养条件的优化
2.2.1 接种量的影响
研究了不同接种量对Schizochytriumsp.DP-16生长和油脂积累的影响,如图5所示。结果表明,在接种量为2%~10%,生物量及油脂积累与接种量的大小表现出正向相关性;进一步扩大接种量至13%,菌体生物量和油脂产量均降低,这可能是由于接种量过大,菌体生长过快,从而使发酵液黏度增加,导致溶氧不足所致。因此选择适宜的接种量为10%。

表1 无机盐质量浓度对菌体生物量和油脂产量的影响
Tab.1 Effects of inorganic salt concentrations on biomass and lipid yields of the strain

实验号ρ(MgSO4·7H2O)∶ρ(KH2PO4·H2O)ρ/(g·L-1)生物量油脂产量18∶134.57.228∶437.57.338∶734.06.845∶138.57.755∶433.06.665∶739.59.572∶134.57.582∶437.57.992∶732.56.5
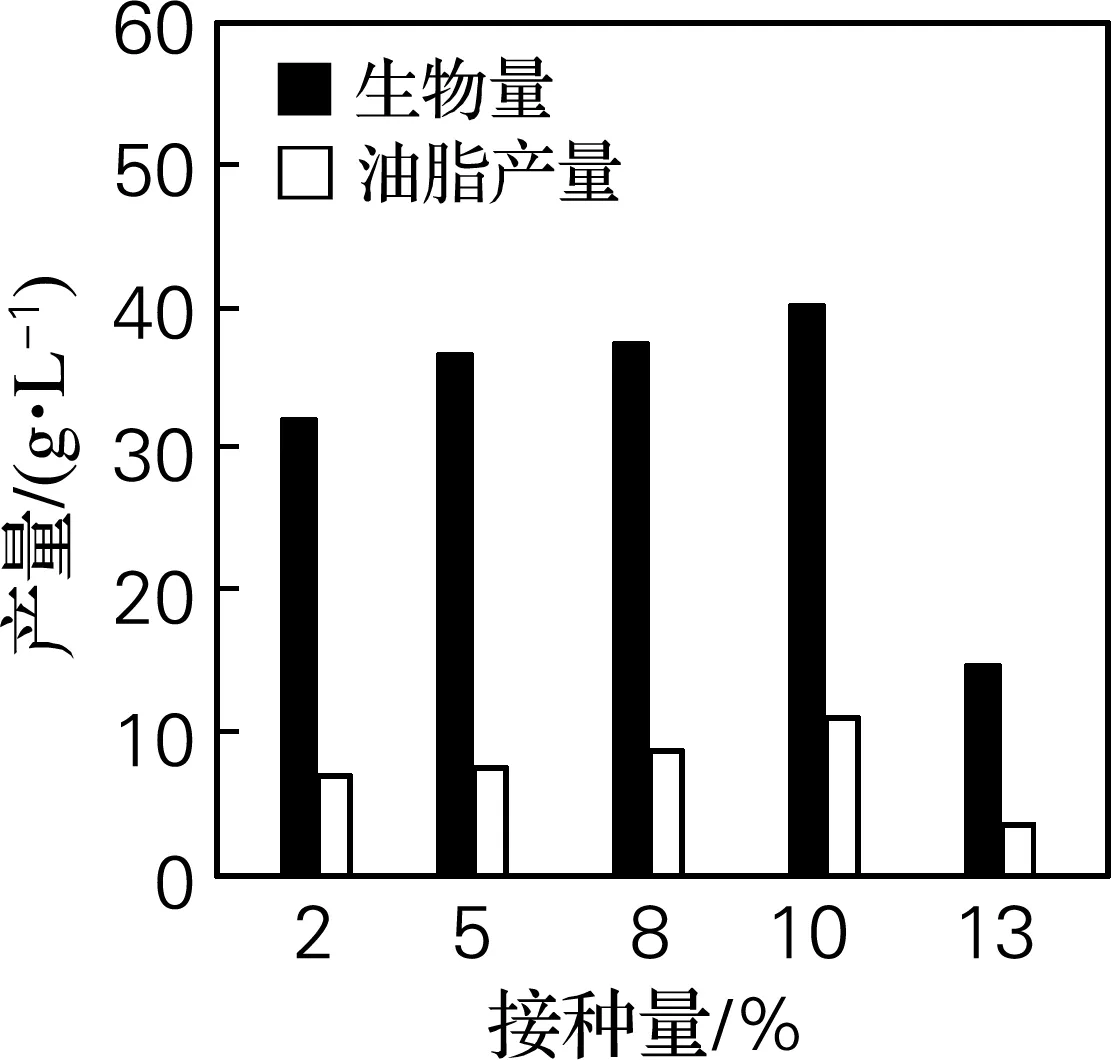
图5 接种量对菌体生物量和油脂产量的影响
2.2.2 装液量的影响
研究了不同装液量对Schizochytriumsp. DP-16生长和油脂积累的影响,结果如图6所示。结果表明,摇瓶装液量DHA影响较大,250 mL三角瓶中随着发酵培养基装液量的增加,生物量和油脂产量先上升后急剧下降,这可能是因为该发酵过程需要适宜的溶氧量。当装液量为30 mL时,生物量达57.5 g/L,油脂产量为14.9 g/L。
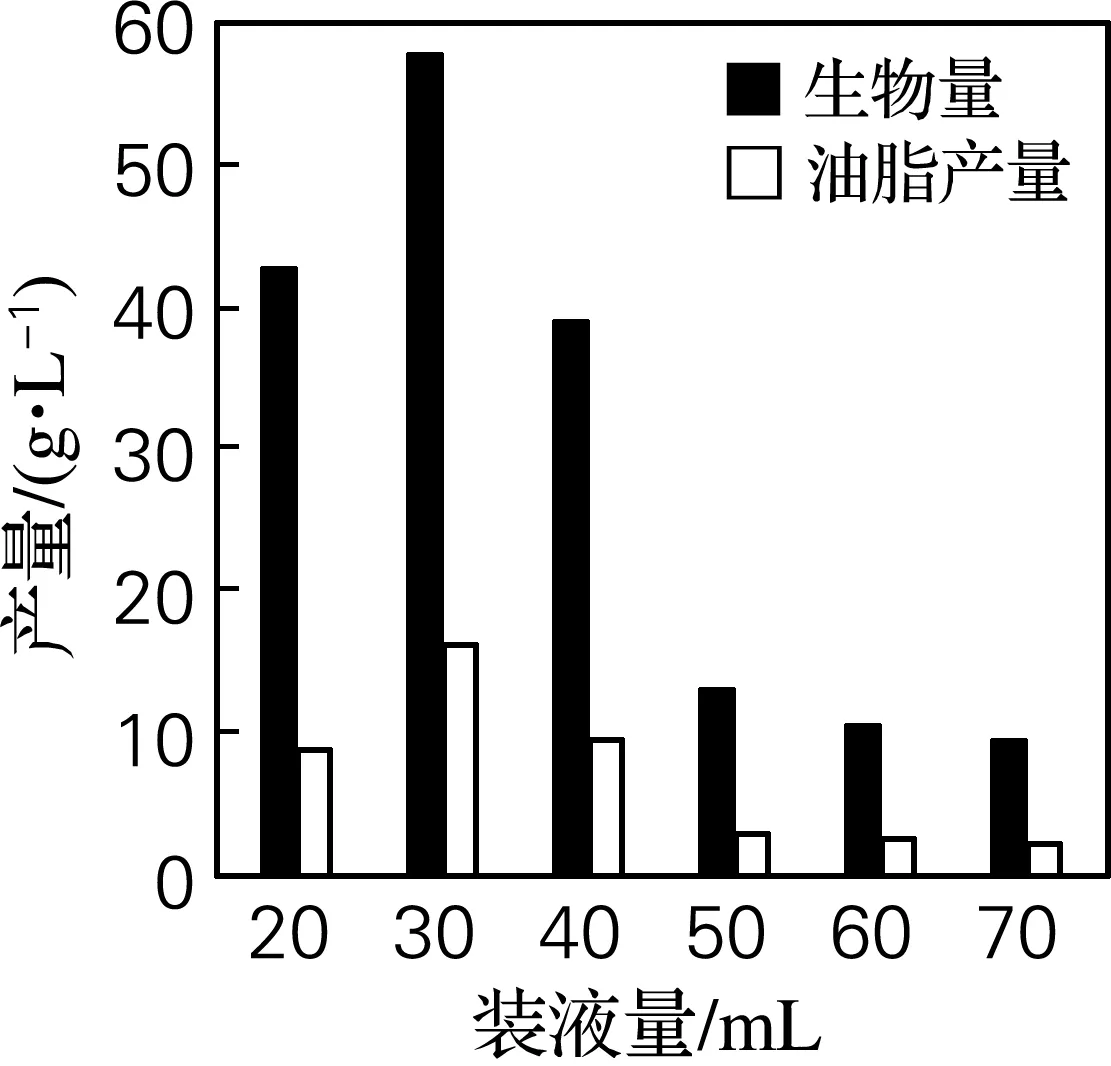
图6 装液量对菌体生物量和油脂产量的影响
2.2.3 培养时间的影响
利用优化后的培养基配方,在摇瓶装液量30 mL、接种量为10%条件下,研究了Schizochytriumsp. DP-16发酵产DHA油脂的时间进程,其中生物量和葡萄糖质量浓度每隔12 h测定,油脂和DHA产量每隔24 h测定,结果如图7所示。结果表明,随着发酵的进行,葡萄糖被Schizochytriumsp. DP-16细胞利用,其质量浓度逐渐降低,同时细胞生物量、油脂产量和DHA质量浓度随发酵时间延长而不断提高,在120 h时达到最高值,分别为65.0、30.7和8.9 g/L。因此,确定适宜的发酵时间为120 h。


a) 葡萄糖和生物量
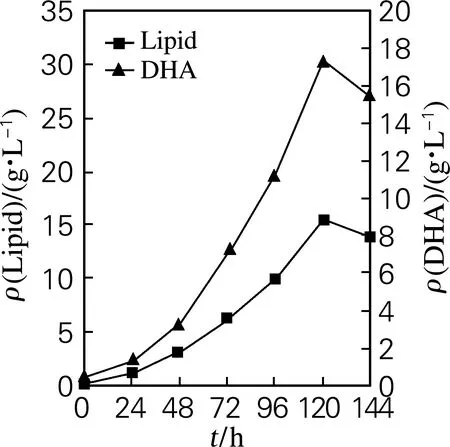
b) 脂肪酸和DHA
图7Schizochytriumsp. DP-16发酵产DHA油脂的时间进程
Fig.7 Time course of fermentation by Schizochytrium sp. DP-16 for DHA lipid production
2.3 油脂的脂肪酸组成分析
对Schizochytriumsp.DP-16油脂的脂肪酸组成进行GC-MS分析,图8为总离子色谱图。对总离子色谱图的各色谱峰选择美国国家标准研究所(NIST)标准质谱库数据系统进行检索分析,结果表明,脂肪酸甲酯对应的色谱峰保留时间为13~31min,共检出8种脂肪酸,分析结果如表2所示。结果表明,Schizochytriumsp.DP-16油脂中主要含有C14:0和C16:0两种饱和脂肪酸,不饱和脂肪酸主要包括DPA和DHA,其中DHA质量分数达28.784%。
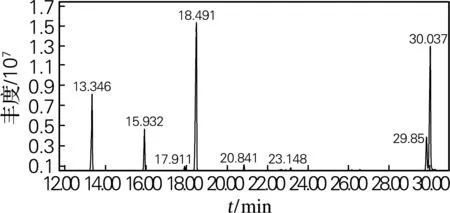
图8 Schizochytriumsp.DP-16油脂GC-MS分析的总离子色谱图
Fig.8 Total ions chromatograph profile of Schizochytrium sp. DP-16 fatty acids analyzed by GC-MS

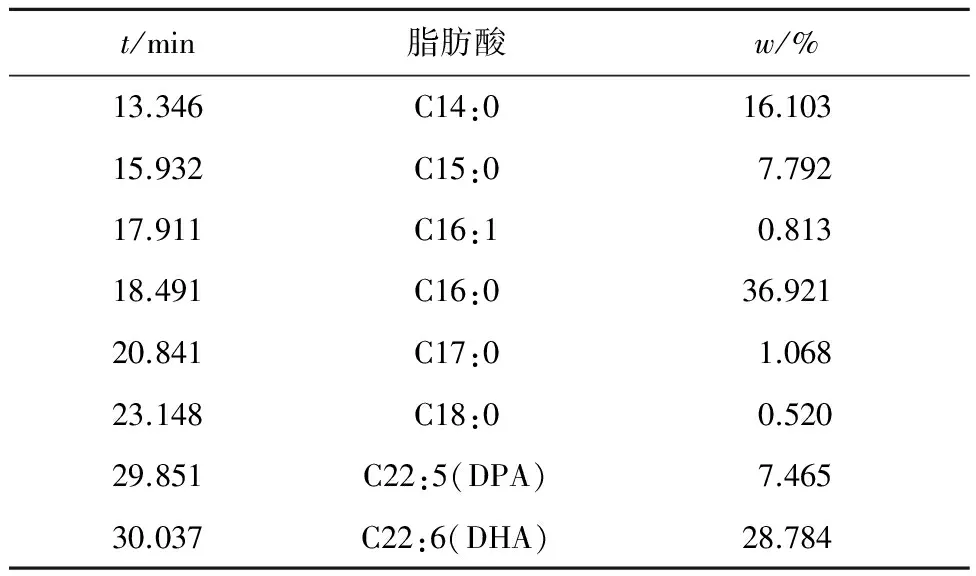
表2 Schizochytrium sp. DP-16的脂肪酸组成
3 结 论
对Schizochytriumsp. DP-16发酵产DHA的过程进行了优化,确定了其发酵培养基配方(g/L):葡萄糖110,酵母浸粉10,谷氨酸钠10,海水晶15,MgSO4·7H2O 5 ,KH2PO4·H2O 7;培养条件为种龄48 h,接种量10%,装液量250 mL 摇瓶装液30 mL,初始pH 6.0,25 ℃下培养120 h,其生物量达65.0 g/L,油脂30.7 g/L,DHA 8.9 g/L。GC-MS分析结果表明,Schizochytriumsp. DP-16油脂中主要含有C14:0和C16:0两种饱和脂肪酸,不饱和脂肪酸主要包括DPA和DHA,其中DHA质量分数达28.784%。
[1] KATAKURA M, HASHIMOTO M, SHAHDAT H M, et al. Docosahexaenoic acid promotes neuronal differentiation by regulating basic helix-loop-helix transcription factors and cell cycle in neural stem cells[J]. Neuroscience, 2009, 160(3): 651-660.
[2] SIJTSMA L, de SWAAF M E. Biotechnological production and applications of the ω-3 polyunsaturated fatty acid docosahexaenoic acid[J]. Applied Microbiology and Biotechnology, 2004, 64(2): 146-153.
[3] 冯云,魏萍,任路静,等.微生物发酵产二十二碳六烯酸代谢机理的研究进展[J].生物工程学报,2010,26(9):1225-1231.
[4] CHANG G F, WU J, JIANG C H, et al. The relationship of oxygen uptake rate and kLa with rheological properties in high cell density cultivation of docosahexaenoic acid bySchizochytriumsp. S31[J]. Bioresource Technology, 2014, 152: 234-240.
[5] QU L, JI X J, REN L J, et al. Enhancement of docosahexaenoic acid production bySchizochytriumsp. using a two-stage oxygen supply control strategy based on oxygen transfer coefficient[J]. Letters in Applied Microbiology, 2011, 52(1): 22-27.
[6] HAUVERMALE A, KUNER J, ROSENZWEIG B, et al. Fatty acid production inSchizochytriumsp.: involvement of a polyunsaturated fatty acid synthase and a type Ⅰ fatty acid synthase[J]. Lipids, 2006, 41(8): 739-747.
[7] 齐香君,苟金霞,韩戌珺,等.3,5-二硝基水杨酸比色法测定溶液中还原糖的研究[J].纤维素科学与技术,2004,12(3):17-20.
[8] 张广昊,董天飞,陈明,等.野野村放线菌Nonomuraeasp.ATCC39727脂肪酸的GC-MS分析[J].大连工业大学学报,2015,34(3):172-175.
[9] 陈丽珠.高密度培养裂殖壶菌生产二十二碳六烯[D].厦门:厦门大学,2008.
[10] 康晶,郑志永,詹晓北,等.氮源和溶氧限制对裂殖壶菌SchizochytriumlimacinumSR21合成二十二碳六烯酸的影响[J].工业微生物,2013,43(2):58-63.
[11] 谢辰.裂殖壶菌高产DHA的发酵技术研究[D].武汉:华中科技大学,2012.
周广麒,孙琳,张磊,刘会莹,孙嘉莹,王越,吴鑫惠,才迎.蓝莓酒降酸方法的比较[J].大连工业大学学报,2016,35(6): 416-419.
Optimization of fermentation process by a marine fungus strainSchizochytriumsp. DP-16 for DHA lipid production
XU Tao1, DONG Tianfei2, CHEN Ming1, FAN Shengnan1, SHI Chao1
( 1.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China; 2.Chifeng Industry Vocational Technology College, Chifeng 024005, China )
The fermentation process of Schizochytrium sp. DP-16 for DHA lipid production was optimized by single factor test, and the composition of cell fatty acids was analyzed as fatty acid methyl esters derivatives (FAMEs) by GC-MS. The results showed that the biomass, lipid production and DHA concentration could reach to 65.0, 30.7 and 8.9 g/L respectively at 120 h under optimized conditions. Eight fatty acids were detected in Schizochytrium sp. DP-16 cells by GC-MS, in which the main saturated fatty acids were C14:0 and C16:0 acid, and the main polyunsaturated fatty acids were DPA and DHA. The content of DHA in Schizochytrium sp. DP-16 cells accounted for 28.784% of the total fatty acids.
marine fungus;Schizochytriumsp.; DHA; fermentation optimization; GC-MS
2015-05-16.
辽宁省自然科学基金资助项目(2014026011).
徐 涛(1990-),男,硕士研究生;通信作者:陈 明(1979-),男,副教授.
TS225.6;Q815
A
1674-1404(2016)06-0411-05
XU Tao, DONG Tianfei, CHEN Ming, FAN Shengnan, SHI Chao. Optimization of fermentation process by a marine fungus strainSchizochytriumsp. DP-16 for DHA lipid production[J]. Journal of Dalian Polytechnic University, 2016, 35(6): 411-415.

