肉苁蓉属化学成分及生物活性研究进展
丁 燕, 张 开 梅, 苍 小 鑫, 孙 浩, 萧 伟, 朱 靖 博
( 1.大连工业大学 食品学院, 辽宁 大连 116034; 2.大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034; 3.江苏康缘药业股份有限公司, 江苏 连云港 222001 )
肉苁蓉属化学成分及生物活性研究进展
丁 燕1,2, 张 开 梅1, 苍 小 鑫1, 孙 浩1, 萧 伟3, 朱 靖 博1,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034; 2.大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034; 3.江苏康缘药业股份有限公司, 江苏 连云港 222001 )
肉苁蓉为传统补益类中药,近年来被研究发现具有广泛的生物活性作用。参考近30年国内外相关文献,综述了肉苁蓉的化学成分及生物活性。肉苁蓉属含有苯苷类(苯乙醇苷类、苯甲醇苷类)、环烯醚萜及其苷类、木质素及其苷类等,具有神经保护、抗疲劳、防治脑缺血及脑缺血再灌注损伤等作用;其中,苯乙醇苷类作为肉苁蓉中的主要活性物质在神经保护作用中起主导作用。
肉苁蓉属;化学成分;生物活性
0 引 言
肉苁蓉属为列当科多年生寄生草本植物,全世界约有20种,主要分布于欧洲、亚洲温暖的干燥地区[1]。在我国,肉苁蓉主要分布在西北部的沙漠地区,如内蒙古、新疆等[2]。中国高等植物科属检索表记载我国肉苁蓉有6种[3],后据国内学者屠鹏飞等[1,4]进一步调查后,确定为4种及1变种,分别为荒漠肉苁蓉(CistanchedeserticolaY.C.Ma,Cd)、管花肉苁蓉(C.tubulosaSchenk R. Wight,Ct)、盐生肉苁蓉(C.salsaC.A. Mey. G. Beck,Csa)、白花盐苁蓉(C.salsavar. albiflora P.F. Tu et Z.C. Lou,Csv)及沙苁蓉(C.sinensisG. Beck,Csi)。《中华人民共和国国药典》2000年版[5]收载荒漠肉苁蓉为正品药材,2010版[6]将管花肉苁蓉纳入正品药材。本文就近30年来有关肉苁蓉属的化学成分和生物活性研究进行了综述。
1 化学成分
近年来,国内外学者对肉苁蓉的化学成分进行了许多分析研究,已从中分离到化合物127个,包括苯苷类化合物64个:其中苯乙醇苷类61个,苯甲醇苷类3个、环烯醚萜及其苷类25个、木质素及其苷类13个、其他类化合物包括单萜苷类、生物碱等25个。对肉苁蓉属中各个种所分离得到的化合物进行归纳发现,从荒漠肉苁蓉(Cd)中分离出61个,管花肉苁蓉(Ct)中分离出67个,盐生肉苁蓉(Csa)中分离出17个,沙苁蓉(Csi)中分离出8个,鳔苁蓉中(Cp)分离出9个。
1.1 苯苷类
目前,从肉苁蓉属中分离得到的苯苷类化合物包括苯乙醇苷类及苯甲醇苷类。苯乙醇苷类(PhGs)成分的含量及种类是评价肉苁蓉质量的最重要指标[7-9]。PhGs具有以下特征:与苷元直接相连的内侧糖为葡萄糖;除单糖苷外,内侧葡萄糖的3位均连有鼠李糖;三糖苷中第2个葡萄糖或木糖连在内侧葡萄糖的6位;在内侧葡萄糖的4或6位还常连有咖啡酰基、阿魏酰基或香豆酰基等苯丙烯酰基类官能团。按照PhGs结构的不同,61个化合物分为A(1~55)、B(57~61)及crenatoside(56),见图1,表1、2。
Li等[10]研究管花肉苁蓉的化学成分,从中分离出3个苯甲醇苷类化合物(62~64),即salsasides A-C(图1)。
1.2 环烯醚萜及其苷类
目前为止,已从肉苁蓉属中分离出4个环烯醚萜苷元及21个环烯醚萜苷(图2、表3)。其环烯醚萜苷具有以下特征:1位连有葡萄糖;4位偶有羧基存在;6、7、8或10位常常含有羟基,或失去羟基形成双键或环氧醚键。
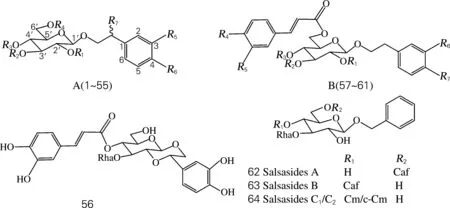
图1 肉苁蓉属苯苷类化学结构
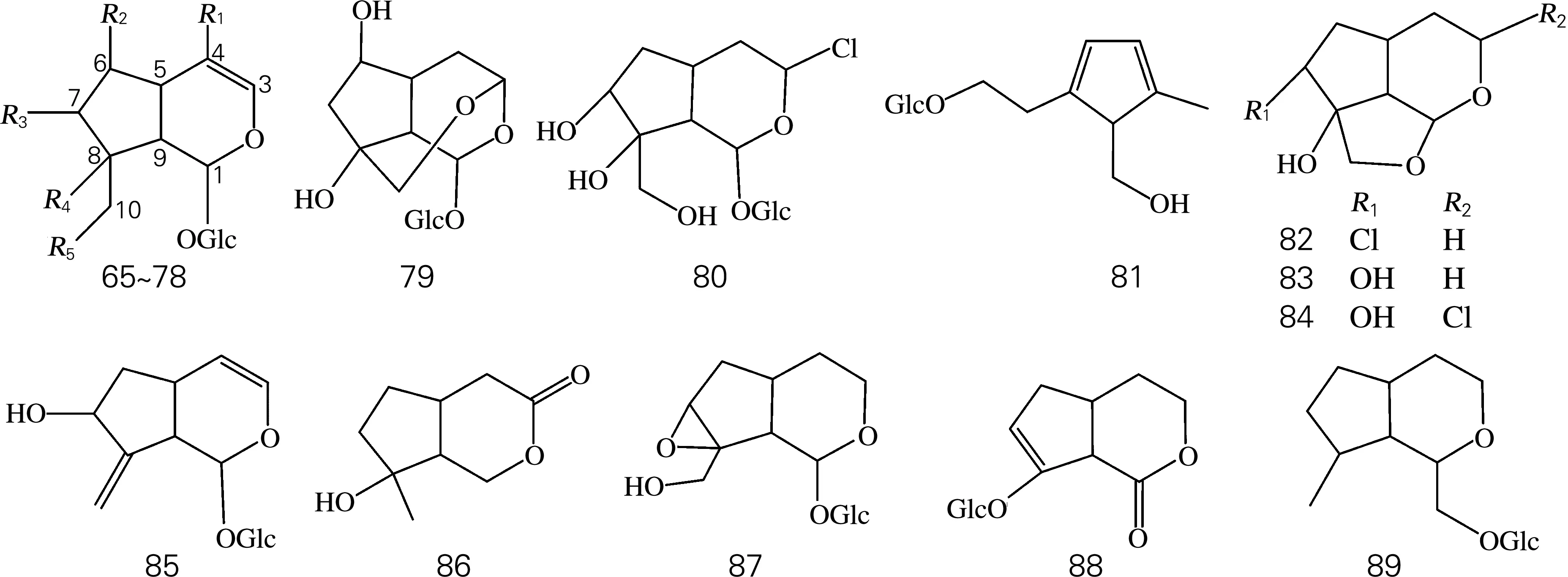
图2 环烯醚萜及其苷类化学结构

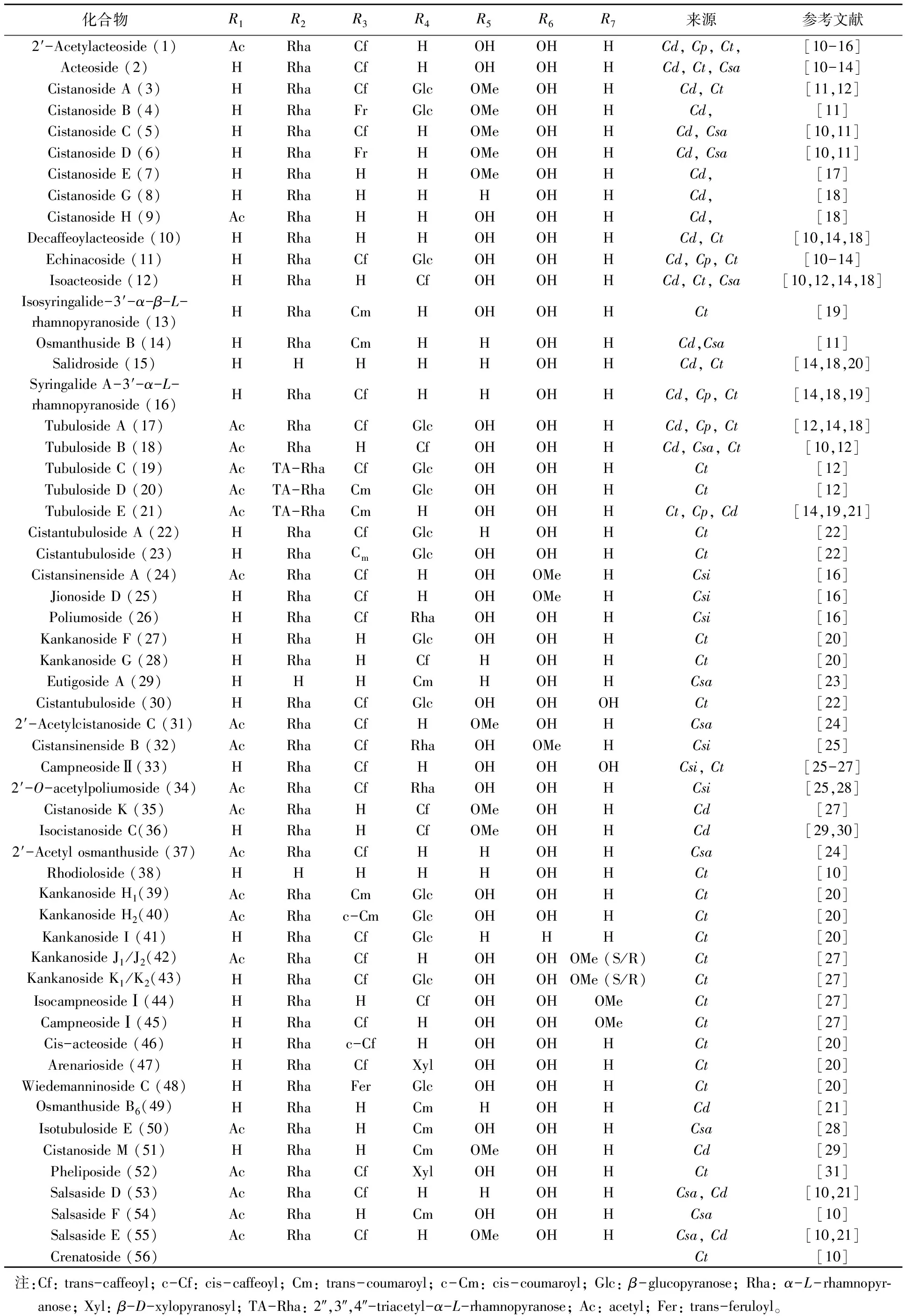
表1 以A为母核苯乙醇苷类化合物

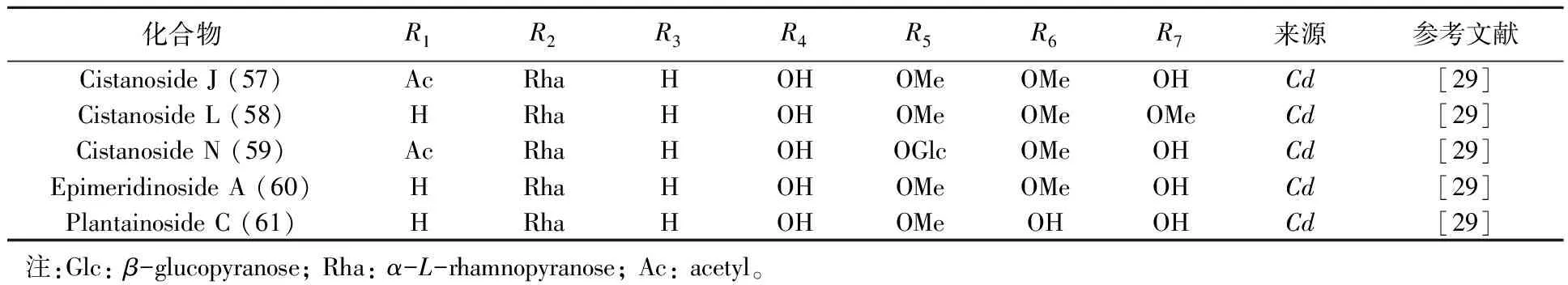
表2 以B为母核苯乙醇苷类化合物


表3 环烯醚萜及其苷类化合物
1.3 木质素及其苷类
目前从肉苁蓉中分离得到1个木质素苷元及12个木质素苷(表4、图3)。

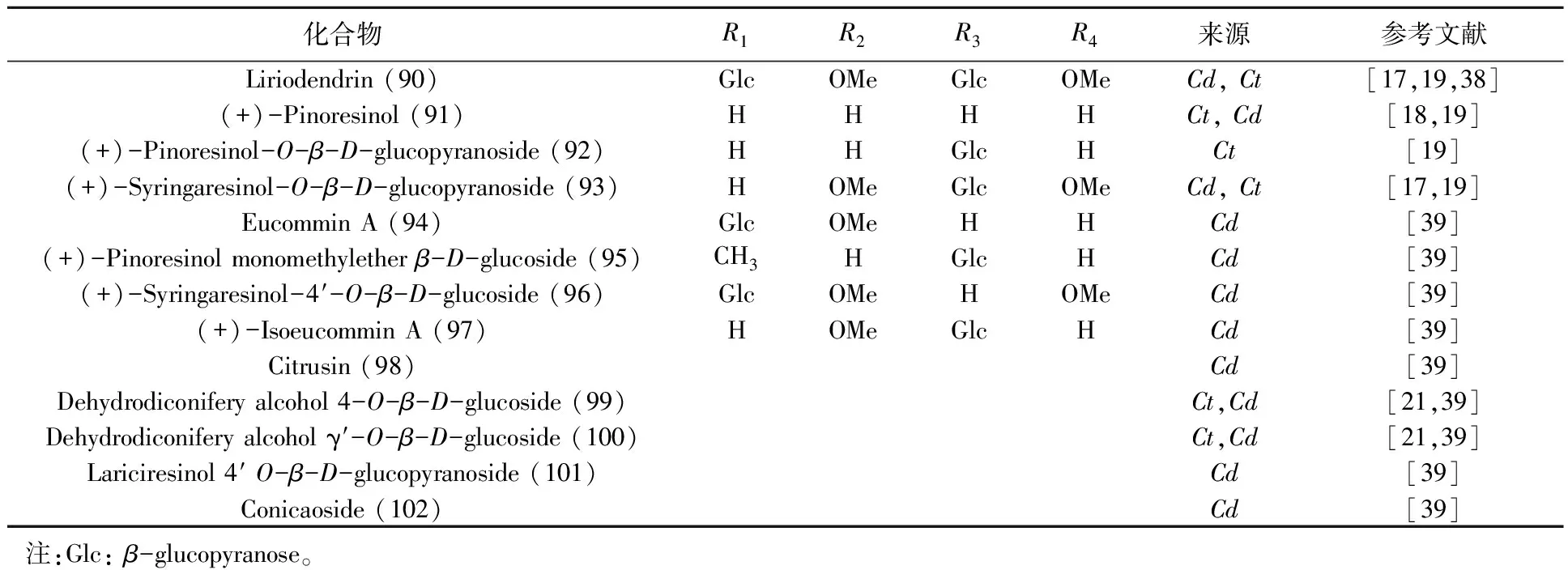
表4 木质素及其苷类化合物
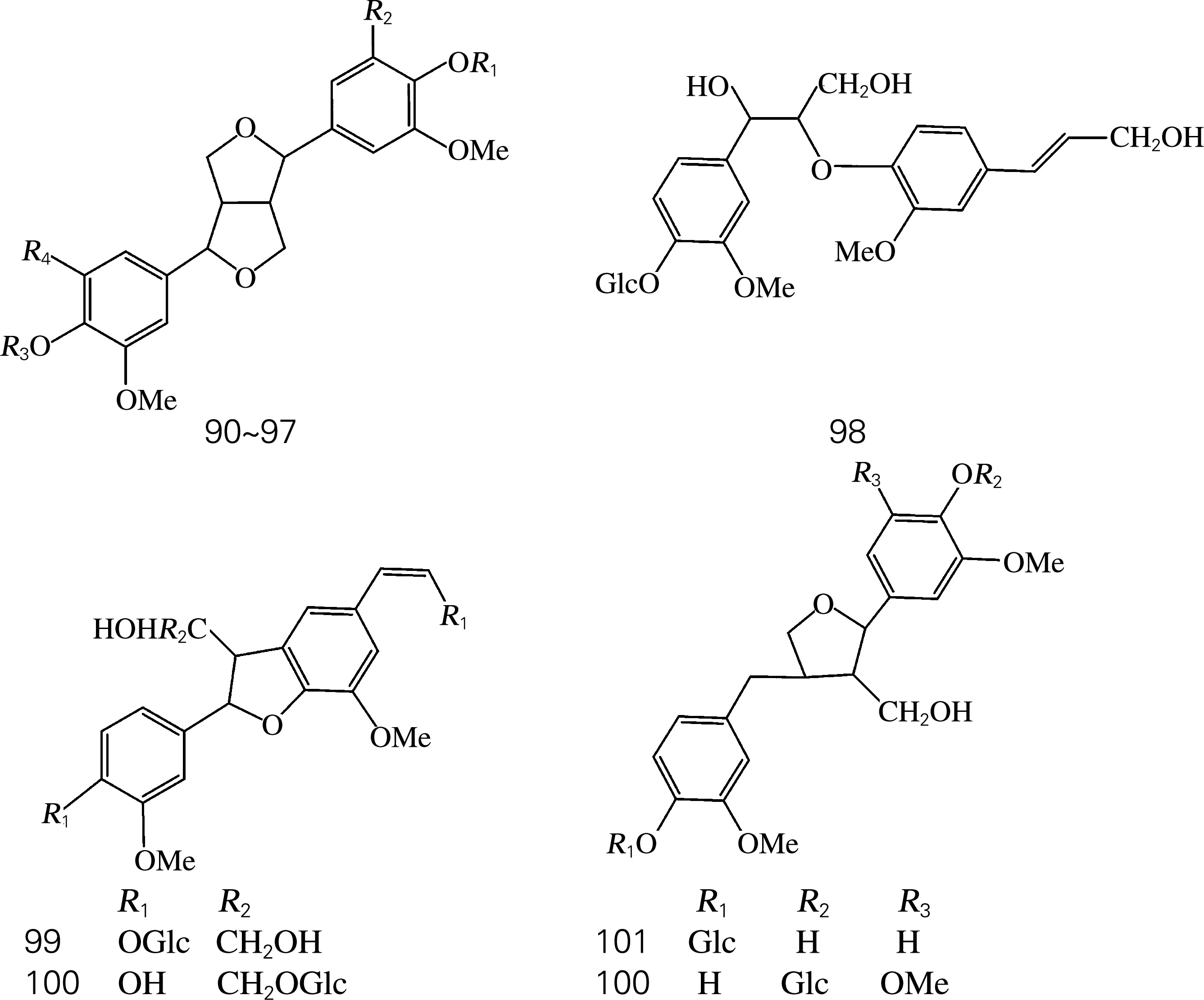
图3 木质素及其苷类化学结构
1.4 其 他
肉苁蓉属中化学成分除苯苷类、环烯醚萜及其苷类、木质素及其苷类等主要成分外,还含有单萜苷、生物碱、甾醇等成分(表5、图4)。

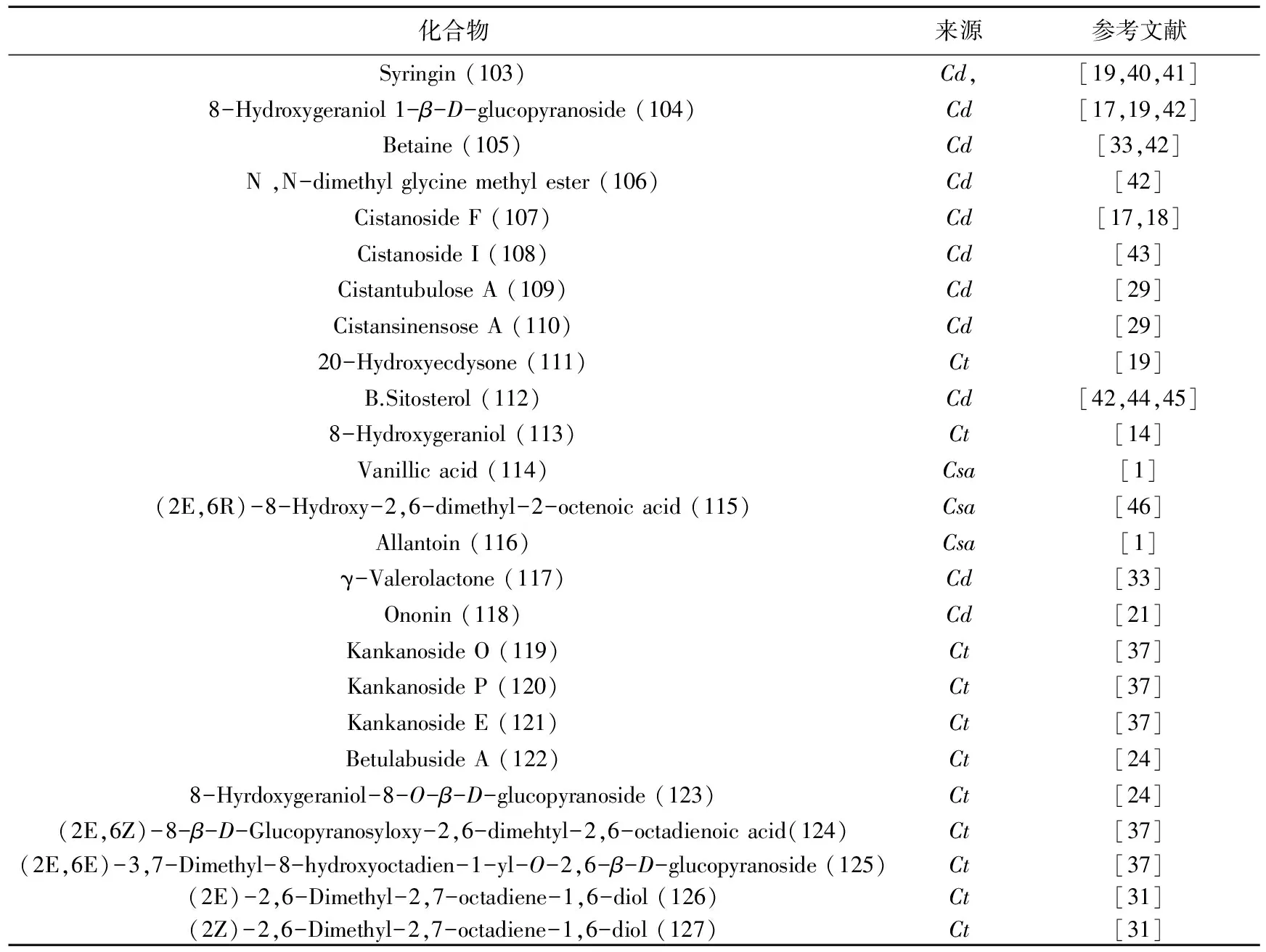
表5 其他类化合物
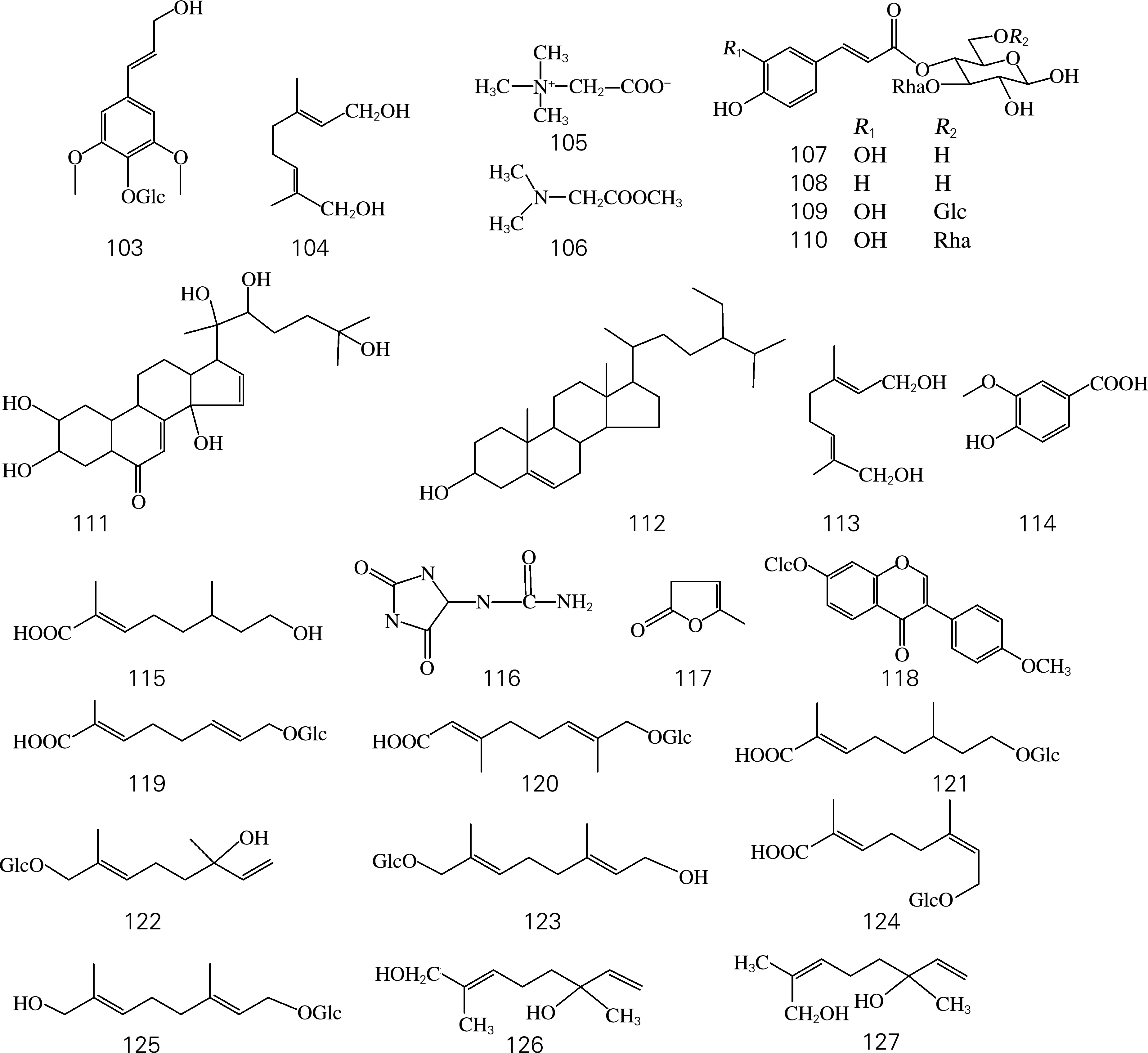
图4 其他类化学结构
2 生物活性
2.1 神经保护
阿尔兹海默病(AD)是常见于中老年人的神经系统退行性疾病,近年来国内外学者对肉苁蓉对AD的防治作用进行了广泛研究。Li等[47]通过探讨肉苁蓉胶囊对中度AD患者的防治作用,认为肉苁蓉能够提高中度AD患者的认知能力及独立生活能力,减缓海马萎缩,降低T-tau、TNF-α,IL-1β水平,暗示其具有潜在的抗AD的作用。
2.2 抗疲劳
杨宏新等[48]观察肉苁蓉对负重游泳小鼠肝脏乳酸脱氢酶同工酶、糖原及一氧化氮合酶3(NOS3)的影响,深入研究其抗运动性疲劳的作用机制,结果显示肉苁蓉可降低LDH5活性,上调NOS3的表达,促进肝糖原合成,具有肝脏保护和促进体能恢复的作用。
2.3 防治脑缺血及脑缺血再灌注损伤
王晓雯等[49]研究肉苁蓉总苷对清醒小鼠脑缺血在灌注损伤的防治作用,表明肉苁蓉总苷可显著降低脑卒中指数,缩小了脑梗死范围,提高超氧化物歧化酶(SOD)活性,降低一氧化氮合酶(NOS)活性及MDA含量,从而减轻海马CA1区的病理损伤,减少神经细胞凋亡数目,对清醒小鼠缺血再灌注损伤有明显的防治作用。
2.4 其 他
肉苁蓉还具有除神经保护、抗疲劳等主要活性外的其他生物活性。曾群力等[50]发现肉苁蓉多糖具有显著的免疫活性作用,能够促进细胞进入分裂期,推断其对小鼠胸腺淋巴细胞增殖的促进作用与其促进小鼠胸腺淋巴细胞内钙释放有关。此外,肉苁蓉还具有抗炎镇痛[29]、保护肝脏及防治肝纤维化[20]等作用。
3 结论及展望
肉苁蓉作为应用价值很高的传统中草药,素有沙漠人参之美誉。荒漠肉苁蓉及管花肉苁蓉作为药典收录的正品药材,近年来,国内外学者对其化学成分及生物活性研究逐步深入。目前从肉苁蓉属中发现的化合物主要分为三大类,即苯苷类、环烯醚萜及其苷类、木质素及其苷类。在生物活性方面,具有抗阿尔兹海默病等神经保护作用等。其中,多数学者针对苯乙醇苷类的结构及生物活性进行了深入研究,通过体内外实验证实其很可能成为抗阿尔兹海默病的新药。日后,随着相关研究的深入,肉苁蓉所含有效成分将更多地为人们所发现,并且从整体、器官、组织、细胞、分子、基因、蛋白表达等不同水平进行研究,寻找作用靶点。肉苁蓉很可能被应用于中老年神经退行性疾病等新型药物的开发,具有巨大的市场开发潜力。
[1] 张慧文.盐生肉苁蓉的化学成分及指纹图谱研究[D].呼和浩特:内蒙古医学院,2008.
[2] 何松春,施大文.中药肉苁蓉类的药源调查及原植物鉴别[J].上海医科大学学报,1995,22(3):186-188.
[3] 中国科学院植物研究所.中国高等植物科属检索表[M].北京:科学出版社,1979.
[4] 屠鹏飞,何燕萍,楼之岑.中国宁夏产盐生肉苁蓉一新变种[J].植物研究,1994,14(1):32-34.
[5] 国家药典委员会.中华人民共和国药典:2000年版[M].北京:中药医药科技出版社,2000.
[6] 国家药典委员会.中华人民共和国药典:一部[M].北京:中药医药科技出版社,2010.
[7] JIANG Y, LI S P, WANG Y T, et al. Differentiation of HerbaCistanchesby fingerprint with high-performance liquid chromatography-diode array detection-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(11): 2156-2162.
[8] LU D Y, ZHANG J Y, YANG Z Y, et al. Quantitative analysis ofCistanchesHerba using high-performance liquid chromatography coupled with diode array detection and high-resolution mass spectrometry combined with chemometric methods[J]. Journal of Separation Science, 2013, 36(12): 1945-1952.
[9] YANG Z Y, LU D Y, YAO S, et al. Chemical fingerprint and quantitative analysis ofCistanchedeserticolaby HPLC-DAD-ESI-MS[J]. Journal of Food and Drug Analysis, 2013, 21(1): 50-57.
[10] LEI L, JIANG Y, LIU X M, et al. New glycosides fromCistanchesalsa[J]. Helvetica Chimica Acta, 2007, 90(1): 79-85.
[11] KOBAYASHI H, KARASAWA H, MIYASE T, et al. Studies on the constituents ofCistanchisherba. Ⅳ. isolation and structures of two new phenylpropanoid glycosides, cistanosides C and D[J]. Chemical and Pharmaceutical Bulletin, 1984, 32(10): 3880-3885.
[12] KOBAYASHI H, OQUCHI H, TAKIZAWA N, et al. New phenylethanoid glycosides fromCistanchetubulosa(SCHRENK) HOOK. f. Ⅰ[J]. Chemical and Pharmaceutical Bulletin, 1987, 35(8): 3309-3314.
[13] OUYANG J, WANG X D, ZHAO B, et al. Effects of rare earth elements on the growth ofCistanchedeserticolacells and the production of phenylethanoid glycosides[J]. Journal of Biotechnology, 2003, 102(2): 129-134.
[14] 宋志宏,莫少红,陈燕,等.管花肉苁蓉化学成分的研究[J].中国中药杂志,2000,25(12):728-730.
[15] 宋志宏,屠鹏飞,赵玉英.管花肉苁蓉的苯乙醇苷类成分[J].中草药,2000,31(11):808-810.
[16] TU P F, SHI H M, SONG Z H, et al. Chemical constituents ofCistanchesinensis[J]. Journal of Asian Natural Products Research, 2007, 9(1): 79-84.
[17] KOBAYASHI H, KARASAWA H, MIYASE T, et al. Studies on the constituents ofCistanchisHerba. Ⅴ: isolation and structures of two new phenylpropanoid glycosides, cistanosides E and F[J]. Chemical and Pharmaceutical Bulletin, 1985, 33(4): 1452-1457.[18] XIONG Q B, KADOTA S, TANI T, et al. Antioxidative effects of phenylethanoids fromCistanchedeserticola[J]. Biological and Pharmaceutical Bulletin, 1996, 19(12): 1580-1585.
[19] YOSHIZAWA F, DEYAMA T, TAKIZAWA N, et al. The constituents ofCistanchetubulosa(SCHRENK) HOOK. f. Ⅱ. isolation and structure of a new phenylethanoid glycoside and a new neolignan glycoside[J]. Chemical and Pharmaceutical Bulletin, 1990, 38(7): 1927-1930.
[20] MORIKAWA T, PAN Y N, NINOMIYA K, et al. Acylated phenylethanoid oligoglycosides with hepatoprotective activity from the desert plantCistanchetubulosa[J]. Bioorganic and Medicinal Chemistry, 2010, 18(5): 1882-1890.
[21] 刘晓明,姜勇,孙永强,等.肉苁蓉化学成分研究[J].中国药学杂志,2011,46(14):1053-1058.
[22] TU P F, SONG Z H, SHI H M, et al. Arylethyl (= phenylethanoid) glycosides and oligosaccharide from the stem ofCistanchetubulosa[J]. Helvetica Chimica Acta, 2006, 89(5): 927-935.
[23] YANG J H, DU N S, KASIMU R. Phenylethanoid glycosides from cultivatedCistanchesalsa[J]. Journal of Chinese Pharmaceutical Sciences, 2005, 14(4): 242-245.[24] 雷厉.盐生肉苁蓉的化学成分研究及苯乙醇总苷体内药物学初探[D].沈阳:沈阳药科大学,2001.
[25] LIU X M, LI J, JIANG Y, et al. Chemical constituents fromCistanchesinensis(Orobanchaceae)[J]. Biochemical Systematics and Ecology, 2013, 47: 21-24.
[26] IMAKURA Y, KOBAYASHI S, MIMA A. Bitter phenyl propanoid glycosides fromCampsischinensis[J]. Phytochemistry, 1985, 24(1): 139-146.
[27] PAN Y N, MORIKAWA T, NINOMIYA K, et al. Bioactive constituents from Chinese natural medicines. ⅩⅩⅩⅥ. four new acylated phenylethanoid oligoglycosides, kankanosides J1, J2, K1, and K2, from stems ofCistanchetubulosa[J]. Chemical and Pharmaceutical Bulletin, 2010, 58(4): 575-578.
[28] LAHLOUB M F, ZAGHLOUL A M, El-KHAYAAT S A, et al. 2′-O-acetylpoliumoside: a new phenylpropanoid glycoside fromOrobancheramosa[J]. Planta Medica, 1991, 57(5): 481-485.
[29] NAN Z D, ZENG K W, SHI S P, et al. Phenylethanoid glycosides with anti-inflammatory activities from the stems ofCistanchedeserticolacultured in Tarim desert[J]. Fitoterapia, 2013, 89: 167-174.
[30] HAYASHI K. Studies on the constituents ofCistanchisHerba[J]. The Japanese Journal of Pharmacognosy, 2004, 58(6): 307-310.
[31] 潘英妮.管花肉苁蓉鲜品化学成分及生物活性的研究[D].沈阳:沈阳药科大学,2011.
[32] 屠鹏飞,何燕萍,楼之岑.肉苁蓉鲜花序的化学成分研究[J].中草药,1994,25(9):451-352.
[33] 屠鹏飞,何燕萍,楼之岑.栽培肉苁蓉的化学成分研究[J].天然产物研究与开发,1997,9(2):7-10.
[34] DAMTOFT S, ROSENDAL S, NIELSEN B J.13C and1H NMR spectroscopy as a tool in the configurational analysis of iridoid glucosides[J]. Phytochemistry, 1981, 20(12): 2717-2732.
[35] 李丽,时东方,桂语歌,等.肉苁蓉中苯乙醇苷化合物的抗氧化活性研究[J].安徽农业科学,2009,37(32):15835-15836.
[36] XIE H H, MORIKAWA T, MATSUDA H, et al. Monoterpene constituents fromCistanchetubulosachemical structures of kankanosides AE and kankanol[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(5): 669-675.
[37] MORIKAWA T, PAN Y N, NINOMIYA K N, et al. Iridoid and acyclic monoterpene glycosides, kankanosides L, M, N, O, and P fromCistanchetubulosa[J]. Chemical and Pharmaceutical Bulletin, 2010, 58(10): 1403-1407.
[38] LEI L, YANG F Q, ZHANG T Y, et al. Preparative isolation and purification of acteoside and 2′-acetyl acteoside fromCistanchessalsa(CA Mey.) G. Beck by high-speed counter-current chromatography[J]. Journal of Chromatography A, 2001, 912(1): 181-185.
[39] 南泽东,赵明波,姜勇,等.塔中栽培荒漠肉苁蓉中的木脂素类成分[J].中国中药杂志,2015,40(3):463-468.[40] 徐朝晖,杨松松,杨俊山,等.肉苁蓉化学成分的研究[J].中草药,1999,30(4):244-246.
[41] 薛德钧.管花肉苁蓉化学成分研究[J].中国中药杂志,1997,22(3):170-171.
[42] 曲淑惠,堵年生,金羽新,等.新疆肉苁蓉化学成分的初步研究[J].新疆医科大学学报,1986,9(2):161-162.[43] KOBAYASHI H, KARASAWA H, MIYASE T, et al. Studies on the constituents ofCistanchisherba. Ⅵ: isolation and structure of a new iridoid glycoside, 6-deoxycatalpol[J]. Chemical and Pharmaceutical Bulletin, 1985, 33(9): 3645-3650.
[44] 堵年生,周丕文,王健,等.管花肉苁蓉化学成分的研究[J].中国药科大学学报,1993,24(1):46-48.
[45] 陈妙华,刘凤山,许建萍.补肾壮阳中药肉苁蓉的化学成分研究[J].中国中药杂志,1993,18(7):424-426.[46] YAMAGUCH K, SHINOHARA C, KOJIMA S, et al. (2 E, 6 R)-8-Hydroxy-2, 6-dimethyl-2-octenoic acid, a novel anti-osteoporotic monoterpene, isolated fromCistanchesalsa[J]. Bioscience Biotechnology and Biochemistry, 1999, 63(4): 731-735.
[47] LI N, WANG J P, MA J, et al. Neuroprotective effects ofCistanchesHerba therapy on patients with moderate Alzheimer’s disease[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 12(1): 1-12.
[48] 杨宏新,杨勇,闫晓红.肉苁蓉抗运动性疲劳机制的实验研究[J].中国中医药信息杂志,2008,15(4):24-28.[49] 王晓雯,孟新珍,蒋晓燕,等.肉苁蓉总苷对清醒小鼠脑缺血再灌注损伤的保护作用[J].中国药理通讯,2003,20(3):43-43.
[50] 曾群力,郑一凡,吕志良.肉苁蓉多糖的免疫活性作用及机制[J].浙江大学学报(医学版),2002,31(4):284-287.
石晓梅,车丽辉,董秀芳,孙美玲,付颖寰.沙蜇蛋白酶解物类蛋白反应修饰及其生物活性[J].大连工业大学学报,2016,35(6):403-406.
Advance in chemical constituents and biological activity of genusCistanche
DING Yan1,2, ZHANG Kaimei1, CANG Xiaoxin1, SUN Hao1, XIAO Wei3, ZHU Jingbo1,2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China; 2.Institute of Chemistry and Applications of Plant Resources, Dalian Polytechnic University, Dalian 116034, China; 3.Jiangsu Kanion Pharmaceutical Company Limited, Lianyungang 222001, China )
Species of Cistanche has been discovered to have a wide range of biological activities as traditional Chinese herbal medicines in recent years. The objective of this study was to summary the chemical constituents of genus Cistanche, and their corresponding biological activities that reported in domestic and foreign studies over the last three decades. The chemical constituents of Cistanche mainly include phenylethylanoid glycosides (PhGs), benzyl alcohol glycosides, iridoids, lignans and their glycosides, which could regulate the nervous system and anti-fatigue, prevent cerebral ischemia and ischemia-reperfusion, in which PhGs are the main active components of Cistanche playing an important role in regulation of the nervous system.
Cistanche; chemical constituents; biological activities
2016-01-22.
辽宁省教育厅基本科研项目(2016J008);大连市高层次人才项目(2016RQ064).
丁 燕(1980-),女,讲师.
R282
A
1674-1404(2016)06-0395-08
DING Yan, ZHANG Kaimei, CANG Xiaoxin, SUN Hao, XIAO Wei, ZHU Jingbo. Advance in chemical constituents and biological activity of genusCistanche[J]. Journal of Dalian Polytechnic University, 2016, 35(6): 395-402.

