氧化苦参碱与S-腺苷蛋氨酸联合治疗酒精性肝硬化疗效观察
李 亚,程 丹,柯文炳,陈 刚
(鄂东医疗集团黄石市中医医院(市传染病医院),湖北 黄石 435000)
氧化苦参碱与S-腺苷蛋氨酸联合治疗酒精性肝硬化疗效观察
李 亚,程 丹,柯文炳,陈 刚
(鄂东医疗集团黄石市中医医院(市传染病医院),湖北 黄石 435000)
目的 评价S-腺苷蛋氨酸联合氧化苦参碱治疗酒精性肝硬化的临床疗效及安全性。方法 选择酒精性肝硬化患者60例,随机分为2组,对照组30例给予S-腺苷蛋氨酸治疗,观察组30例在对照组用药基础上联合使用氧化苦参碱,疗程均为24周,检测2组肝脏硬度值(LSM),并测定肝功能、肝纤维化指标变化情况,同时观察试验过程中出现的不良反应。结果 治疗2后2组间肝功能、肝纤维化指标及LSM情况比较有统计学意义(P均<0.05)。2组在用药期间均无严重不良事件发生。结论S-腺苷蛋氨酸联合氧化苦参碱可显著提高酒精性肝硬化临床疗效,改善肝功能,降低肝脏硬度值,减轻肝纤维化程度,是治疗酒精性肝硬化的有效方案,有临床推广应用价值。
S-腺苷蛋氨酸;氧化苦参碱;酒精性肝硬化
酒精性肝硬化(AC)是酒精性肝病(ALD)程度比较严重的一类病症类型,近年发病率有逐年上升的趋势,其治疗棘手,多预后不良。西医治疗AC对患者生活质量改善不明显[1],而中医药治疗酒精性肝病已展现出其潜在优势和特色[2-3]。S-腺苷蛋氨酸治疗可以改善AC患者的临床症状和生物化学指标,从而提高生存率[4];氧化苦参碱对各种肝病有明显的疗效,在治疗肝纤维化已得到广泛的应用[5]。因此本研究采用了S-腺苷蛋氨酸联合氧化苦参碱治疗AC患者,对治疗前后肝功能、肝纤维化指标、肝脏弹力硬度值变化情况展开分析,现报道如下。
1 临床资料
1.1 一般资料 选择2013年10月—2015年10月在我院肝病科住院首诊的AC患者60例为研究对象,符合2010年中华医学会新修订的《酒精性肝病诊疗指南》诊断标准[4],child-push分级A级。排除由肝炎病毒、自身免疫、代谢、遗传、药物、非酒精性脂肪肝病等原因引起的肝硬化及肝硬化失代偿表现。按随机原则分观察组和对照组各30例。观察组男22例,女8例;年龄41~69(55.81±14.21)岁。对照组男21例,女9例;年龄39~69(54.12±15.01)岁。2组年龄、性别、病程等一般资料比较差异无显著性意义(P均>0.05),具有可比性。所有患者同意配合检测,接受随访并签知情同意书。
1.2 治疗方法 2组均严格戒酒。对照组口服S-腺苷蛋氨酸片(思美泰)500mg/次, 每日2次。观察组在对照组处理基础上口服氧化苦参碱(苦参素胶囊)300mg/次,每日3次。2组均于治疗24周后进行临床总体治疗效果的对比分析。
1.3 观察项目 治疗前后行肝脏瞬时弹性成像技术(TE)检查肝脏硬度值(LSM)。治疗前及治疗后24周分别抽取静脉血检测肝功能指标:丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶(AST)、血清总胆红素(TBil)、γ-谷氨酰转肽酶(γ-GT)、总胆汁酸(TBA);肝纤维化指标:透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、层黏蛋白(LN)及Ⅳ型胶原(Ⅳ-C)。
1.4 疗效评定标准[5]显效:肝功能指标(TBil、ALT、AST、TBA、γ-GT)水平持续下降至正常值1.5倍; 肝纤维化血清学标志物(HA、PCⅢ、Ⅳ-C、LN)2项以上测定值较治疗前下降≥50%或恢复正常;LSM下降50%以上。有效:血清肝功能指标与治疗前比较下降≥50%,但低于正常上限值2倍以下;HA、PCⅢ、Ⅳ-C、LN有任何2项测定值较治疗前下降≥25%;LSM下降20%~50%。无效:未达到有效标准。总有效率为显效率与有效率之和。
1.5 统计学方法 应用SPSS12.5统计学学软件处理数据。计数资料比较采用2检验;计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组疗效比较 对照组显效12例(40.0%),有效13例(43.3%),无效5例(16.7%),总有效率为83.3% ;观察组显效16例(53.3%),有效12例(40.0%),无效2例(6.7%),总有效率为93.3%。2组总有效率比较差异有统计学意义(P<0.05)。
2.2 2组治疗前后患者肝功能指标比较 与治疗前相比,2组治疗后肝功能(TBil、ALT、AST、γ-GT、TBA)均显著降低(P均<0.05),且观察组下降更显著(P均<0.05)。见表1。
2.3 2组治疗前后肝纤维化指标比较 与治疗前相比,治疗后观察组HA、PCⅢ、Ⅳ-C、LN及对照组HA、PCⅢ均明显降低(P均<0.05),且观察组HA、PCⅢ、Ⅳ-C、LN较对照组下降更显著(P均<0.05)。见表2。
2.4 2组肝硬化情况比较 观察组和对照组分别有26例、25例完成LSM测定,2组治疗后LSM均显著降低(P均<0.05),且观察组显著低于对照组(P<0.05)。见表3。
2.5 不良反应 2组患者在24周疗程内均未见明显不良反应,动态观察治疗前后血常规、尿常规、电解质、肾功能及心电图均无明显变化。
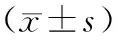
表1 2组治疗前后血清肝功能指标比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
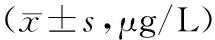
表2 2组治疗前后血清肝纤维化指标比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
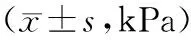
表3 2组治疗前后LSM结果比较
注: ①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
3 讨 论
AC是酒精肝病情发展到末期阶段出现的一种症状,已成为肝硬化的第二大原因[2]。过量饮酒,大量乙醇及其代谢产物乙醛、氧自由基对肝细胞引起强烈氧化应激及脂质过氧化反应和毒性作用,使肝细胞大量变性、坏死,体内腺苷蛋氨酸合成酶的活性显著下降,腺苷蛋氨酸代谢异常,加重肝脏损伤和肝纤维化,最终进展为肝硬化[6];激活肝星状细胞(HSC),HSC活化后生成大量胶原纤维,形成窦周纤维化,向汇管区扩展,然后进一步弥漫包绕肝小叶,最终导致肝硬化[7]。S-腺苷蛋氨酸已经成为酒精性肝硬化行之有效的治疗药物[8-9],主要通过补充外源性腺苷蛋氨酸,有助于肝细胞恢复乙醇引起腺苷蛋氨酸代谢异常导致的肝损害,增强胆汁分泌、流动和肝脏的解毒能力,使患者的生化指标、组织学等都得以改善。据报道,S-腺苷蛋氨酸可通过抑制内质网应激诱发的肝细胞凋亡的作用来改善酒精所致的肝损伤[10]。氧化苦参碱为常用的保肝药物之一,是从豆科槐属植物苦参中提取的一种生物碱[11]。现代药理学研究发现氧化苦参碱是含有多种肝脏药理活性的单体药物,能从多环节、多途径发挥抗肝损伤的作用,并促进胆汁分泌和黄疸消退,能对各种肝病的症状和体征起到明显改善功效,还可以通过抗炎、抗氧化应激和调节免疫等多种机制延缓肝硬化进程[12-13]。
本研究采用S-腺苷蛋氨酸联合氧化苦参碱治疗,结果显示治疗24周后观察组肝功能的迅速恢复,肝功能各项指标已基本降至正常水平显著低于对照组,与两药联用的协同促进受损肝细胞胆汁分泌功能,改善氧化应激、减少肝细胞凋亡、减轻肝脏损伤等作用有关。与对照组治疗后比较,观察组HA、PCⅢ显著降低的同时,可降低血清Ⅳ-C、LN水平, 因而有效阻止肝窦毛细血管化和窦周纤维化的进程,说明联合用药对抗纤维化、肝硬化效果更佳,其机制可能为氧化苦参碱能针对肝纤维化形成的机制进行多靴点的作用,其中主要能抑制细胞外基质(ECM)、活化的HSCs及细胞因子而起效;增加胶原酶的活性并促进胶原降解和肝细胞再生;减轻乙醇所致的肝组织病理损伤,降低自由基生成和减轻脂质过氧化,有效地减轻肝脏组织内炎症活动度及肝内胶原纤维组织增生,阻断肝细胞继续受损,阻止肝纤维化和肝硬化的发展;同时还影响许多与肝纤维化有关的功能性基因的表达,减少肝纤维化程度[14-17]。近年来,许多研究证实瞬时弹性成像技术测定肝组织弹性值与肝纤维化病理分级极其相关,是评估肝脏纤维化和肝硬化程度及观察疗效的一个很有前景的非侵入性诊断技术,对于AC的防治及预后评价均具有重要意义[18-19]。本研究结果显示,观察组在降低LSM方面明显优于对照组,进一步证实了联合用药阻滞并有效逆转肝纤维化,能显著改善肝硬化患者的肝纤维化、肝硬化病情。
总之,采用S-腺苷蛋氨酸与氧化苦参碱联合治疗AC可显著提高临床疗效,且优于对照组。其机制可能通过协同改善肝损伤及有效抑制和逆转肝纤维化阻断肝硬化的发展来发挥作用的。在用药期间患者没有发生严重不良事件,有较好的安全性,是治疗AC较为有效的方案,有临床推广应用价值。
[1] 燕丽银,刘向华. 酒精性肝硬化的临床分析[J]. 中华中西医学杂志,2011,9(1):24-25
[2] 袁晓燕. 中西药联用治疗酒精性肝病疗效观察[J]. 山东医药,2011,51(10):103-104
[3] 刘成海,吕靖,周扬. 肝硬化的中西医结合临床治疗[J]. 内科理论与实践,2015,10(4):259-262
[4] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):167-170
[5] 史丽娟,石磊,宋光耀,等. 氧化苦参碱肝脏药理作用的研究进展[J]. 世界科学技术—中医药现代化,2014,16(2):448-451
[6] 姚朝光,欧琴. 酒精性肝硬化治疗现状和研究进展[J]. 医学综述,2012,18(9):1372-1374
[7] 杨宝清. 丹参酮ⅡA治愈两例酒精性肝硬化的临床分析[J]. 中国中医药咨讯,2011,3(4):91-92
[8] 陈予. 腺苷蛋氨酸与多烯磷脂酰胆碱治疗酒精性肝硬化的疗效比较[J]. 胃肠病学和肝病学杂志,2014, 23(8):927-929
[9] 黄晓平. 思美泰治疗酒精性肝硬化及乙型病毒性肝硬化的对比研究[J]. 中华全科医学,2014,12(9):1523-1524
[10] 孙丽娜,周东方,周俊英,等. 腺苷蛋氨酸预防酒精性肝病及其作用机制探讨[J]. 中国组织化学与细胞化学杂志,2012,21(3):224-228
[11]GuoC,ZhangC,LiL,WangZ,etal.Hypoglycemicandhypolipidemiceffectsofoxymatrineinhigh-fatdietandstreptozotocin-induceddiabeticrats[J].Phytomedicine,2014,21:807-814
[12] 季晓雯,张国伟. 苦参生物碱的药理作用及临床应用[J]. 医学研究与教育,2014, 31(6):85-99
[13] 石磊,史丽娟. 中药单体—氧化苦参碱药理作用研究新进展[J]. 山西医药杂志,2015,44(2):123-126
[14] 吴洋,王洋,马学琴,等. 苦参碱对小鼠急性酒精性肝损伤的保护作用研究[J]. 亚太传统医药,2014,10(9):6-9
[15] 李南,高艳,李海讯,等. 苦参碱对大鼠慢性酒精性肝损伤肝组织病理学影响的研究[J]. 北方药学,2011,8(1):65-66
[16] 吴琴,高云. 氧化苦参碱药理作用的分子机制研究进展[J]. 中国药理学通报,2015,31(6):759-762
[17]JianYC,LiW,HeY,etal.Effectofoxymatrineonhepaticgeneexpressionprofileinexperimentalliverfibrosisofrats[J].ChinJIntegrMed,2012,18(6):445-450
[18] 瞬时弹性成像技术(TE)临床应用共识专家委员会. 瞬时弹性成像技术(TE)临床应用专家共识[J/CD]. 中国肝脏病杂志:电子版,2015,7(2):12-18
[19] 林利静,陈高峰,顾宏图,等.Fibroscan评判中医药抗肝纤维化疗效的价值[J]. 中华肝脏病杂志,2014,22(2):113-117
10.3969/j.issn.1008-8849.2016.35.033
R
B
1008-8849(2016)35-3967-03
2016-02-25

