小麦条锈菌果胶酶基因PsPL1的克隆与功能分析
李 曼,郑佩晶,怀宝玉,李 丹,康振生,刘 杰
(西北农林科技大学 a 生命科学学院,b 植物保护学院 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
小麦条锈菌果胶酶基因PsPL1的克隆与功能分析
李 曼a,郑佩晶a,怀宝玉a,李 丹a,康振生b,刘 杰a
(西北农林科技大学 a 生命科学学院,b 植物保护学院 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
【目的】 研究小麦条锈菌果胶酶基因PsPL1的功能,确定其在小麦条锈菌侵染过程中的作用,为揭示小麦与病原菌互作的分子机理奠定理论基础。【方法】 利用RACE技术扩增PsPL1基因全长,通过qRT-PCR对PsPL1的表达特征进行分析,并在酵母系统中验证其编码蛋白信号肽的分泌功能,最后通过HIGS技术沉默PsPL1基因,确定其在条锈菌侵染小麦过程中的作用。【结果】 克隆得到PsPL1基因全长,其ORF长471 bp,编码157个氨基酸;经预测PsPL1 蛋白包含一个果胶酶保守结构域,N端含有一段由21个氨基酸组成的信号肽序列;经酵母系统验证,确定PsPL1蛋白信号肽具有分泌功能;qRT-PCR分析发现,PsPL1在条锈菌侵染早期表达上调;利用HIGS技术沉默PsPL1基因后,条锈菌的产孢量没有发生明显变化。【结论】 成功克隆了小麦条锈菌果胶酶基因PsPL1,明确了其分泌特性及表达特征。
小麦条锈菌;果胶酶;qRT-PCR;分泌型;HIGS
由条型柄锈菌小麦专化型(Pucciniastriiformisf.sp.tritici)引起的小麦条锈病是我国小麦生产中的最重要病害之一。其流行性强,分布广,危害严重。小麦条锈菌为活体营养专性寄生真菌,其侵染夏孢子的过程始于夏孢子的萌发,夏孢子萌发产生芽管,沿叶表生长,遇到气孔后,顶端膨大形成附着胞,侵入气孔形成气孔下囊,长出侵染菌丝,蔓延至叶肉细胞间隙中,同时产生吸器伸入叶肉细胞内吸取养分以营寄生生活[1-3]。
条锈菌形成吸器首先要突破宿主细胞细胞壁形成的物理屏障。植物细胞壁是由果胶与纤维素、半纤维素共同组成的。研究表明,病原菌侵染过程中,植物细胞壁的降解酶类大多数都能由病原菌分泌,其中果胶酶是病原菌分泌降解植物细胞壁的主要酶。截至目前,对病原菌产生的果胶酶研究最多的是多聚半乳糖醛酸酶和果胶裂解酶[4]。
目前,有关果胶酶的研究大多集中在多种病原真菌果胶酶的致病性上。大量试验表明,病原菌引起植物腐烂就是果胶酶在起作用,它能溶解细胞壁中胶层而破坏细胞原生质,且果胶酶的活动与寄主体内的水分含量有直接关系,水分含量升高时则酶活性降低;同时,病原菌可通过一系列联合活动的酶分解细胞壁,其中果胶水解酶和裂解酶发挥了重要作用[5]。研究表明,Didymellabryoniae和Botrytiscinerea等病原真菌产生的果胶酶在病原菌侵染过程中对寄主组织的分解起重要作用[6-7]。在对炭疽菌(Colletotrichummagna)致病突变体的研究中发现,果胶裂解酶(PL)缺失是导致炭疽菌致病力缺失的主要原因[8]。Ke等[9]利用免疫胶体金技术,发现寄主细胞壁中的果胶物质在苹果腐烂菌侵染过程中被大量降解,推测果胶酶在病原菌侵染过程中起重要作用。
目前,有关小麦条锈菌果胶酶在条锈菌侵染小麦过程中的作用尚未见报道。本研究根据实验室构建的小麦条锈菌cDNA文库,对果胶酶基因PsPL1从基因克隆、表达特征、蛋白分泌功能和基因沉默四个方面进行研究,以确定其在小麦条锈菌侵染过程中的作用,为进一步揭示小麦与病原菌互作的分子机理奠定重要的理论基础。
1 材料与方法
1.1 材 料
供试条锈菌菌种为CYR31;供试小麦品种为水源11;菌种鉴定、繁殖及接种方法参照Kang等[10]的方法。大肠杆菌菌株JM109、酵母菌株 YTK12、pSUC2T7M13ORI(pSUC2)载体均为旱区作物逆境生物学国家重点实验室保存。
试剂为Taq DNA聚合酶(Thermo Scientific)、dNTP、3′-Full RACE Core Set Ver.2.0(TaKaRa)、M-MLV Reverse Transcriptase (Promega)、RNase inhibitor (Promega)、限制性内切酶(NEB)、SYBR GreenⅠ(Invitrogen),其他均为常规试剂。
1.2 基因克隆
根据旱区作物逆境生物学国家重点实验室现有的cDNA文库得到果胶酶基因序列,通过软件预测得知该序列3′端不完整,利用3′RACE技术获得全长序列,操作过程按照TaKaRa 的3′-Full RACE Core Set Ver.2.0使用说明进行。设计特异性引物PLF和PLR及3′RACE Outer Primer见表1。获得全长序列后设计ORF引物F-PLF与F-PLR(表1)得到ORF序列片段,连接至pMD-18 T-simple载体后送北京奥科鼎盛生物科技有限公司测序。

表 1 小麦条锈菌果胶酶基因克隆所用引物
1.3 序列分析
使用Vector NTI Advance软件和ORF finder online软件,分析果胶酶基因的ORF区域,将果胶酶基因氨基酸序列在NCBI中进行在线Blast分析,验证其与不同物种中同源序列的一致性;进一步利用InterProScan (http://www.ebi.ac.uk/InterProScan/)、Pfam(http://pfam.xfam.org/search)、SMART(http://smart.embl-heidelberg.de)等,分析该基因编码氨基酸序列的蛋白结构域,结合与其他物种的序列比对结果,利用MEGA软件构建进化树,分析氨基酸序列在进化中的亲缘关系;通过SignalP(http://www.cbs.dtu.dk/services/SignalP/)和PSORT等对该基因的分泌信号肽功能进行预测。
1.4PsPL1基因的表达特征分析
根据果胶酶基因PsPL1序列和内参基因(条锈菌延伸因子)PsEF,分别设计定量PCR引物qRT-PLF、qRT-PLR和PsEF-F、PsEF-R。以接种条锈菌后0,6,12,18,24,48,72,120 h的小麦条锈菌cDNA为模板,按照95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 40 s,40个循环;72 ℃延伸10 min的程序进行qRT-PCR反应,采用2-ΔΔCt法计算目标基因的相对表达量。
1.5 PsPL1蛋白信号肽的分泌功能验证
采用酵母信号肽筛选(Yeast signal peptide screen,YSST)法,验证PsPL1效应蛋白信号肽的分泌功能[11]。选用载体pSUC2T7M13ORI (pSUC2),该载体含有色氨酸合成基因和一个缺失信号肽,以及起始密码子ATG的蔗糖转化酶基因(SUC2)缺失,因此只有插入具有分泌功能的基因时,缺失的SUC2基因才能被启动表达并分泌到培养基中,将蔗糖转化为酵母生长所需的葡萄糖等。选用酵母菌株为YTK12,该菌株缺失蔗糖转化酶基因,在以蔗糖为唯一碳源的培养基上不能生长。根据SignalP(http://www.cbs.dtu.dk/services/SignalP/)和PSORT等信号肽预测软件,预测PsPL1基因的蛋白序列,设计引物S-PLF与S-PLR(表1)扩增该基因的信号肽序列,将扩增产物连接到pSUC2载体上,转入大肠杆菌,提取质粒,热转至酵母菌株YTK12,挑取在以蔗糖为碳源的CMD-W培养基上生长的阳性克隆,在以棉籽糖为碳源的YPRAA 培养基上划线验证信号肽的分泌功能。
1.6PsPL1基因沉默后的功能验证
利用HIGS技术(Host induced gene silencing),在小麦与条锈菌亲和互作中特异沉默PsPL1基因,构建由大麦条斑花叶病毒(BSMV)介导的PsPL1 HIGS载体。根据PsPL1全长序列,设计HIGS引物H-PLF与H-PLR(表1),在引物的 5′端前加上PacⅠ和NotⅠ的酶切位点。将扩增序列连接到 BSMV-γ载体上,测序确定载体构建是否成功。再将沉默载体线性化,电泳检测之后进行体外转录,当小麦长到2叶1心时接种重组病毒(BMSV:PsPL1)于小麦2叶,同时设接种空病毒(BMSV:00)和携带八氢番茄红素脱氢酶基因片段的重组病毒(BMSV:PDS)分别为空白对照和阳性对照,并设置未接种的Mock组,接种FES缓冲液,7 d左右观察染毒症状,12~14 d后接种条锈菌CYR31,分别在24,48和120 h采取第4叶,用于沉默效率检测,具体操作可参考Holzberg等[12]的方法。
2 结果与分析
2.1PsPL1基因的克隆
根据已经获得的条锈菌果胶酶基因部分cDNA序列,设计基因特异性引物,采用3′RACE方法进行扩增,根据测序结果,通过Vector NTI Advance软件和ORF finder online软件分析,得到PsPL1基因序列的完整ORF,大小为471 bp,编码157个氨基酸(图1)。
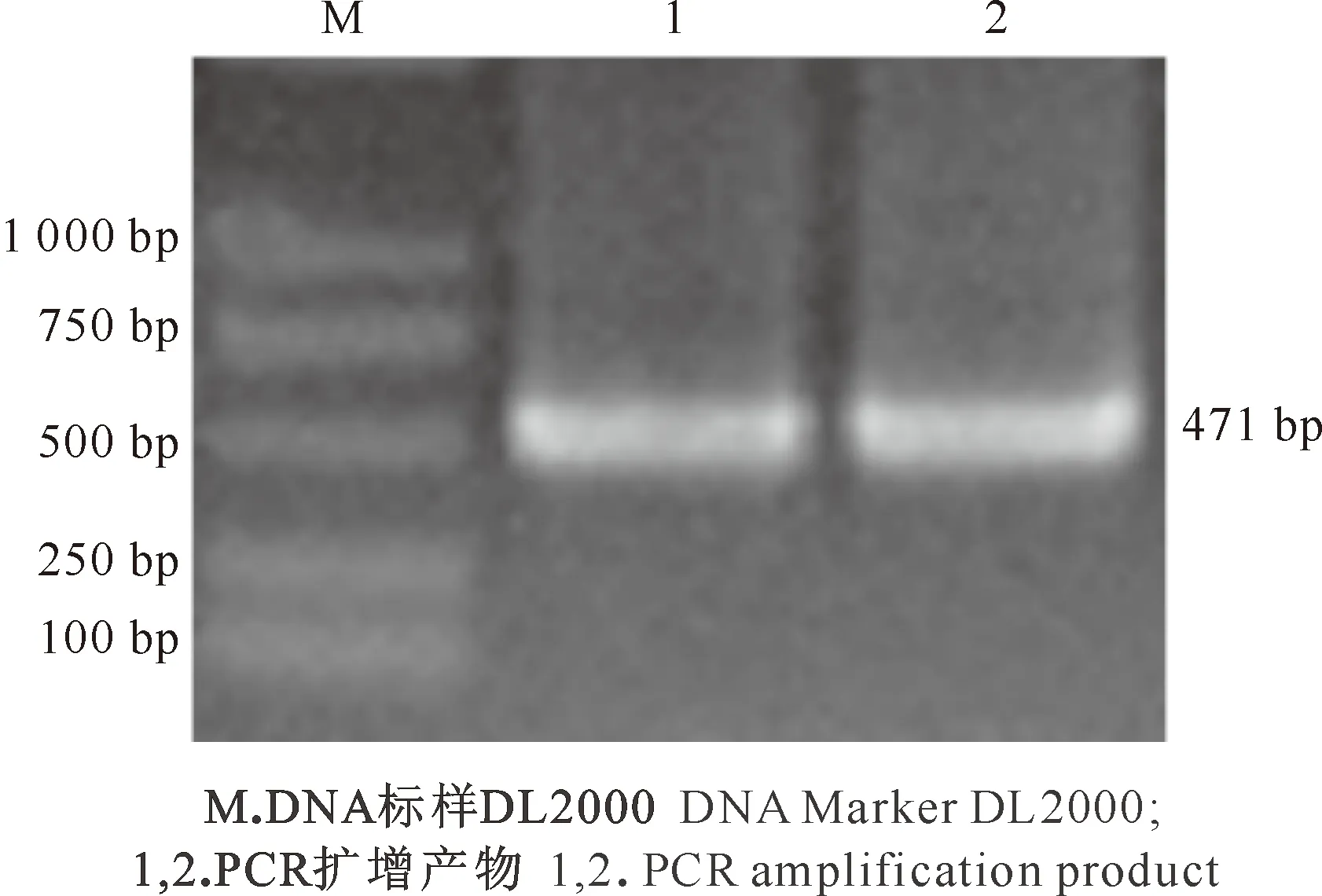
图 1 PsPL1基因ORF的PCR扩增
2.2PsPL1基因编码氨基酸序列分析
利用InterProScan预测软件对PsPL1基因编码氨基酸序列的结构域进行分析,结果显示,PsPL1蛋白序列含有果胶酶的保守功能域;在NCBI中与其他物种的序列进行Blast同源性分析,结果见图2。

图 2 PsPL1氨基酸序列与其他真菌果胶酶的进化树分析
图2显示,PsPL1氨基酸序列与其他真菌果胶酶具有高度同源性,且与小麦秆锈菌的同源性最高;通过SignalP和PSORT软件进一步分析,预测PsPL1蛋白N末端含有一段由21个氨基酸组成的信号肽序列。
2.3PsPL1基因的表达特征
为了研究PsPL1基因在小麦条锈菌侵染小麦过程中的表达模式,使用实时荧光定量PCR技术进行分析,结果见图3。由图3可以看出,PsPL1基因在孢子中的表达水平较低,接菌后表达量逐渐增高,并在12 h达到最大值,大约是孢子时期的23倍,随后表达量逐渐下降,但在18 h仍有较高水平的表达,24 h后表达量降至孢子表达水平。
2.4 PsPL1蛋白信号肽的分泌功能
含有非分泌型或分泌型蔗糖转化酶的酵母菌株在蔗糖为碳源的CMD-W培养基上能生长,但是只有携带分泌型蔗糖转化酶的酵母菌株才能在以棉籽糖为碳源的YPRAA培养基中正常生长。如图4所示,携带有空载体pSUC2或非分泌蛋白mg87的酵母不能在YPRAA培养基中生长,而含有分泌蛋白Avr1b信号肽或PsPL1信号肽的酵母转化子在YPRAA培养基中可以正常生长,表明PsPL1蛋白信号肽序列具有分泌功能。
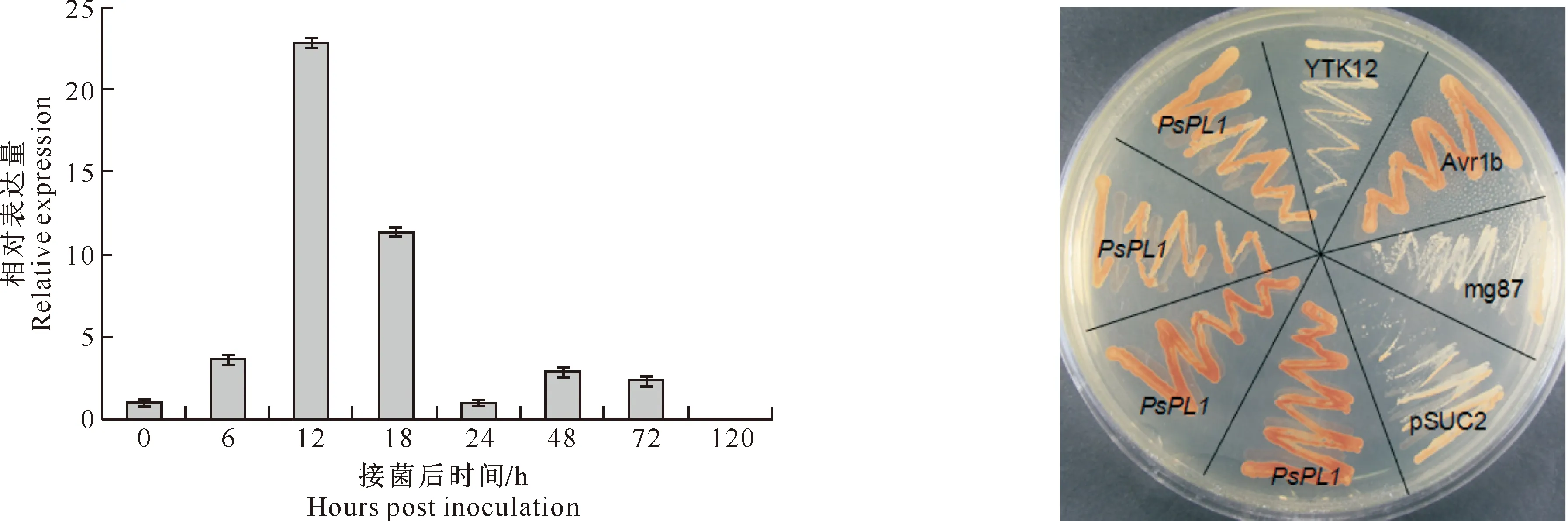
图 3 接菌不同时期PsPL1基因的表达模式
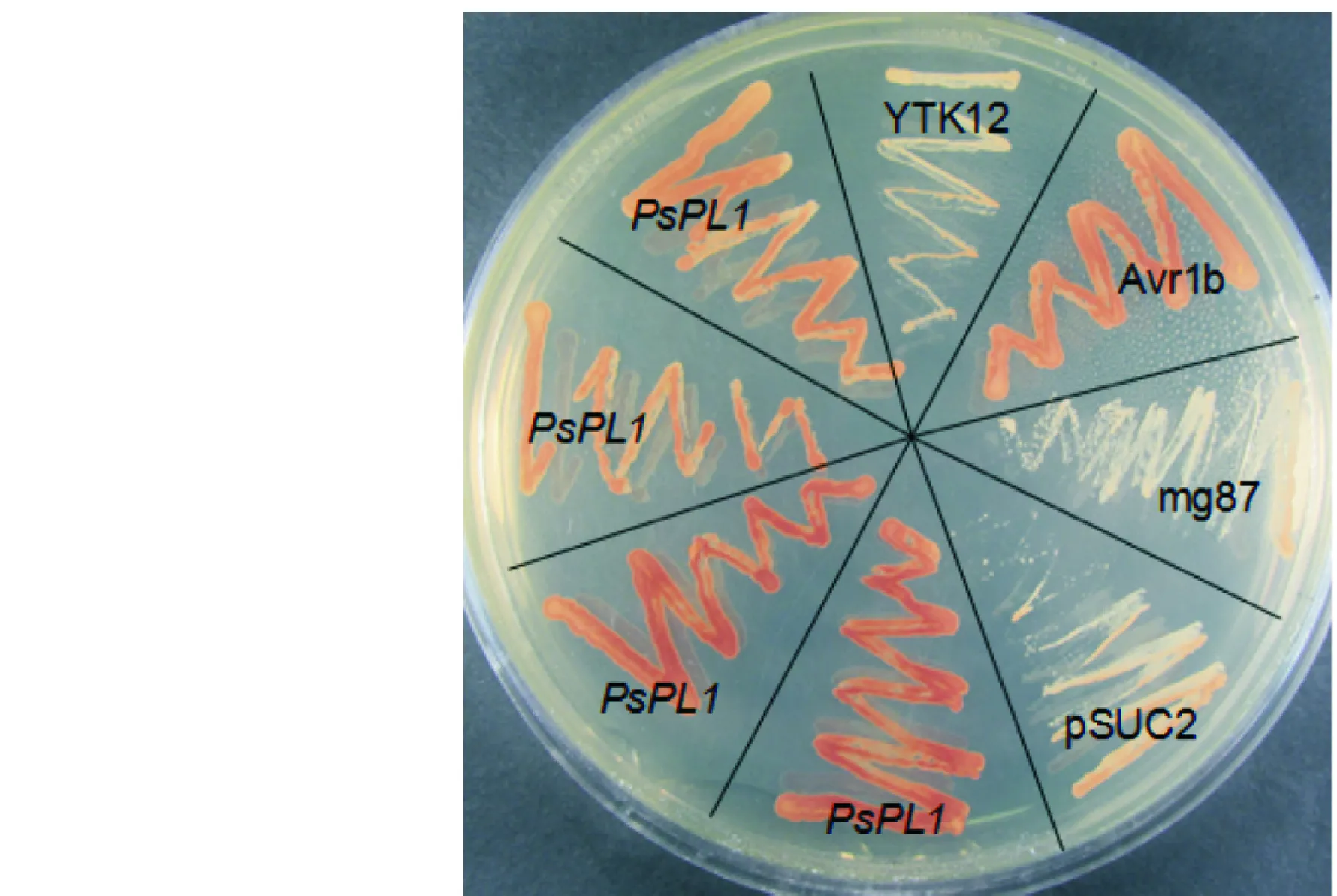
图 4 PsPL1蛋白信号肽的分泌功能验证

A.接种病毒7 d后观察到的染毒症状,其中接种BSMV:PDS的小麦叶片光漂白明显;B.接种毒性小种CYR31后小麦叶片的反应型特征
通过qRT-PCR,检测PsPL1基因在条锈菌CYR31侵染小麦叶片 24,48和120 h后,以被空病毒(BSMV:00)侵染叶片中PsPL1基因的表达量为参照,衡量重组病毒侵染叶片中PsPL1基因的表达水平,结果(图6)表明,在接种 BSMV:PsPL1的小麦叶片中,PsPL1 基因的表达水平与接种空病毒载体的叶片相比明显下降;其中,接种24 hPsPL1基因表达已经开始下调,下调幅度约为60%,48 h目的基因表达水平下调幅度约为80%,120 h基因表达水平下调幅度约为70%,说明病毒在处理后期毒性逐渐减弱,沉默效率缓慢恢复。表达量检测结果表明,利用HIGS技术,PsPL1基因说明表达被部分沉默。

*.P<0.05
3 讨 论
条锈菌穿透宿主细胞壁是侵染小麦的关键步骤,而果胶酶是降解宿主细胞壁的主要酶。本研究通过RACE技术得到了小麦条锈菌果胶酶基因PsPL1的全长cDNA序列,其编码蛋白序列含有完整的果胶酶结构域;Blast分析发现,PsPL1与秆锈菌及叶锈菌的果胶酶蛋白高度同源,表明该基因的编码蛋白为果胶酶。
PsPL1基因在条锈菌侵染12~24 h表达量较高。同时,利用酵母信号肽验证系统确定PsPL1为分泌蛋白。根据康振生等[13-16]的研究报道,接种6~8 h后条锈菌的夏孢子在寄主表面萌发产生芽管,趋向气孔,12 h后侵入气孔,形成气孔下囊,产生初生侵染菌丝,初生侵染菌丝向气孔周围的叶肉细胞生长,形成吸器母细胞,与寄主细胞壁相接触,形成入侵栓穿透寄主细胞壁,并继续在寄主细胞内延伸,接种24 h左右其顶端部分逐渐膨大而成吸器,因此,推测条锈菌在侵染过程中可能通过分泌PsPL1帮助降解宿主细胞壁进而形成吸器。
本研究利用HIGS技术沉默PsPL1,然后接种条锈菌,观察PsPL1沉默对条锈菌侵染的影响。结果发现,PsPL1的表达下调并没有对条锈菌的侵染产生明显影响,推测可能还有其他的家族基因参与侵染过程,PsPL1沉默产生的影响能够通过其他家族基因的参与得到补偿,因此条锈菌的侵染及产孢量并没有发生明显的变化。具体有哪些基因参与了此过程,还有待进一步研究。
[1] Hahn M.The rust fungi:cytology,physiology and molecular biology of infection [J].Fungal Pathology,2000,9:267-306.
[2] Kang Z S,Huang L L,Buchenauer H.Ultrastructural changes and localization of lignin and callose incompatible and incompatible interactions between wheat andPucciniastriiformis[J].Plant Dis Protect,2002,109:25-37.
[3] Kang Z S,Huang L L,Buchenauer H.Subcellular localization of chitinase and β-1,3-glucanase in compatible and incompatible interactions between wheat andPucciniastriiformisf.sp.Tritici[J].Plant Dis Protect,2003,110:170-183.
[4] Markovic O,Janecek S.Pectin degrading glycoside hydrolases of family 28:sequence-structural features,specificities and evolution [J].Protein Engineering,2001,14(9):615-631.
[5] Schena M,Shalon D,Davis R W,et al.Quantitative monitoring of gene expression patterns with a complementary DNA microarray [J].Science,1995,270(5235):467-470.
[6] Reignault P,Kunz C,Delage N,et al. Host-and symptom-specific pectinase isozymes produced byBotrytiscinerea[J].Mycological Research,2000,104(4):421-428.
[7] Zhang J,Bruton B,Miller M,et al.Relationship of developmental stage of cantaloupe fruit to black rot susceptibility and enzyme production byDidymellabryoniae[J].Plant Disease,1999,83:1025-1032.
[8] Wattad C,Freeman S,Dinoor A,et al.A nonpathogenic mutant ofColletotrichummagnais deficient in extracellular secretion of pectate lyase [J].Molecular Plant-Microbe Interactions,1995,8(4):621-626.
[9] Ke X,Huang L,Han Q,et al.Histological and cytological investigations of the infection and colonization of apple bark byValsamalivar.Mali[J].Australasian Plant Pathology,2013,42(1):85-93.
[10] Kang Z S,Li Z Q.Discovery of a normal T.type new pathogenic strain to Lovrin 10 [J].Acta Cllegii Septentrionali Occidentali Agricuhurae,1984,4:18-28.
[11] Link T,Voegele R T.Secreted proteins ofUromycesfabae:similarities and stage specificity [J].Molecular Plant Pathology,2008,9(1):59-66.
[12] Holzberg S,Brosio P,Gross C,et al.Barley stripe mosaic virus-induced gene silencing in a monocot plant [J].Plant Journal,2002,30:315-327.
[13] 康振生,李振岐,商鸿生,等.小麦条锈菌吸器母细胞超微结构的研究 [J].真菌学报,1994a,13(1):52-57.
Kang Z S,Li Z Q,Shang H S,et al.Ultrastructure of haustorial mother cell of wheat stripe rust [J].Mycosystema,1994a,13(1):52-57.
[14] 康振生,李振岐,Chong J,等.小麦条锈菌吸器超微结构和细胞化学的研究 [J].真菌学报,1994b,13(1):52-57.
Kang Z S,Li Z Q,Chong J,et al.Ultrastructure and cytochemistry of haustorium of wheat stripe rust [J].Mycosystema,1994b,13(1):52-57.
[15] 康振生.植物病原真菌的超微结构 [M].北京:中国科学技术出版社,1995.
Kang Z S.Ultrastructure of plant pathogenic fungi [M].Beijing:Science and Technology of China Press,1995.
[16] 康振生,王 瑶,黄丽丽,等.小麦品种对条锈病低反应型抗性的组织学和超微结构研究 [J].中国农业科学,2003,36(9):1026-1031.
Kang Z S,Wang Y,Huang L L,et al.Histology and ultrastructure of incompatible combination betweenPucciniastriiformisand wheat cultivars with resistance of low reaction type [J].Scientia Agricultura Sinica,2003,36(9):1026-1031.
Cloning and functional analysis ofPsPL1 fromPucciniastriiformisf.sp.tritici
LI Mana,ZHENG Peijinga,HUAI Baoyua,LI Dana,KANG Zhenshengb,LIU Jiea
(aCollegeofLifeSciences,bCollegeofPlantProtection,SateKeyLaboratoryofCropStressBiologyforAridAreas,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study investigated the role of pectin enzyme genePsPL1 fromPucciniastriiformisf.sp.triticiand determined its function in wheat stripe rust infection to provide theoretical foundation for the molecular mechanism of wheat and pathogen interactions.【Method】 RACE and qRT-PCR technology were used to amplifyPsPL1 length gene and analyze its expression pattern.Then, its secretion system in yeast was verified and HIGS technology was used to silencePsPL1 gene and determine its role in wheat rust infection.【Result】 This study obtained the full-length ofPsPL1 with ORF of 471 bp encoding 157 amino acids.The PsPL1 protein contained a conserved pectin lyase domain and a signal peptide with 21 amino acids on the N-terminal,which had secretion function.Gene expression analysis suggested thatPsPL1 was up-regulated during the early infection.The sporulation quantity had no significant change after knocking downPsPL1 by HIGS.【Conclusion】PsPL1 gene has been cloned successfully,and its secretion function and expression characteristics were determined.
Pucciniastriiformisf.sp.tritici;pectin lyase;qRT-PCR;secretion type;HIGS
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.022
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.044.html
2015-09-01
国家自然科学基金项目(31000078);中央高校基本科研业务费项目(QN2011027)
李 曼(1988-),女,陕西户县人,在读硕士,主要从事植物与病原菌互作分子病理研究。 E-mail:sweet_lemon0718@163.com
刘 杰(1979-),男,黑龙江大庆人,副教授,博士,主要从事植物与病原菌互作分子机理研究。 E-mail:neauliu@sina.com
S435.121.4+2
A
1671-9387(2016)11-0155-06

