纳米二氧化钛皮肤暴露对小鼠脑和血管的毒性研究
郭 晴,刘志敏,李潇潇,赵 云,沈世平,蔡 洁,袁均林,杨 旭,李 睿
(华中师范大学生命科学学院 湖北省遗传调控和整合生物学重点实验室,湖北 武汉 430079)
纳米二氧化钛皮肤暴露对小鼠脑和血管的毒性研究
郭 晴,刘志敏,李潇潇,赵 云,沈世平,蔡 洁,袁均林,杨 旭,李 睿
(华中师范大学生命科学学院 湖北省遗传调控和整合生物学重点实验室,湖北 武汉 430079)
为研究纳米二氧化钛(nano-TiO2)对小鼠脑和血管的毒性,将56只小鼠随机分为8组,每组7只,分别为control、solvent control、4 mg·kg-1nano-TiO2、20 mg·kg-1nano-TiO2、100 mg·kg-1nano-TiO2、500 mg·kg-1nano-TiO2、100 mg·kg-1维生素E(VE)+100 mg·kg-1nano-TiO2和100 mg·kg-1VE+500 mg·kg-1nano-TiO2,采用皮肤涂抹的方式,对小鼠进行连续42 d暴露。结果表明:4 mg·kg-1nano-TiO2和20 mg·kg-1nano-TiO2对小鼠的大脑毒性和血管损伤较低,100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2对小鼠的大脑毒性和血管损伤明显,暴露中VE的添加对nano-TiO2给脑和血管造成的损伤具有一定的缓解作用。初步证明nano-TiO2皮肤暴露在一定剂量下可对小鼠脑和血管引起毒性作用,其原因可能为氧化损伤。
纳米二氧化钛;毒性;小鼠;皮肤暴露
随着纳米技术的发展,越来越多的纳米材料应用到药载系统、抗菌材料、化妆品以及电子产品中[1-2]。TiO2是一种常见的纳米材料,具有极强的催化能力、较小的尺寸[3]以及紫外吸收[4]等特点,被作为防晒霜中的一种保护成分。随着防晒霜的使用越来越普遍,TiO2对人体的安全性问题逐渐引起了研究者的关注。有研究者认为TiO2不能穿过完整的皮肤屏障。如Sadrieh等[5]将微米级TiO2、纳米级TiO2以及用氢氧化铝和二甲聚乙烷聚合物修饰过的nano-TiO2,以2mgcream/cm2的浓度涂抹于小型猪的皮肤上,结果表明nano-TiO2颗粒不能穿过完整的表皮。但是也有研究证明nano-TiO2可以穿过皮肤。如人的包皮被移植到严重联合免疫缺陷小鼠上,利用透射电子显微镜和质子激发X荧光光谱分析法,观察到nano-TiO2颗粒可进入到达皮肤的角质层[6]。Wu等[7]将nano-TiO2暴露于离体的猪皮24h,结果表明nano-TiO2没有穿过皮肤的角质层;但是将nano-TiO2涂抹到活体猪耳朵上30d,发现nano-TiO2可以穿过猪的角质层,且最终分布到较深的表皮层;此外将nano-TiO2颗粒涂抹于裸小鼠的皮肤上,nano-TiO2可穿过皮肤进入不同的组织,并可引起一些组织损伤。这些结果表明nano-TiO2长时间暴露于人的皮肤,有可能对人体造成损伤。
纳米颗粒可以通过各种途径进入血液进而到达各个组织器官[8]。Liu等[9]研究表明,nano-TiO2通过腹腔注射后可以经血液循环进入大脑。Hu等[10]利用灌胃方式将nano-TiO2暴露于小鼠,结果表明nano-TiO2长期低剂量的暴露,有可能对小鼠大脑造成损伤。此外,nano-TiO2还可以通过呼吸系统进入大脑[11]。因此,化妆品中的nano-TiO2是否会穿过皮肤经血液循环进入大脑,对人的血管系统和大脑造成危害值得探讨。作者采用皮肤涂抹的方式将nano-TiO2暴露于小鼠42d,探究nano-TiO2对小鼠脑和血管的影响。
1 实验
1.1 材料、试剂与仪器
无特定病原体(specific pathogen free,SPF)雌性BALB/c小鼠,湖北省预防医学科学院动物实验中心。
nano-TiO2(白色粉末,含量85%~90%),江苏河海纳米科技股份有限公司;2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)、硫代巴比妥酸(TBA)、5,5′-二硫代双(2-硝基苯甲酸)(DTNB),Sigma-Aldrich公司;维生素E(VE),国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒,碧云天公司;小鼠血栓调节蛋白酶联免疫吸附检测试剂盒、小鼠可溶性细胞粘附因子1酶联免疫吸附检测试剂盒、小鼠D-二聚体酶联免疫吸附试剂盒,上海蓝基生物科技有限公司;小鼠IL-4酶联免疫吸附检测试剂盒、小鼠IFN-γ酶联免疫吸附检测试剂盒、小鼠IgE酶联免疫吸附检测试剂盒,eBioscience公司。
Eppendorf 5415R型低温冷冻离心机,Beckman公司;-20 ℃冰箱、玻璃匀浆器,广东科龙公司;-80 ℃超低温冰箱,日本Sanyo公司;ML-902型定时恒温磁力搅拌器,上海浦江分析仪器厂;FLx800型荧光酶标分析仪,北京普朗新技术有限公司;JN-3200DT型超声处理器,宁波江南仪器厂。
1.2 方法
1.2.1 染毒方式
56只6周龄SPF级雌性BALB/c小鼠随机分为8组,每组7只,分别为control、solvent control、4 mg·kg-1nano-TiO2、20 mg·kg-1nano-TiO2、100 mg·kg-1nano-TiO2、500 mg·kg-1nano-TiO2、100 mg·kg-1VE+100 mg·kg-1nano-TiO2和100 mg·kg-1VE+500 mg·kg-1nano-TiO2。分组之后先进行一周的实验室环境饲养,然后每天对小鼠进行脱毛处理。按0.01 mL·(g体重)-1对小鼠进行皮肤涂抹染毒,染毒周期为42 d。nano-TiO2用溶剂进行配制,实验前用超声处理器进行超声分散,VE用生理盐水配制,染毒期间小鼠均可自由进水进食。
1.2.2 脑组织样品制备
第42 d染完毒24 h后,先对小鼠进行心脏取血,然后取出脑置于冰上,按10 mL·g-1添加PBS溶液(pH=7.5)。使用玻璃匀浆器配制成脑组织匀浆。将脑组织匀浆在4 ℃、10 000 r·min-1的条件下离心10 min,收集上清液置于-80 ℃冰箱保存。
1.2.3 活性氧簇(ROS)含量的测定
ROS含量采用DCFH-DA[12]法进行检测。DCFH-DA本身不具备荧光特征,但其可进入细胞,在胞内被水解产生DCFH,DCFH可与胞内的ROS发生反应,被氧化生成DCF,DCF具有荧光特征,其荧光强弱将间接地反映细胞内ROS含量的多少。
实验步骤如下:用PBS溶液(pH=7.5)将匀浆上清液稀释100倍;用排枪取100 μL稀释液加入酶标板中;加入100 μL荧光染料染色,避光反应20 min;利用荧光酶标仪测出485 nm激发光、525 nm发射光下的荧光强度。
1.2.4 丙二醛(MDA)含量的测定
采用TBA法测定MDA的含量[13]。MDA能够与TBA反应缩合形成红色产物,通过吸光值的测定可以计算出MDA的含量。
实验步骤如下:取500 μL匀浆上清液于试管中,加入2 mL 0.6 % TBA,沸水浴15 min;取1 mL 上清液于EP管中,100 000×g离心5 min;取100 μL上清液于酶标板中;用酶标仪测出532 nm、600 nm和450 nm波长处的吸光值,按照下式计算MDA的含量(μmoL·g-1):MDA含量 = 6.45× (OD532-OD600)-0.56×OD450。
1.2.5 谷胱甘肽(GSH)含量的测定
采用DTNB法测定GSH含量[14]。DTNB可以在黑暗的条件下与GSH反应形成黄色化合物TNB。
实验步骤如下:取200 μL匀浆上清液,加入1 mL有机溶剂(V氯仿∶V正丁醇=4∶1),用涡旋仪混合均匀,在冰上静置10 min后,100 000×g离心5 min;在不破坏蛋白层的情况下,取上清液50 μL加入酶标板,加150 μL浓度为60 ng·mL-1的DTNB,室温下避光反应5 min;用酶标仪测出412 nm波长处的吸光值。
1.2.6 脑组织IL-4和IFN-γ含量的测定
实验原理:采用双抗夹心法ELISA来检测抗原。将纯化的抗小鼠IL-4和IFN-γ(一抗)预先包被在酶标板每个微孔底部,使其充分吸附在固相载体上,加入待测样品或标准品,待测物质与抗体结合后,加入酶标二抗,待二抗与待测物质结合后,加入酶反应底物,充分显色后终止反应,通过检测吸光值绘制标准曲线,计算出样品中待测物质的含量。
取匀浆上清液测定其中IL-4和IFN-γ的含量,按照成品ELISA试剂盒步骤完成测定内容。
1.2.7 血清中TM、sICAM-1、D2D和Ig-E含量的测定
实验原理同1.2.6。
取匀浆上清液测定其中TM、sICAM-1、D2D和Ig-E的含量,按照成品ELISA试剂盒步骤完成测定内容。
1.3 统计分析
数据采用Origin 6.1统计软件进行t检验处理,比较暴露组与对照组测量值的差异:P<0.05为差异显著,P<0.01为差异极显著。利用Prism进行作图。
2 结果与讨论
2.1 nano-TiO2的形态特征(图1)

图1 nano-TiO2的扫描电子显微镜(SEM)照片
由图1可知,nano-TiO2在SEM下呈片层结构,粒径约为15~40 nm,表面光滑。本防晒剂用nano-TiO2对可见光具有很高的透过性,对紫外线有很好的阻隔作用,广泛适用于美白润肤露、美白面霜、防晒霜等化妆品中。
2.2 nano-TiO2暴露后小鼠脑组织氧化应激指标的测定(图2)
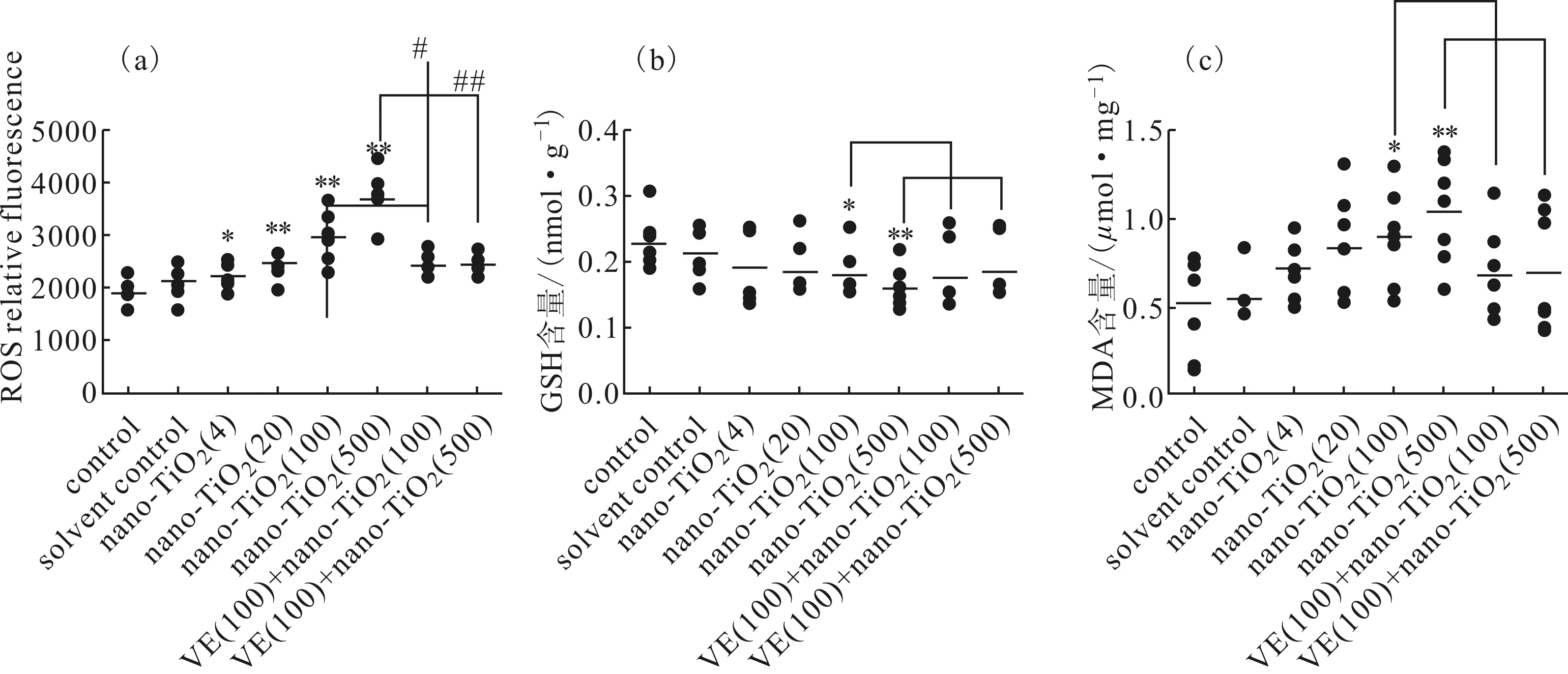
图2 nano-TiO2暴露后小鼠脑组织氧化应激指标的测定
由图2a可知,小鼠脑组织中ROS含量随nano-TiO2暴露量的增加逐渐升高,与对照组相比,4 mg·kg-1nano-TiO2暴露组ROS含量显著升高 (P<0.05),20 mg·kg-1nano-TiO2、100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2暴露组的ROS含量分别出现极显著升高 (P<0.01);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组与100 mg·kg-1nano-TiO2暴露组相比,ROS含量出现显著性下降(P<0.05);100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与500 mg·kg-1nano-TiO2暴露组相比,ROS含量出现极显著性下降(P<0.01)。
由图2b可知,小鼠脑组织中GSH含量随nano-TiO2暴露量的增加逐渐降低,与对照组相比,100 mg·kg-1nano-TiO2暴露组GSH含量显著降低 (P<0.05),500 mg·kg-1nano-TiO2暴露组GSH含量极显著降低 (P<0.01);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组、100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与相应的100 mg·kg-1nano-TiO2暴露组、500 mg·kg-1nano-TiO2暴露组相比,GSH含量都呈升高的趋势,但是无统计学意义。
由图2c可知,小鼠脑组织中MDA含量随nano-TiO2暴露量的增加逐渐升高,与对照组相比,100 mg·kg-1nano-TiO2暴露组的MDA含量显著升高 (P<0.05);500 mg·kg-1nano-TiO2暴露组的MDA含量极显著升高 (P<0.01);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组、100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与相应的100 mg·kg-1nano-TiO2暴露组、500 mg·kg-1nano-TiO2暴露组相比,小鼠脑组织中MDA含量都呈下降趋势,但是无统计学意义。
2.3 nano-TiO2暴露后小鼠脑组织炎症指标的测定(图3)

图3 nano-TiO2暴露后小鼠脑组织炎症指标的测定
由图3a可知,与对照组相比,100 mg·kg-1nano-TiO2暴露组和500 mg·kg-1nano-TiO2暴露组的IL-4含量均极显著升高 (P<0.01);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组、100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与相应的100 mg·kg-1nano-TiO2暴露组、500 mg·kg-1nano-TiO2暴露组相比,小鼠脑组织IL-4含量均出现显著性降低(P<0.05)。
由图3b可知,与对照组相比,500 mg·kg-1nano-TiO2暴露组的IFN-γ含量显著升高 (P<0.05);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组、100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与相应的100 mg·kg-1nano-TiO2暴露组、500 mg·kg-1nano-TiO2暴露组相比,小鼠脑组织中IFN-γ含量虽有一定程度的升高,但是无统计学意义。
2.4 nano-TiO2暴露后小鼠血清中Ig-E、D2D、sICAM-1和TM含量的测定(图4)
由图4a可知,与对照组相比,20 mg·kg-1nano-TiO2、100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2暴露组的Ig-E含量均极显著升高 (P<0.01);100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与500 mg·kg-1nano-TiO2暴露组相比,Ig-E含量呈显著性下降(P<0.05);而100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组与100 mg·kg-1nano-TiO2暴露组相比,Ig-E含量呈下降趋势,但是无统计学意义。
由图4b可知,与对照组相比,100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2暴露组的D2D含量均极显著升高 (P<0.01);100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组与100 mg·kg-1nano-TiO2暴露组相比,D2D含量呈显著性下降(P<0.05);100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与500 mg·kg-1nano-TiO2暴露组相比,D2D含量呈极显著性下降(P<0.01)。

图4 nano-TiO2暴露后小鼠血清中Ig-E、D2D、sICAM-1和TM的含量
由图4c可知,与对照组相比,4 mg·kg-1nano-TiO2暴露组的sICAM-1含量显著升高 (P<0.05),20 mg·kg-1nano-TiO2、100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2暴露组的sICAM-1含量均极显著升高 (P<0.01);100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组、100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组与相应的500 mg·kg-1nano-TiO2暴露组、100 mg·kg-1nano-TiO2暴露组相比,sICAM-1含量都呈下降趋势,但是无统计学意义。
由图4d可知,与对照组相比,4 mg·kg-1nano-TiO2暴露组的TM含量显著升高 (P<0.05),20 mL·g-1nano-TiO2、100 mg·kg-1nano-TiO2和500 mg·kg-1nano-TiO2暴露组的TM含量均极显著升高 (P<0.01);100 mg·kg-1VE+500 mg·kg-1nano-TiO2暴露组与500 mg·kg-1nano-TiO2暴露组相比,TM含量显著性下降(P<0.05);而100 mg·kg-1VE+100 mg·kg-1nano-TiO2暴露组与100 mg·kg-1nano-TiO2暴露组相比,TM呈下降趋势,但是无统计学意义。
2.5 讨论
2.5.1 nano-TiO2暴露后对小鼠脑组织的影响
研究表明,纳米材料的毒性机制主要是氧化损伤造成的ROS失衡[15-16]。细胞内的ROS增多时抗氧化剂就会清除多余的ROS,当抗氧化剂无法清除多余的ROS时,就会导致ROS在细胞内产出和清除失衡,引起氧化应激反应,造成蛋白质、脂质以及DNA等大分子的损伤[17]。氧化水平可以分为3个层次[18]:低水平的氧化应激会通过机体的自我保护作用来清除多余的ROS,一般不会引起机体的损伤;中水平的氧化应激不会完全清除体内多余的ROS,多余的ROS会造成一些组织损伤;高水平氧化应激会产生炎症反应,进一步对机体造成损伤。因此,本实验通过测定小鼠脑组织的ROS、GSH和MDA氧化应激指标以及IL-4和IFN-γ炎症指标来检测不同浓度的nano-TiO2通过皮肤涂抹方式对小鼠大脑的影响,结果表明,低剂量(4 mg·kg-1和20 mg·kg-1)的nano-TiO2对小鼠的大脑毒性较弱,只有较高剂量(100 mg·kg-1和500 mg·kg-1)的nano-TiO2才对小鼠的大脑有明显的影响(图2和图3)。
2.5.2 nano-TiO2暴露后对小鼠血管的影响
Ig-E可与血液中的肥大细胞结合,进而对肥大细胞进行调节作用,主要是促使肥大细胞脱颗粒,这些颗粒会对附近的血管有直接作用[19]。比如动脉粥样硬化患者病变处肥大细胞和Ig-E增加[20]。因此,Ig-E含量的上升说明血管受到一定的损伤。D2D是纤溶酶溶解时产生的交联纤维蛋白凝块,D2D含量升高,会导致血栓形成及血管各部位的严重出血。研究发现,冠心病患者的D2D含量均高于正常人[21]。sICAM-1是一种重要的表面粘附分子,属免疫球蛋白超家族,sICAM-1可诱导细胞发生增殖和迁移,激活T淋巴细胞,继而影响斑块的稳定性,导致斑块破裂,直接影响心血管疾病的发生率。研究发现,sICAM-1的含量越低,其心血管疾病发生率越低[22]。TM是一种糖蛋白,存在于血管内皮细胞表面,具有抗凝的作用,TM水平可以反应冠心病患者血管内皮细胞损伤的严重程度,许武红等[23]指出TM是心血管疾病危险因素的标志物。因此,本实验选用Ig-E、D2D、sICAM-1和TM作为指标来评价nano-TiO2暴露对小鼠血管的影响。
2.5.3 VE对nano-TiO2暴露后小鼠脑和血管的影响
VE具有抗氧化功能,因此本实验中使用 VE 作为一种保护剂。对100 mg·kg-1和500 mg·kg-1nano-TiO2暴露组添加保护剂VE,与100 mg·kg-1和500 mg·kg-1nano-TiO2暴露组相比,VE可以降低脑组织氧化应激、炎症反应,并对血管有一定的保护作用。因此,VE对nano-TiO2对脑和血管系统造成的损伤具有一定的缓解作用。
3 结论
利用nano-TiO2对小鼠皮肤涂抹42 d,并使用VE 作为一种保护剂,考察nano-TiO2对小鼠大脑毒性和血管的损伤作用。结果表明,低剂量(4 mg·kg-1和20 mg·kg-1)的nano-TiO2对小鼠的大脑毒性和血管损伤较低,较高剂量(100 mg·kg-1和500 mg·kg-1)的nano-TiO2才对小鼠的大脑毒性和血管损伤明显,VE对nano-TiO2对脑和血管系统造成的损伤具有一定的缓解作用,证明nano-TiO2对心脑血管的毒性作用至少部分来源于氧化损伤。因此,长期暴露nano-TiO2有可能对人体造成损害,后续还需进一步研究长期暴露nano-TiO2对小鼠大脑和血管的影响,以充分地对化妆品中的nano-TiO2的安全性进行评估。
[1] KISIN E R,MURRAY A R,KEANE M J,et al.Single-walled carbon nanotubes:geno- and cytotoxic effects in lung fibroblast V79 cells[J].Journal of Toxicology & Environmental Health Part A,2007,70(24):2071-2079.
[2] ROBERTSON T A,SANCHEZ W Y,ROBERTS M S.Are commercially available nanoparticles safe when applied to the skin?[J].Journal of Biomedical Nanotechnology,2010,6(5):452-468.
[3] SHI H,MAGAYE R,CASTRANOVA V,et al.Titanium dioxide nanoparticles:a review of current toxicological data[J].Particle and Fibre Toxicology,2013,10(1):1-33.
[4] Titanium Dioxide Stewardship Council,About Titanium Dioxide,2200 Pennsylvania Avenue,N.W.Suite 100W Washington,D.C.2012.
[5] SADRIEH N,WOKOVICH A M,GOPEE N V,et al.Lack of significant dermal penetration of titanium dioxide(TiO2) from sunscreen formulations containing nano- and sub-micron-size TiO2particles[J].Toxicological Sciences,2010,115(1):156-166.
[6] KERTÉSZ Z,SZIKSZAI Z,GONTIER E,et al.Nuclear microprobe study of TiO2-penetration in the epidermis of human skin xenografts[J].Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,2005,231(1):280-285.
[7] WU J H,LIU W,XUE C,et al.Toxicity and penetration of TiO2nanoparticles in hairless mice and porcine skin after subchronic dermal exposure[J].Toxicology letters,2009,191(1):1-8.
[8] STERN S T,MCNEIL S E.Nanotechnology safety concerns revisited[J].Toxicological Sciences an Official Journal of the Society of Toxicology,2008,101(1):4-21.
[9] LIU H T,MA L,ZHAO J,et al.Biochemical toxicity of nano-anatase TiO2,particles in mice[J].Biological Trace Element Research,2009,129(1/2/3):170-180.
[10] HU R,GONG X,DUAN Y,et al.Neurotoxicological effects and the impairment of spatial recognition memory in mice caused by exposure to TiO2nanoparticles[J].Biomaterials,2010,31(31):8043-8050.
[11] WANG J,CHEN C,LIU Y,et al.Potential neurological lesion after nasal instillation of TiO2nanoparticles in the anatase and rutile crystal phases[J].Toxicology Letters,2008,183(3):72-80.
[12] WU D,LU J,ZHANG Y,et al.Ursolic acid improves domoic acid-induced cognitive deficits in mice[J].Toxicol Appl Pharmacol,2013,271(2):127-136.
[13] TANDON V,GUPTA R K.Effect of Vitex negundo on oxidative stress[J].Indian J Pharm,2005,37:38-40.
[14] CHA K E,MYUNG H.Cytotoxic effects of nanoparticles assessedinvitroandinvivo[J].J Microbiol Biotechnol,2007,17(9):1573-1578.
[15] LI N,XIA T,NEL A E.The role of oxidative stress in ambient particulate matter-induced lung diseases and its implications in the toxicity of engineered nanoparticles[J].Free Radical Biology and Medicine,2008,44(9):1689-1699.[16] MOCAN T,CLICHICI S,AGOSTON-COLDEA L,et al.Implications of oxidative stress mechanisms in toxicity of nanoparticles(review)[J].Acta Physiologica Hungarica,2010,97(3):247-255.
[17] NALABOTU S K.Evaluation of the role of oxidative stress,inflammation and apoptosis in the pulmonary and the hepatic toxicity induced by cerium oxide nanoparticles following intratracheal instillation in male sprague-dawley rats[D].Marshall University,2012.
[18] XIAO G G,WANG M Y,LI N,et al.Use of proteomics to demonstrate a hierarchical oxidative stress response to diesel exhaust particle chemicals in a macrophage cell line[J].Journal of Biological Chemistry,2003,278(50):50781-50790.
[19] CHENG L E,HARTMANN K,ROERS A,et al.Perivascular mast cells dynamically probe cutaneous blood vessels to capture immunoglobulin E[J].Immunity,2013,38(1):166-175.
[20] ERDOGAN O,GUL C,ALTUN A,et al.Increased immunoglobulin E response in acute coronary syndromes[J].Angiology,2003,54(1):73-79.
[21] 余静,骆雷鸣,余远琳.尿激酶治疗冠心病血浆D-二聚体的变化研究[J].临床心血管病杂志,1998,14(1):21-23.
[22] MILLER M A,SAGNELLA G A,KERRY S M,et al.Ethnic differences in circulating soluble adhesion molecules:the wandsworth heart and stroke study[J].Clinical Science,2003,104(6):591-598.
[23] 许武红,邹原方,梁翔.血栓调节蛋白升高是维持性血液透析患者心血管疾病的危险因素[J].中国血液进化,2015,14(4):224-226.
The Toxicity of Nano-TiO2on Brain and Blood Vessel of Mice by Dermal Exposure
GUO Qing,LIU Zhi-min,LI Xiao-xiao,ZHAO Yun,SHEN Shi-ping,CAI Jie,YUAN Jun-lin,YANG Xu,LI Rui
(HubeiKeyLaboratoryofGeneticRegulationandIntegrativeBiology,CollegeofLifeScience,CentralChinaNormalUniversity,Wuhan430079,China)
Toinvestigatetoxiceffectsofnano-TiO2onbrainandbloodvesselofmice,56BALB/cmicewererandomlydividedinto8groups,includingcontrol,solventcontrol,4mg·kg-1nano-TiO2,20mg·kg-1nano-TiO2,100mg·kg-1nano-TiO2,500mg·kg-1nano-TiO2,100mg·kg-1VE+100mg·kg-1nano-TiO2and100mg·kg-1VE+500mg·kg-1nano-TiO2,with7miceineachgroup.Micewerecontinuouslyexposedtonano-TiO2bydermalexposurefor42days.Theresultsshowedthat,thebrainandbloodvesselofmicein4mg·kg-1nano-TiO2and20mg·kg-1nano-TiO2groupswereslightlydamaged,whileobviouslydamagedin100mg·kg-1nano-TiO2and500mg·kg-1nano-TiO2groups,andvitaminEcouldrelievethatinjurytoacertainextent.Thisstudyshowednano-TiO2hadtoxiceffectsonbrainandbloodofmicebydermalexposureatadoseofnano-TiO2andoxidativedamagemightbeoneofthereasons.
nano-TiO2;toxicity;mice;dermalexposure
国家自然科学基金重点项目(21577045)
2016-07-02
郭晴(1989-),女,河南南阳人,硕士研究生,研究方向:生物化学与分子生物学,E-mail:295100071@qq.com;通讯作者:李睿,副教授,E-mail:ruili@mail.ccnu.edu.cn。
10.3969/j.issn.1672-5425.2016.11.003
郭晴,刘志敏,李潇潇,等.纳米二氧化钛皮肤暴露对小鼠脑和血管的毒性研究[J].化学与生物工程,2016,33(11):15-20,26.
R 114
A
1672-5425(2016)11-0015-06

