越橘EST-SSR分子标记的开发及其遗传多样性分析
孙海悦,郭瑞雪,王佳卉,盖钰卓,刘禹姗,董 梅,李亚东
(1 吉林农业大学 园艺学院,吉林 长春 130118; 2 沈阳农业大学 园艺学院,辽宁 沈阳 110161)
越橘EST-SSR分子标记的开发及其遗传多样性分析
孙海悦1,郭瑞雪2,王佳卉2,盖钰卓1,刘禹姗1,董 梅1,李亚东1
(1 吉林农业大学 园艺学院,吉林 长春 130118; 2 沈阳农业大学 园艺学院,辽宁 沈阳 110161)
【目的】 探讨越橘EST序列中SSR位点的分布规律,开发越橘EST-SSR引物,并分析其在越橘品种遗传多样性研究中的作用。【方法】 以91份越橘种质为材料,利用越橘果实转录组(RNA-Seq)的测序结果,通过SSRIT在线搜索,利用Primer Premier 5.0软件设计30对引物,并筛选扩增效果理想的引物,用筛选出的引物分析91份种质的多态性,构建91份种质的系统发育树。【结果】 34 464条越橘unigene序列中含有SSR位点的序列有829条,SSR位点有913个,其中二核苷酸、三核苷酸重复是主要的SSR类型,分别占全部SSR位点的13.69%和81.27%。不同核苷酸数目重复基元的重复次数差异很大;越橘EST-SSR位点集中在11~15 bp;三核苷酸和六核苷酸重基元复种类最多,在所有重复基元中GAA/TTC发生频率最高。设计的30对引物中有17对引物在供试越橘种质中扩增出理想的PCR产物,17对引物均有多态性。聚类分析结果显示,在遗传相似系数为0.69时,可以将供试越橘种质分成4组。【结论】 EST-SSR标记可以用于越橘品种的鉴定与遗传多样性分析。
越橘;EST;SSR;遗传多样性
越橘(俗称蓝莓)、蔓越橘和红豆越橘是经人类驯化的杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,栽培最为广泛的越橘主要分为矮丛越橘(Lowbush blueberries)、北高丛越橘(Northern highbush blueberries)、半高丛越橘(Half-highbush blueberries)、南高丛越橘(Southern highbush blueberries)和兔眼蓝莓(Rabbiteye blueberries)品种群。全世界越橘属植物有400多个种,广泛分布于北半球冷凉地区和南美高山地区[1],我国共有约91个种、28个变种,主要分布于东北和西南地区[2],特别是在我国长白山等地区蕴含着丰富的野生越橘属植物资源,这些野生资源是越橘抗性育种的必要基础和重要材料。我国现有的越橘属栽培品种主要引自美国、加拿大、波兰等国,而根据我国的气候特点和本土植物资源优势,积极培育具有自主知识产权的越橘优良品种是今后我国越橘产业发展的关键环节。
近年来,分子标记技术已广泛应用于果树遗传连锁图构建、种质资源遗传多样性、亲缘关系分析、纯度鉴定和分类及分子标记辅助选择育种等研究领域。在众多的分子标记技术中,简单重复序列(Simple Sequence Repeat,SSR)标记以其高度的多态性和可重复性,得到了广泛应用[3]。根据SSR来源不同,可分为基因组SSR(Genomic-SSR)和表达序列标签SSR(EST-SSR)。基因组SSR标记开发费时、费力,且成本较高,需要投入大量的人力物力[4];而EST-SSR标记是从随机选择的cDNA克隆中获得的cDNA序列片段,代表完整基因的一部分,通过搜索SSR开发的EST-SSR标记具有稳定性高、通用性好、成本低、开发简单快捷等特点[5]。目前,EST-SSR在梨[6]、砂梨[7]、刺梨[8-9]、梅[10]、荔枝[11-12]、草莓[13]、桃[14]、猕猴桃[15]、柑橘[16]、核桃[17]、香蕉[18]等果树上已有相关报道。随着二代测序技术的迅猛发展,越来越多的EST序列被大量而快速地获取,为开发SSR标记提供了大量可利用的数据资源,EST-SSR标记目前已成为一种有效的技术被广泛应用于遗传连锁图谱构建、亲缘关系、遗传多样性分析等研究中[19-20]。
分子标记技术在越橘研究上也有一定的应用,Aruna等[21]利用RAPD标记对19个兔眼越橘品种的亲缘关系进行了分析;Levi等[22]对高丛越橘品种、兔眼越橘、南方野生越橘种间的亲缘关系进行了RAPD和SSR分析;Dhanaraj等[23]筛选了26个野生矮丛越橘品种(V.angustifolium),包括栽培品种和野生品种,结果表明,基因型的聚类分析与地理起源相关性较好。但关于越橘EST-SSR标记的研究不多, Boches等[24]使用20个EST-SSR和8个基因组SSR引物,成功区分了60多个越橘品系的遗传多态性,其中包括半高丛品种群、南高丛品种群、北高丛品种群和野生品系。本课题组在前期工作中,采用Illumina高效测序技术构建了越橘果实转录组测序文库[25],本研究拟对这些序列中的SSR信息进行分析,以了解越橘EST-SSR的发生频率和特点,开发新的EST-SSR引物,并对越橘种质资源进行遗传多样性分析,根据越橘种质资源的利用现状和我国越橘育种的实际需要,开发建立基于EST的越橘分子标记体系,对育种材料进行早期鉴定,加快育种进程,以期提高我国在越橘品种方面的自主创新能力。
1 材料与方法
1.1 材 料
本试验所用的91份越橘品种种质资源取自吉林农业大学小浆果资源圃,供试品种包括矮丛越橘、北高丛越橘及其杂种后代、半高丛越橘、南高丛越橘和红豆越橘,试材具体情况见表1。2012年5月采集新鲜幼嫩叶片,经液氮处理后置于-80 ℃超低温冰箱保存。
1.2 方 法
1.2.1 基因组DNA的提取 采用改良的CTAB法[26]提取基因组DNA,用0.8%的琼脂糖凝胶电泳检测DNA的完整性,用德国Implen NanoPhotometer®P-Class超微量分光光度计检测DNA的浓度和纯度。
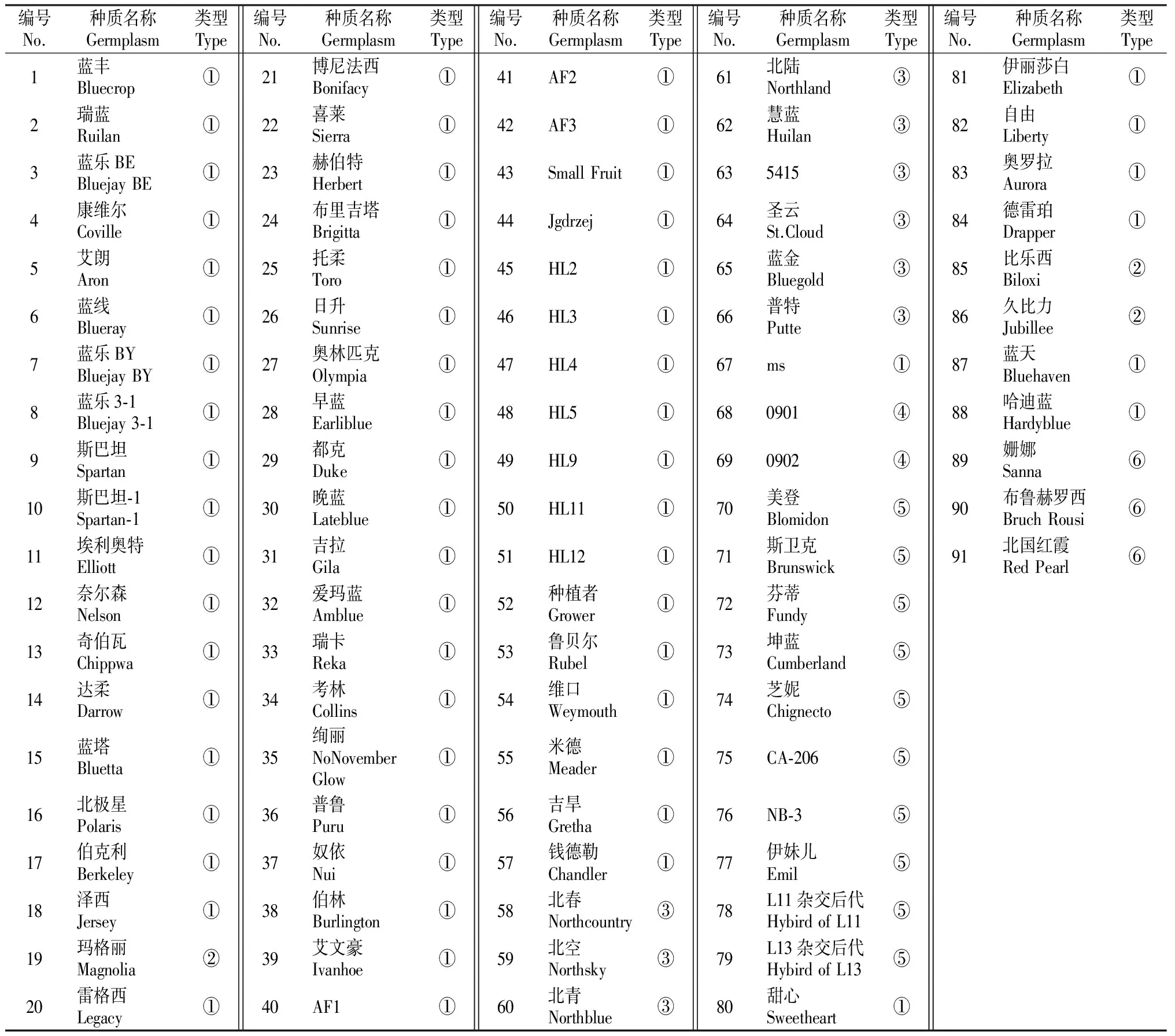
表 1 供试越橘种质资源的基本情况
注:①代表北高丛越橘,②代表南高丛越橘,③代表半高丛越橘,④代表北高丛越橘杂种后代,⑤代表矮丛越橘,⑥代表红豆越橘。
Note:①.Northern highbush blueberries,②.Southern highbush blueberries,③.Half-highbush blueberries,④.Northern highbush blueberry hybrids,⑤.Lowbush blueberries,⑥.V.vitis-idaea,Lingonberries.
1.2.2 转录组数据来源 越橘果实转录组数据来源于本课题组有关半高丛越橘品种“北陆”的Illumina高通量深度测序结果[25],分别以越橘成熟果实的果皮和果肉为样品构建测序cDNA文库,共获得34 464条unigene序列(SRA046311)。
1.2.3 SSR位点的鉴定 使用简单序列重复识别工具SSRIT(Simple Sequence Repeat Identification Tool,http://gramene.org/db/markers/ssrtool)筛选SSR;搜索SSR位点的标准是二核苷酸(Di-nucleotide,Di-)重复6次,三核苷酸(Tri-nucleotide,Tri-)重复5次,四核苷酸(Tetra-nucleotide,Tetra-)及以上重复4次。
1.2.4 EST-SSR 引物设计 引物设计主要参考Thiel等[27]的方法,并将筛选条件适当改进为:SSR位点距序列两端大于50 bp,引物(G+C)含量为40%~60%,引物长度为18~24 bp,复性温度为50~60 ℃,上下游引物复性温度相差小于5 ℃,产物片段大小为150~350 bp。用Primer Premier 5.0 软件设计引物。引物命名规则为RX-序号,如RX-1。
1.2.5 EST-SSR引物筛选 将设计的30对ESR-SSR 引物交由苏州金唯智生物科技有限公司合成。选择“蓝丰”(北高丛越橘)、“美登”(矮丛越橘)、“北陆”(半高丛越橘)进行引物筛选。PCR反应体系为20 μL,其中包括:10×PCR buffer (Mg2+Plus) 2 μL,dNTPs (2.5 mmol/μL) 1.6 μL,TaKaRaTaq(5 U/μL) 0.1 μL,DNA模板(10 ng/μL) 0.4 μL,上、下游引物各0.8 μL,ddH2O 14.3 μL。PCR扩增程序为:95 ℃预变性1 min;然后进行33个循环,每个循环包括95 ℃变性30 s,50~60 ℃退火30 s,72 ℃延伸30 s;最后72 ℃延伸5 min。
PCR 反应产物利用6%非变性聚丙烯酰胺凝胶电泳分离(DYY-П型垂直板电泳仪和DYC-30 型电泳槽均为北京六一仪器厂生产),上样完毕后在300 V电压下电泳1 h, 电泳结束后进行银染显色,Alpha Imager HP 凝胶成像系统拍照记录。
1.2.6 多态性检测及聚类分析 对PCR扩增效果较好的EST-SSR引物进行越橘种质资源多态性分析,反应条件及反应程序同1.2.5节,不同引物组合的最适退火温度有别。根据电泳结果,在相同迁移位置有扩增条带的记作1,无扩增条带的记作0,建立0,1矩阵。根据SSR位点统计信息,利用NTSYSpc 2.10 e 软件获得样品间的遗传相似度,并以此进行聚类分析,构建聚类树。
2 结果与分析
2.1 越橘EST中SSR的总体特点及出现频率
对来自越橘果实转录组文库的34 464条unigene序列进行SSR搜索,结果显示,共检索到913个SSR位点,占全部unigene序列总数的2.65%;含SSR位点的unigene序列共计829条,占总序列数的2.41%。在这829条序列中,发现包含1个SSR位点的unigen序列762条,包含2个SSR位点的有54条,包含3个SSR位点的有10条,包含4个SSR位点的序列有2条,包含5个SSR位点的序列有1条。
检测出的913个SSR位点中,2~6核苷酸重复都有出现,但各核苷酸出现的频率不同。三核苷酸和二核苷酸重复类型占主导地位,共占SSR总位点数的94.96%;其次是六核苷酸重复,占SSR总位点数的4.60%;而四核苷酸和五核苷酸重复较少,仅占0.33%和0.11%(表2)。

表 2 越橘EST中SSR的出现频率
2.2 越橘的EST-SSR特性
搜索的越橘EST-SSR中,共观察到101种重复基元,其中三核苷酸和六核苷酸重复基元种类最多,分别为51和38种;其次为二、四、五核苷酸重复,分别为8,3,1种(表2)。而在5种重复类型中,虽然六核苷酸的重复基元种类多,占总重复基元类型总数的37.62%,但是出现频率较低,仅占总SSR位点的4.60%(表2)。在二核苷酸重复基元中,以AG/CT重复基元最多,其次是GA/TC。三核苷酸重复基元类型中,以GAA/TTC、CAG/CTG、AAG/CTT所占比例较高,为三核苷酸的主要重复基元。在所有重复基元中,GAA/TTC的发生频率最高,其次为CAG/CTG、AAG/CTT、GA/TC(表3)。

表 3 越橘EST中SSR重复基元的特点
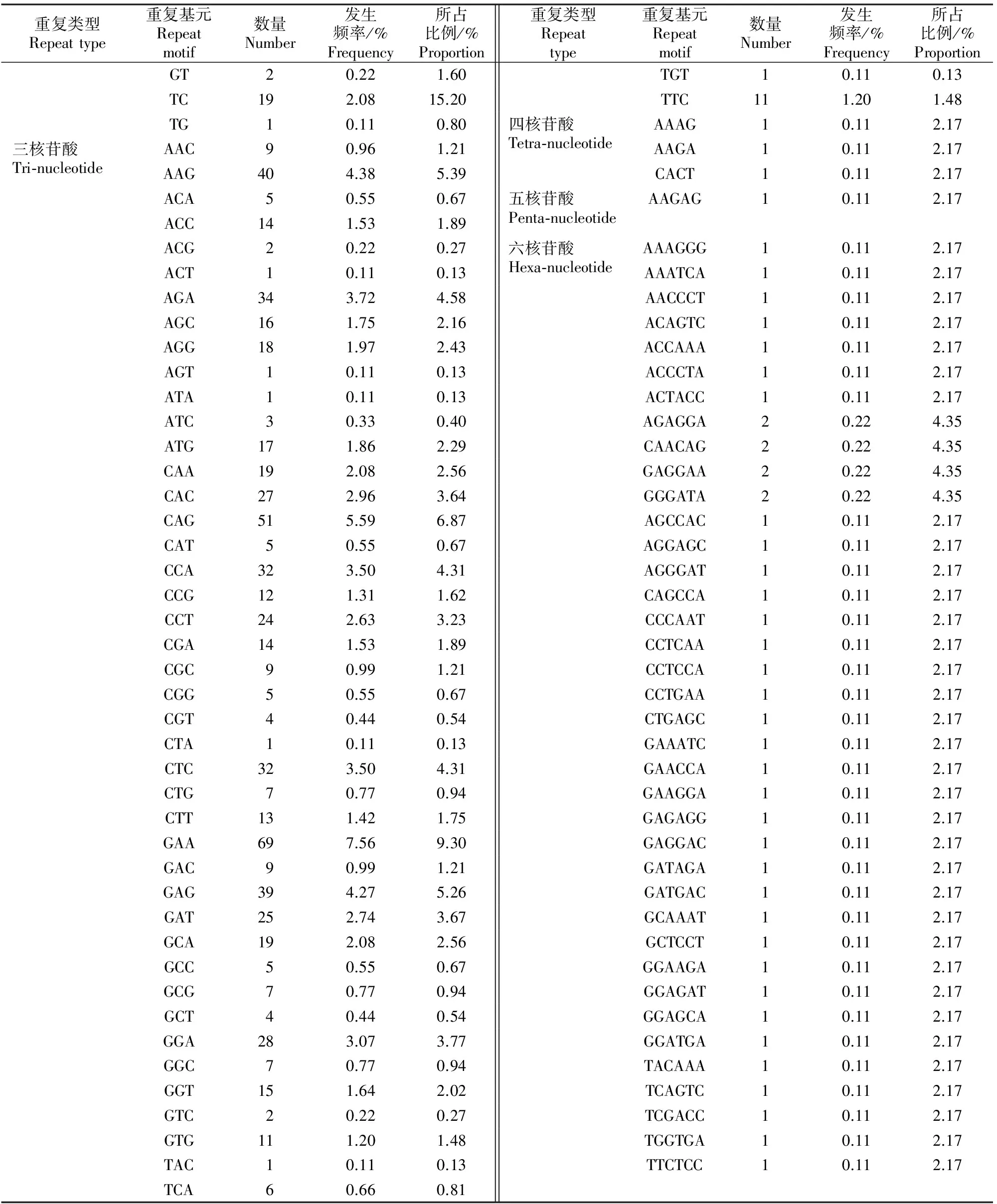
表 3(续) Continued table 3
从表4可知,不同核苷酸数目重复基元的重复次数差异很大,二核苷酸重复基元组成的SSR共有16种重复次数类型,主要为6次重复;三核苷酸重复基元组成的SSR有7种重复次数类型,主要为5次重复;四、五核苷酸重复基元组成的SSR只有1种重复次数类型,均为4次重复;六核苷酸重复基元组成的SSR有4种重复次数类型,为4~7次重复。可见随着组成SSR重复基元核苷酸数目的不断增多,重复基元的重复次数减少。
从图1可以看出,越橘EST-SSR位点集中在11~15 bp,其次是16~20 bp。统计发现,越橘长度分布在11~15 bp的EST-SSR位点约有512个,占总数的56.08%;16~20 bp的EST-SSR位点约有264个,占总数的28.92%; 21~25 bp的EST-SSR位点有78个,占总数的8.54%;26~30 bp的EST-SSR位点有29个,约占总数的3.18%;而长度大于31 bp的EST-SSR位点约有30个,占总数的 3.28%。
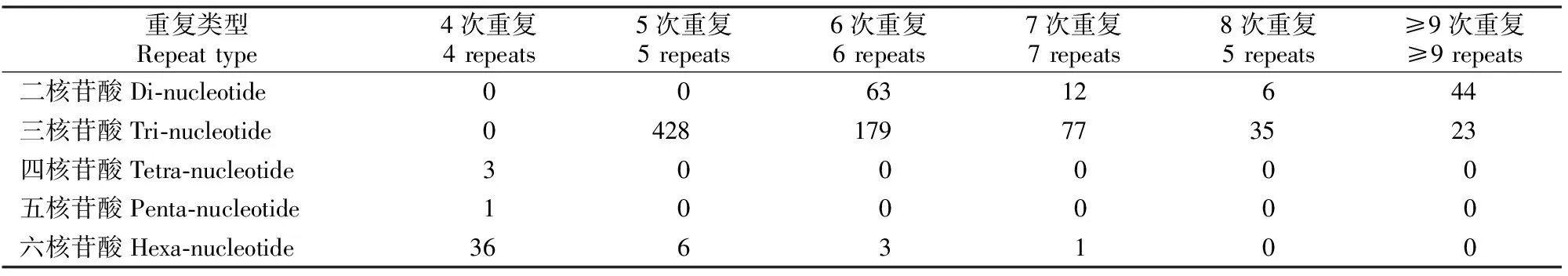
表 4 越橘EST中不同SSR重复基元的重复次数
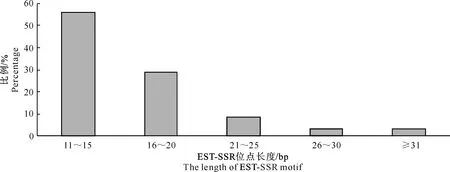
图 1 越橘EST序列中SSR位点长度的分布
2.3 越橘EST-SSR引物的有效性检测及多态性
在随机挑选的30对符合筛选条件的EST-SSR引物中,有17对引物均扩增出理想的PCR产物,有效扩增率为56.67%,说明利用越橘EST序列开发EST-SSR标记是可行的。选用91份越橘种质资源对17对有效EST-SSR引物进行扩增及多态性评价。结果表明,17对引物均呈现多态性,共得到92条条带,其中多态性片段85个。图2为引物RX-17的扩增情况,不同引物的扩增及其显示的多态性情况见表5。

1~48.代表越橘种质与表1相同;M.DL2000 Marker 1-48.Germplasms are same with Table 1;M is DL2000 Marker
图 2 引物RX-17在越橘不同种质资源间的多态性图谱
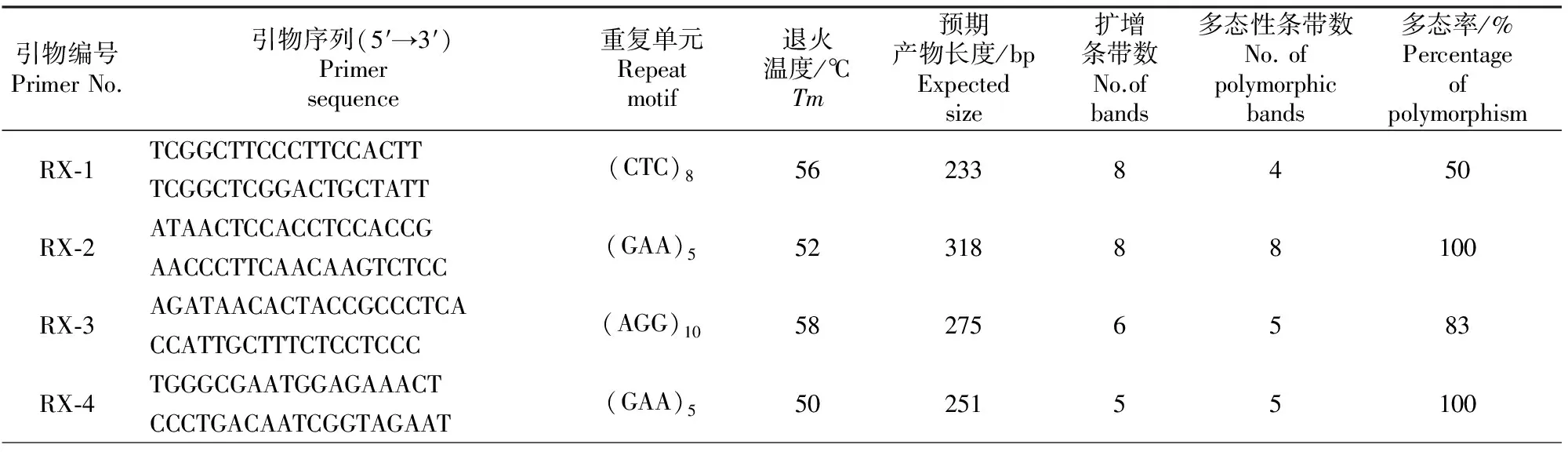
Fig.2 Polymorphic bands in different Vaccinium accessions revealed by primer RX-17
表 5(续) Continued table 5
2.4 越橘种质资源的遗传多样性分析
为了评价所开发的EST-SSR标记的可利用性,用具有SSR位点的17对引物对越橘品种进行聚类分析。遗传关系分析结果(图3)表明,这些引物可以将91个越橘品种区分开来,遗传相似系数在0.59~1.00。总体而言,91个越橘种质主要被分为两大类。在遗传相似系数为0.69时,可以将91个越橘品种分为4组:第4组为9号“斯巴坦”;第3组为89号红豆越橘“姗娜”;第2组为5号“艾朗”和3号“蓝乐BE”;其余所有品种为第1组,这一组包含了矮丛越橘、半高丛越橘、北高丛越橘和南高丛越橘的大部分品种,表明在现有越橘品种培育过程中,各品种亲缘关系较近,遗传背景较狭窄。
3 讨 论
本研究对来自越橘果实转录组文库中的34 464条unigene序列进行了SSR搜索,得到了913个SSR位点,占全部unigene序列总数的2.65%,低于荔枝(16.53%)[12]、草莓(2.67%)[13]、梅(9.24%)[10]。这种差异的存在可能是由于物种间SSR位点的真实差异,也可能是由于构建的cDNA文库容量与得到的EST数量不同,或用来分析的EST数量和质量不同,或是由于搜寻SSR的所用软件标准参数设置不同造成的。相信随着EST数据库容量的不断增加,各个物种间SSR位点的比较将会有统一的标准。前人研究发现,绝大多数植物以二核苷酸和三核苷酸为主要重复类型,多数双子叶植物和单子叶植物以三核苷酸重复基元为主[20],如香蕉[18]、甘蔗[28]等。本研究发现,越橘中以三核苷酸重复基元最为常见,发生频率平均为2.135%,这与鄢秀芹等[9]、孙清明等[12]、Kota等[29]的研究结果相一致。
利用SSRIT软件,本研究从越橘果实转录组文库中共搜索到913个SSR位点,通过PCR验证,发现设计的30对引物中仅17对具有扩增产物,引物有效扩增率为56.67%;17对引物均有多态性,占可扩增引物的100%。董清华等[13]根据草莓EST-SSR设计60对引物,其中42对引物具有扩增产物,引物有效扩增率为70%;42对引物中有36对引物具多态性,占可扩增引物的85.7%。可见与草莓相比,越橘EST-SSR引物有效扩增率稍低,但是引物多态性所占比例高。这可能是由于部分引物设计的EST序列对应的基因组序列上含有内含子,从而引起引物间序列过长或引物无法与模板DNA互补配对,导致PCR无法正常扩增所致,引物的设计质量也可能是影响因素之一。供试种质中的3、7、8号均标记为越橘品种“蓝乐”,这是由于引种批次和来源不同造成的。鉴于越橘品种“蓝乐”的母本是“伯克利”[30],根据本研究的聚类分析结果,“蓝乐”应与17号“伯克利”亲缘关系最近,因此判断7号“蓝乐BY”为准确品种。此外,9、10号均标记为越橘品种“斯巴坦”,“斯巴坦”的母本是28号“早蓝”[30],而根据聚类分析结果,10号“斯巴坦-1”为准确品种。这一结果说明,本研究开发的EST-SSR引物可以用于越橘品种的区分鉴别。

1~91代表种质与表1同 1-91 are same with Table 1
图 3 91个越橘种质的聚类分析树状图
Fig.3 Dendrogram of 91Vacciniumgermplasms based on Dice’s similarity coefficient
Boches等[24]使用北高丛越橘的EST数据作为SSR引物设计来源,而本研究以兼具高丛越橘和矮丛越橘的中间类型——半高丛越橘为EST-SSR引物设计来源,这类新开发的EST-SSR引物对越橘属植物的遗传分析研究具有更高的引物通用性。本研究结果也证明,新开发的EST-SSR引物不仅可以用于越橘的4大品种群,也可以用于红豆越橘。将本研究新开发的EST-SSR标记用于91份越橘品种间遗传多样性分析,结果表明,EST-SSR分子标记体系的聚类结果与越橘品种的实际情况基本相符,可用于越橘属植物品种遗传多样性分析。特别值得注意的是,本研究结果显示,95.6%的越橘供试品种聚类在第1组,这与Boches等[24]的研究结论相似,证实在人类驯化过程中蓝果类型的越橘属植物,栽培品种遗传背景过于集中,仅仅集中在狭叶越橘、绒叶越橘等8个属,因此在今后的育种研究中,有必要引入更多的野生种质资源,重视种、属、组之间的杂交。
[1]Vander K S P.The genusVacciniumin North America [M].Ottawa:Canadian Government Publishing Centre Supply and Services,1988:201.
[2]郝 瑞.长白山区笃斯越橘资源调查 [J].园艺学报,1979,6(2):87-93.
Hao R.Investigation on the dusi blueberry in the Changbaishan Mountain regions [J].Acta Horticulturae Sinica,1979,6(2):87-93.
[3]Tautz D.Hypervariability of simple sequence as a general sour-ce of polymorphic DNA markers [J].Nucleic Acids Research,1989,17:6463-6471.
[4]Powell W,Machray G C,Provan J.Polymorphism revealed by simple sequence repeats [J].Trends in Plant Science,1996,1(7):215-222.
[5]陈全求,詹先进,蓝佳祥,等.EST分子标记开发研究进展 [J].中国农业学通报,2008,24(9):72-77.
Chen Q Q,Zhan X J,Lan J X,et al.Study progress in development of EST (expressed sequence tags) [J].Chinese Agricultural Science Bulletin,2008,24(9):72-77.
[6]王西成,姜淑苓,上官凌飞,等.梨EST-SSR 标记的开发及其在梨品种遗传多样性分析中的应用评价 [J].中国农业科学,2010,43(24):5079-5087.
Wang X C,Jiang S L,Shanguan L F,et al.Development of EST-Derived SSR markers for pear and evaluation of their application in pear genetic diversity analysis [J].Scientia Agricultura Sinica,2010,43(24):5079-5087.
[7]崔海荣,刘金义,佟兆国,等.砂梨EST-SSR引物开发及其应用 [J].西北植物学报,2010,30(8):1551-1556.
Cui H R,Liu J Y,Tong Z G,et al.Development and application of EST-SSRs in sand pear [J].Acta Bot Boreal-Occident Sin,2010,30(8):1551-1556.
[8]Yan X,Zhang X,Lu M,et al.De novo sequencing analysis of theRosaroxburghiifruit transcriptome reveals putative ascorbate biosynthetic genes and EST-SSR markers [J].Gene,2015,561(1):54-62.
[9]鄢秀芹,鲁 敏,安华明.刺梨转录组SSR 信息分析及其分子标记开发 [J].园艺学报,2015,42(2):341-349.
Yan X Q,Lu M,An H M. Analysis on SSR information in transcriptome and development of molecular markers inRosaroxburghii[J].Acta Horticulturae Sinica,2015,42(2):341-349.
[10]上官凌飞,李晓颖,宋长年,等.梅EST-SSR标记的开发及利用 [J].西北植物学报,2010,30(9):1766-1772.
Shanguan L F,Li X Y,Song C N,et al.Development of EST-SSR markers inPrunusmumeand its application [J].Acta Bot Boreal-Occident Sin,2010,30(9):1766-1772.
[11]向 旭,欧良喜,陈厚彬,等.中国96个荔枝种质资源的EST-SSR遗传多样性分析 [J].基因组学与应用生物学,2010,29(6):1082-1092.
Xiang X,Ou L X,Chen H B,et al.EST-SSR analysis of genetic diversity in 96 Litchi (LitchichinensisSonn.) germplasm resources in China [J].Genomics and Applied Biology,2010,29(6):1082-1092.
[12]孙清明,马文朝,马帅鹏,等.荔枝EST 资源的SSR信息分析及EST-SSR 标记开发 [J].中国农业科学,2011,44(19):4037-4049.
Sun Q M,Ma W C,Ma S P,et al.Characteristics of SSRs derived from ESTs and development of EST-SSR markers in Litchi (LitchichinensisSonn.) [J].Scientia Agricultura Sinica,2011,44(19):4037-4049.
[13]董清华,王西成,赵密珍,等.草莓EST-SSR 标记开发及在品种遗传多样性分析中的应用 [J].中国农业科学,2011,44 (17):3603-3612.
Dong Q H,Wang X C,Zhao M Z,et al.Development of EST-derived SSR markers and their application in strawberry genetic diversity analysis [J].Scientia Agricultura Sinica,2011,44 (17):3603-3612.
[14]Vendramin E,Dettori M T,Giovinazzi J,et al.A set of EST-SSRs isolated from peach fruit transcriptome and their transportability acrossPrunusspecies[J].Molecular Ecology Notes,2007,7:307-310.
[15]徐小彪,姜春芽,廖 娇,等.中华猕猴桃矮型性状EST-SSR 连锁标记的筛选 [J].园艺学报,2010,37(4):553-558.
Xu X B,Jiang C Y,Liao J,et al.Screening of EST-SSR marker linked to dwarf character inActinidiachinensisPlanch [J].Acta Horticulturae Sinica,2010,37(4):553-558.
[16]江 东,钟广炎,洪棋斌.柑橘EST-SSR分子标记分析 [J].遗传学报,2006,33(4):345-353.
Jiang D,Zhong G Y,Hong Q B.Analysis of microsatellites inCitrusUnigenes[J].Acta Genetica Sinica,2006,33(4):345-353.
[17]齐建勋,郝艳宾,朱 艳,等.核桃属种质资源的EST-SSR标记研究 [J].园艺学报,2011,38(3):441-448.
Qi J X,Hao Y B,Zhu Y,et al.Studies on germplasm of juglans by EST-SSR markers [J].Acta Horticulturae Sinica,2011,38(3):441-448.[18]王静毅,陈业渊,刘伟良,等.香蕉EST-SSRs标记的开发与应用 [J].遗传,2008,30(7):933-940.
Wang J Y,Chen Y Y,Liu W L,et al.Development and application of EST-derived SSR markers for bananas (MusananaLour.) [J].Hereditas,2008,30(7):933-940.
[19]Morgante M,Hanafey M,Powell W.Microsatellites are preferentially associated with nonrepetitive DNA in plant genomes [J].Nature Genetics,2002,30:194-200.
[20]Rota L R,Kantety R V,Yu J K.Nonrandom distribution and frequencies of genomic and EST-derived microsatellite markers in rice,wheat and barley [J].BMC Genomics,2005,6(1):23.
[21]Aruna M,Ozias-Akins P,Austin M E,et al.Genetic relatedness among rabbiteye blueberry (Vacciniumashei) cultivars determined by DNA amplification using single primers of arbitrary sequence [J].Genome,1993,36:971-977.
[22]Levi A,Rowland L J.Identifying blueberry cultivars and evaluating their genetic relationships using randomly amplified polymorphic DNA (RAPD) and simple sequence repeat-(SSR-) anchored primers [J].J Amer Soc Hort Sci,1977,122(1):74-78.
[23]Dhanaraj A L,Slovin J P,Rowland L J.Analysis of gene expression associated with cold acclimation in blueberry floral buds using expresses sequence tags [J].Plant Science,2004,166:863-872.
[24]Boches P,Bassil N V,Rowland L.Genetic diversity in highbush blueberry evaluated with microsatellite markers [J].J Amer Soc Hort Sci,2006,131(5):676-686.
[25]Li X,Sun H,Pei J,et al.De novo sequencing and comparative analysis of the blueberry transcriptome to discover putativegenes related to antioxidants [J].Gene,2012,511(1):54-61.
[26]Lodhi M A,Ye G N,Weeden N F,et al.A simple and efficient method for DNA extraction from grapevine cultivarsVitisspecies andAmpelopsis[J].Plant Mol Biol Rep,1994,12(1):6-13.
[27]Thiel T,Michalek W,Varshney R K,et al.Exploiting EST databases for the development and characterization of gene derived SSR-markers in barley (HordeumvulgareL.) [J].Theor and Appl Genet,2003,106:411-422.
[28]Cordeiro G M,Cash R E,Mcintyre C L,et al.Microsatellite markers from sugareane (Saccharumspp.) ESTs cross transferable to erianthus and sorghum [J].Plant Science,2001,160(6):1115-1123.
[29]Kota R,Varshney R K,Thiel T,et al.Generation and comparison of EST-derived SSRs and SNPs in berley (HordeumvulgareL.) [J].Hereditas,2001,135 (2/3):145-151.
[30]李亚东,郭修武,张冰冰.浆果栽培学 [M].北京: 中国农业出版社,2012:139-150.
Li Y D,Guo X W,Zhang B B.Cultivation science of berry fruit [M].Beijing:China Agricultural Press,2012:139-150.
Development of expressed sequence tag-derived simple sequence and genetic diversity analysis of blueberry
SUN Haiyue1,GUO Ruixue2,WANG Jiahui2,GAI Yuzhuo1,LIU Yushan1,DONG Mei1,LI Yadong1
(1 College of Horticulture,Jilin Agricultural University,Changchun,Jilin 130118, China;2CollegeofHorticulture,ShenyangAgriculturalUniversity,Shenyang,Liaoning110161,China)
【Objective】 The objective of this study was to analyze the SSR distribution in blueberry transcriptome, and develop new EST-SSR markers for studying the genetic diversity ofVacciniumgermplasms. 【Method】 Using 91Vacciniumgermplasms for materials,SSR motifs were selected by SSRIT online software based on RNA-Seq results of blueberry fruits.A total of 30 primer pairs were designed by the software Primer Primer 5.0 and phylogenetic tree was constructed by optimal primers to analyze the polymorphism of 91 germplasm resources.【Result】 A total of 913 SSRs were identified from 34 464Vacciniumunigenes.The dinucleotide and trinucleotide repeats were the dominant types with the frequency of 13.69% and 81.27%,respectively.The difference among different number of repeats of different SSR types was large.The most abundant repeat length of EST-SSR motif was 11-15 bp.Tri-nucleotide and hexa-nucleotide repeats had the most abundant repeat types and GAA/TTC was the most common motif.Among the 30 EST-SSR primers,amplified distinct bands and expected products were obtained by 17 pairs primers.The 17 polymorphic EST-SSR amplicons were validated by resequencing PCR products.Cluster analysis showed that 91Vacciniumgermplasms can be distinguished into 4 groups with the genetic similarity coefficient of 0.69.【Conclusion】 The EST-SSR markers can be used in germplasm identification and genetic analysis inVaccinium.
Vaccinium;EST;SSR;genetic diversity
时间:2016-10-20 16:36
10.13207/j.cnki.jnwafu.2016.12.024
2015-06-10
国家自然科学基金项目(31301755);教育部博士点基金项目(20132223120004);人事部留学人员科技活动择优资助项目; 吉林省科技发展计划项目(20150414047GH)
孙海悦(1981-),女,辽宁沈阳人,博士,主要从事果树遗传育种与生物技术研究。
李亚东(1964-),男,河北昌黎人,教授,博士生导师,主要从事果树种质资源与栽培生理研究。 E-mail:blueberryli@163.com
S663.9
A
1671-9387(2016)12-0172-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161020.1636.048.html

