核桃凋落叶对萝卜种子发芽和幼苗生长的影响
张如义,胡红玲,胡庭兴,阮若玉,杨丽妹,舒 兰
(1 四川农业大学 林学院,四川 成都 611130;2 内江市农业科学院,四川 内江 641000)
核桃凋落叶对萝卜种子发芽和幼苗生长的影响
张如义1,2,胡红玲1,胡庭兴1,阮若玉1,杨丽妹1,舒 兰1
(1 四川农业大学 林学院,四川 成都 611130;2 内江市农业科学院,四川 内江 641000)
【目的】 分析核桃(Juglansregia)凋落叶浸提液和腐解液对萝卜(Raphanussativus)种子萌发及幼苗生长的影响,探讨核桃凋落叶潜在的化感效应。【方法】 采用浸提和腐解(20和40 d)两种方式处理核桃凋落叶,得到3种质量浓度(25 mg/mL(低)、50 mg/mL(中)、100 mg/mL(高))核桃凋落叶浸提液和腐解液,以蒸馏水处理为对照(CK),分析不同质量浓度核桃凋落叶浸提液和腐解液处理下萝卜种子萌发、幼苗生长相关生理指标的变化。【结果】 与对照相比,核桃凋落叶浸提液和腐解液均降低了萝卜种子的发芽率、发芽指数和发芽势,并对萝卜幼苗的苗高、根长、鲜质量表现出低促高抑的浓度效应;核桃凋落叶浸提液和20,40 d腐解液均提高了萝卜种子内可溶性蛋白和可溶性糖含量,并明显增加了萝卜幼苗叶片丙二醛含量,对幼苗超氧化物歧化酶(SOD)活性具有促进作用,对过氧化氢酶(CAT)活性具有抑制作用,而对幼苗氧化物酶(POD)活性表现为低促高抑的浓度效应。幼苗可溶性蛋白和可溶性糖含量均随处理液质量浓度的增加而升高。核桃凋落叶腐解液对萝卜的化感效应强于浸提液,且40 d腐解液的化感效应强于20 d腐解液。【结论】 在一定质量浓度范围内,核桃凋落叶浸提液和腐解液对萝卜种子萌发及幼苗生长具有较明显的抑制作用,且抑制作用随着处理液质量浓度的升高而增强,同时在一定的时间范围内随凋落叶腐解时间的延长而呈增强趋势。
核桃凋落叶;浸提液;腐解;萝卜;化感作用
化感作用在自然生态系统中普遍存在,且在群落演替、生物入侵和作物产出等过程中扮演着重要角色[1]。自然环境中,植物由于新陈代谢而凋落大量的组织,如叶片、枝条等,这些植物残体通过挥发、淋溶及腐解等途径释放化感物质,其中以腐解释放方式为主[2]。而化感作用则被认为是人工林下生物多样性降低以及连作效应产生的重要原因之一[3]。
核桃(Juglansregia)又名胡桃,是胡桃科(Juglandaceae)核桃属(Juglans)落叶乔木,具有重要的食用和药用价值,在我国广泛栽植[4]。近年来,我国南方一些地区在退耕还林和农业产业结构调整中,发展了大面积的果类经济林,到2010年四川核桃种植总面积已达40万 hm2[5]。核桃农林复合种植因具有经济和生态双重效益受到广泛重视,但核桃及其同属植物被认为具有强烈化感作用,其化感作用所带来的生态负效应也受到了国内外广泛关注,研究人员对此展开了大量研究[6-8]。核桃与冬性作物复合种植是在秋季核桃落叶后,选取适合的冬性作物在核桃林下进行复合种植,并于来年核桃进入生长旺盛时期之前进行收获的一种复合种植模式。该模式可以缓解核桃与林下作物之间对阳光、水分及养分等的竞争[9],在开展这种农林复合种植时,通常将核桃凋落叶翻耕于土壤中,因而凋落叶作为化感物质释放的主要来源之一,在核桃凋落叶累积过多的情况下,套种在林间的农作物可能因此而受到影响。目前关于核桃化感作用方面的研究,主要集中在核桃组织器官提取物和浸提液对受体植物生长发育的影响上。有研究表明,核桃叶、果皮及根系会分泌胡桃醌(5-羟基苯醌)、黄酮类、酚类、亚油酸、棕榈酸等化合物,而这些化合物具有抑制农作物发芽及生长的潜能[10-11]。由于叶片是植物进行光合作用的主要场所,是植物体中数量最多、更新最快的器官,植物化感物质在叶片中含量也较多[12]。已有大量研究证明,核桃枝或叶水浸液对作物种子萌发及幼苗生长有影响[13-14],其叶片腐解液对小麦、玉米和萝卜等作物的生长也有明显的抑制作用[15]。为研究核桃凋落叶化感潜力在腐解过程中的变化情况,本试验通过模拟核桃凋落叶淋溶及在土壤中腐解释放化感物质的过程,对核桃凋落叶进行浸提和腐解处理,并使用未分解过的核桃凋落叶浸提液及腐解不同时间的腐解液进行室内生物测试,选用核桃栽培区常见冬性作物萝卜(Raphanussativus)为受体植物,对其种子萌发和幼苗的生长、生理特性等指标进行测定,以期为核桃凋落叶化感作用的研究以及核桃与冬性作物复合种植模式中林下凋落叶的管理提供一定参考。
1 材料与方法
1.1 试验材料
供体核桃叶收集于四川农业大学实验林场10年生核桃林中,选择自然凋落到地表的干净、未分解的叶片,取回后风干,剪成面积1 cm2左右的碎片备用;受体选择秋末冬初时节核桃叶凋落后常种植于核桃林下的园地作物萝卜(Raphanussativus),品种为“板叶满身红”,种子由四川种都种业有限公司提供。试验用土取自核桃生长地的表层土壤(pH 7.84,有机质24.282 g/kg,全氮0.672 g/kg,全磷6.720 g/kg,全钾5.708 g/kg,速效磷12.631 mg/kg,速效钾15.269 mg/kg),去除杂质,风干后过0.3 mm筛备用。培养基质为珍珠砂,其组分为:二氧化硅74.4%,三氧化二铝11.3%,三氧化二铁2%,氧化钙3%,锰2%,氧化钠5%,钾2.3%(均为质量分数);基本理化性质为:体积质量0.16 g/cm3,总孔隙度60.3%,大孔隙29.5%,小孔隙30.8%,水气比1∶1.04,pH 6.3。
1.2 试验设计
1.2.1 核桃凋落叶浸提液和腐解液的制备 根据野外调查,每年1 hm2核桃林地上的凋落叶量为8 000~9 000 kg,本试验地多年平均降雨量1 800 mm左右,折算核桃凋落叶的水浸液质量浓度为400 mg/mL,经过前期对各处理液多种浓度梯度的预试验,本试验以100 mg/mL代表核桃凋落叶水浸提液和腐解液高质量浓度处理(H),并将各处理液母液分别再稀释成50,25 mg/mL,分别代表中(M)、低质量浓度(L)处理。称取核桃凋落叶碎片20 g浸泡于200 mL蒸馏水中,在振荡器上振荡24 h(25 ℃),过滤后得质量浓度为100 mg/mL的浸提液母液(EH);另称取其碎片20 g,参照马世荣等[15]的方法,与相同质量的土样混匀后,按供试材料(核桃叶碎片+土壤):水质量比为1∶20,加入蒸馏水,置入200 mL容量瓶密封,再置于培养箱内(温度25 ℃)遮光腐解,期间每天搅拌2次,分别在培养20,40 d后,加入适量的无菌蒸馏水抽滤提取,并用无菌蒸馏水定容至200 mL,经纱布粗滤2次,分别得到质量浓度为100 mg/mL的凋落叶20 d腐解液母液(D1H)和40 d腐解液母液(D2H),试验时将各处理液母液分别再稀释成50 mg/mL(M)、25 mg/mL(L)。试验共设9个处理,即核桃凋落叶浸提液处理3个(EH、EM、EL),20 d腐解液处理3个(D1H、D1M、D1L),以及40 d腐解液处理3个(D2H、D2M、D2L),以蒸馏水作对照,4 ℃条件下贮藏备用。
1.2.2 核桃凋落叶浸提液和腐解液的化感效应 (1)对萝卜种子萌发的影响。采用培养皿滤纸法,选取粒大、饱满、无病虫害的萝卜种子作为试验材料。培养皿直径为9 cm,试验前置于烘箱内120 ℃消毒4 h。取不同处理核桃凋落叶浸提液或腐解液5 mL,加入铺有双层滤纸的培养皿,每个培养皿放置50粒种子,3次重复,对照加5 mL蒸馏水。各处理随机摆放到光照强度为4 000 lx的恒温光照培养箱中,每天记录不同处理的发芽种子数,以胚根突破种皮为准,每处理每天补充5 mL浸提液或腐解液,对照补充5 mL蒸馏水,7 d后计算发芽率、发芽势及发芽指数。
为了解不同处理液对萝卜种子碳氮代谢的影响,在进行发芽试验的同时,参照白祯等[16]的方法,在各处理液浸种48 h后,分别测定萝卜种子可溶性蛋白和可溶性糖含量。
(2)对萝卜幼苗生长的影响。采用培养皿砂培法。在直径9 cm培养皿中铺5 mm厚的已灭菌珍珠砂,将消毒且大小一致的萝卜种子20粒均匀放在珍珠砂表面,每皿加不同处理核桃凋落叶浸提液或腐解液5 mL,对照加5 mL蒸馏水,每处理3个重复,之后将培养皿置于25 ℃人工气候室培养30 d。每天观察种子发芽情况和珍珠岩的干湿度,适时加等量蒸馏水、核桃凋落叶浸提液和腐解液,30 d 时收获,并测量幼苗根长、苗高、鲜质量,同时取各处理新鲜叶片5 g立即测定抗性生理指标。
1.3 测定指标及方法
1.3.1 种子萌发指标 发芽率(GR)=(规定时间内发芽种子数/供试种子总数)×100%。
发芽势(GE)=(第3天发芽种子数/供试种子总数)×100%。
发芽指数(GI)=∑(Gt/Dt)。式中:Gt为第t天的发芽数,Dt为相应发芽天数。
1.3.2 抗性生理指标 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法[17],以抑制NBT光化还原的50%为1个酶活单位(U);过氧化物酶(POD)活性测定采用愈创木酚法[18],将1 min OD增加0.01定义为1个酶活单位(U);过氧化氢酶(CAT)活性测定采用紫外分光光度法[19],以1 min内OD减少0.1为1个酶活单位(U);丙二醛(MDA)含量测定采用硫代巴比妥酸加热显色法[18]测定。
种子和幼苗中可溶性糖(SS)和可溶性蛋白(SP)测定方法相同,其中可溶性糖(SS)含量测定采用硫代巴比妥酸加热显色法[18],可溶性蛋白(SP)含量测定采用考马斯亮蓝G250法[18]。
1.4 数据处理
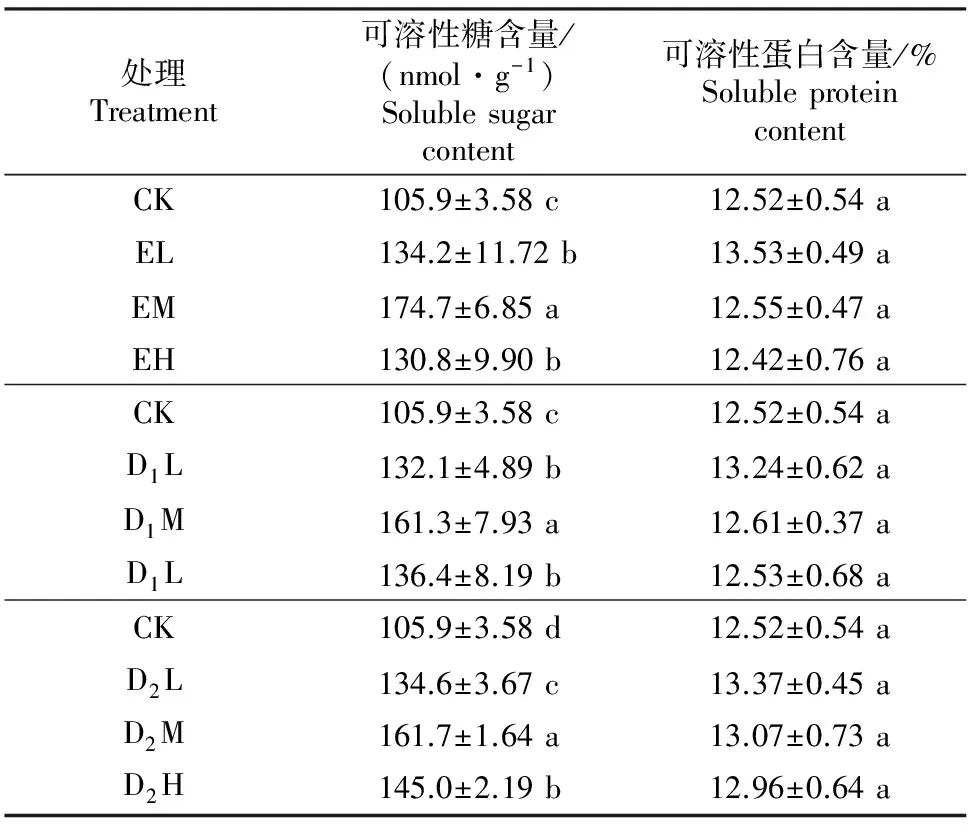
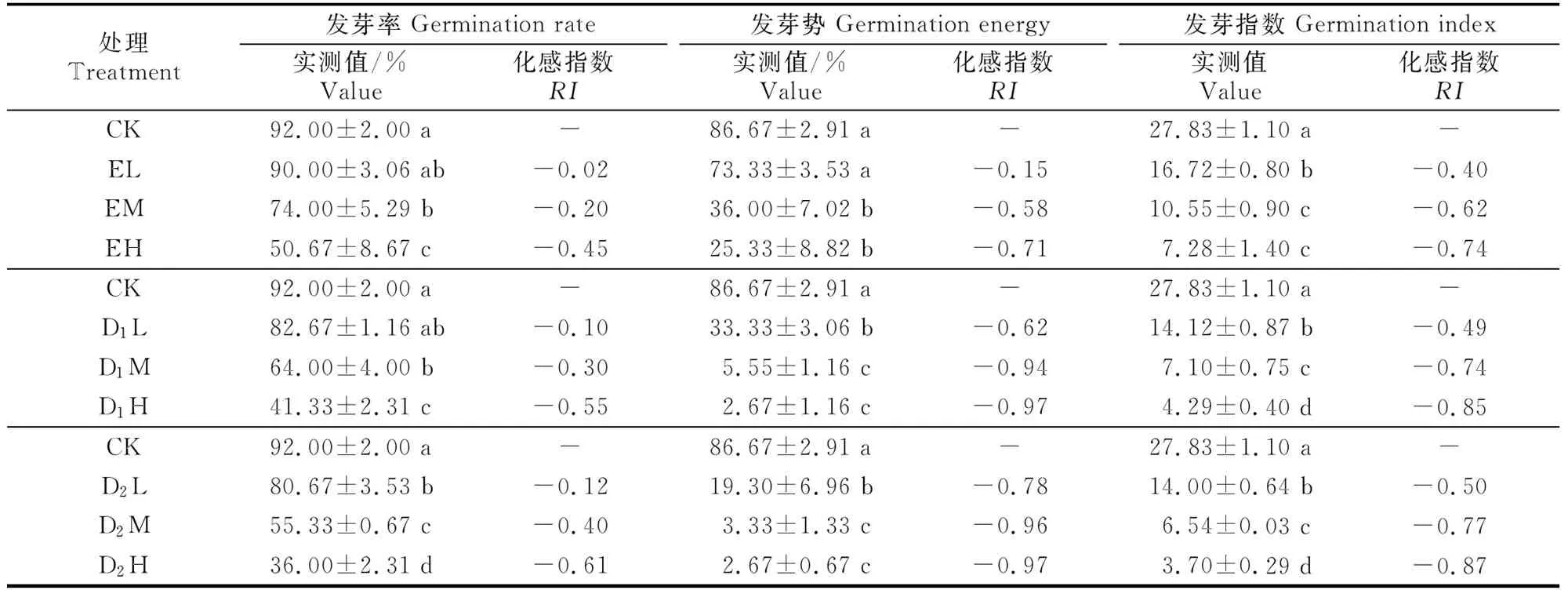
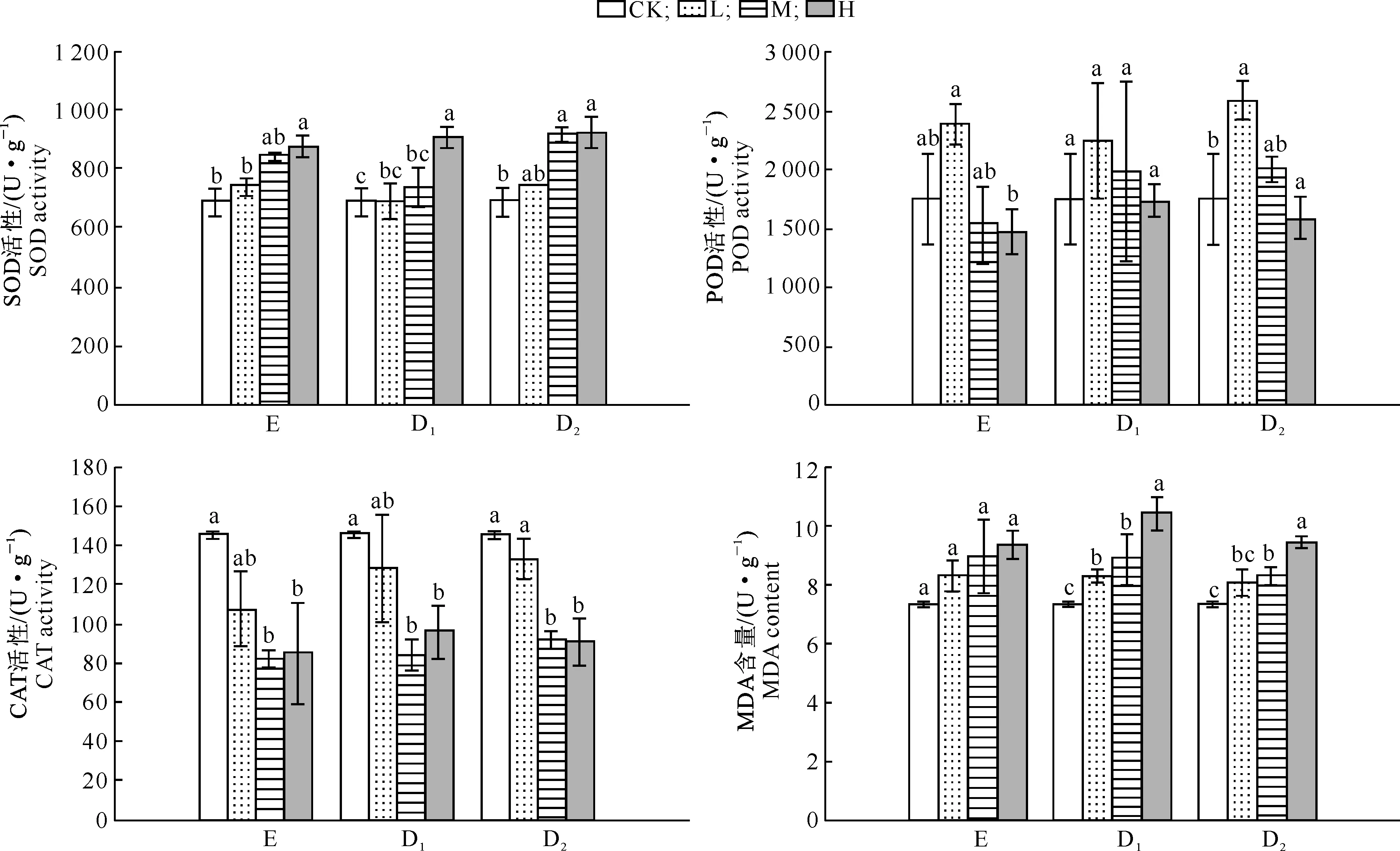
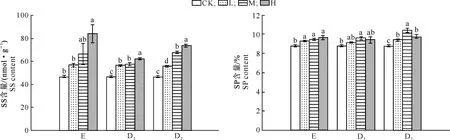
化感指数采用Williamson等[20]提出的计算方法:当T≥C时,RI=1-C/T;当T 采用SPSS 17.0(SPSS Inc.,USA)软件对数据进行单因素方差分析(One-way ANOVA),如果差异显著(P<0.05),再用最小显著差数法(LSD法)进行多重比较。用Excel 2007制表,Sigmaplot 10.0(Systat Software Inc.,USA)绘图。 2.1 核桃凋落叶浸提液和腐解液对萝卜种子萌发的影响 由表1可以看出,核桃凋落叶浸提液和腐解液均显著降低了萝卜种子的发芽率(EL、D1L处理除外)、发芽势(EL处理除外)和发芽指数,萝卜种子萌发受到的抑制效应随处理液质量浓度的升高而增强。植物的发芽指数可以用来衡量植物的发芽能力及活力,不同质量浓度核桃凋落叶浸提液和腐解液处理种子发芽指数均存在显著差异,且随着处理液质量浓度的升高,抑制作用逐渐加强;与对照相比,EL、EM和EH处理的发芽指数分别降低了39.9%,62.1%和73.9%,D1L、D1M和D1H处理分别降低了49.3%,74.5%和84.6%,D2L、D2M和D2H处理降低了49.6%,76.5%和86.7%。 注:CK.对照(不添加浸提液和腐解液);E、D1、D2分别表示核桃凋落叶浸提液以及20,40 d腐解液;L、M、H分别表示低(25 mg/mL)、中(50 mg/mL)、高质量浓度(100 mg/mL)处理;表中数据为3次重复的“平均数±标准差”;同列数据后标不同小写字母代表在P=0.05水平上差异显著,下表同。 Note:CK.Control(without aqueous extracts or decomposition liquids);E,D1,and D2stand for leaf litter water extracts,20 d leaf decomposition liquids and 40 d liquids;L,M and H stand for the low (25 mg/mL),medium (50 mg/mL) and high concentration (100 mg/mL) of aqueous extracts and decomposition liquids;The data in the table are the means for three samples±standard errors.Different lowercase letters indicate significant difference atP=0.05 level.The same below. 从表1化感指数看,核桃凋落叶腐解液和浸提液均对萝卜种子萌发有明显的抑制作用,且抑制效应与质量浓度呈正相关关系,同一质量浓度下,其化感抑制效应表现为D2>D1>E,即40 d腐解液>20 d腐解液>浸提液。 2.2 核桃凋落叶浸提液和腐解液对萝卜种子可溶性糖及可溶性蛋白含量的影响 由表2可知,核桃凋落叶浸提液和腐解液处理下萝卜种子可溶性糖含量与对照相比均表现为促进作用,且促进效应以中质量浓度处理最强,不同质量浓度浸提液以及20和40 d腐解液处理可溶性糖含量均显著高于对照(P<0.05),其中,EL、EM、EH处理与对照相比分别上升了26.72%,64.97%,23.51%;D1L、D1M、D1H处理分别上升24.74%,52.31%,28.80%;D2L、D2M、D2H处理分别上升27.10%,52.69%,36.92%。各处理液浸种后种子可溶性蛋白含量与对照差异均未达到显著水平(P>0.05),变化规律也不明显。 表 2 核桃凋落叶浸提液和腐解液对萝卜种子可溶性糖及可溶性蛋白含量的影响 2.3 核桃凋落叶浸提液和腐解液对萝卜幼苗生长的影响 由表3可知,在不同质量浓度核桃凋落叶浸提液和腐解液处理下,萝卜幼苗根长、苗高的生长多表现出“低促高抑”的浓度依赖效应。幼苗鲜质量是根生长和苗生长的综合表现,低质量浓度浸提液和腐解液处理幼苗鲜质量与对照相比表现为促进作用(RI≥0),与对照相比,EL、D1L、D2L处理幼苗鲜质量分别增加了16.12%,0.29%,0.80%。中、高质量浓度处理液对萝卜幼苗鲜质量表现为抑制作用(RI<0),与对照相比,EM、D1M、D2M处理幼苗鲜质量分别降低了2.07%,19.45%,13.60%;EH、D1H、D2H处理幼苗分别降低了22.38%,28.40%,36.55%。3种处理液中,E对萝卜幼苗鲜质量的化感抑制效应最弱,D1和D2的化感抑制效应较强。 表 3 核桃凋落叶浸提液和腐解液对萝卜幼苗生长的影响 总体而言,核桃凋落叶浸提液和腐解液对萝卜幼苗生长的化感作用随处理液质量浓度的增加而升高,其作用强度顺序总体为根长>鲜质量>苗高,对地下部分的抑制作用大于地上部分。 2.4 核桃凋落叶浸提液和腐解液对萝卜种子萌发及幼苗生长的综合化感效应 由表1和表3可以看出,各处理液对萝卜种子萌发和幼苗生长多表现出抑制作用。种子萌发试验结果表明,化感效应随处理液质量浓度的增加而增强,随处理液种类不同而发生变化,40 d腐解液(D2)处理的综合抑制效应最强(总RI=-5.98),其次是20 d腐解液(D1,总RI=-5.56),浸提液(E)最弱(总RI=-3.87)。对幼苗生长的化感综合效应的变化规律(D2处理总RI为-1.29,D1处理RI为-0.72,E处理RI为-0.43)与种子萌发试验结果一致,说明核桃凋落叶的化感物质首先通过影响萝卜种子萌发进而影响其幼苗生长。表明核桃凋落叶浸提液和腐解液都具有化感作用,且腐解液的化感潜力大于浸提液。 2.5 核桃凋落叶浸提液和腐解液对萝卜幼苗抗氧化保护酶活性及丙二醛含量的影响 由图1可知,随着核桃凋落叶浸提液和腐解液质量浓度的增加,萝卜幼苗SOD活性均表现出逐渐增强的趋势,其中高质量浓度处理下SOD活性与CK之间差异达到显著水平(P<0.05);EH、D1H、D2H分别较对照上升27.1%,31.8%,34.0%。 由图1可知,随处理液质量浓度的升高,POD活性呈现出先升高后降低的变化规律,但仅D2L、D2H处理的POD活性与对照差异达到了显著水平(P<0.05),其他处理与对照差异均不显著(P>0.05)。 由图1可知,萝卜幼苗CAT活性表现为随各处理液质量浓度的升高而降低,其中低质量浓度处理与对照差异均未达到显著水平(P>0.05),而中、高质量浓度处理均达到了显著水平(P<0.05)。 由图1可知,各处理萝卜幼苗的MDA含量均高于CK,并随处理液质量浓度的增加而增大。表明核桃凋落叶浸提液和腐解液可使萝卜幼苗叶片细胞膜发生膜脂过氧化反应,但不同质量浓度浸提液处理的MDA含量与CK差异均不显著(P>0.05),而20和40 d腐解液(低质量浓度处理除外)处理MDA含量均显著高于CK(P<0.05)。 2.6 核桃凋落叶浸提液和腐解液处理对萝卜幼苗渗透调节物质的影响 从图2可以看出,核桃凋落叶浸提液和腐解液处理萝卜幼苗叶片可溶性糖含量均明显著高于CK,且随各处理液质量浓度的增加呈上升趋势;各处理液的化感效应均在高质量浓度时最强,EH、D1H、D2H处理的RI值分别为0.44,0.25,0.37,随处理液质量液浓度的降低,其化感效应随之减弱, EL、D1L、D2L处理的RI值分别仅为0.18,0.17,0.16。 CK.对照(不添加浸提液和腐解液);E、D1、D2分别表示凋落叶浸提液及培养20,40 d腐解液;L、M、H分别表示3种处理液低(25 mg/mL)、中(50 mg/mL)、高质量浓度(100 mg/mL)处理;图柱上标不同字母表示差异显著(P<0.05),下图同 图 1 核桃凋落叶浸提液和腐解液处理下萝卜幼苗抗氧化保护酶活性及丙二醛含量的变化 Fig.1 SOD, CAT, and POD activities and MDA content of radish seedlings tread with the walnut leaf litter water extracts and decomposition liquids 图 2 核桃凋落叶浸提液和腐解液处理下萝卜幼苗可溶性糖(SS)和可溶性蛋白(SP)含量的变化 由图2可见,萝卜幼苗叶片可溶性蛋白含量随处理液质量浓度的增加而升高,且几乎均表现为促进作用(RI>0),只有20 d腐解液(D1)的效应相对不明显,仅D1M处理与对照差异达到显著水平(P<0.05)。浸提液(E)处理下,SP含量随处理液质量浓度的增加而呈现上升趋势,化感效应在高质量浓度时最强,RI值为0.09。40 d腐解液(D2)处理下,SP含量随处理液质量浓度的升高呈明显的先增加后减少的变化规律,各质量浓度处理均显著高于对照,中质量浓度时化感效应最强,RI值为0.15。 3.1 核桃凋落叶浸提液和腐解液对萝卜种子萌发及幼苗生长的影响 在秋季核桃落叶后,利用林下良好的光照条件开展核桃与冬性作物复合种植,是核桃种植区发展林下经济的一种优良林农复合经营模式,在该种植模式下,核桃化感物质释放的主要途径即是凋落物分解。有研究发现,化感物质有选择性和专一性,同一种化感物质,对不同受体植物的作用效果不同,同一受体的不同发育时期和生长部位对化感作用的敏感性不同,化感效应也存在差异[21]。Chen等[22]研究发现,相对于地上部分,根部对化感物质的反应更敏感。这可能是因为幼根和幼苗对外界刺激的敏感程度不同,根部与处理液直接接触,最先受到处理液的影响,导致根系更容易受到伤害,而地上部分的受害症状只有当根的受害作用积累到一定程度时才会表现出来[23]。本研究结果表明,核桃凋落叶腐解液和浸提液对萝卜种子各项萌发指标及幼苗部分部位生长产生了明显的抑制作用。其中萝卜幼苗根对各处理液的反应最为敏感,进一步印证了“化感物质主要通过对胚根生长的抑制而使植物矮小瘦弱,降低对资源的有效利用,进而影响植物后续的生长发育[24]”的观点。 3.2 核桃凋落叶浸提液和腐解液对萝卜化感作用的机理 逆境条件下,植物细胞内的自由基平衡被打破,自由基积累导致膜脂过氧化,对其机体造成损害,并伴有MDA的产生[25]。同时也诱导以超氧SOD、POD和CAT为主的保护酶系统活性升高,但胁迫超过一定范围后,保护酶系统会受到破坏,植物体内的活性氧代谢失调[26]。本试验结果表明,各处理萝卜幼苗SOD活性均高于CK,表现为促进作用,但此时处理后的幼苗CAT活性低于CK,可能是萝卜幼苗中的CAT酶对各处理液中的成分较敏感而活性受到抑制所致,这与钟宇等[27]用巨桉叶片水浸液处理紫花苜蓿的研究结果一致。而本研究中POD活性表现出低促高抑的现象,与孙海燕等[28]的研究结论相同。这可能是因为植物在外界因素诱导的胁迫下抗氧化酶系统产生积极的响应,但当胁迫压力超出一定范围时,活性氧的大量积累可能致使POD活性受到抑制。各处理MDA含量较CK而言表现出明显的升高趋势,说明核桃凋落叶分解释放的化感物质使植物体内活性氧的平衡遭到破坏,尽管萝卜幼苗体内的SOD和POD做出了积极响应,但仍无法将活性氧控制到正常水平,致使MDA含量升高,李翔等[29]的研究也得出了类似的结论。 逆境条件下,植物体内作为有机渗透保护物质的可溶性蛋白和可溶性糖含量会明显增加[30]。本研究中,与对照相比,不同核桃叶处理萝卜幼苗叶片中可溶性糖含量都明显增长,而可溶性蛋白含量却因处理液和质量浓度不同表现出差异,但总体呈现增长趋势。原因可能有几个方面:一是核桃凋落叶中释放的化感物质妨碍了萝卜幼苗对水分的吸收,造成了一定程度的水分胁迫,从而使可溶性糖大量积累[31];二是处理液对萝卜幼苗的化感胁迫导致细胞内大分子的糖类、组织蛋白质开始降解,转化为小分子的可溶性糖或可溶性蛋白;三是化感胁迫促使可溶性蛋白转化成可溶性糖,进而实现渗透调节作用,维持细胞渗透势稳定[31]。种子萌发是一个复杂的生理生化过程,本试验中各核桃叶处理萝卜种子可溶性糖和可溶性蛋白含量高于对照,表明萝卜种子对核桃凋落叶处理液的化感胁迫有明显的防护作用,通过促进其自身体内淀粉和贮藏蛋白的转化,提高种子体内的碳氮代谢速率,满足种子萌发及胚根和胚芽生长对物质与能量需要,增强化感胁迫下防御和修复损伤的能力。此外,从渗透调节状况看,萝卜种子通过增加体内渗透调节物质可溶性蛋白和可溶性糖来抵抗逆境,降低化感胁迫对种子萌发及生长的伤害。 由此可见,核桃凋落叶浸提液和腐解液通过影响萝卜种子内部碳氮代谢、幼苗抗氧化保护酶系统平衡及渗透调节物质的积累,降低了幼苗自身清除自由基的能力,破坏了幼苗活性氧平衡,导致膜脂过氧化,破坏了膜系统,最终抑制了萝卜种子的萌发及幼苗生长。 3.3 核桃凋落叶浸提液和腐解液化感潜力的差异 核桃凋落叶浸提液和不同时间段腐解液显示出不同化感效应。萝卜种子萌发、幼苗生长以及抗氧化能力和渗透物质调节的综合结果显示,40 d腐解液(D2)化感效应最强,20 d腐解液(D1)次之,浸提液(E)最弱。这与于建光等[32]在小麦秸秆浸提液和腐解液对水稻化感效应上的研究结论相似。植物体分解过程中表现出的化感效应具有明显的动态变化规律[27],核桃凋落叶对萝卜生长的抑制作用随其在土壤中腐解时间的延长而呈增强趋势,其原因可能与不同时间段植物残体分解释放化感物质的种类、数量及浓度差异相关[33]。本研究中,各处理液母液经稀释后对萝卜的化感效应有所减轻且缓解程度不同,其原因也可能在于此。此外不同化感物质之间作用强度的差异可能是不同化感物质针对生物膜上的靶位点不同造成的[34],化感物质通过某种方式将不同胁迫信息传送到植物体内,从而引起植物形态、细胞分裂、离子吸收、激素平衡、保护酶活性等生理过程的改变[35],这可能是不同化感物质化感效应强度不同的深层次原因。 本试验中,核桃凋落叶浸提液和腐解液对萝卜种子的萌发及幼苗部分部位生长具有较明显的抑制作用,且随着处理液质量浓度的升高而增强,并在一定的时间范围内随凋落叶腐解时间的延长抑制作用呈增强趋势。因此在生产实践中,减少单位面积上土壤表面核桃凋落叶的堆积量,可以有效减弱对其他植物生长的抑制作用。本研究虽在一定程度上模拟了核桃凋落叶经淋溶和腐解而释放化感物质的过程,但与自然条件下的化感作用形式可能还存在较大差距,特别是植物残体通过土壤腐解是一个复杂的生化过程,其化感潜力随腐解进程的变化规律还需要进一步研究。 [1]Chou C H.Introduction to allelopathy [M]//Reigosa M J,Pedrol N,González L,et al.Allelopathy:a physiological process with ecological implications.Dordrecht:Springer,2006:1-10. [2]孔垂华.植物化感作用研究中应注意的问题 [J].应用生态学报,1998,9(3):332-336. Kong C H.Problems needed attention on plant allelopathy research [J].Chinese Journal of Applied Ecology,1998,9(3):332-336. [3]马祥庆,刘爱琴,黄宝龙.杉木人工林自毒作用研究 [J].南京林业大学学报,2000,24(1):12-16. Ma X Q,Liu A Q,Huang B L.A study on self-poisoning effects of Chinese fir plantation [J].Journal of Nanjing Forestry University,2000,24(1):12-16. [4]郗荣庭,张毅萍.中国果树志:核桃卷 [M].北京:中国林业出版社,1996:1. Xi R T,Zhang Y P.Chinese journal of fruit tree:walnut volume [M].Beijing:China Forestry Publishing House,1996:1. [5]朱益川,韩华柏,吴万波.四川核桃及时栽培区划 [J].四川林业科技,2010,31(2):21-26. Zhu Y C,Han H B,Wu W B.Walnut resources and their cultivation division in Sichuan [J].Sichuan for Sci &Technol,2010,31(2):21-26. [6]Ercisli S,Esitken A,Turkkal C,et al.The allelopathic effects of juglone and walnut leaf extracts on yield,growth,chemical and PNE compositions of strawberry cv.fern [J].Plant Soil and Environment,2005,51(6):283-287. [7]Yun L,Bi H,Gao L,et al.Soil moisture and soil nutrient content in walnut-crop intercropping systems in the Loess Plateau of China [J].Arid Land Research and Management,2012,26(4):285-296. [8]Lu S,Zhang J,Meng P,et al.Soil respiration and its temperature sensitivity for walnut intercropping,walnut orchard and cropland systems in north China [J].Journal of Food,Agriculture and Environment,2012,10(2):1204-1208. [9]Garrett H,Jones J,Kurtz W,et al.Black walnut (JuglansnigraL.) agroforestry-its design and potential as a land-use alternative [J].The Forestry Chronicle,1991,67(3):213-218. [10]Cui C,Cai J,Jiang Z. Isolation and identification of allelochemicals in rhizosphere and adjacent soil under walnut(JuglunsregiaL.)trees [J].Allelopathy Journal,2012,29(1):25-36. [11]Cui C,Cai J,Jiang Z.Allelopathy in black walnut(JuglunsregiaL.)root exudates on germination,seeding growth and enzymatic of turnip(BrassicarapaL.) [J].Allelopathy Journal,2011,28(2):237-250. [12]Turk M A,Tawaha A M.Inhibitory effects of aqueous extracts of black mustard on germination and growth of lentil [J].Pak J Agronom,2002,1(1):28-30. [13]翟梅枝,高小红,赵彩霞,等.核桃枝叶水溶物的化感作用研究 [J].西北农业学报,2006,15(3):179-182. Zhai M Z,Gao X H,Zhao C X,et al.Study on allelopathy of aqueous extracts from walnut leaf and stem [J].Acta Agr Boreali-occidentalis Sinica,2006,15(3):179-182. [14]彭晓邦,程 飞,张硕新.核桃叶水浸液对不同产地黄苓的化感效应 [J].草地学报,2011,19(5):839-845. Peng X B,Cheng F,Zhang S X.Allelopathy of aqueous walnut leaf extracts on scutellaria [J].Acta Agrestia Sinica,2011,19(5):839-845. [15]马世荣,赵庆芳,郭小强,等.核桃叶腐解液化感作用初探 [J].北方园艺,2008(7):63-66. Ma S R,Zhao Q F,Guo X Q,et al.Allelopathy on decomposition liquids from the leaves ofJuglansregia[J].North Garden,2008(7):63-66. [16]白 祯,黄 明,黄建国.青篙素对蔬菜种子发芽和幼苗生长的化感效应 [J].生态学报,2013,33(23):7576-7582. Bai Z,Huang M,Huang J G.Allelopathic effects of artemisinin on seed germination and seeding growth of vegetables [J].Acta Ecologica Sinica,2013,33(23):7576-7582. [17]Giannopolitis C N,Roes S K.Superoxide dismutases:Ⅰ.occurrence in high plants [J].Plant Physiology,1977,59:309-314. [18]熊庆娥.植物生理学实验教程 [M].成都:四川科技出版社,2003. Xiong Q E.Plant physiology experiment course [M].Chengdu:Sichuan Sci-tech Publishing House,2003. [19]赵世杰,史国安,董新纯.植物生理学实验指导 [M].北京:中国农业科学技术出版社,2002. Zhao S J,Shi G A,Dong X C.Plant physiology experiment course [M].Beijing:China Agriculture Sci-tech Publishing House,2002. [20]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls [J].Journal of Chemical Ecology,1998,14(1):181-187. [21]Inderjit.Experimental complexities in evaluating the allelopathic activities in laboratory bioassays:a case study [J].Soil Biology and Biochemistry,2006,38(3):256-262. [22]Chen S U,Choib S K,Jung S.Effect of alfalfa leaf extracts and phenolic allelochemocals on early seeding growth and morphology of alfalfa and barnyard [J].Crop Protection,2002,21(10):1077-1082. [23]晏 婷,翟梅枝,王 元,等.核桃根系提取物对3种植物种子萌发和幼苗生长的化感作用 [J].华中农业大学学报,2012(6):713-719. Yan T,Zhai M Z,Wang Y,et al.Allelopathic effects of root extracts from walnut on seed germination and seedling growth of three plant types [J].Journal of Huazhong Agricultural University,2012(6):713-719. [24]许桂芳,许明录,刘明久.火炬树叶片腐解物浸提液对上海青种苗生长的影响 [J].生态环境学报,2010,19(10):2313-2317. Xu G F,Xu M L,Liu M J.Effect of aqueous from decomposed rhus typhina leaves on the seeding growth ofBrassicachinensis[J].Ecology Environ Sinica,2010,19(10):2313-2317. [25]李 坤,郭修武,郭印山,等.葡萄根系浸提液的化感作用 [J].应用生态学报,2010,21(7):1779-1784. Li K,Guo X W,Guo Y S,et al.Allelopathy of grape toot aqueous extracts [J].Chinese Journal of Applied Ecology,2010,21(7):1779-1784. [26]Polityck A B.Peroxidase activity and lidid peroxidation in roots of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids [J].Acta Physiologiae Plantarum,1996,18(4):365-370. [27]钟 宇,张 健,杨万勤,等.不同土壤水分条件下生长的巨桉对紫花苜蓿的化感作用 [J].草业学报,2009,18(4):81-86. Zhong Y,Zhang J,Yang W Q,et al.Allelopathic effect ofEucalyptusgrandisonMedicagosativagrowing in different soil water condition [J].Acta Prataculturae Sinica,2009,18(4):81-86. [28]孙海燕,王 炎.辣椒根系分泌的潜力化感物质对生菜幼苗抗氧化代谢的影响 [J].植物生理学报,2012,48(9):887-894. Sun H Y,Wang Y.Effect of root exudated potential allelochemicals in hot pepper(CapsicumannummL.)on antioxidative metabolism for lettuce(LactucasativaL.) [J].Plant Physiology Journal,2012,48(9):887-894. [29]李 翔,杨顺义,沈慧敏,等.黄花棘豆水提液对燕麦的化感作用及其机理研究 [J].西北植物学报,2011,31(7):1367-1375. Li X,Yang S Y,Shen H M,et al.Allelopathy and its mechanism of extract solution ofOxytropisochrocephalaonAvenasativa[J].Acta Bont Bore-Occi Sinica,2011,31(7):1367-1375. [30]高英志,王艳华,王静婷,等.草原植物碳水化合物对环境胁迫响应研究进展 [J].应用生态学报,2009,20(11):2827-2831. Gao Y Z,Wang Y H,Wang J T,et al.Research advances in the responses of carbohydrate in grassland plants to environmental stress [J].Chinese Journal of Applied Ecology,2009,20(11):2827-2831. [31]陈 洪,胡庭兴,杨万勤,等.巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响 [J].草业学报,2011,20(5):57-65. Chen H,Hu T X,Yang W Q,et al.Effects ofEucalyptusgrandisleaf litter on growth ang resistance physiology ofElymussibiricusin the initial decomposition process of litter in soil [J].Acta Prataculturae Sinica,2011,20(5):57-65. [32]于建光,顾 元,常志州,等.小麦秸秆浸提液和腐解液对水稻的化感效应 [J].土壤学报,2013,50(2):349-356. Yu J G,Gu Y,Chang Z Z,et al.Allelopathic effects of wheat straw extract and decomposition liquid on rice [J].Acta Pedologica Sinica,2013,50(2):349-356. [33]韩丽梅,王树起,鞠会艳,等.大豆根茬腐解产物的鉴定及化感作用的初步研究 [J].生态学报,2000,20(5):771-778. Han L M,Wang S Q,Ju H Y,et al.Identification and allelpathy on the decomposition products from soybean stubs [J].Acta Ecologica Sinica,2000,20(5):771-778. [34]Chen P K,Leather G R.Plant growth regulatory activities of artenisinin and its related compounds [J].J Chem Ecol,1990,16(6):1867-1876. [35]孔垂华,徐 涛,胡 飞,等.环境胁迫下植物的化感作用及其诱导机制 [J].生态学报,2000,20(5):849-854. Kong C H,Xu T,Hu F,et al.Allelopathy under environmental stress and its induced mechanism [J].Acta Ecologica Sinica,2000,20(5):849-854. Effect of water extracts and decomposed liquids of walnut leaf litter on seed germination and seedling growth of radish ZHANG Ruyi1,2,HU Hongling1,HU Tingxing1,RUAN Ruoyu1,YANG Limei1,SHU Lan1 (1 College of Forestry,Sichuan Agricultural University,Chengdu,Sichuan 611130,China;2NeijiangCityAcademyofAgriculturalSciences,Neijiang,Sichuan641000,China) 【Objective】 This study aimed at analyzing the influence of water extracts and leaching solution of decomposed walnut leaf litter (Juglansregia) on seed germination and seedling growth of radish (Raphanussativus) and exploring the potential allelopathic effect of walnut leaf litter.【Method】 Walnut leaf litter was treated by extraction and decomposition (20 d and 40 d).Four concentration levels of water extracts and leaching solution of decomposed walnut leaf litter including L (25 mg/mL),M (50 mg/mL),H (100 mg/mL) and CK (treated by distilled water) were used to test their effects on seed germination and seedling growth of radish.【Result】 Both water extract of non-decomposed walnut leaf litter and leaching solution of decomposed leaf litter reduced the germination rate,germination index and germination potential of radish seeds compared with control.The height,the root length,and the fresh weight of radish seedlings were increased at low level and decreased at high level.Water extracts and leaching solution improved the contents of soluble protein and soluble sugar of seeds and the malondialdehyde (MDA) content of seedling leaves.The activity of peroxidase (POD) and superoxide dismutase (SOD) in seedling leaves were also promoted,but the activity of catalase (CAT) was suppressed,the activity of peroxidase (POD) in seedling lesves exhibited a concentration effect of low concentration promotion and high concentration inhibition.The contents of soluble protein and soluble sugar increased with the dose.The allelopathic effect of leaching solution of decomposed leaf litter was higher than that of water extracts of non-decomposed leaf litter,and that of leaching solution after 40 d decomposition was higher than that of 20 d.【Conclusion】 Water extracts and leaching solution of decomposed leaf litter of walnut had significant inhibition on seed germination and seedling growth of radish.The inhibition increased as the increase of concentrations of solution and the inhibition increased as the increase of decomposition time of leaf litter. walnut leaf litter;water extract;leaching solution of decomposing leaf litter;radish;allelopathic effect 时间:2016-10-20 16:36 10.13207/j.cnki.jnwafu.2016.12.023 2015-04-20 国家“十二五”科技支撑计划项目(2011BAC09B05) 张如义(1989-),男,四川广元人,硕士,主要从事森林培育学研究。E-mail:847408099@qq.com 胡红玲(1985-),女,四川成都人,副教授,博士,主要从事林木栽培生理及森林生态学研究。 E-mail:hutx001@aliyun.com S664.1;S631.1 A 1671-9387(2016)12-0163-09 网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161020.1636.046.html2 结果与分析
3 讨 论
4 结 论

