碘过量的危害及相关机制
冯艳妮,姚小梅
碘过量的危害及相关机制
冯艳妮,姚小梅△
碘是合成甲状腺激素和维持机体正常生理功能的重要元素。碘过量可引起甲状腺功能减退、甲状腺功能亢进、自身免疫性甲状腺疾病等,不同个体对碘过量的易感性不同,过度的氧化应激及继发的免疫反应可能是碘过量引起甲状腺细胞毒性的潜在机制。本文对碘过量的流行病学现状、推荐摄入量和摄入来源、机体对碘过量的调节机制及其相关致病机制做一综述。
碘;甲状腺素;促甲状腺素;碘过量;流行病学;参考值;致病机制;氧化应激;免疫反应
碘是合成甲状腺激素所必需的微量元素,适宜的碘摄入量是维持甲状腺功能和正常生命活动的基础。碘缺乏可引起甲状腺疾病,特别是地方性甲状腺肿,俗称“大脖子病”;孕妇缺碘可导致早产、流产、死产、先天畸形儿、先天聋哑儿等。随着预防碘缺乏病的全球共同努力,消除碘缺乏病的目标已取得显著成效。碘过量和碘缺乏一样,都是引起甲状腺疾病的危险因素,日益引起人们的关注。本文就碘过量的流行病学现状、对机体的影响及相关机制做一综述。
1 流行病学现状
流行病学调查显示,碘过量可引起甲状腺功能减退[1-4]、甲状腺功能亢进[1-5]、自身免疫性甲状腺疾病[1-3]和甲状腺肿[2-3]等。世界卫生组织(WHO)的数据显示,已有三十多个国家碘摄入充足或过量[6-7]。2011年Shan等[8]对我国10个城市15 008名成人的碘营养状态调查结果显示,6个城市碘营养状态充足(AII),4个城市碘营养状态超足量(MTAII);且MTAII城市临床甲状腺功能减退症、亚临床甲状腺功能减退症的患病率以及甲状腺自身抗体阳性率明显高于AII城市。另外,在MTAII城市临床甲状腺功能亢进和Graves病的患病率也显著增加,与1999年相比,甲状腺肿的患病率显著下降,但甲状腺结节患病率显著增加。
2 推荐摄入量及机体易感性
国际控制碘缺乏病委员会提出碘的推荐摄入量为:成人(非孕妇)150 μg/d,孕妇220~250 μg/d,哺乳期妇女250~290 μg/d,该摄入量足以满足甲状腺合成激素的需求[1-4]。WHO将尿碘中位数>300 μg/L定义为碘过量,尿碘水平升高是判断碘过量的有力证据[1,6-7]。欧洲联盟(欧盟)制定的碘的最高适宜摄入量是600 μg/d,美国为1 100 μg/d。值得注意的是,不同个体对碘过量的表现不一,有些个体即使摄入较低量的碘即可引起不良反应[1]。老年人、孕妇、胎儿、哺乳期妇女和新生儿、有甲状腺疾病史的患者[如自身免疫性桥本病(Hashimoto’s disease)、Graves病、非毒性甲状腺结节、部分甲状腺切除术史等患者]是过量碘摄入引发不良结局的易感人群[1-5,9]。
3 摄入来源
可能造成碘过量的因素包括(1)含碘药物[1,5,9]。如含有碘化钾的咳喘糖浆、抗心律失常药胺碘酮,每天摄入300 mg的胺碘酮相当于摄入约9 mg碘;局部外用消毒碘制品等。(2)海藻制品。在日本和韩国特别是沿海地区,一些可食用的海藻含碘量丰富,是造成碘过量的危险因素[5,10]。研究提示藻类消费与甲状腺肿、自身免疫性甲状腺疾病的高发病率有关[9,11-12]。(3)特定的医疗条件也存在短期高碘摄入的情况。治疗严重甲亢的过程中,有甲状腺危象、术前有Graves病的患者、核电站附近核事故受害者,用卢戈氏液(Lugol’s solution)和饱和碘化钾溶液进行治疗的患者;放射学检查中,使用大量含碘造影剂的患者,使用碘化造影剂是急性碘过量与甲状腺疾病发生的潜在危险因素[5,9]。(4)含碘食品添加剂。如赤鲜红,常用于改善樱桃罐头或糖果的颜色,其成分中含有57%的碘[5]。(5)加碘食盐及利用含碘盐加工的食品(如面包、牛奶和各种零食),是最广泛的膳食碘的来源。随着“食盐加碘”的实施,多数地区的碘缺乏已得到有效控制,虽然加碘盐的工艺已取得很大进步,但仍需要在制作过程中格外注意,严格监控,确保加碘盐中碘的含量适量而不是超量[1,5,9]。(6)在饮水含碘量高的地区,居民摄入食用盐的碘含量应相应降低,以避免碘过量。动物饲料中的碘含量高或使用碘伏清洗奶罐,牛奶和奶制品也可含有丰富的碘[9]。因此,碘过量可能是上述一种或多种因素共同造成,缺乏准确而有效的监控也是重要原因之一。
4 碘过量对甲状腺激素和促甲状腺激素(TSH)的影响
短期高碘可能引发甲状腺激素的释放减少,血清TSH水平增加。表1列出了不同碘摄入量对个体甲状腺激素水平的影响。多数情况下,碘摄入对甲状腺激素的改变只是短暂的,在机体的急性Wolff-Chaikoff效应后恢复正常。目前没有发现短期高碘导致的明显的甲状腺功能减退或甲状腺肿大等临床症状,仅甲状腺体积略有增加[13]。
5 机体的调节机制
当碘摄入超过生理需要量时,机体可启动多种机制维持正常的甲状腺激素分泌。包括(1)钠-碘转运体(NIS)调节。NIS是位于甲状腺细胞基底膜上的一种特殊糖蛋白,碘过量时,NIS可调节进入甲状腺细胞的碘的浓度。(2)Wolff-Chaikoff效应。Wolff-Chaikoff效应指机体碘过量反常性地阻断了碘的有机化,抑制甲状腺激素的释放。Wolff-Chaikoff效应的发生取决于细胞内碘离子的浓度,是TSH依赖的自身调节性阻断。(3)TSH调节甲状腺的碘供给量。(4)阻断胶质分泌甲状腺激素。(5)有机碘的再分配[1]。
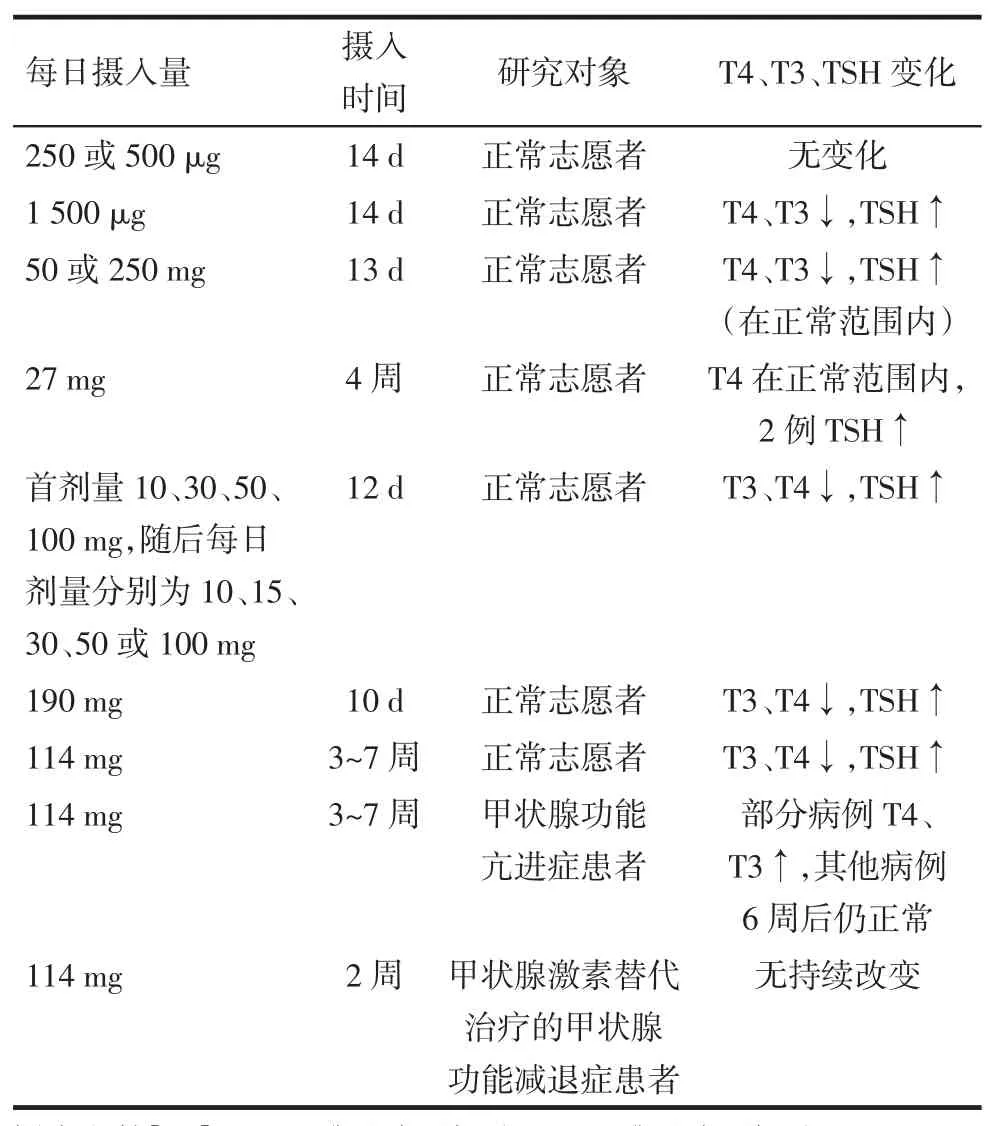
Tab.1Effects of different iodine intake levels and different time points on the thyroid hormone levels表1 不同碘摄入量及摄入时间对甲状腺激素水平的影响
6 致病机制
6.1 过度的氧化应激在生理条件下,甲状腺上皮细胞产生一定的活性氧,满足甲状腺激素合成的需要。同时甲状腺细胞具有各种酶系统,如谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶(SOD)和过氧化物酶家族,以维持氧化与抗氧化的平衡。而高碘状态可产生大量的活性氧,包括超氧阴离子、羟基自由基和过氧化氢(H2O2)等,从而导致氧化应激过度,超过了机体的抗氧化防御能力,导致细胞损伤[14]。
6.1.1 高浓度碘刺激H2O2的产生,影响氧化应激的水平在生理情况下,碘离子在H2O2和甲状腺过氧化物酶的作用下形成碘化酪氨酸,这是甲状腺激素合成的重要步骤。高浓度的碘在有机化过程中可产生过多的活性氧,进而破坏了氧化与抗氧化的平衡,破坏细胞内DNA、蛋白质、脂类等大分子物质。且高碘可刺激甲状腺产生H2O2,而高浓度的H2O2(>0.1 mmol/L)可诱导甲状腺细胞凋亡,当H2O2浓度>0.4 mmol/L时可导致甲状腺细胞坏死[14-15]。
6.1.2 高浓度碘刺激甲状腺线粒体超氧化物产生线粒体含有甲状腺激素的特异性受体,是甲状腺激素作用的重要位点之一,也是细胞内活性氧的重要来源,线粒体超氧化物在线粒体功能障碍中起着至关重要的作用。笔者前期利用线粒体荧光探针MitoSOX研究早期高浓度碘对大鼠甲状腺细胞(Fischer rat thyroid cell line,FRTL)影响,发现高浓度碘处理2 h后,FRTL中线粒体超氧化物产生显著增加、脂质过氧化、细胞色素C大量释放、细胞膜损伤,24 h后出现明显的DNA碎片和凋亡小体的形成;经抗甲状腺功能亢进药物丙基硫氧嘧啶(PTU,300 μmol/L)、TSH(10 mU/mL)、NIS竞争抑制剂过氯酸盐(KClO4,30 μmol/L)干预后,线粒体超氧化物产生明显减少;反之,SOD抑制剂二乙基二硫代氨基甲酸银(DETC,2mmol/L)可进一步促进甲状腺线粒体超氧化物产生[14]。
同时,线粒体呼吸链抑制剂也参与了高碘诱导的线粒体超氧化物的产生过程。线粒体呼吸链是活性氧产生的主要来源,线粒体超氧化物产生的两个主要位点是线粒体复合体Ⅰ和复合体Ⅲ。线粒体复合体Ⅰ抑制剂鱼藤酮(Rotenone)常被用作植物杀虫剂,线粒体复合体Ⅲ抑制剂Antimycin A常用于鱼类养殖的杀虫剂,可通过食用植物或鱼类被人体摄入。笔者研究发现,碘化钾处理FRTL细胞后2 h,线粒体超氧化物产生显著增加,且鱼藤酮(0.5 μmol/L)和Antimycin A(10 μmol/L)均可促进线粒体超氧化物产生,降低细胞活力[16]。
6.1.3 金属硫蛋白(Metallothionein-Ⅰ/Ⅱ,MT-Ⅰ/Ⅱ)基因敲除小鼠短期高碘饮食模型的研究金属硫蛋白具有较强的抗氧化活性、能够保护细胞免受活性氧损伤,被视为活性氧的清除剂。动物研究表明,与适碘饮食组相比,给予短期(28 d)100倍高碘饮食的MT-Ⅰ/Ⅱ基因敲除小鼠尿碘水平增高,线粒体超氧化物增加,乳酸脱氢酶活性增加,细胞活力下降,但血清甲状腺激素水平无明显变化[13,17]。
6.1.4 Wistar大鼠高碘饮食模型的研究笔者将Wistar大鼠随机分为适碘组、10倍高碘组和100倍高碘组处理7、14和28 d,发现各组间甲状腺激素水平无明显差别,但随着碘摄入量的增加,尿碘浓度显著增高,线粒体超氧化物产生增强,同时Nrf2-Keap 1抗氧化防御能力也增强。目前正在进行对Wistar大鼠高碘饮食长时间(5个月)处理的研究,初步研究结果提示除尿碘含量增加外,可出现甲状腺功能障碍。
6.2 高碘诱导的甲状腺自身免疫反应流行病学调查显示:碘过量与甲状腺自身抗体阳性和甲状腺功能障碍相关[3,18-19]。动物实验也提示碘过量可促进甲状腺自身免疫疾病的发生,导致淋巴细胞浸润及甲状腺滤泡结构的破坏[16]。碘过量可诱导氧化应激增强,导致甲状腺球蛋白氧化裂解,多肽链的免疫部位暴露,被自身抗体所识别,从而导致自身免疫性甲状腺疾病的发生[9]。
淋巴细胞浸润在碘诱导的自身免疫性甲状腺炎中起关键作用。碘致性甲状腺功能亢进可发生于有自身免疫倾向的动物,其特征为甲状腺淋巴细胞浸润,细胞因子的分泌增加,甲状腺主要组织相容性复合体(MHC)Ⅱ抗原和甲状腺自身抗体滴度升高。研究发现,高碘处理NOD-H2h4小鼠后,甲状腺出现CD4+T细胞,随后出现CD8+T细胞、巨噬细胞和B细胞。在浸润细胞聚集早期,同时出现白细胞介素(IL)-12和干扰素(IFN)-γ阳性细胞[20]。另外,高碘还可诱导甲状腺细胞MHCⅡ表达,且随着淋巴细胞浸润,甲状腺自身抗体的滴度明显上调[21]。
细胞间黏附分子(ICAM)-1是免疫反应的重要调节器,它可介导淋巴细胞在炎症部位聚集。高碘可诱导NOD-H2h4小鼠甲状腺细胞ICAM-1表达,分泌细胞因子和趋化因子,促进淋巴细胞浸润[22-23]。此外,甲状腺球蛋白的碘含量与T细胞自身识别有关。充分碘化的甲状腺球蛋白容易被T细胞亚群识别,而非碘化的甲状腺球蛋白不能引起明显的甲状腺病变。自身免疫性甲状腺炎的患者或健康人的淋巴细胞对非碘化的甲状腺球蛋白的刺激均不出现增殖效应,但对于充分碘化的甲状腺球蛋白的刺激均可出现明显的淋巴细胞增殖[24]。
7 小结
综上,碘过量可对机体造成多方面的影响,而不同个体对碘过量的表现不一。目前关于碘过量还缺乏深入的研究,过度氧化应激和自身免疫功能紊乱可能是其危害健康的致病基础,这为今后的研究指明了方向。在日常生活中,应注意合理膳食,科学补碘,针对特殊人群制定个体化方案。
[1]Bürgi H.Iodine excess[J].Best Pract Res Clin Endocrinol Metab,2010,24(1):107-115.doi:10.1016/j.beem.2009.08.010.
[2]Teng W,Shan Z,Teng X,et al.Effect of iodine intake on diseases in China[J].N Eng J Med,2006,29,354(26):2783-2793.doi:10.1056/NEJMoa054022.
[3]Laurberg P,Cerqueira C,Ovesen L,et al.Iodine intake as a determinant of thyroid disorders in populations[J].Best Pract Res Clin Endocrinol Metab,2010,24(1):13-27.doi:10.1016/j. beem.2009.08.013.
[4]Leung AM,Braverman LE.Consequences of excess iodine[J].Nat RevEndocrinol,2014,10(3):136-142.doi:10.1038/ nrendo.2013.251
[5]Roti E,Uberti ED.Iodine excess and hyperthyroidism[J].Thyroid,2001,11(5):493-500.doi:10.1089/105072501300176453.
[6]Zimmermann MB.Iodine deficiency and excess in children:Worldwide status in 2013[J].Endocr Pract,2013,19(5):839-846.doi:10.4158/EP13180.
[7]Zimmermann MB,Andersson M.Update on iodine status worldwide[J].Curr Opin Endocrinol Diabetes Obes,2012,19(5):382-387. doi:10.1097/MED.0b013e328357271a
[8]Shan Z,Chen L,Lian X,et al.Iodine status and prevalence of thyroid disorders after introduction of mandatory universal salt iodization for 16 years in China:a cross-sectional study in 10 cities[J].Thyroid,2016,26(8):1125-1130.doi:10.1089/ thy.2015.0613.
[9]Luo Y,Kawashima A,Ishido Y,et al.Iodine excess as an environmental risk factor for autoimmune thyroid disease[J].Int J Mol Sci,2014,15(7):12895-12912.doi:10.3390/ijms150712895.
[10]Zava TT,Zava DT.Assessment of Japanese iodine intake based on seaweed consumption in Japan:a literature-based analysis[J]. Thyroid Res,2011,4:14.doi:10.1186/1756-6614-4-14.
[11]Michikawa T,Inoue M,Shimazu T,et al.Japan Public Health Center-based Prospective Study Group.Seaweed consumption and the risk of thyroid cancer in women:the Japan public health centerbased prospective study[J].Eur J Cancer Prev,2012,21:254-260. doi:10.1097/CEJ.0b013e32834a8042.
[12]Tsubota-Utsugi M,Imai E,Nakade M,et al.Evaluation of the prevalence of iodine intakes above the tolerable upper intake level from four 3-day dietary records in a Japanese population[J].J Nutr Sci Vitaminol Tokyo,2013,59(4):310-316.
[13]Zhang N,Wang L,Duan Q,et al.Metallothionein-Ⅰ/Ⅱknockout miceaggravatemitochondrialsuperoxideproductionandperoxiredoxin 3 expression in thyroid after excessive iodide exposure[J].Oxid Med Cell Longev,2015,2015:267027.doi:10.1155/2015/267027.
[14]Yao XM,Li M,He J,et al.Effect of early acute high concentrations of iodide exposure on mitochondrial superoxide production in FRTL cells[J].Free Radic Biol Med,2012,52(8):1343-1352.doi:10.1016/j.freeradbiomed.2012.02.002.
[15]Poncin S,Gérard AC,Boucquey M,et al.Oxidative stress in the thyroid gland:from harmlessness to hazard depending on the iodine content[J].Endocrinology,2008,149(1):424-433.doi:10.1210/ en.2007-0951.
[16]Wang L,Duan Q,Wang T,et al.Mitochondrial respiratory chain inhibitors involved in ROS production induced by acute high concentrations of iodide and the effects of SOD as a protective factor[J].Oxid Med Cell Longev,2015,2015:217670.doi:10.1155/ 2015/217670.
[17]Duan Q,Wang T,Zhang N,et al.Propylthiouracil,perchlorate,and thyroid-stimulating hormone modulate high concentrations of iodide instigated mitochondrial superoxide production in the thyroids of metallothionein I/II knockout mice[J].Endocrinol Metab(Seoul),2016,31(1):174-184.doi:10.3803/ EnM.2016.31.1.174.
[18]Alsanosy RM,Gaffar AM,Khalafalla HE,et al.Current iodine nutrition status and progress toward elimination of iodine deficiency disorders in Jazan,Saudi Arabia[J].BMC Public Health,2012,12:1006.doi:10.1186/1471-2458-12-1006.
[19]Teng X,Shan Z,Chen Y,et al.More than adequate iodine intake mayincreasesubclinicalhypothyroidismandautoimmune thyroiditis:across-sectionalstudybasedontwoChinese communitieswithdifferentiodineintakelevels[J].EurJ Endocrinol,2011,164(6):943-950.doi:10.1530/EJE-10-1041.
[20]Bonita RE,Rose NR,Rasooly L,et al.Kinetics of mononuclear cell infiltration and cytokine expression in iodine-induced thyroiditis in the NOD-H2h4mouse[J].Exp Mol Pathol,2003,74(1):1-12.doi:10.1016/S0014-4800(03)80002-3.
[21]Xue H,Wang W,Shan Z,et al.Dynamic changes of CD4+CD25+regulatory T cells in NOD.H-2h4mice with iodine-induced autoimmune thyroiditis[J].Biol Trace Elem Res,2011,143(1):292-301.doi:10.1007/s12011-010-8815-x.
[22]Sharma RB,Alegria JD,Talor MV,et al.Iodine and IFN-γ synergisticallyenhanceintercellularadhesionmolecule1 expression on NOD.H2h4mouse thyrocytes[J].J Immunol,2005,174(12):7740-7745.
[23]Horie I,Abiru N,Nagayama Y,et al.T helper type 17 immune response plays an indispensable role for development of iodineinduced autoimmune thyroiditis in nonobese diabetic-H2h4mice[J].Endocrinology,2009,150(11):5135-5142.doi:10.1210/ en.2009-0434.
[24]Rasooly L,Burek CL,Rose NR.Iodine-induced autoimmune thyroiditis in NOD-H-2h4mice[J].Clin Immunol Immunopathol,1996,81(3):287-292.
(2016-10-09收稿2016-10-29修回)
(本文编辑胡小宁)
The harm of iodine excess and the related mechanism
FENG Yanni,YAO Xiaomei△
Department of Physiology and Pathophysiology,School of Basic Medicine,Tianjin Medical University,Tianjin 300070,China△
Iodine is a key element in the synthesis of thyroid hormones and maintaining the normal physiological function.The iodine excess can lead to hypothyroidism,hyperthyroidism and autoimmune thyroid diseases.Individuals have different susceptibility to iodine excess.Excessive oxidative stress and secondary immune response may be the potential mechanisms of thyrotoxicity induced by iodine excess.This review updates the epidemiological results of iodine excess,and recommended intake standards,which may be involved in iodine excess and the regulatory mechanisms and pathogenesis in body to counteract iodine excess.
iodine;thyroxine;thyrotropin;iodine excess;epidemiology;reference values;pathogenic mechanism; oxidative stress;immune reaction
R335.2,R581
A
10.11958/20161087
国家自然科学基金资助项目(81273009);天津市科委课题(16JCYBJC26100,09JCYBJC11700)
天津医科大学基础医学院生理与病理生理学系(邮编300070)
冯艳妮(1992),女,硕士在读,主要从事碘与甲状腺相关病理生理学机制的研究
△通讯作者E-mail:jupx@163.com

