草鱼多肽功能性质及营养价值
陈丽丽, 白春清, 袁美兰, 赵 利, 毛 洁
(江西科技师范大学 生命科学学院/江西省生物加工过程重点实验室/国家大宗淡水鱼加工技术研发分中心, 江西 南昌 330013)

草鱼多肽功能性质及营养价值
陈丽丽, 白春清, 袁美兰, 赵 利, 毛 洁
(江西科技师范大学 生命科学学院/江西省生物加工过程重点实验室/国家大宗淡水鱼加工技术研发分中心, 江西 南昌 330013)
研究草鱼多肽的溶解性、起泡性、乳化性、吸湿保湿性和稳定性等功能性质,以及草鱼多肽的氨基酸组成,并评价其营养价值。结果表明草鱼多肽具有良好的功能特性。草鱼多肽粉18种氨基酸总质量分数为90.94%,必需氨基酸占总氨基酸质量分数的41.33%;草鱼多肽的生物价、必需氨基酸指数、营养指数和氨基酸比值系数分别为71.51,76.34,74.81和77.19。草鱼多肽的氨基酸组成平衡、合理,是一种优质的蛋白质资源。
草鱼; 多肽; 功能性质; 营养价值; 氨基酸
草鱼(grass carp)属鲤形目鲤科雅罗鱼亚科草鱼属。草鱼味甘、性温、无毒,入肝和胃经,具有暖胃和中、平降肝阳、祛风、治痹、益肠和明目之功效。任娇艳[1]对草鱼、青鱼、鳙鱼、鲢鱼、鲫鱼和鲈鱼的相关性质进行研究,得到草鱼鱼肉中的蛋白质质量分数(18.20%)均高于其他四大家鱼,并且脂肪质量分数也较低(1.97%)。黄春红等[2]对四大家鱼(青、草、鲢、鳙)的鱼头进行了营养成分的测定,结果表明草鱼中必需氨基酸占总氨基酸的含量高于其他3种鱼,草鱼中总氨基酸里的呈味氨基酸含量也是最高的。草鱼鱼肉高蛋白低脂肪,是一种比较优质的蛋白质资源。
鱼蛋白质经酶解后得到的水解物,其溶解性、乳化性、起泡性和流变性等物理特性得到明显改善[3-4],且水解液中氨基酸种类齐全[5],其中不同长度的肽段具有促进氨基酸、矿物质元素吸收[6]、抗疲劳[7]和抗氧化[8-9]等生理功能。杨东等[10]用胰蛋白酶水解鲢鱼蛋白,提取得到了不同水解度(degree of hydrolysis,DH)的鱼蛋白水解物(fish protein hydrolysate,FPH),结果表明在一定范围内鲢鱼蛋白溶解性随着水解度的增加而增强;同时,酶解得到的鱼蛋白水解物还能提高其乳化和起泡能力。
生物活性肽独特的生理、理化以及感官特性,使其在保健食品和药品中具有重要的应用价值。其口感质量、生物效价以及贮藏稳定性等均受其理化特性的影响。生物活性肽具有抗氧化性和抗菌性,不仅可以提高食品的营养和功效,同时对食品的保存期也有一定的延长作用[11-12]。
目前国内外学者研究主要集中在利用水解动物蛋白(hydrolyzed animal protein,HAP)开发具有鲜味、香味的蛋白肽,1996年日本医药公司通过酶解大马哈鱼制备了一种滋味天然纯正、鲜味醇厚的低聚肽调味料[13]。
由于蛋白质在强酸或强碱环境中会使氨基酸遭到不同程度的破坏,也会引起消旋反应,同时,在反应的过程中会产生大量的盐并且有毒副作用。目前比较常用的方法是蛋白酶水解法,它具有反应条件温和、安全无污染、产物有效成分保存较完全等优点。但是,水解过程中原料蛋白的选择、水解程度的控制也是影响多肽生物活性的重要因素。碱性蛋白酶对羧端疏水性氨基酸的专一性较强,能分解蛋白质分子肽链生产多肽和氨基酸,具有较强的分解蛋白质的能力,它可以水解酪蛋白的Glu、Leu、Met、Lys、Tyr 以及 Gln 的羧端肽键[14]。所以一般会选择碱性蛋白酶来水解鱼蛋白。
采用Alcalase碱性蛋白酶酶解草鱼蛋白,通过脱盐、浓缩及冷冻干燥等方法制备得到草鱼多肽。测定草鱼多肽的溶解性、起泡性、乳化性、流变性、吸湿保湿性、稳定性能等功能性质;进一步测定草鱼多肽的氨基酸含量、构成比例,对其营养做出全面的评价。
1 材料与方法
1.1 材料与试剂
Alcalase碱性蛋白酶(200 000 U/mL),Novozymes公司;牛血清蛋白,上海蓝季科技发展有限公司;大豆分离蛋白,天津环宇红星食品贸易;乳清蛋白,南京松冠生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma 公司;盐酸、氢氧化钠均为分析纯。
1.2 仪器与设备
DELTA- 320型精密pH计,Mettler Toledo;HZ- 8812S型多用途水浴恒温振荡器,Hualida Laboratory Equipment Company;TDL- 5A型离心机,上海菲恰尔分析仪器有限公司;T25型高速分散机,Ika Works Guangzhou;NDJ- 1型旋转黏度计,上海精密仪器有限公司;BSA224S- CW 型电子分析天平,北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 草鱼多肽溶液的制备
参照文献[15],称取300 g预处理好的草鱼肉于酶反应器中,加4 500 mL蒸馏水,温度设为55 ℃,转速200 r/min,1 mol/L NaOH溶液调pH值至 9.0。待温度上升到55 ℃时,加入质量分数1.8%的Alcalase碱性蛋白酶,反应180 min,反应过程中维持pH 9.0恒定。酶解结束后,95 ℃下灭活5 min,冷却至室温,用1 mol/L盐酸调pH值至7.0,离心得上清液,即草鱼多肽溶液。
1.3.2 草鱼多肽黏度的测定
在大孔吸附树脂DA201- C对草鱼多肽最佳脱盐工艺的基础上,对不同水解度的草鱼多肽进行脱盐处理[16]。水解液经过脱盐、浓缩、冷冻干燥得到水解度为5%,10%,15%和20%的草鱼多肽粉末,从而对不同水解度草鱼多肽进行功能性质的测定。利用NDJ- 1型旋转黏度计在pH值7.0和25 ℃下,测定不同水解度草鱼多肽表观黏度。
1.3.3 草鱼多肽溶解性的测定
用氮溶解指数[15](nitrogen solubility index,NSI)来评价草鱼多肽的溶解性能。取不同水解度(5%,10%,15%和20%)草鱼多肽1 g加入50 mL水溶解,用1 mol/L HCl或NaOH溶液调节溶液pH值 (2.0~10.0),振荡30 min,在转速5 000 r/min离心30 min,测定样品的含氮量。氮溶解指数的计算方法如式(1):
(1)
1.3.4 草鱼多肽乳化性的测定
参照文献[17-18],分别取0.2 g不同水解度的草鱼多肽、大豆分离蛋白和乳清蛋白溶于100 mL磷酸缓冲液(0.2 mol/L pH 7.0)中。取30 mL样品溶液与10 mL大豆色拉油混合,均质1 min(15 000 r/min,25 ℃),此时记为0时刻,静置10 min记为10时刻,分别在均质0和10 min后取样。每次取50 μL乳化液用10 mL质量浓度1 mg/mL的SDS(pH值7.0)溶液稀释,混匀后500 nm处测定吸光值,以SDS溶液作为空白。乳化性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)计算方法见式(2)、式(3):
EAI=(2 000×2.303dil×A0)/(ρ×φ×L);
(2)
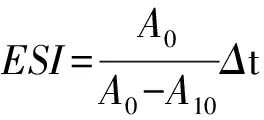
(3)
其中dil为稀释倍数,A0为乳化液0时刻的吸光值,ρ为样品质量浓度(g/mL),φ为乳化液中油相的比例(0.25),L为比色池光径10 mm,A10为10 min后的吸光值,Δt为10 min。EAI表示每克蛋白质的乳化面积(m2/g)。
1.3.5 草鱼多肽起泡性的测定
将不同水解度的草鱼多肽、大豆分离蛋白和乳清蛋白配制成质量浓度30 mg/mL的溶液。取50 mL置于250 mL量筒中,用均质机在15 000 r/min下均质3 min,记录均质后液体与泡沫的总体积。计算起泡性(FC)、泡沫稳定性(FS),方法见式(4)、式(5):
起泡性
FC=[(V0-50)/50]×100%;
(4)
泡沫稳定性
FS=[(Vt-50)/50]×100%。
(5)
其中V0为均质后溶液与泡沫的总体积;Vt为均质不同时间后泡沫与溶液的总体积。
1.3.6 草鱼多肽吸湿性的测定
取不同水解度的草鱼多肽1 g于培养皿中,置于培养箱中,控制相对湿度(relative humidity,RH)分别为81%和32%,温度20 ℃。分别称量吸湿 1,3,6,12,24,36和48 h后各试样的质量。吸湿率(Rn)计算见式(6):
Rn=[(Wn-W0)/W0]×100%。
(6)
其中W0为草鱼多肽吸湿前的质量,Wn为草鱼多肽放置n小时后的质量。
1.3.7 草鱼多肽保湿性的测定
取不同水解度的草鱼多肽1 g于培养皿中,置于培养箱中,加入质量浓度0.1 g/mL的多肽,然后分别置于RH为32%和0(硅胶环境)的培养箱中,控制温度20 ℃,称量放置1,3,6,12,24,36和48 h后各试样的质量。保湿率(Rr)的计算见式(7):
Rr=(Hn/H0)×100%。
(7)
其中H0为草鱼多肽含水质量,Hn为草鱼多肽n小时后的质量。
1.3.8 不同水解度草鱼多肽稳定性的测定
1.3.8.1 温度对草鱼多肽抗氧化活性的影响
将不同水解度草鱼多肽(蛋白质量浓度10 mg/mL)分别在 20, 40,60,80,100,120 ℃水浴(高压灭菌锅中反应)保温2 h后,快速冷却,测其清除DPPH·的活性保持率。
1.3.8.2 pH值对草鱼多肽抗氧化活性的影响
将不同水解度草鱼多肽(蛋白质量浓度10 mg/mL)的pH值分别调至2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0和10.0,室温下放置2 h,然后将各溶液的pH值调至7.0,测其清除 DPPH·的活性保持率。
1.3.8.3 金属离子对草鱼多肽抗氧化活性的影响
分别在不同水解度草鱼多肽(蛋白质量浓度10 mg/mL)中添加 0.5,1.0,2.5,5.0 mmol/L的Ca2+、Fe3+、K+、Zn2+和Mg2+溶液,静置2 h后测其清除DPPH·的活性保持率。
1.3.8.4 食品配料对草鱼多肽抗氧化活性的影响
分别在不同水解度草鱼多肽溶液(蛋白质量浓度10 mg/mL)中添加质量分数2.0%,4.0%,6.0%,8.0%和10.0%的葡萄糖、蔗糖和NaCl。在120 ℃、0.1 MPa条件下加热10 min,冷却至室温,测其清除DPPH·的活性保持率。
1.3.9 草鱼多肽的营养评价
1.3.9.1 氨基酸组成分析
采用高效液相色谱法测定草鱼多肽的氨基酸组成[19],样品经过6 mol/L 含质量浓度10 mg/mL苯酚的盐酸在110 ℃下水解24 h。
1.3.9.2 化学评分
化学评分(chemical score,CS)采用联合国粮食及农业组织(Food and Agriculture Organization of the United, FAO)推荐的方法[20-21]。
化学评分值越大说明待测样品中蛋白质必需氨基酸组成与标准鸡蛋蛋白的必需氨基酸组成越接近。计算如式(8):
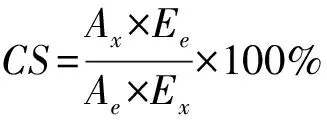
(8)
Ax为待测蛋白质中某一必需氨基酸的质量分数;Ae为待测蛋白质中必需氨基酸的总质量分数;Ex为标准鸡蛋白中相应必需氨基酸的质量分数;Ee为标准鸡蛋白中必需氨基酸的总质量分数。
1.3.9.3 氨基酸评分
氨基酸评分(amino acid score,AAS)是指样品蛋白质中某一必需氨基酸质量分数占FAO和世界卫生组织(World Health Organization, WHO)评分模式中相应的氨基酸质量分数的百分比。计算方法如式(9):
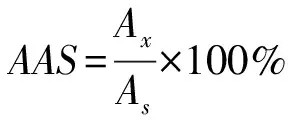
(9)
Ax为实验样品中某一必需氨基酸质量分数,As为FAO评分模式中相应氨基酸质量分数。
1.3.9.4 必需氨基酸指数的计算
必需氨基酸指数(essential amino acid index,EAAI)的测定参照陈丽华等[22]的方法,稍作修改。EAAI是指样品蛋白质中所有必需氨基酸相对于标准蛋白质中所有必需氨基酸的比率。EAAI的计算如式(10):
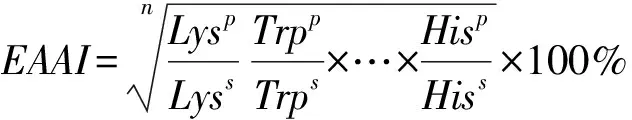
(10)
p代表样品;s代表标准蛋白质(鸡蛋);n为参与计算的氨基酸个数。
生物价与必需氨基酸指数存在一定的相关性,经验公式为BV=1.09×EAAI-11.7。营养指数(nutritional index,NI)则为必需氨基酸指数与蛋白质质量分数(PP)的成绩计算公式如式(11):
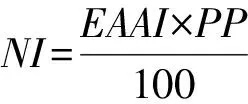
(11)
1.3.9.5 氨基酸比值系数分的计算
氨基酸比值系数分(score of ratio coefficient of amino acid,SRCAA)按吴晓红等[23]的方法进行测定。SRCAA是一个没有单位的相对数,用各种必需氨基酸偏离模式氨基酸的离散度来评价蛋白质。它与食物中蛋白质的含量没有关系,因此不受蛋白质换算、水分含量测定、定氮等人为因素的影响。计算方法如式(12)~式(14):

(12)

(13)
氨基酸比值系数分=100-CV×100。
(14)
氨基酸比值系数(radio coefficient of amino acid, RCAA)表示氨基酸偏离模式氨基酸的程度,RCAA大于1表示氨基酸相对过量,限制性氨基酸的RCAA值最小;CV表示RCAA的变异系数,它是标准差与均数的商。
2 结果与讨论
2.1 草鱼多肽的溶解性与黏度
2.1.1 溶解性分析
蛋白质的溶解性主要与蛋白质分子表面电荷有关[24-25]。蛋白质中精氨酸的侧链氨基和天门冬氨酸残基的侧链羧基等基团可随体系中pH值的变化而电离,从而使蛋白质所带电荷随pH值的变化而变化。在等电点附近,蛋白质分子表面的分子间静电斥力减小,分子聚集沉淀,从而导致溶解度降低;而在酸性和碱性pH环境下,因偏离等电点,蛋白质分子表面分别带正电荷或负电荷,分子趋于解离,溶解度增大。酶解使得蛋白质分子中的极性基团(—COOH和—NH2)数目增加,削弱了蛋白质之间的疏水相互作用[24-25],同时离心和过柱还可去除部分不溶性蛋白质。水解后的草鱼多肽在pH值为2~10均具有良好的溶解性能,不同水解度的草鱼多肽溶解性没有显著差异(见图1)。
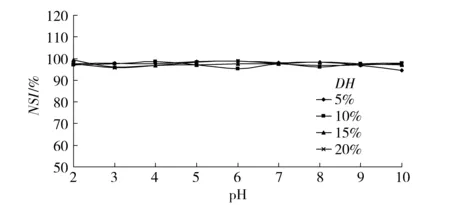
图1 不同pH值条件下草鱼多肽的溶解性Fig.1 Effect of pH values on nitrogen solubility index
2.1.2 黏度
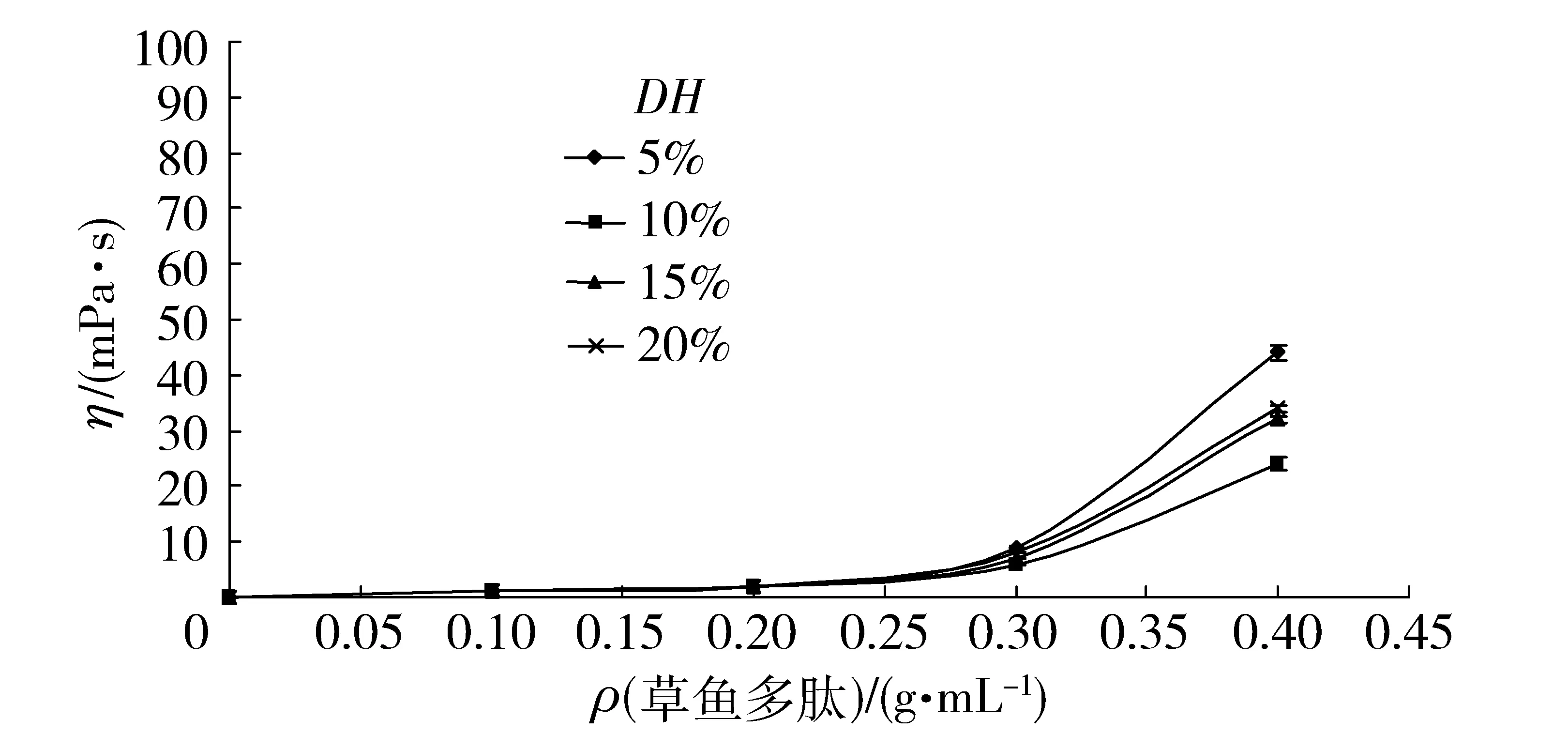
图2 草鱼多肽质量浓度对黏度的影响Fig.2 Effects of concentrations on viscosity of grass carp peptides
溶液的黏度反映了液体流动时的阻力,黏度对食品分散的成分有一定的稳定作用,同时也可以改善食品的口感。不同水解度的多肽黏度随质量浓度变化情况如图2。当草鱼多肽的质量浓度从0.1 g/mL增加到30%,不同水解度草鱼多肽的黏度变化不大。当草鱼多肽的质量浓度为0.4 g/mL时,不同水解度草鱼多肽溶液的黏度均增加明显,但仍然具有良好的流动性。这是因为当蛋白质溶解在水中时,酸性和基本的亚单位就会通过双硫键连接起来,形成牢固的网状结构,有利于蛋白质吸水膨胀,进而使黏度增加[26]。酶解时,草鱼蛋白质被水解为小分子肽或氨基酸,网状结构遭到破坏,黏度也随之下降[26]。
2.2 草鱼多肽的乳化性与起泡性
2.2.1 乳化性分析
酶解破坏草鱼蛋白质分子的空间结构,产生的多肽是一种表面活性物质,油相在分散过程中形成许多细小的油滴,酶解产生的多肽吸附在油滴表面阻止了小油滴之间的结合,疏水与亲水基团共同促进了反应体系产生水包油型乳化物。草鱼蛋白经过Alcalase碱性蛋白酶水解后,乳化性和乳化稳定性有提高的趋势(见图3、图4)。当水解度达到20%时,蛋白质酶解物的EAI达到56.97%,大豆分离蛋白和乳清蛋白的乳化性能低于水解度为15%和20%的草鱼蛋白,略高于水解度为5%和10%的草鱼蛋白。草鱼多肽的乳化稳定性能随着水解度的增大先增加后减小,在水解度为15%时达到最大值41.11%,不同水解度的草鱼蛋白乳化稳定性均优于大豆分离蛋白和乳清蛋白。
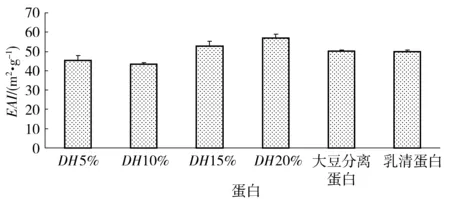
图3 水解度对草鱼多肽乳化性能影响Fig.3 Effects of DH values on emulsifying activities of grass carp peptides
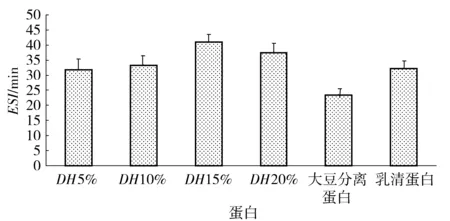
图4 水解度对草鱼多肽乳化稳定性的影响Fig.4 Effects of DH values on emulsion stabilityof grass carp peptides
2.2.2 起泡性分析
起泡性一般是指气体在连续或半连续相中分散所形成的多孔膜状分散体系,酶解产生的肽链能降低溶液的表面张力,从热力学角度上讲,整个体系表面能的降低有利于泡沫的产生。多肽的起泡性随着水解度的升高而下降,水解度为5%的草鱼多肽的起泡能力最强达到86%,是相同质量浓度下大豆分离蛋白的1.8倍,是乳清蛋白的2.4倍,见图5。随着水解度的增加,草鱼多肽的泡沫稳定性逐渐降低。在10 min时,不同水解度草鱼多肽的泡沫稳定性均低于大豆分离蛋白和乳清蛋白。这可能是由于蛋白质水解度越高多肽的平均链长越短,而较短的肽链表面活性较差,维持泡沫稳定的能力比大分子蛋白和长链多肽差。同时随着蛋白质的水解,体系的黏度逐渐降低,使多孔膜的排液速率升高从而降低泡沫稳定性[27]。
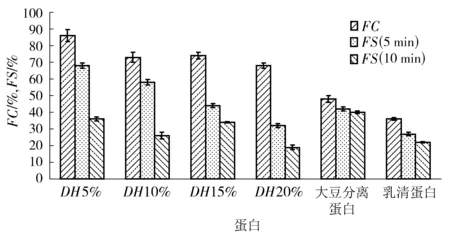
图5 水解度对草鱼多肽起泡性和泡沫稳定性的影响Fig.5 Effects of DH values on foaming capacity and foaming stability of grass carp peptides
2.3 草鱼多肽吸湿保湿性能
2.3.1 吸湿性分析
不同水解度的草鱼多肽在RH32%和81%环境中的吸湿性如图6。4种草鱼多肽在RH32%中的吸湿性与RH81%中的相比,有显著差异。在RH81%环境下草鱼多肽具有良好的吸湿性,而在RH32%环境下多肽的吸湿率均不随时间的延长而增加,这可能是由于草鱼多肽在RH32%的环境下迅速达到了动态平衡。比较图6a和图6b可知,10%水解度的草鱼多肽吸湿效果最好。
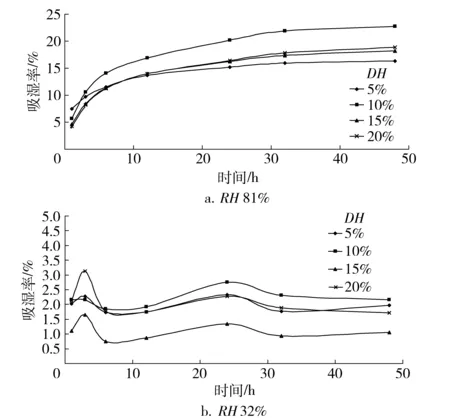
图6 不同水解度草鱼多肽吸湿率与时间的变化关系Fig.6 Correlations between hygroscopicity of grass carp peptides with different DH values and time
2.3.2 保湿性分析
随着时间的延长,不同水解度的草鱼多肽保湿率开始下降,不同相对湿度下草鱼多肽均在30 h后趋于平衡(见图7)。RH81%和 32%时,10%水解度的草鱼多肽保湿能力相对较好。
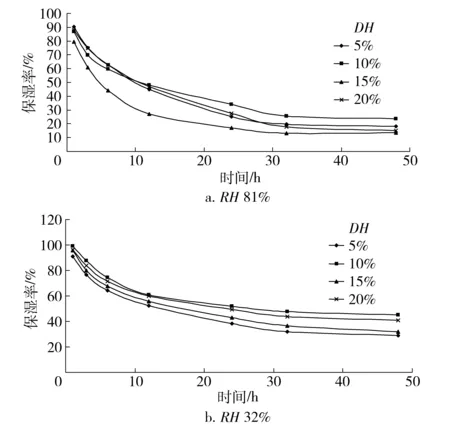
图7 不同水解度草鱼多肽保湿率与时间的变化关系Fig.7 Correlations between moisture retention of grass carp peptides with different DH values and time
2.4 不同因素对草鱼多肽抗氧化活性的影响
2.4.1 草鱼多肽的相对分子质量
当相对分子质量Mr在1 000~10 000 Da,随着水解度的增加Mr逐渐降低;水解度为20%时,Mr大于5 000 Da的只占总肽质量分数的0.05%(见表1)。而Mr小于1 000 Da时,随着水解度的增加Mr增加,尤其是在180~500 Da,各种水解度的草鱼多肽的相对分子质量所占的比率最大。所以草鱼多肽是小分子肽,易于被人体吸收利用。
2.4.2 温度对草鱼多肽DPPH·清除活性的影响
随着温度的升高,不同水解度的草鱼多肽对DPPH·的清除效率均不断升高,120 ℃时水解度5%,10%,15%和20%的草鱼多肽对DPPH·的清除率,分别是20 ℃时的125.8%,129%,136.7%,131.7%(见图8)。这可能是由于高温下多肽中含有的少量糖类与氨基酸发生了美拉德反应从而使抗氧化能力提高[28-32]。
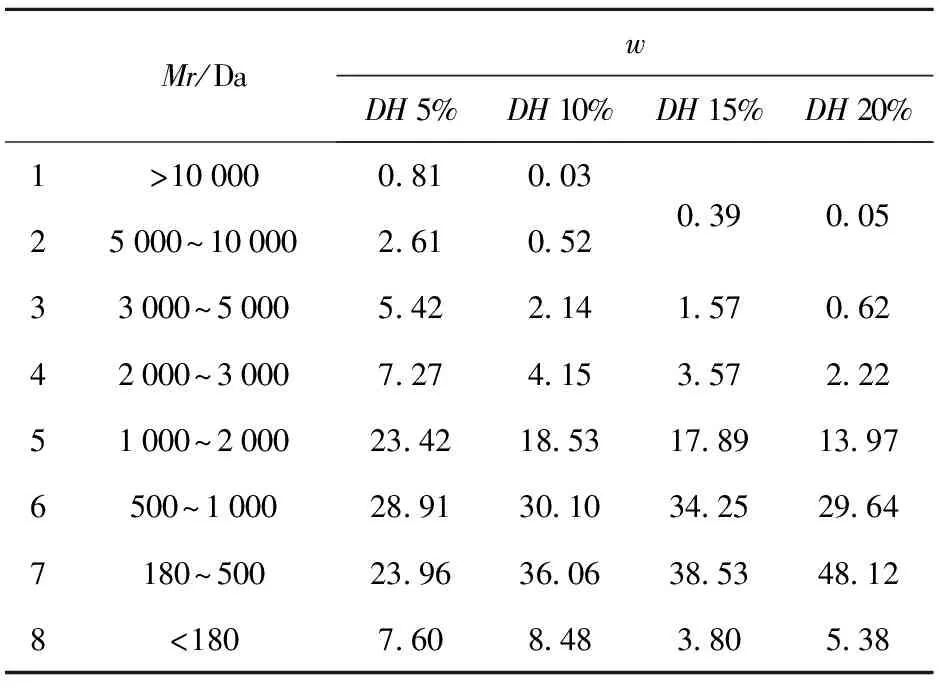
表1 不同水解度草鱼多肽的相对分子质量分布
2.4.3 pH值对草鱼多肽DPPH·清除活性的影响
草鱼多肽对pH值具有良好的稳定性能。pH值2~10,草鱼多肽对DPPH·的清除率均在95%以上(见图9)。表明不同pH值对草鱼多肽的抗氧化活性影响不显著。

图9 pH值对不同水解度草鱼多肽抗氧化活性的影响Fig.9 Effects of pH on antioxidant activity of grass carp peptides with different DH values
2.4.4 金属离子对草鱼多肽DPPH·清除活性的影响
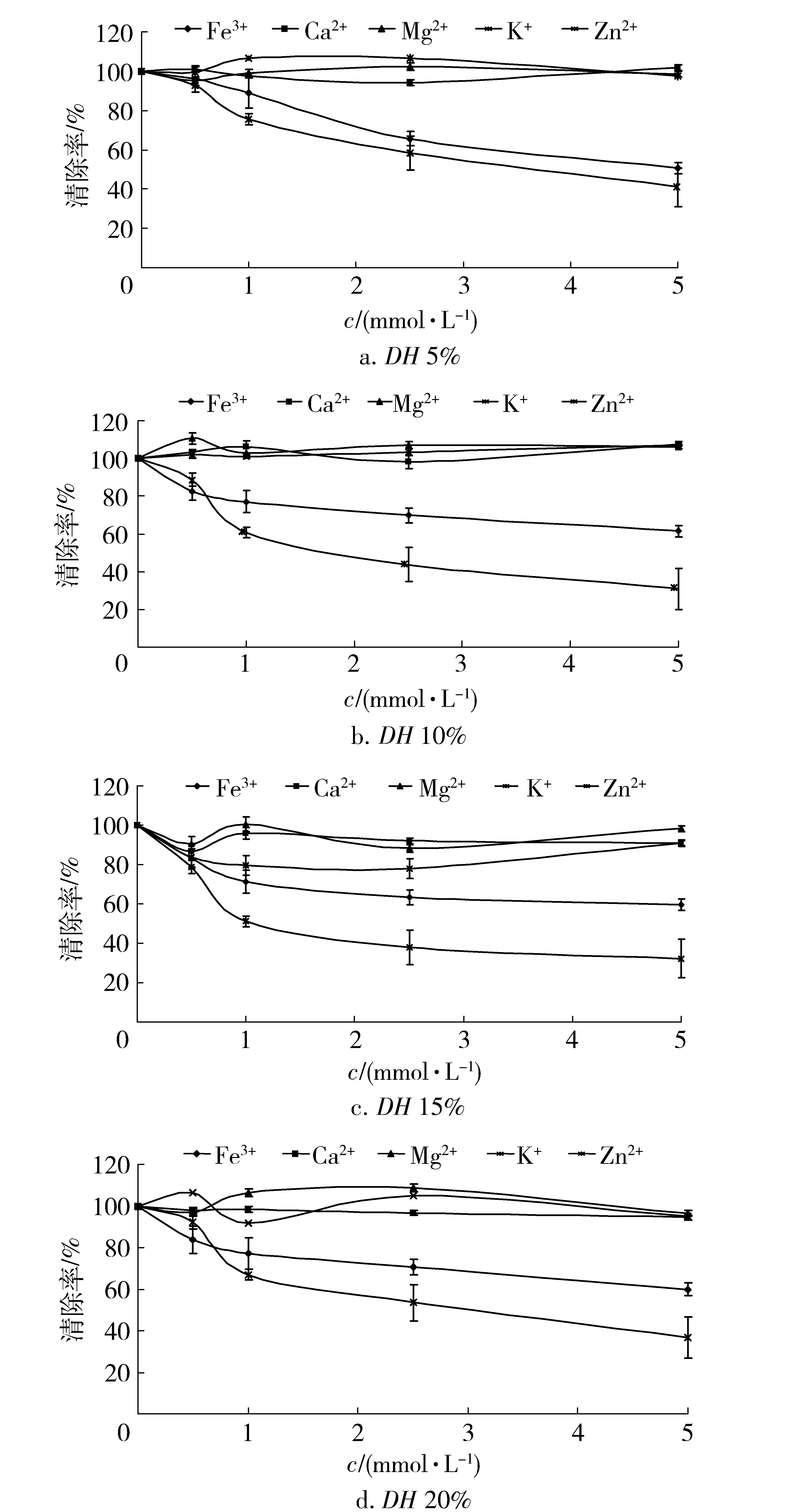
图10 金属离子对草鱼多肽抗氧化活性的影响Fig.10 Effects of metal ions on antioxidant activity of grass carp peptides
不同的金属离子对不同水解度草鱼多肽抗氧化活性的影响如图10。随着Fe3+和Zn2+浓度的增加,草鱼多肽抗氧化活性均有所降低,在Fe3+浓度达到 5.0 mmol/L时,水解度为10%草鱼多肽清除DPPH·的活性保持率仅达到30.8%。Mg2+、Ca2+和K+则对不同水解度草鱼多肽的抗氧化活性影响不显著。此外,当Fe3+浓度为0.5 mmol/L和1.0 mmol/L,Zn2+浓度为2.5 mmol/L和5.0 mmol/L时,不同水解度的草鱼多肽均会出现沉淀现象,所以草鱼多肽在加工储存时应该尽量避免与Fe3+和Zn2+接触。2.4.5 食品配料对草鱼多肽DPPH·清除活性的影响
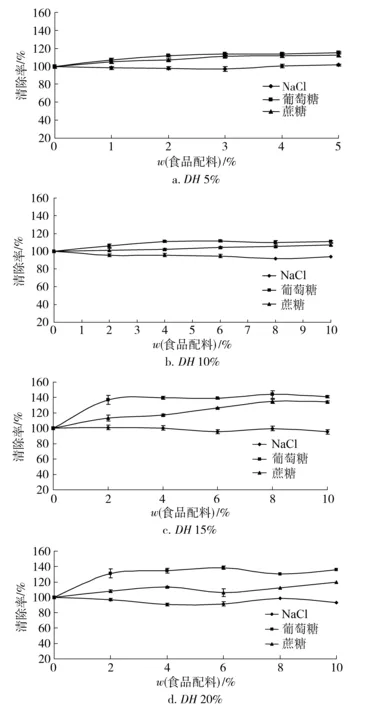
图11 食品配料对草鱼多肽抗氧化活性的影响Fig.11 Effects of food ingredients on antioxidant activity of grass carp peptides
在加工过程中,葡萄糖类对不同水解度草鱼多肽抗氧化活性的影响大于蔗糖(见图11)。当葡萄糖添加量为质量分数10.0%时,水解度5%,10%,15%和20%草鱼多肽清除DPPH·的能力比空白样品分别提升 1.15,1.10,1.41和1.35倍。当蔗糖添加量为质量分数10.0%时,水解度5%,10%,15%和20%草鱼多肽清除DPPH·的能力比空白样品分别提升1.12,1.07,1.34和1.19倍。这可能是蔗糖和葡萄糖与草鱼多肽发生了美拉德反应,生成了还原性物质醛和酮等,使得草鱼多肽的抗氧化活性有一定程度的增加。NaCl对不同水解度草鱼多肽抗氧化活性的影响不显著,当氯化钠的添加量达到质量分数10.0%时,不同水解度草鱼多肽清除DPPH·活性损失不到8%。
2.5 草鱼多肽的营养评价
草鱼多肽中非必需氨基酸质量分数分别为天门冬氨酸9.54%、谷氨酸14.30%、丝氨酸3.53%、组氨酸2.07%、精氨酸5.29%、甘氨酸5.22%、脯氨酸4.34%、丙氨酸5.32%。草鱼多肽中必需氨基酸质量分数及营养评分如表2。草鱼多肽粉18种氨基酸总质量分数为90.94%,第一限制性氨基酸为色氨酸,占总氨基酸的0.76%。草鱼多肽中必需氨基酸占总氨基酸的41.33%。在必需氨基酸中质量分数最高的为赖氨酸(9.07%),氨基酸评分为164.89,而赖氨酸为大部分谷物的第一限制性氨基酸,故草鱼多肽粉可以与赖氨酸相对不足的五谷杂粮形成互补,有助于提高草鱼蛋白的利用价值。草鱼多肽中谷氨酸、天门冬氨酸和甘氨酸的总质量分数达到29.06%,而这3种氨基酸于甘味和鲜味有关,草鱼多肽粉适合用于开发高档风味调料、调味品以及作为功能食品的添加剂等。由表2可知,草鱼多肽中不同必需氨基酸的AAS和CS不同。草鱼多肽的BV、EAAI、NI和SRCAA分别为71.51,76.34,74.81和77.19。
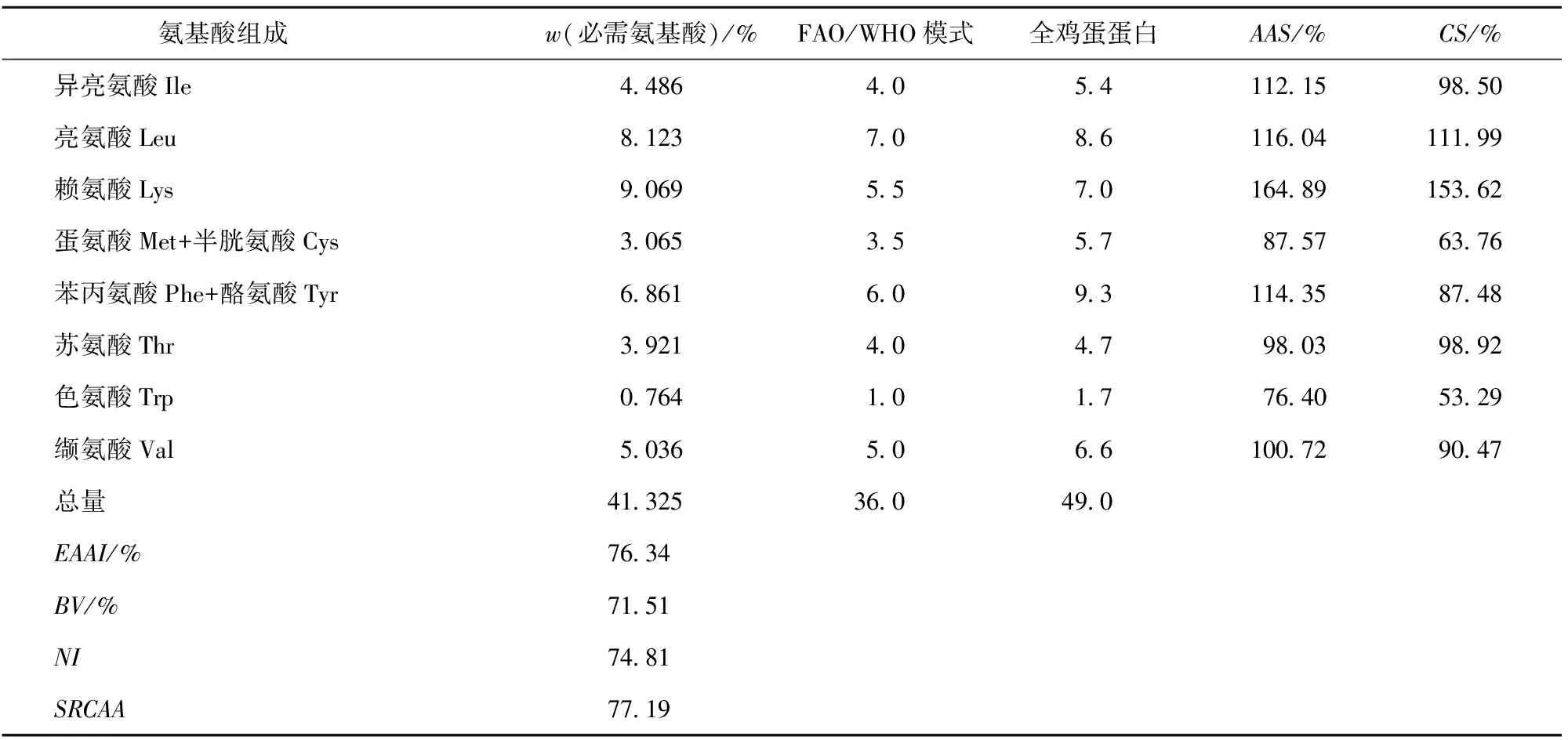
表2 草鱼多肽的氨基酸组成与评分
3 结 论
水解后的草鱼多肽在pH值为2.0~10.0均具有良好的溶解性能,不同水解度的草鱼多肽溶解性没有明显差异。草鱼多肽粉18种氨基酸总质量分数为90.94%,必需氨基酸占总氨基酸的41.33%;第一限制性氨基酸为色氨酸,占总氨基酸的0.76%;在必需氨基酸中质量分数最高的为赖氨酸(9.07%);氨基酸评分为164.89。草鱼多肽中呈味氨基酸(谷氨酸、天门冬氨酸和甘氨酸)的总质量分数达到29.06%,表明草鱼多肽可用于开发高档风味调料、调味品以及作为功能食品的添加剂等。
[1] 任娇艳. 草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D]. 广州: 华南理工大学, 2008.
[2] 黄春红,曾伯平,董建波. 青鱼、草鱼、鲢鱼和鳙鱼鱼头营养成分比较[J]. 湖南文理学院学报(自然科学版), 2008, 20(3): 46-48. HUANG C H, ZENG B P, DONG J B. Comparison of nutrients in the head of blank carp, grass carp, silver carp and bighead carp[J]. Journal of Hunan University of Arts and Science (Science and Technology), 2008, 20(3): 46-48.
[3] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroidesleptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102: 1317-1327.
[4] RAHALI V, CHOBERT J M, HTERTLE T, et al. Emusification of chemical and enzymatic hydrolysates of β-lactogobulin: characterization of the peptides adsorbed at the interface[J]. Nahrung, 2000, 44(2): 89-95.
[5] 王新星, 孔凡华, 许团辉, 等. 水解鱼蛋白营养组成及评价[J]. 渔业科学进展, 2011, 32(3): 104-110. WANG X X, KONG F H, XU T H, et al. Evaluation on the nutritional composition of fish protein hydrolysate[J]. Progress in Fishery Sciences, 2011, 32(3): 104-110.
[6] NESSE K O, NAGALAKSHMI A P, MARIMUTHU P, et al. Efficacy of a fish protein hydrolysate in malnourished children[J]. Indian Journal of Clinical Bio-chemistry, 2011, 26(4): 360-365.
[7] 赵玉红, 孔保华, 张立钢. 鱼肽的抗疲劳功能研究[J]. 东北农业大学学报, 2005, 36(4): 490-493. ZHAO Y H, KONG B H, ZHANG L G.Study on the anti-fatigued function of fish peptide[J]. Journal of Northeast Agricultural University, 2005, 36(4): 490-493.
[8] LI Li, WANG Jinshui, ZHAO Mouming, et al. Artificial neural networks for production of antioxidant peptides derived from big head carp with alcalase[J]. Food Technology Biotechnology, 2006, 44(3): 441-448.
[9] 李琳. 鳙鱼蛋白控制酶解及酶解物抗氧化研究[D]. 广州: 华南理工大学, 2006.
[10] 杨东,王慥. 水解鱼蛋白及其功能特性的研究[J]. 食品科学,1999(11): 23-26. YANG D, WANG Z. Study on the functional characteristics of hydrolysis of fish protein[J]. Food Science, 1999(11): 23-26.
[11] DE HOLANDA H D, NETTO F M. Recovery of components from shrimp (Xiphopenaeuskroyeri) processing waste by enzymatic hydrolysis[J]. Journal of Food Science, 2006, 71(5): 298-303.
[12] 许学书,王宏,周家春,等. 营养鲜味剂的研制[J]. 无锡轻工大学学报, 2002, 21(3): 268-272. XU X S, WANG H, ZHOU J C,et al. Preparation of nutrient flavor[J]. Journal of Wuxi University of Light Industry, 2002, 21(3): 268-272.
[13] 秦莹. 日本天然调味料的市场动向[J]. 食品工业,1996, 50(5): 30-31. QIN Y. Market trends of Japan’s natural seasoning[J]. Food Industry, 1996, 50(5):30-31.
[14] 石岭. 草鱼多肽粉及其功能性质的研究[D]. 南昌: 江西科技师范大学, 2014.
[15] 石岭,赵利,袁美兰,等. 响应面法优化碱性蛋白酶酶解草鱼蛋白质[J]. 食品科学, 2014, 35(4): 26-29. SHI L, ZHAO L, YUAN M L, et al. Optimizing conditions for alcalase-catalyzed hydrolysis of grass carp protein by response surface methodology[J]. Food Science, 2014, 35(4):26-29.
[16] 蒋清君, 侯利霞. 花生蛋白酶解液特性的研究[J]. 现代食品科技, 2010, 26(6): 566-568. JIANG Q J, HOU L X. Physicochemical properties of protein hydrolyzates obtained from peanut[J]. Modern Food Science and Technology, 2010, 26(6): 566-568.
[17] 于泓鹏, 陈运生, 吴克刚, 等. 罗非鱼水解多肽的乳化性及乳化稳定性研究[J]. 食品科技, 2015, 40(2): 328-333. YU H P, CHEN Y S, WU K G, et al. Emulsifying activity and emulsifying stability of hydrolyzed polypeptide of tilapia[J]. Food Science and Technology, 2015, 40(2): 328-333.
[18] HIROTSUKA M, TANIGUCHI H, NARITA H, et al. Functionaltiy and digestibility of a highly pholsphorylated soybean protein[J]. Agricultural and Biological Chemistry, 1984, 48(1): 93-100.
[19] ADEYEYE E I. Amino acid composition of three species of Nigerian fish:Clariasanguillaris,OreochromisniloticusandCynoglossussenegalensis[J]. Food chemistry, 2009, 113(1): 43-46.
[20] PIRILA V. FAO: nutrition studies:amino acid content of foods and biological data on proteins[J]. Fao Nutritional Studies, 1970,26(24): 1-285.
[21] SELIGSON F H, MACKEY L N. Variable predictions of protein quality by chemical score due to amino acid ana-lysis and reference pattern[J]. The Journal of Nutrition, 1984, 114(4): 682-691.
[22] 陈丽华, 肖作兵, 周培根. 中国对虾蛋白质的营养价值评价[J]. 上海海洋大学学报, 2009, 18(1):87-93. CHEN L H, XIAO Z B, ZHOU P G. Nutritional value evaluation of proteins inPenaeuschinensis[J]. Journal of Shanghai Ocean University, 2009, 18(1):87-93.
[23] 吴晓红, 王振宇, 郑洪亮, 等. 红松仁蛋白氨基酸组成分析及营养评价[J]. 食品工业科技, 2011, 32(1):267-270. WU X H, WANG Z Y, ZHENG H L, et al. Study on content of amino acid in the pine seed protein and its nutritive evaluation[J]. Science and Technology of Food Industry, 2011, 32(1):267-270.
[24] 郭浩楠. 鲢鱼蛋白酶解物的功能性质、抗氧化活性及其ACE抑制肽的制备[D]. 杭州: 浙江工商大学, 2011.
[25] 唐小丹. 罗非鱼肉蛋白的分离及其性质研究[D]. 湛江: 广东海洋大学, 2011.
[26] 杜冬梅. 酶法制备菜籽多肽及其特性研究[D]. 长沙: 湖南农业大学, 2012.
[27] MARTIN A H, GROLLE K, BOS M A, et al. Network forming properties of various proteins adsorbed at the air/water interface in relation to foam stability[J]. Journal of Colloid and Interface Science, 2002, 254(1): 175-183.
[28] LAN Xiaohong, LIU Ping, XIA Shuqin, et al. Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system: further insights into thermal degradation and cross-linking[J]. Food Chemistry, 2010, 120(4): 967-972.
[29] 刘平. 美拉德肽的形成机理及功能特性研究[D]. 无锡: 江南大学, 2012.
[30] 孟艳丽, 董士远. 美拉德反应修饰的鲢鱼肽抗氧化活性初探[J]. 肉类研究, 2010(8): 26-30. MENG Y L, DONG S Y. Preliminarily research on antioxidant activity of silver carp peptides modified by Maillard reaction[J]. Meat Research, 2010(8): 26-30.
[31] BENJAKUL S, LERTITTIKUL W, BAUE F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93(2): 189-196.
[32] NICOLI M C, ANESE M, PARPINEL M T, et al. Loss and/or formation of antioxidants during food processing and storage [J]. Cancer Letters, 1997, 114(1/2): 71-74.
Function Properties and Nutrition Value of Grass Carp Peptides
CHEN Lili, BAI Chunqing, YUAN Meilan, ZHAO Li*, MAO Jie
(College of Life Science, Jiangxi Science and Technology Normal University/JiangxiProvinceKeyLaboratoryforBioprocessProcessing/NationalR&DBranchCenterforFreshwaterFishProcessing,Nanchang330013,China)
The solubility, foaming, emulsification, hygroscopic, moisture and stable performance of grass carp peptides were researched in this study. The amino acid content and composition proportion of grass carp peptides were also determined and the nutrition value of grass carp peptides was evaluated. The results showed that the grass carp peptides had good function properties. Grass carp peptide had 18 kinds of amino acids and the content of amino acids was 90.94%. The content of essential amino acids was 41.33%. The biological value, essential amino acid index, nutritional index and amino acid ratio coefficient of grass carp peptide were 71.51, 76.34, 74.81 and 77.19, respectively. The results showed that grass carp peptide had reasonable amino acids composition, which could be high-quality protein resource.
grass carp; peptides; function properties; nutrition value; amino acids
檀彩莲)
10.3969/j.issn.2095-6002.2016.05.005
2095-6002(2016)05-0033-10
陈丽丽,白春清,袁美兰,等. 草鱼多肽功能性质及营养价值[J]. 食品科学技术学报,2016,34(5):33-42. CHEN Lili, BAI Chunqing, YUAN Meilan, et al. Function properties and nutrition value of grass carp peptides[J]. Journal of Food Science and Technology, 2016,34(5):33-42.
2016-05-04
江西省大宗淡水鱼产业技术体系项目(JXARS-04-赣中片);江西省科技厅科技支撑重大项目(20152ACF60008);江西省青年科学基金资助项目(20151BAB214023)。
陈丽丽,女,讲师,主要从事食品化学方面的研究;
*赵 利,女,教授,博士,主要从事食品化学方面的研究。通信作者。
TS201.2; TS254.4
A

