酸性木聚糖酶交联酶聚集体的制备条件优化
吴春玲, 李 璠, 马 超, 袁 月, 范光森,2,3, 李秀婷,2,3,*
(1.北京工商大学 食品学院, 北京 100048;2.北京市食品风味化学重点实验室, 北京 100048;3.北京食品营养与人类健康高精尖创新中心, 北京 100048)

酸性木聚糖酶交联酶聚集体的制备条件优化
吴春玲1, 李 璠1, 马 超1, 袁 月1, 范光森1,2,3, 李秀婷1,2,3,*
(1.北京工商大学 食品学院, 北京 100048;2.北京市食品风味化学重点实验室, 北京 100048;3.北京食品营养与人类健康高精尖创新中心, 北京 100048)
交联酶聚集体法是一种新型的无载体酶固定化方法,为提高酸性木聚糖酶的稳定性,使用该法固定化微紫青霉产酸性木聚糖酶,制备无载体固定化木聚糖酶,并对其制备条件进行优化。结果表明,优选的制备条件为将质量浓度0.36 mg/mL的酸性木聚糖酶粗酶液在冰水浴中经饱和质量分数为85%的硫酸铵沉淀30 min后,于40 ℃,加入终体积分数为0.14%的戊二醛,交联4 h可获得较高活性的交联酶聚集体,酶活保留率达42.2%。这有助于酸性木聚糖酶更好地在工业中应用。
微紫青霉; 酸性木聚糖酶; 交联酶聚集体; 无载体固定化
木聚糖酶(EC 3.2.1.8)是降解半纤维素最为关键的水解酶,在纸浆助漂、面包烘烤、饲料工业和能源产业等方面有着广阔的应用前景,近年来一直为生物技术领域研究的热点之一[1]。
酸性木聚糖酶属于一类特殊木聚糖酶,由于其反应pH值低,且稳定性好,在一些酸性环境下应用的行业,如饲料加工、酿酒、果汁澄清和低聚木糖制备等,具有突出的应用价值。
相比游离酶而言,固定化酶具有稳定性好,利用率高等优点,可以降低酶催化成本,提高生产效率[2],一直是酶工程领域的研究热点之一。
交联酶聚集体(cross-linked enzyme aggregates,CLEAs)技术是在交联酶(cross-linked enzymes,CLEs)技术和交联酶晶体(cross-linked enzyme crystals, CLECs)技术的基础上提出的一种新型无载体固定化酶技术[3]。其制备过程包括沉淀和交联2步:利用中性盐、有机溶剂、非离子型高聚物等蛋白沉淀剂将溶解状态的酶蛋白进行沉淀得到酶沉淀聚集体,随后利用戊二醛等交联剂与酶聚集体分子上的氨基发生反应,从而制得水不溶性颗粒[4]。使用该方法所制备的固定化酶仅由酶蛋白分子和少量交联剂组成,无惰性载体,具有酶活高、稳定性好等优势,且此方法操作简单、成本低廉,是一种极具开发和应用前景的固定化酶技术[5]。
近年来CLEAs一直受到广大研究者青睐,已成功用于过氧化酶、葡糖淀粉酶、纤维素酶、芳香酯酶、谷氨酸脱羧酶、酰胺酶、半乳糖苷酶、蛋白酶等的研究制备中[6-13]。国外学者采用CLEAs固定化木聚糖酶和其他纤维质降解酶,研究多种酶交联后聚集体降解纤维质的能力和特性[14-16];国内仅见任延刚等[17]和王冬伟等[18]对其制备条件进行研究,而有关该应用技术固定酸性木聚糖酶的研究未见报道。本实验室筛选保存的微紫青霉菌MA21601所产木聚糖酶最适反应pH值为4.0,其在饲料加工、果汁澄清和低聚木糖制备方面具有潜在应用价值[19]。因此以该菌所产木聚糖酶为研究对象,采用CLEAs制备固定化酸性木聚糖酶,优化固定化条件。
1 材料与方法
1.1 材料与仪器
微紫青霉菌MA21601分离于土壤样品,实验室保存;玉米芯(20~40目),山东龙力生物科技股份有限公司;榉木木聚糖,Sigma公司;考马斯亮蓝G250,Amresco公司;硫酸铵、体积分数25%戊二醛、七水硫酸镁、磷酸二氢钾、磷酸氢二钾、盐酸、乙酸钠、冰乙酸、琼脂粉、葡萄糖、木糖均为分析纯,国药集团化学试剂有限公司。
AIRTECH型超净工作台,苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;TU- 1800PC型紫外可见分光光度计,北京普析通用仪器设备有限责任公司;DF- 101S型集热式恒温加热磁力搅拌器,北京瑞成伟业仪器设备有限公司;高速离心机,美国Sigma公司;TB- 214型电子分析天平,北京赛多利斯仪器有限公司;BI- 250A型低温生化培养箱,施都凯仪器设备上海有限公司;DK- S22型电热恒温水浴锅,上海精宏实验设备有限公司;THZ- 103B型恒温培养摇床,上海一恒科学仪器有限公司。
1.2 培养基的配制
PDA培养基:200 g去皮的新鲜土豆,切块沸水煮30 min,纱布过滤取滤液,加20 g葡萄糖和20 g琼脂煮沸溶解,定容至1 L,装瓶后115 ℃灭菌30 min。
发酵培养基组成(g/L):20~40目玉米芯60,硫酸铵 15,磷酸二氢钾 6,磷酸氢二钾 1.5,七水硫酸镁 0.5。pH值调至3.5。
1.3 木聚糖酶制备
木聚糖酶的制备参考王雅珍等[19],将微紫青霉MA21601接种于PDA培养基上,30 ℃培养3 d,切下1 cm2左右的菌块接种于50 mL发酵培养基中,25 ℃,125 r/min,培养7 d。发酵结束后,用纱布过滤,滤液在10 000 r/min的转速下离心10 min,收集上清液即为粗酶液。
1.4 木聚糖酶酶活及蛋白质量浓度测定
木聚糖酶酶活测定方法采用DNS法[20],具体步骤依照范光森等[21]研究方法并进行适当修改:取0.1 mL适当稀释的酶液,加入到0.9 mL质量浓度10 mg/mL的榉木木聚糖底物溶液中(用50 mmol/L,pH值4.0的乙酸- 乙酸钠缓冲液配制),55 ℃水浴反应5 min后加入1 mL DNS试剂,煮沸终止反应并显色,测定所释放的还原糖量,同时以木糖作为标准。木聚糖酶的活力单位定义为在上述反应条件下,每分钟生成1 μmol木糖所需要的酶量。
蛋白质质量浓度的测定采用Bradford法[22],以牛血清白蛋白作为标准蛋白。
1.5 木聚糖酶CLEAs的制备
木聚糖酶CLEAs的制备过程包括沉淀和交联2个步骤,对其制备条件进行优化。
1.5.1 沉淀剂质量分数优化实验
取15 mL木聚糖酶粗酶液(质量浓度为0.24 mg/mL)于50 mL烧杯中,在冰水浴中,低速搅拌状态下缓慢加入不同量的硫酸铵,使其饱和质量分数分别为40%,55%,70%,85%和100%。继续搅拌30 min后,将上述酶液在10 000 r/min的转速下低温冷冻离心10 min,弃去上清液,所得沉淀用5 mL 50 mmol/L pH值为4.0的乙酸- 乙酸钠缓冲液溶解后,测定其酶活力,计算酶活回收率。
1.5.2 温度优化实验
在多份按照1.5.1优选条件沉淀过的酶蛋白溶液中(无需后续离心操作),分别于0,10,20,30,40,50,60 ℃下恒温慢速搅拌,加入一定体积的戊二醛溶液,使得溶液中戊二醛体积分数为0.10%,交联反应2 h。交联完成后将上述混合溶液在10 000 r/min下离心10 min得到下层沉淀物即CLEAs,用50 mmol/L,pH值4.0的乙酸- 乙酸钠缓冲液缓慢冲洗沉淀数次后,测定其酶活力,计算酶活保留率。
1.5.3 交联剂(戊二醛)体积分数优化实验
在多份按照1.5.1优选条件沉淀过的酶蛋白溶液中(无需后续离心操作),于40 ℃恒温慢速搅拌中加入不同体积的戊二醛溶液,使得溶液中戊二醛体积分数分别为0.02%,0.06%,0.10%,0.14%,0.18%,0.22%,0.26%和0.30%。后续操作同1.5.2。
1.5.4 酶质量浓度优化实验
取多份不同质量浓度的酶溶液(0.12,0.24,0.36,0.48,0.60 mg/mL)在冰水浴条件下用硫酸铵进行沉淀,硫酸铵饱和质量分数为85%,继续搅拌30 min后,在40 ℃恒温条件下加入一定体积戊二醛溶液,使其终体积分数为0.14%,交联2 h后,离心,测定酶活力,计算酶活保留率。
1.5.5 交联时间优化实验
冰水浴条件下,向多份质量浓度为0.36 mg/mL的酶溶液中加入硫酸铵,使其饱和质量分数达到85%,继续搅拌30 min后,在40 ℃恒温条件下加入一定体积戊二醛溶液,使其终体积分数为0.14%,交联不同时间(1,2,3,4,5 h),离心,测定酶活力,计算酶活保留率。
1.6 计算方法
以酶活回收率和酶活保留率分别表征木聚糖酶沉淀后和交联后的优劣。酶活回收率为沉淀后剩余酶活力与原始粗酶液酶活力之比;而交联后酶活力与原始粗酶液酶活力之比为酶活保留率。
1.7 实验数据分析
每组实验设置3个重复,实验数据采用Excel软件处理,结果取平均值并计算标准偏差。
2 结果与分析
2.1 沉淀剂质量分数对木聚糖酶活力回收率的影响
沉淀剂的作用是使溶液状态的酶形成物理聚集,以便从溶液中析出。无机盐类、有机溶剂等是常规性的沉淀剂[23]。选用硫酸铵作为沉淀剂研究其浓度对木聚糖酶CLEAs制备的影响。木聚糖酶的活力回收率随着硫酸铵饱和质量分数的升高而升高,当硫酸铵质量分数达到85%以上时,上清液基本检测不到酶活力,木聚糖酶粗酶液形成可见的絮状,见图1。继续增大饱和质量分数至100%时,虽然上清液中残留酶活力低于85%饱和质量分数,但酶活回收率有明显降低。这主要由于过量硫酸铵导致大量木聚糖酶分子内非共价键(如氢键)的破坏,造成其空间结构不可恢复的变形而影响到酶分子的活性中心,使酶分子部分或完全失活[24]。因此,选择合适质量分数的硫酸铵沉淀剂是获得最佳CLEAs的前提。综合考虑成本和成效,木聚糖酶优选沉淀条件为饱和质量分数85%的硫酸铵冰水浴下保持30 min,这与农嘉仪等[25]报道结果相近。
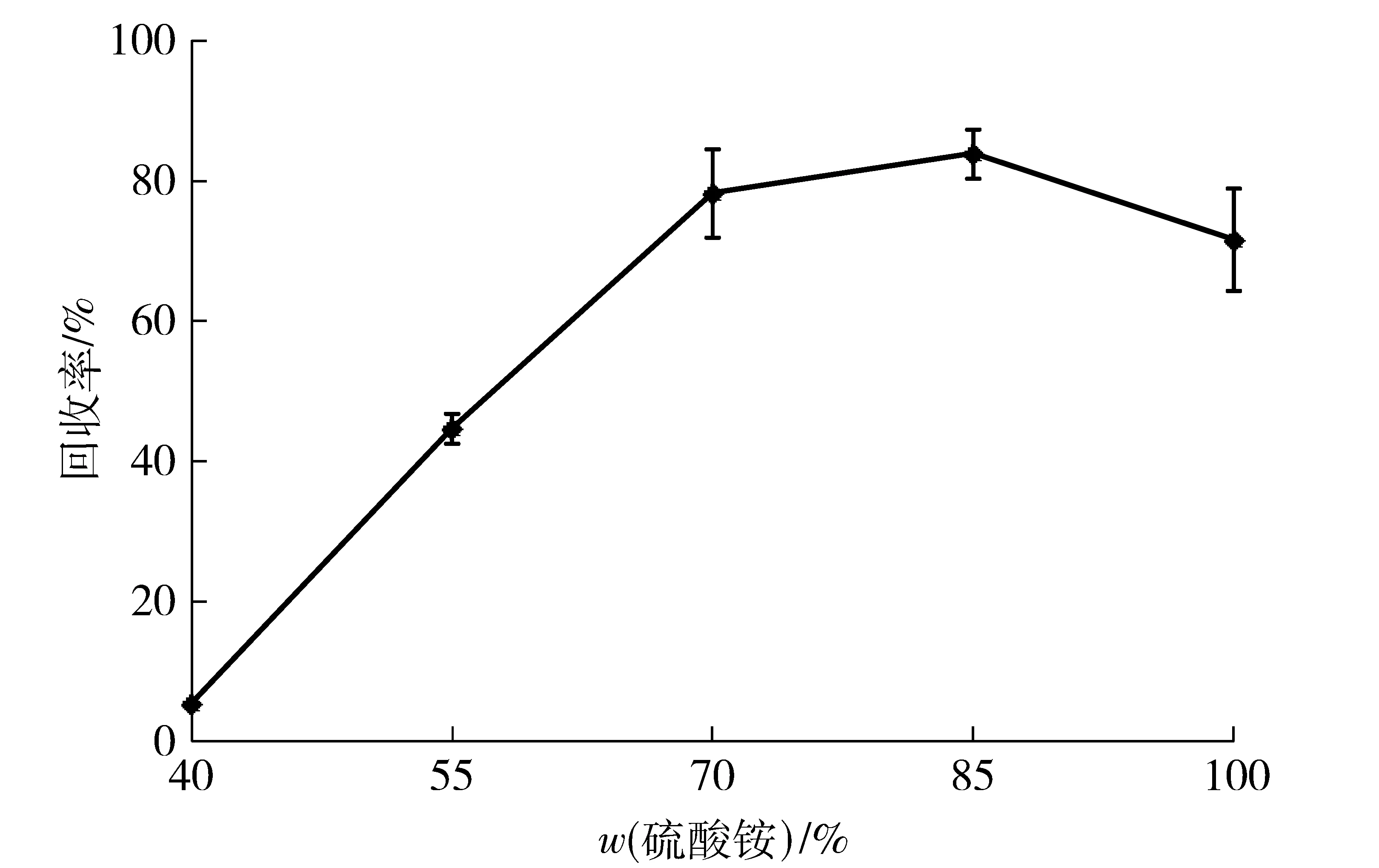
图1 硫酸铵饱和质量分数与酸性木聚糖酶酶活回收率的关系Fig.1 Effects of ammonium sulfate saturation on activity recovery of acid-stable xylanase
2.2 温度对木聚糖酶CLEAs制备的影响
在化学反应过程中,温度影响着分子运动,从而对反应速度产生影响;另外,酶分子属于生物蛋白,高温能够使蛋白变性。因此,交联温度是制备CLEAs过程中一个很重要的因素,在一定程度上影响着CLEAs的活性。交联温度的改变对酸性木聚糖酶CLEAs活力保留率的影响如图2。随着交联温度的升高,木聚糖酶CLEAs活力保留率逐渐增大,交联温度为40~60 ℃时酶活保留率变化不明显,温度继续升高,保留率开始降低。考虑到成本问题,选择40 ℃制备木聚糖酶CLEAs,这与该菌所产木聚糖酶的最适反应温度和温度稳定性相近。Bhattacharya等[14-15]研究结果表明在37 ℃制备木聚糖酶CLEAs效果最好,与本研究结果相近,Nadar等[10-11]研究发现制备交联α-淀粉酶和葡糖淀粉酶聚集体的优选温度为30 ℃,Khorshidi等[9]在交联纤维素酶时发现最佳温度为4 ℃。
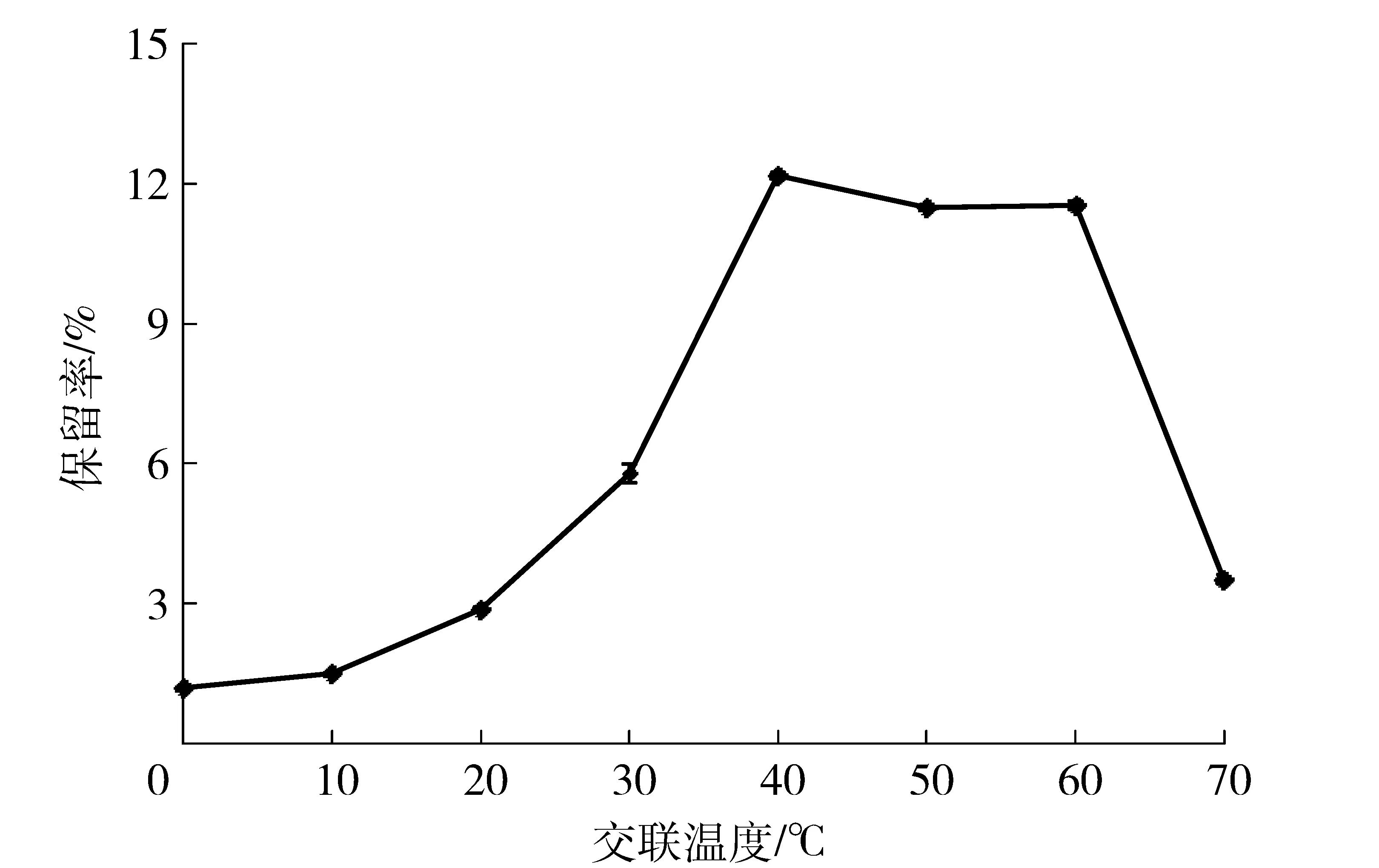
图2 温度与酸性木聚糖酶CLEAs活力保留率的关系Fig.2 Effects of temperature on activity of acid-stable xylanase CLEAs
2.3 交联剂体积分数对木聚糖酶CLEAs制备的影响
酶聚集体的交联是通过双功能试剂将酶的物理聚集体进行共价捆绑,保持酶聚集体形成的超分子结构和活性,在反应体系中不易被破坏、并可被回收使用[3]。戊二醛是最为常用的交联剂,除具有价格低廉、来源便捷的优点,最重要的是其分子量小,在溶液中可形成长度和结构不同的寡聚体混合物,使得CLEAs具有相对有序的三维结构和一定的空隙,允许某些物质通过,从而保证了CLEAs发挥催化功能[3, 26-27]。戊二醛的体积分数与酶聚集体交联的效果密切相关,如图3。由图3可见,戊二醛体积分数较低时,酶聚集体交联不充分,酶活力保留率较低,并且酶交联聚集体不稳定,机械强度弱,容易溶解;当戊二醛体积分数达到0.14%时,获得较好的酶活力保留率;之后随着戊二醛体积分数的继续增加而酶活保留率降低。究其原因,戊二醛含有双功能基团,既是交联剂,同时也是蛋白质变性剂,合适体积分数时有利于木聚糖酶聚集体交联,而低体积分数交联程度低,高体积分数则会造成一定空间范围内酶分子交联过于紧密,产生空间位阻而影响酶的活性,同时加剧酶蛋白的变性失活[28-29]。不同酶聚集体所需要的合适戊二醛交联体积分数差异很大,张茜等[30]以高达10%戊二醛终体积分数交联糖化酶获得最佳CLEAs;李丰硕等[31]以体积分数为4%的戊二醛溶液对果胶酶聚集体交联;Tandjaoui等[12]采用终体积分数为2%的戊二醛交联过氧化酶聚集体;Hormigo等[4]研究表明戊二醛体积分数为1.25%时交联效果最好,酶活力保留率达到18.4%;Agyei等[6]利用体积分数为0.8%的戊二醛对蛋白酶聚集体进行交联,酶活力保留率几乎达到100%;邢肖肖等[32]和沙凤等[33]的研究结果与本研究相近;梁跃等[34]则以较低体积分数的戊二醛(0.06%)进行交联。
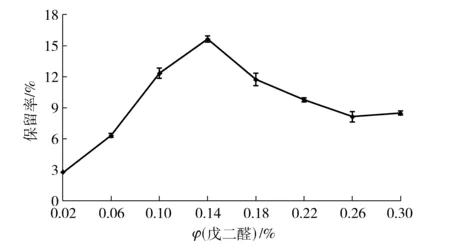
图3 戊二醛体积分数与酸性木聚糖酶CLEAs活力保留率的关系Fig.3 Effects of glutaraldehyde concentrations on activity of acid-stable xylanase CLEAs
2.4 蛋白质量浓度对木聚糖酶CLEAs制备的影响
游离酶质量浓度对CLEAs的制备也存在一定的影响,如图4。随着游离酶质量浓度的增加,CLEAs酶活力保留率逐渐增大,当游离酶质量浓度达到0.36 mg/mL时,酶活力保留率最大,继续增大酶质量浓度,酶活力保留率反而下降。陈颖等[35]研究表明游离酶质量浓度过低时交联后的酶活力相对较低,而游离酶质量浓度过高时由于酶分子大量的聚集交联,形成不规则的大团簇CLEAs,影响底物的传质过程,从而造成CLEAs酶活力的降低。
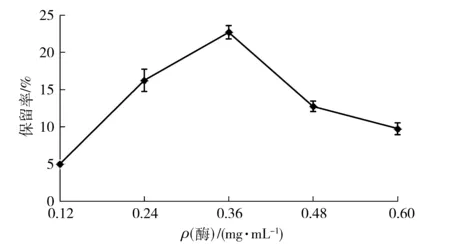
图4 酶质量浓度与酸性木聚糖酶CLEAs制备的关系Fig.4 Effects of enzyme concentrations on activity of acid-stable xylanase CLEAs
2.5 交联时间对木聚糖酶CLEAs制备的影响
在酶聚集体的交联过程中,交联时间会影响到CLEAs的活性和稳定性[36]。交联时间对酸性木聚糖酶CLEAs酶活的影响见图5。由图5可知,交联时间对酶活保留率的影响非常明显。当交联时间小于4 h时,随交联时间的延长,酶活保留率逐渐增大,主要原因是交联时间过短,酶分子交联不充分,离心沉淀得到的酶蛋白固体量较少;当交联时间为4 h时,酸性木聚糖酶CLEAs酶活保留率达到最大;当交联时间大于4 h时,随着时间的延长,酶活保留率逐渐下降,这是因为交联时间过长,交联剂使酶分子构型发生显著变化而使其失活[32]。因此,本研究选定4 h作为制备酸性木聚糖酶CLEAs的交联时间,比Hormigo等[4]、Khorshidi等[9]以及邢肖肖等[32]探究的最佳交联时间长,与Bhattacharya等[14]和Dalal等[16]研究结果一致,而Bhattacharya等[15]和Yu等[37]研究所得交联时间更长,分别长达5 h和20 h。
优化后酸性木聚糖酶CLEAs酶活保留率达到42.2%,与参考文献[9-10, 25, 30, 32]研究结果相近,高于Hormigo等[4]和Montoro-Garcia等[29]制备的CLEAs酶活保留率,而低于参考文献[11,37]的研究结果。出现以上不同酶活保留率的原因主要是不同蛋白分子特性不同。
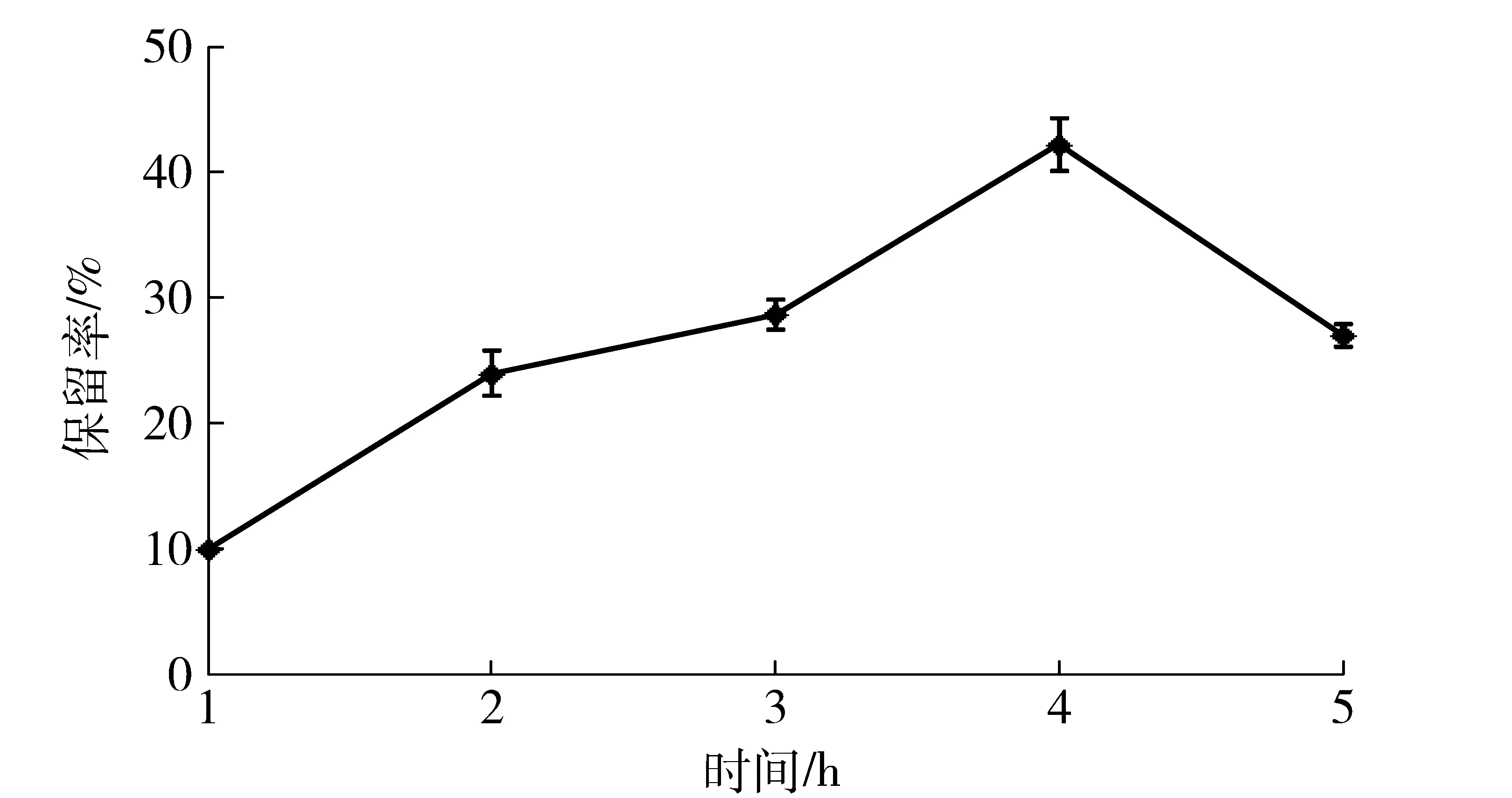
图5 交联时间与酸性木聚糖酶聚集体制备的关系Fig.5 Effects of cross-linking time on activity of acid-stable xylanase CLEAs
3 结 论
CLEAs技术在酶固定化方面具有重要的作用,是一种简单有效的无载体酶固定化方法,其制备工艺简单,沉淀和交联发生在同一个反应体系中,被认为是最有希望能够取代载体固定化酶的新技术[38]。本文对微紫青霉产酸性木聚糖酶进行固定化操作,并优化其制备条件。结果表明:选用质量浓度为0.36 mg/mL的酸性木聚糖酶,以饱和质量分数为85%的硫酸铵作为沉淀剂,用体积分数为0.14%的戊二醛作为交联剂,在40 ℃的条件下交联4 h制备得到的木聚糖酶CLEAs酶活力保留率较高,达42.2%,相比海藻酸钠法、壳聚糖- 海藻酸钠微胶囊法回收率(28.77%和39.4%)[39]高,但相比介孔氧化钛法回收率(93.37%)[40]低,由此可见该方法固定化木聚糖酶具有一定的研究价值。本研究为固定酸性木聚糖酶提供了借鉴性作用,同时为更好地应用酸性木聚糖酶于工业生产中提供了便利。
[1] COLLINS T, GERDAY C, FELLER G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS Microbiology Reviews, 2005, 29(1): 3-23.
[2] PERSSON M, MLADENOSKA I, WEHTJE E, et al. Preparation of lipases for use in organic solvents[J]. Enzyme and Microbial Technology, 2002, 31(6): 833-841.
[3] CAO L Q, VAN RANTWIJK F, SHELDON R A. Cross-linked enzyme aggregates: a simple and effective method for the immobilization of penicillin acylase[J]. Organic Letters, 2000, 2(10): 1361-1364.
[4] HORMIGO D, GARCIA-HIDALGO J, ACEBAL C, et al. Preparation and characterization of cross-linked enzyme aggregates (CLEAs) of recombinant poly-3-hydroxybutyrate depolymerase fromStreptomycesexfoliatus[J]. Bioresource Technology, 2012, 115: 177-182.
[5] ROESSL U, NAHALKA J, NIDETZKY B. Carrier-free immobilized enzymes for biocatalysis[J]. Biotechnology Letters, 2010, 32(3): 341-350.
[6] AGYEI D, HE L. Evaluation of cross-linked enzyme aggregates ofLactobacilluscell-envelope proteinases, for protein degradation[J]. Food and Bioproducts Processing, 2015, 94: 59-69.
[7] GUERRERO C, VERA C, ARAYA E, et al. Repeated-batch operation for the synthesis of lactulose with beta-galactosidase immobilized by aggregation and crosslinking[J]. Bioresource Technology, 2015, 190: 122-131.
[8] INMACULADA N, FRANCISCO G. Characterization of cross-linked immobilized arylesterase fromGluconobacteroxydans621H with activity toward cephalosporin C and 7-aminocephalosporanic acid[J]. Biotechnology Progress, 2016, 32(1): 36-42.
[9] KHORSHIDI K J, LENJANNEZHADIAN H, JAMALAN M, et al. Preparation and characterization of nanomagnetic cross-linked cellulase aggregates for cellulose bioconversion[J]. Journal of Chemical Technology and Biotechnology, 2016, 91(2): 539-546.
[10] NADAR S S, MULEY A B, LADOLE M R, et al. Macromolecular cross-linked enzyme aggregates (M-CLEAs) of alpha-amylase[J]. International Journal of Biological Macromolecules, 2016, 84: 69-78.
[11] NADAR S S, RATHOD V K. Magnetic macromolecular cross linked enzyme aggregates (CLEAs) of glucoamylase[J]. Enzyme and Microbial Technology, 2016, 83: 78-87.
[12] TANDJAOUI N, ABOUSEOUD M, COUVERT A, et al. A new combined green method for 2-chlorophenol removal using cross-linkedBrassicarapaperoxidase in silicone oil[J]. Chemosphere, 2016, 148: 55-60.
[13] THU H D, JANG N Y, MCDONALD K A, et al. Cross-linked aggregation of glutamate decarboxylase to extend its activity range toward alkaline pH[J]. Journal of Chemical Technology and Biotechnology, 2015, 90(11): 2100-2105.
[14] BHATTACHARYA A, PLETSCHKE B I. Strategic optimization of xylanase-mannanase combi-CLEAs for synergistic and efficient hydrolysis of complex lignocellulosic substrates[J]. Journal of Molecular Catalysis B: Enzymatic, 2015, 115: 140-150.
[15] BHATTACHARYA A, PLETSCHKE B I. Magnetic cross-linked enzyme aggregates (CLEAs): a novel concept towards carrier free immobilization of lignocellulolytic enzymes[J]. Enzyme and Microbial Technology, 2014, 61/62: 17-27.
[16] DALAL S, SHARMA A, GUPTA M N. A multipurpose immobilized biocatalyst with pectinase, xylanase and cellulase activities[J]. Chemistry Central Journal, 2007, 13(1):2510-2515.
[17] 任延刚, 朱启忠, 黄庆瑞, 等. 交联木聚糖酶聚集体的制备及其性质研究[J]. 资源开发与市场, 2009(6): 487-489. REN Y G, ZHU Q Z, HUANG Q R, et al. Preparation and characteristics of cross-linked xylanase aggregates[J]. Resource Development and Market, 2009(6): 487-489.
[18] 王冬伟, 孙谧. 固载化木聚糖酶交联酶聚集体的制备及性质[J]. 中国海洋药物, 2016(1): 39-49. WANG D W, SUN M. The preparation and properties of the immobilized xylanase by carrier-cross linked enzyme aggregation[J]. Chinese Journal of Marine Drugs, 2016(1): 39-49.
[19] 王雅珍, 滕超, 朱运平, 等. 酸性木聚糖酶高产菌株的筛选及其液体发酵产酶条件优化[J]. 中国食品学报, 2015(1): 73-79. WANG Y Z, TENG C, ZHU Y P, et al. Screening of acid-xylanase high-yield strain and its improvement of xylanase production in liquid-state fermentation[J]. Journal of Chinese Institute of Food Science and Technology, 2015(1): 73-79.
[20] BAILEY M J, BIELY P, POUTANEN K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23(3): 257-270.
[21] 范光森, 杨绍青, 闫巧娟, 等. 嗜热棉毛菌固体发酵产木聚糖酶条件的优化[J]. 食品工业科技, 2012(6): 219-224. FAN G S, YANG S Q, YAN Q J, et al. Optimization of xylanase production fromThermomyceslanuginosusCAU44 by solid-state fermentation[J]. Science and Technology of Food Industry, 2012(6): 219-224.
[22] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[23] TALEKAR S, JOSHI A, JOSHI G, et al. Parameters in preparation and characterization of cross linked enzyme aggregates (CLEAs)[J]. RSC Advances, 2013, 31(3): 12485-12511.
[24] FIGUEIREDO K C S, FERRAZ H C, BORGES C P, et al. Structural stability of myoglobin in organic media[J]. Protein Journal, 2009, 28(5): 224-232.
[25] 农嘉仪, 李敏英, 叶剑威, 等. 交联酶聚集体法制备单宁酶及固定化酶性质研究[J]. 食品与机械, 2012(1): 154-158. NONG J Y, LI M Y, YE J W, et al. Preparation and properties of cross-linked enzyme aggregates tannase[J]. Food and Machinery, 2012(1): 154-158.
[26] MARGOLIN A L. Novel crystalline catalysts[J]. Trends in Biotechnology, 1996, 14(7): 223-230.
[27] CAO L, VAN LANGEN L M, van RANTWIJK F, et al. Cross-linked aggregates of penicillin acylase: robust catalysts for the synthesis of beta-lactam antibiotics[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4): 665-670.
[28] 罗建平, 欧杰, 潘利华. 交联β-葡萄糖苷酶聚集体的制备及其性质[J]. 食品科学, 2007(12): 254-257. LUO J P, OU J, PAN L H. Preparation and properties of cross-linked β-glucosidase aggregates[J]. Food Science, 2007(12): 254-257.
[29] MONTORO-GARCIA S, GIL-ORTIZ F, NAVARRO-FERNANDEZ J, et al. Improved cross-linked enzyme aggregates for the production of desacetyl beta-lactam antibiotics intermediates[J]. Bioresource Technology, 2010, 101(1): 331-336.
[30] 张茜, 王家东, 侯红萍. 交联糖化酶聚集体的制备[J]. 中国酿造, 2008(23): 67-69. ZHANG Q, WANG J D, HOU H P. Preparation of cross-linked glucoamylase aggregates[J]. China Brewing, 2008(23): 67-69.
[31] 李丰硕, 李代, 薛永常. 交联果胶酶聚集体的制备及其对罗布麻的脱胶效果[J]. 大连工业大学学报, 2013(4): 243-245. LI F S, LI D, XUE Y C. Preparation of cross-linked pectinase and its effect on apocynum degumming[J]. Journal of Dalian Polytechnic University, 2013(4): 243-245.
[32] 邢肖肖, 王梦凡, 齐崴, 等. β-半乳糖苷酶交联酶聚体的制备及酶学性质研究[J]. 食品工业科技, 2014(23): 158-162. XING X X, WANG M F, QI W, et al. Preparation and properties of cross-linked enzyme aggregates(CLEAs) of β-galactosidase fromKluyveromyceslactis[J]. Science and Technology of Food Industry, 2014(23): 158-162.
[33] 沙凤, 顾金海, 许琳, 等. 交联醇脱氢酶聚集体的制备及其在(R)-4-氯-3-羟基丁酸乙酯合成中的应用[J]. 生物加工过程, 2015(6): 24-29. SHA F, GU J H, XU L, et al. Preparation of alcohol dehydrogenase cross-linked enzyme aggregates and its application to asymmetric synthesis of (R)-4-chloro-3-hydroxybutanoate[J]. Chinese Journal of Bioprocess Engineering, 2015(6): 24-29.
[34] 梁跃, 林日辉, 黄文勤, 等. 交联草酸脱羧酶聚集体的制备及其性质[J]. 食品科学, 2013(1): 215-219. LIANG Y, LIN R H, HUANG W Q, et al. Preparation and properties of cross-linked oxalate decarboxylase aggregates[J]. Food Science, 2013(1): 215-219.
[35] 陈颖, 肖辰鹏, 陈晓云, 等. 交联海藻糖合酶聚集体的制备及其性质[J]. 食品科学, 2013(9): 108-113. CHEN Y, XIAO C P, CHEN X Y, et al. Preparation and properties of cross-linked enzyme aggregates of trehalose synthase[J]. Food Science, 2013(9): 108-113.
[36] 武仙山, 何立千, 叶磊. 交联酶聚集体:一种无载体酶固定化方法[J]. 生物技术, 2005(2): 90-92.
[37] YU H W, CHEN H, WANG X, et al. Cross-linked enzyme aggregates (CLEAs) with controlled particles: application toCandidarugosalipase[J]. Journal of Molecular Catalysis B: Enzymatic, 2006, 43(1/4): 124-127.
[38] CAO L Q. Immobilised enzymes: science or art?[J]. Current Opinion in Chemical Biology, 2005, 9(2): 217-226.
[39] 王娜, 朱启忠, 任延刚, 等. 壳聚糖- 海藻酸钠微胶囊固定化木聚糖酶的研究[J]. 安徽农业科学, 2009(16): 7318-7319. WANG N, ZHU Q Z, REN Y G, et al. Enzymatic characters of free xylanase and immobilized xylanse,research on the immobilized xylanase with chitosan-sodium alginate microcapsule[J]. Journal of Anhui Agricultural Sciences, 2009(16): 7318-7319.
[40] 单宗星, 韦策, 李鑫, 等. 介孔氧化钛与海藻酸钠固定化木聚糖酶的对比研究[J]. 林产化学与工业, 2013(1): 64-68. SHAN Z X, WEI C, LI X, et al. Comparison of immobilized xylanase using mesoporous titania and sodium alginate as carriers[J]. Chemistry and Industry of Forest Products, 2013(1): 64-68.
Optimizing Preparation Conditions of Cross-linked Acid-stable Xylanase Aggregates
WU Chunling1, LI Fan1, MA Chao1, YUAN Yue1, FAN Guangsen1,2,3, LI Xiuting1,2,3,*
(1.School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China;2.BeijingKeyLaboratoryofFlavorChemistry,Beijing100048,China;3.BeijingAdvancedInnovationCenterforFoodNutritionandHumanHealth,Beijing100048,China)
The cross-linked enzyme aggregates method was a new carrier-free immobilized enzyme technology. In order to improve the stability of xylanase, the technology was applied for the preparation of the acid-stable xylanase fromPenicilliumjanthinellum. This study explored conditions of the preparation of cross-linked xylanase aggregates. The results showed that the crude xylanase at the concentration of 0.36 mg/mL was precipitated with 85% saturated ammonium sulfate for 30 min at 40 ℃. Then the aggregates were cross-linked by 0.14% glutaraldehyde solution for 4 h at 40 ℃. The obtained activity of cross-linked xylanase aggregates remained 42.2% of total enzyme activity, which is helpful for the further application of acid xylanase in the industry.
Penicilliumjanthinellum; acid-stable xylanase; cross-linked enzyme aggregates; carrier-free immobilized
檀彩莲)
10.3969/j.issn.2095-6002.2016.05.007
2095-6002(2016)05-0048-07
吴春玲,李璠,马超,等. 酸性木聚糖酶交联酶聚集体的制备条件优化[J]. 食品科学技术学报,2016,34(5):48-54. WU Chunling, LI Fan, MA Chao, et al. Optimizing preparation conditions of cross-linked acid-stable xylanase aggregates[J]. Journal of Food Science and Technology, 2016,34(5):48-54.
2016-06-13
国家自然科学基金面上项目(31371723);北京市自然科学基金青年项目(6164029)。
吴春玲,女,本科生,研究方向为酶工程;
*李秀婷,女,教授,博士,主要从事酶工程及传统发酵食品方面的研究。通信作者。
TS201.1; Q814.2
A

