响应面法优化鹿皮曲霉ZJOU-AC1产壳聚糖酶的发酵条件
章晔敏,邵一凡,熊妍妍,毛贵珠,陈小娥*,方旭波,2,傅鹏程
(1.浙江海洋大学食品与医药学院,浙江舟山316022;2.浙江省水产品加工技术研究联合重点实验室,浙江舟山316022;3.舟山海圣生物有限公司,浙江舟山316112)
响应面法优化鹿皮曲霉ZJOU-AC1产壳聚糖酶的发酵条件
章晔敏1,邵一凡1,熊妍妍1,毛贵珠1,陈小娥1*,方旭波1,2,傅鹏程3
(1.浙江海洋大学食品与医药学院,浙江舟山316022;2.浙江省水产品加工技术研究联合重点实验室,浙江舟山316022;3.舟山海圣生物有限公司,浙江舟山316112)
以壳聚糖酶活力为评价指标,在单因素试验的基础上,采用响应面法对鹿皮曲霉(Aspergillus cervinus)ZJOU-AC1产壳聚糖酶的发酵条件进行优化。结果表明,最佳发酵条件为胶体壳聚糖1.5%,硫酸铵0.4%,磷酸二氢钾0.2%,硫酸镁0.05%,麸皮2%,Tween-80 0.06%,发酵时间96 h,发酵温度30℃,初始pH 5.9,接种量3%。在此最佳条件下,最终测得壳聚糖酶平均酶活为8.26 U/mL,是优化前(2.05 U/mL)的4.03倍。
壳聚糖酶;鹿皮曲霉ZJOU-AC1;响应面法;优化
壳聚糖(chitosan)是由自然界广泛存在的几丁质经脱乙酰作用得到的一种多糖,被誉为继蛋白质、糖类、维生素、脂肪等生命元素之外的第六大生命物质[1]。壳聚糖及其降解产物壳寡糖(chitooligosaccharides)都具有较好的生物活性,在食品、医药、化工等很多行业都受到高度重视[2-5]。然而壳聚糖为天然高分子物质,存在晶体结构紧密,水溶性差,不易被吸收等缺点,使其在开发利用上存在局限。而降解产物壳寡糖水溶性强、易吸收,也具有清除体内垃圾、免疫激活、抗肿瘤等功效[6-7],应用前景十分广阔。
目前降解壳聚糖的方法主要有化学法、物理法及生物酶解法[7-9]。其中化学法制得产率低,降解产物聚合度小,产物纯化难,且对环境污染严重不符合当代推崇的绿色科学。酶解法降解条件反应温和,壳寡糖的得率高、生物活性强,又绿色环保,是最理想的制备方法。因此,用生物酶解法来降解壳聚糖已成为生产功能性壳聚糖的首选方法。壳聚糖酶主要分布于细菌、真菌、放线菌等[10-12]微生物体内,且微生物主要是通过土壤或海水筛选[10,13-14]得到。本研究从浙江省舟山市毗邻常年养殖虾蟹的厂家生产场地的山坡及海域筛选产壳聚糖酶菌株,最终得到一株高产壳聚糖酶的菌株—鹿皮曲霉(Aspergillus cervinus)ZJOU-AC1,可作为高产壳聚糖酶的新菌株进行研究。
响应面法是优化微生物发酵培养过程中常用的一种方法[15-16]。陈桂光等[17]采用响应面法对产壳聚糖酶菌株烟曲霉(Aspergillus fumigatus)K1的发酵培养基进行了优化,酶活较之前提高了2.4倍;刘杰等[18]在壳聚糖酶发酵培养基条件优化过程中,利用响应面优化的方式使发酵液中壳聚糖含量较优化前提高了4.32倍,产酶周期缩短了23~47 h;陈静等[19]利用响应面法优化了产壳聚糖酶菌株—苏云金杆菌(Bacillus thuringiensis)ZJOU-010的培养条件,并研究得出虾加工副产物可作为单一碳、氮源用于生产壳寡糖。本研究以鹿皮曲霉(Aspergillus cervinus)ZJOU-AC1作为研究对象,进行液体发酵培养产壳聚糖酶,利用单因素试验和响应面法优化发酵条件,以期为工业发酵培养产壳聚糖酶菌株提供新型的技术支持和应用参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
鹿皮曲霉(Aspergillus cervinus)ZJOU-AC1:由生工生物工程上海股份有限公司鉴定,本实验室分离保藏。
1.1.2 试剂
壳聚糖(脱乙酰度≥90%):浙江普陀兴业药业有限公司提供;酵母粉(LP0021):英国OXOID公司;氨基葡萄糖盐酸盐(glucosaminehydrochloride,GAH):美国Sigma公司;3,5-二硝基水杨酸(3,5-dinitrosalicylicacid,DNS):国药集团药业股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,121℃灭菌20 min。
种子培养基:葡萄糖1%,麸皮1%,胶体壳聚糖0.2%,磷酸二氢钾0.2%,硫酸铵0.2%硫酸镁0.05%,自然pH,121℃灭菌20 min。
原始发酵培养基:胶体壳聚糖1%,硫酸铵0.2%,磷酸二氢钾0.2%,硫酸镁0.05%,麸皮2%,pH5.5,121℃灭菌20min。
1.2 仪器与设备
LDZX-75KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;SPX-250B-Z生化培养箱:上海博讯实业有限公司医疗设备厂;HHS电热恒温水浴锅:上海棱光技术有限公司;BS110电子分析天平:北京赛多利斯天平有限公司;JZ-Ⅱ四方均质器:铁道部电化院四方电气设备厂;DGC-9140A电热恒温鼓风干燥箱:北京林茂科技有限公司;UV-6000紫外分光光度计:苏州江东精密仪器有限公司。
1.3 方法
1.3.1 壳聚糖酶活测定方法
参照陈小娥等[12]的方法并略做改动。将发酵液4000r/min离心10 min,取1 mL上清液,稀释适当倍数,加入1 mL 0.5%的胶体壳聚糖,在50℃恒温水浴锅中反应15 min后,立即加入2 mL DNS试剂,摇匀,沸水浴8 min,马上冷却,加2 mL水,4 000 r/min离心10 min,取上清液在波长510 nm处比色,测吸光度值A510nm。灭活酶液按照上述方法同样处理作为对照扣除发酵液残糖。以蒸馏水加DNS为空白。以氨基葡萄糖盐酸盐含量(x)为自变量,吸光度值A510nm(y)值为应变量绘制出标准曲线,获得回归方程y=0.001x-0.084 8(R2=0.999 1),根据该方程计算并折算成酶活。
壳聚糖酶活单位定义为:在50℃下,每分钟产生1μmol氨基葡萄糖盐酸盐所需要的酶量为一个酶活单位(U/mL)。
1.3.2 菌株活化及种子液的制备
鹿皮曲霉(Aspergillus cervinus)ZJOU-AC1经PDA斜面培养基活化后,挑取适量菌体接入种子培养基中,25℃150r/min下摇床培养20~30h,然后以2%的接种量接入原始发酵培养基中进行发酵培养。在25℃、装液量75mL/250mL、150 r/min条件下摇床培养72 h。
1.3.3 最优发酵培养基研究
(1)最适碳源的选择
用相同浓度的葡萄糖、乳糖、胶体壳聚糖、淀粉、氨基葡萄糖、乙酰氨基葡萄糖6种碳源来代替原始发酵培养基中的碳源,对菌株进行发酵培养,在0.5%~2.5%范围内按照发酵液酶活选取最佳碳源浓度。
(2)最适氮源的选择
在优化碳源的基础上,分别以0.2%的硫酸铵、硝酸钠、牛肉膏、氯化铵、酵母粉、蛋白胨6种氮源来代替原始发酵培养基中的氮源,对菌株进行发酵培养,在0.1%~1.0%范围内按照发酵液酶活选取最佳氮源浓度。
(3)最适表面活性剂浓度的选择
在原始发酵培养基中分别添加0.02%、0.04%、0.06%、0.08%的表面活性剂Tween-80,进行发酵培养,通过检测发酵液酶活得出最适表面活性剂浓度。
1.3.4 单因素试验探究产酶发酵条件
初始pH对产酶的影响:接种量2%,其他条件均不变,调整原始发酵培养基的初始pH值为5.0、5.5、6.0、6.5、7.5,25℃条件下发酵72 h,测定壳聚糖酶活力。
发酵时间对产酶的影响:接种量2%,初始pH 5.5,原始发酵培养基的发酵时间分别调整为48 h、72 h、96 h、120 h、144 h、168 h,其他条件均不变,25℃条件下进行发酵,测定壳聚糖酶活力。
发酵温度对产酶的影响:接种量2%,初始pH 5.5,其他条件均不变,调整发酵温度为20℃、25℃、30℃、35℃、40℃,发酵72 h,测定壳聚糖酶活力。
接种量对产酶的影响:初始pH 5.5,接种量分别为1%、2%、3%、4%、5%在25℃、150r/min进行摇瓶发酵,发酵72 h,测定壳聚糖酶活力。
1.3.5 响应面试验
在单因素试验的基础上,选取对酶活影响更显著的3个因素为自变量,采用Design-Expert8.0.6设计3因素3水平的Box-Behnken试验,得出各因素对菌株A.cervinusZJOU-AC1产酶的影响及最佳发酵条件。
2 结果与分析
2.1 最优发酵培养基的确定
2.1.1 最适碳源及其添加量的确定
分别以1%的葡萄糖、乳糖、淀粉、胶体壳聚糖、氨基葡萄糖、乙酰氨基葡萄糖作为碳源进行发酵产酶试验,考察不同碳源对产壳聚糖酶酶活力的影响,结果见表1。

表1 不同碳源对壳聚糖酶酶活力的影响Table 1 Effects of different carbon sources on chitoanase activity
微生物产壳聚糖酶为诱导酶,底物壳聚糖的存在是产壳聚糖酶的必要条件。由表2可知,在6种碳源中,氨基葡萄糖、乙酰氨基葡萄糖作为碳源,菌株ZJOU-AC1产壳聚糖酶酶活较低,不利于诱导产壳聚糖酶。胶体壳聚糖作为碳源诱导A.cervinusZJOU-AC1菌株产壳聚糖酶活力最高,胶体壳聚糖是菌株ZJOU-AC1产壳聚糖酶的高效诱导剂,因此,选取胶体壳聚糖作为最适碳源。考察不同含量胶体壳聚糖对产壳聚糖酶酶活力的影响,结果见图1。

图1 胶体壳聚糖含量对壳聚糖酶酶活力的影响Fig.1 Effect of colloid chitosan concentration on chitoanase activity
由图1可知,酶活随胶体壳聚糖含量的增大,先升高后降低。在0.5%~1.5%范围内,酶活随胶体壳聚糖含量的增大逐渐升高,当胶体壳聚糖含量为1.5%时,酶活最高。继续增加胶体壳聚糖含量,酶活开始降低,这可能是由于胶体壳聚糖含量高,黏度大,影响了发酵液中的溶解氧含量从而导致菌体量的减少,酶活降低。故选取1.5%的胶体壳聚糖为最适碳源含量。
2.1.2 最适氮源及其含量的确定
分别以0.2%含量的硫酸铵、硝酸钠、牛肉膏、氯化铵、酵母粉、蛋白胨作为氮源进行发酵产酶试验,考察不同氮源对产壳聚糖酶酶活力的影响,结果见表2。

表2 不同氮源对壳聚糖酶酶活力的影响Table 2 Effects of different nitrogen sources on chitoanase activity
由表2可知,以硫酸铵和酵母粉作为氮源时,菌体产壳聚糖酶的效果较好。但两者所对应酶活相差甚小,考虑经济成本,选取硫酸铵作为最适氮源。考察不同含量硫酸铵对产壳聚糖酶活力的影响,结果见图2。
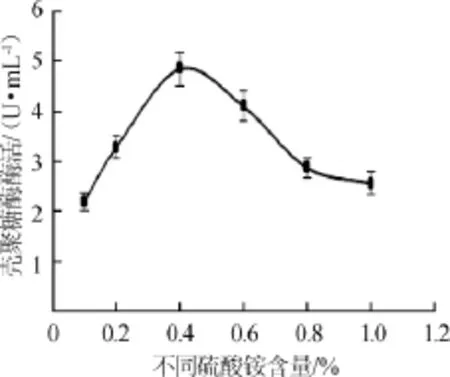
图2 硫酸铵浓度对壳聚糖酶活力的影响Fig.2 Effect of ammonium sulfate concentration on chitoanase activity
由图2可知,酶活随硫酸铵含量的增大,先升高后降低,当硫酸铵的含量为0.4%时,酶活最高。在0.1%~0.4%时,酶活一直处于升高趋势,继续增大硫酸铵浓度,酶活反而降低,这可能是因为硫酸铵为0.4%时,发酵液中碳氮比最佳,有利于产酶,超过0.4%后,碳氮比发生变化影响菌体的生长和产酶,从而导致酶活降低。故选取0.4%硫酸铵为最适氮源添加量。
2.1.3 最适表面活性剂的浓度
表面活性剂可改变微生物细胞结构,提高细胞膜渗透性,促使酶向胞外分泌[20]。由表3可知,随表面活性剂Tween-80浓度的增加,可提高菌株产壳聚糖酶活力,当Tween-80浓度为0.06%时,产壳聚糖酶活为(5.53±0.22)U/mL。因此选择Tween-80添加量为0.06%。

表3 Tween-80含量对壳聚糖酶活力的影响Table 3 Effect of Tween-80 concentration on chitoanase activity
2.2 单因素实验探究发酵条件
2.2.1 初始pH对产酶活力的影响
考察发酵液初始pH对鹿皮曲霉ZJOU-AC1产壳聚糖酶酶活力的影响,结果如图3所示。
由图3可知,随初始pH在5.0~6.0的范围增加,发酵液中壳聚糖酶活逐渐增加;当发酵液初始pH值为6.0时,菌株产壳聚糖酶活力最高,为7.48 U/mL;当初始pH继续增加时,酶活急剧下降,其原因可能是因为pH增大导致部分胶体壳聚糖絮凝不利于被菌株利用从而影响产酶。故选择初始pH值为6.0为宜。

图3 初始pH对壳聚糖酶活力的影响Fig.3 Effect of initial pH on chitoanase activity
2.2.2 发酵时间对产酶活力的影响
考察发酵时间对鹿皮曲霉ZJOU-AC1产壳聚糖酶酶活力的影响,结果如图4所示。

图4 发酵时间对壳聚糖酶活力的影响Fig.4 Effect of fermentation time on chitoanase activity
由图4可知,在48 h~96 h范围内,发酵液酶活随着发酵时间的延长逐步提升,当发酵时间为120 h时,发酵液中壳聚糖酶活达到最高点,为6.68 U/mL;120 h以后酶活随着时间的延长显著降低,造成该现象的原因可能为发酵时间过长进入微生物生长的衰亡期,也有可能为培养基内营养物质消耗殆尽,代谢废物增多导致菌体自溶明显。比较最高点与96 h对应点的酶活,两者相差不大,综合考虑选择最适发酵时间为96 h。
发酵时间相比其他3个因素,酶活达到最高点前的最高值与最低值的变化较小,且本研究采用的菌种发酵产酶时间较长,探究时间对实验进度影响较大,综合考虑在响应面试验中将不对发酵时间进行优化。
2.2.3 发酵温度对产酶的影响
考察发酵温度对鹿皮曲霉ZJOU-AC1产壳聚糖酶活力的影响,结果如图5所示。
由图5可知,发酵液酶活力随着发酵温度的升高呈先升高后降低的趋势,当发酵温度为30℃时,发酵液中酶活力达到最大值,为6.26 U/mL。因此选取30℃为最适发酵温度。

图5 发酵温度对壳聚糖酶活力的影响Fig.5 Effect of fermentation temperature on chitoanase activity
2.2.4 接种量对产酶活力的影响
考察接种量对鹿皮曲霉ZJOU-AC1发酵产壳聚糖酶活力的影响,结果如图6所示。

图6 接种量对壳聚糖酶活力的影响Fig.6 Effect of inoculum on chitoanase activity
由图6可知,发酵液的酶活力随着接种量的增加先升高后降低,这是由于接种量过大时,菌体生长快,在相同的时间内,菌体总数过大,培养基营养不够,易衰老;接种量过小时,则菌体生长慢,在相同的时间内,菌体总数少,产酶少。当接种量为3%时,发酵液酶活力达到最大值,为7.33 U/mL。因此最适接种量为3%。
2.3 响应面法优化菌株产壳聚糖酶发酵条件优化
2.3.1 响应面设计方案及分析结果
在单因素试验基础上,以壳聚糖酶活力(Y)为响应值,选取对A.cervinusZJOU-AC1产酶发酵影响较大的发酵温度(A)、初始pH(B)、接种量(C)3个因素,设计N=17的Box-Behnken试验,结果见表4。运用Design Expert 8.0.6软件程序对表4试验结果进行二次回归响应面分析,建立多元二次响应面回归模型:
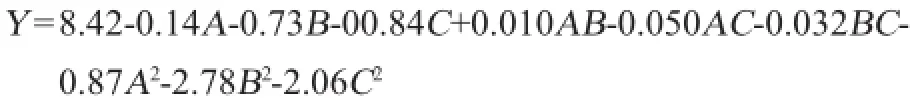
为检验模型的有效性,对其进行方差分析和显著性检验,结果见表5和表6。结果表明,回归模型的P值<0.000 1,失拟项P=0.8712>0.05,表明模型极显著且试验误差较小。对酶活回归方程检验,模型的决定系数为R2=0.981 0,说明模型拟合程度良好;变异系数(coefficientof variation,CV)= 7.30%,说明模型能较好地反应真实试验值。因此可用该模型来预测酶活。

表4 Box-Behnken试验设计及结果Table 4 Design and results of Box-Behnken experiments
分析模型的各系数P值,因素B、A2对酶活影响显著(P<0.05),因素B2、C2对酶活影响极显著(P<0.000 1),其他因素对酶活影响不显著。3个因素对产酶高低的影响顺序为:初始pH(B)>发酵温度(A)>接种量(C)。

表5 Box-Behnken试验设计方差分析Table 5 Variance analysis of Box-Behnken experiments design

表6 回归模型的可信度分析Table 6 Credibility analysis of regression model
根据响应面回归方程得到各因素的响应面立体分析结果见图7。由图7可知,初始pH对应的响应面曲线较为陡峭,说明初始pH对酶活的影响较大,这与方差分析结果相符,并且各参数间的响应面呈椭圆型,交互作用较显著,响应面曲线开口向下,能清晰地看到最高点。

图7 发酵时间、初始pH值和接种量对壳聚糖酶活交互影响的曲面图和等高线Fig.7 Response surface plots and contour lines of the effects of interaction between fermentation temperature,initial pH and inoculum on chitoanase activity
2.3.2 响应面试验结果预测和验证
根据响应面试验结果对壳聚糖酶活进行回归分析预测得到液体发酵菌株A.cervinusZJOU-AC1最佳产酶条件为初始pH值5.93,发酵温度29.58℃,接种量2.98%,由回归方程预测酶活力为8.47 U/mL。基于试验操作可行性,将预测值调整为发酵温度30℃,初始pH值5.9,接种量3%。在此最佳条件下进行重复液体发酵试验3次,最终测得酶活平均值为8.26 U/mL,与理论值相对误差为2.54%,表明回归方程能较好地预测实验值,即该响应面对菌株A.cervinus ZJOU-AC1的发酵条件的优化准确可行。
3 结论
本研究通过单因素试验和响应面法优化了产壳聚糖酶菌株A.cervinusZJOU-AC1的发酵条件。优化后A.cervinus ZJOU-AC1产壳聚糖酶的发酵培养基组成为:胶体壳聚糖1.5%,硫酸铵0.4%,磷酸二氢钾0.2%,硫酸镁0.05%,麸皮2%,Tween-80 0.06%;最优发酵条件为:初始pH 5.9,发酵温度30℃,发酵时间96 h,接种量为3%,摇瓶装液量为75mL/250mL,摇床转速为150r/min。在此条件下,A.cervinus ZJOU-AC1产壳聚糖酶活平均可达到8.26 U/mL,是之前(2.05 U/mL)的4.03倍。从可持续发展角度看,针对近几年水产品加工企业以含大量壳聚糖为首的副产物(虾壳、蟹壳等)日益增多所造成的环境问题,这一生产工艺既能减少环境污染而且具有较高的经济价值,应用前景广泛。
[1]邱并生.壳聚糖酶[J].微生物学通报,2014,41(12):2593.
[2]HAMED I,ÖZOGUL F,REGENSTEIN J.Industrial applications of crustacean by-products(chitin,chitosan,and chitooligosaccharides):A review [J].Trend Food Sci Technol,2016,48:40-50.
[3]张胜文,冯伟,程思,等.羧甲基壳聚糖在草莓保鲜中的应用效果研究[J].中国酿造,2014,33(5):142-145.
[4]LIBIO I,DEMORI R,FERRÃO M,et al.Films based on neutralized chitosan citrate as innovative composition for cosmetic application[J].Materials Sci Eng C,2016,67:115-124.
[5]DEMITRI C,BENEDICTIS V,MADAGHIELE M,et al.Nanostructured active chitosan-based films for food packaging applications:effect of graphene stacks on mechanical properties[J].Measurement,2016,90: 418-423.
[6]NGO H,VO S,NGO N,et al.Biological effects of chitosan and its derivatives[J].Food Hydrocolloid,2015,51:200-216.
[7]梁慧培,覃小丽,钟金锋.壳寡糖制备和生理活性的研究进展[J].食品工业科技,2016,37(3):384-388.
[8]陈小娥,夏文水,余晓斌.微生物壳聚糖酶研究进展[J].海洋科学,2004,28(3):72-76.
[9]陈小娥,方旭波,夏文水.壳寡糖的酶法制备[J].功能高分子学报,2007,19-20(2):204-208.
[10]虞凤慧,徐泽平,谢海涛.一株产壳聚糖酶芽孢杆菌的分离及鉴定[J].中国酿造,2015,34(1):65-67.
[12]陈小娥,夏文水,余晓斌.壳聚糖酶高产菌株选育及发酵条件研究[J].食品与发酵工业,2004,30(3):66-69.
[13]李佳茵,王慧敏,祖国仁.一株产壳聚糖酶海洋真菌MF-08的分离鉴定及酶学性质研究[J].食品工业科技,2015,36(22):193-197.
[14]石会会,高艳艳,王秀英,等.产壳聚糖酶菌株的筛选、鉴定及发酵条件优化[J].食品工业,2014(2):54-57.
[15]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
[16]NIDHEESH T,PAL G,SURESH P.Chitooligomers preparation by chitosanase produced under solid state fermentation using shrimp by-products as substrate[J].Carbohyd Polym,2015,121:1-9.
[17]陈桂光,邵利,潘丽霞,等.响应面分析优化壳聚糖酶产生菌的发酵条件[J].食品科学,2008,29(10):380-383.
[18]刘杰,王延鹏,许晶,等.响应面法优化壳聚糖酶产生菌Mitsuariasp.K1的产酶发酵条件[J].化工进展,2013(12):2946-2951.
[19]陈静,陈小娥,方旭波,等.响应面法优化Bacillus thuringiensis ZJOU-010产壳聚糖酶[J].食品科学,2011,32(5):176-181.
[20]REDDY R,REDDY P,SEENAYYA G.Enhanced production of thermostableβ-amylase and pullulanase in the presence of surfactants by Clostridium thermosulfurogenesSV2[J].Process Biochem,1999,34(1): 87-92.
Optimization of fermentation conditions of chitosanase-producingAspergillus cervinus ZJOU-AC1 by response surface methodology
ZHANG Yemin1,SHAO Yifan1,XIONG Yanyan1,MAO Guizhu1,CHEN Xiaoe1*,FANG Xubo1,2,FU Pengcheng3
(1.College of Food and Medinel,Zhejiang Ocean University,Zhoushan 316022,China;2.State Key Laboratory of Aquatic Products Processing of Zhejiang Province,Zhoushan 316022,China;3.Zhoushan Haisheng Biotechnology Co.Ltd.,Zhoushan 316112,China)
Using chitosanase activity as the evaluation index,on the basis of single factor experiments,the fermentation conditions ofAspergillus cervinusZJOU-AC1 for chitosanase production were optimized by response surface methodology.The results showed that the optimum fermentation conditions were obtained as followed:colloid chitosan 1.5%,ammonium sulfate 0.4%,monopotassium phosphate 0.2%,magnesium sulfate 0.05%,bran 2%,Tween-80 0.06%,fermentation time 96 h,fermentation temperature 30℃,initial pH value 5.9 and inoculum 3%.Under the optimum conditions, the average chitosanase activity was 8.26 U/ml,which was 4.03 times that of before optimization(2.05 U/ml).
chitosanase;Aspergillus cervinusZJOU-AC1;response surface methodology;optimization
Q815
0254-5071(2016)11-0093-06
10.11882/j.issn.0254-5071.2016.11.019
2016-07-09
舟山市科技局项目(2015C41016);浙江省大学生科技创新活动计划暨新苗人才计划项目(2016R4 11033)
章晔敏(1995-),女,本科生,研究方向为食品科学与工程。
*通讯作者:陈小娥(1968-),女,教授,博士,研究方向为海洋生物资源综合利用。

