产葡萄糖氧化酶菌株的诱变筛选及遗传稳定性研究
辛国芹,董佩佩,汪祥燕,赵影,刘秀侠,徐海燕*,谷巍
(山东宝来利来生物工程股份有限公司,山东泰安271000)
产葡萄糖氧化酶菌株的诱变筛选及遗传稳定性研究
辛国芹,董佩佩,汪祥燕,赵影,刘秀侠,徐海燕*,谷巍
(山东宝来利来生物工程股份有限公司,山东泰安271000)
采用平板显色初筛、Underbofler滴定法复筛及紫外-硫酸二乙酯复合诱变的方法,从临沂果园土样中得到一株产葡萄糖氧化酶(GOD)活性较好的菌株,命名为Bla-6,其产GOD酶活为(10.50±0.25)U/mL,与原始菌株LPA-4产GOD酶活(6.75 U/mL)相比提高了55.57%。结合5.8S rDNA-ITS区序列系统进化、菌落形态、生长特性、菌体形态等确定其分类地位。结果表明,所得菌株Bla-6被鉴定为黑曲霉(Aspergillus niger),经8代传代培养后,GOD酶活维持在10.5 U/mL左右,该菌株遗传稳定性较好。
葡萄糖氧化酶;黑曲霉;诱变;遗传稳定性
葡萄糖氧化酶(glucose oxidase,GOD)是一种需氧脱氢酶,最早在黑曲霉(Aspergillus niger)提取物中发现[1]。GOD广泛地分布于动物、植物和微生物体内,在有过氧化氢酶存在时,可专一性氧化葡糖糖成葡萄糖酸和过氧化氢。作为一种新型的绿色天然酶制剂,GOD在食品、工业、医药、养殖业、纺织漂染[2]和生物等领域应用十分广泛[3-7]。GOD安全、无毒副作用,2013年农业部将饲料级GOD生产菌株限定为青霉菌(Penicillium)和黑曲霉菌(Aspergillusniger)。国外对微生物发酵生产GOD酶制剂的发酵工艺研究将近30年,HATZINIKOLAOU D G等[8]研究发现黑曲霉发酵生产GOD酶活多在2~7 U/mL,活性普遍较低,无法满足生产需要。2002年,MIRON J等[9]研究发现通过黑曲霉发酵菌株浸没培养法可优化生产GOD。目前,受技术水平、仪器设备等因素的限制,我国工业生产GOD酶制剂存在成本高、稳定性及酶活性较差等问题。GOD应用广泛,是一种很有潜力的生物催化剂,因此如何获得高活性、高稳定性、高产量的GOD,解决高成本、难纯化等问题是当前研究的重点[10],随着研究的不断深入,GOD的应用前景会更加广阔。如何更加经济有效地制备高纯度、高酶活、高稳定性的GOD是急需解决的问题。
紫外诱变和化学诱变法筛选获得GOD生产菌株是提高原始菌株产酶能力的有效方法。RAY S等[11]通过聚乙烯亚胺和紫外诱变处理黑曲霉孢子共得到1 976株突变株,其中黑曲霉AB1801产葡萄糖酸钙达120 g/L。朱洪菊[12]以初始GOD酶活为1.21 U/mL的黑曲霉菌株为出发菌株,通过紫外诱变、微波诱变处理,最终筛选出了一株酶活达到5.32 U/mL的突变株C3。朱运平等[13]以黑曲霉为出发菌株,通过紫外诱变、亚硝酸钠化学诱变及紫外-亚硝酸钠复合诱变三种方法筛选得到一株高产胞外GOD的突变株,产GOD酶活力达186.32 U/mL,为原始菌株的3.8倍,且产酶能力稳定。此外,定向突变获得高产GOD突变菌株的研究处于起步阶段,发展潜力很大。HOLLAND J T等[14]将黑曲霉GOD基因132位的苏氨酸定向突变成丝氨酸时,发现特异性常数kcat/Km升高较为显著,同时对底物亲和力仅降低3%。本研究从果园土壤中筛选产GOD的菌株,并采用紫外-硫酸二乙酯(diethyl sulfate,DES)复合诱变筛选高产GOD的菌株,旨在为其应用于工业化发酵生产提供一定的参考意义。
1 材料与方法
1.1 材料与试剂
从山东省临沂市秋季桃园内多点混合采集深度为0~10 cm的土样。本试验所选用的平板分离培养基、斜面培养基及发酵培养基详见参考文献[15]。硫代硫酸钠(分析纯):天津博迪化工股份有限公司;硫酸二乙酯(DES)(色谱纯):上海谱振生物科技有限公司。
1.2 仪器与设备
SW-CJ-2F型超净工作台:江苏通净净化设备有限公司;HPX-9082MBE型数显电热培养箱:上海博迅实业有限公司医疗设备厂;DHZ-CA型大容量振荡器:太仓市实验设备厂;FA-1004型电子分析天平:上海太平仪器厂;LDZX-75KBS立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 产GOD菌株的初筛
称取10 g采集的土样于带有玻璃珠的100 mL生理盐水中,振荡培养30 min,吸取1 mL土样上清液梯度稀释,涂布于平板分离培养基,28℃培养3 d后观察平板,将出现蓝色圈的菌株接种到斜面培养基上30℃培养2 d至产生黑色孢子,而后进行复筛。
1.3.2 产GOD菌株的复筛及GOD酶活测定
将斜面培养基上菌株接种于发酵培养基中,于30℃、180 r/min恒温摇床培养5 d,采用Underbofler滴定法[16]测定菌株产GOD酶活。
GOD酶活:测定发酵液经5 000 r/min离心10 min得粗酶液。取250mL三角瓶,加入2%葡萄糖磷酸缓冲溶液25mL及1 mL粗酶液,立即置于30℃水浴振荡1 h然后加入20 mL 0.1 mol/L的NaOH溶液终止反应,用0.1 mol/L HCl滴定剩余的NaOH,记录所消耗的HCl体积为A,空白组(CK)用1 mL蒸馏水替代粗酶液,其他操作相同,记录所消耗的HCl体积B,每个样品测定3个平行,取均值计算酶活。
GOD酶活=(B-A)×F×N×1 000/60
式中:A为中和NaOH所消耗的HCl体积,mL;B为空白组中和NaOH所消耗的HCl体积,mL;F为粗酶液稀释倍数,N为HCl浓度,mol/L;1 000为单位换算系数;60为反应时间,min。
GOD酶活的定义:在上述实验条件下每分钟催化氧化1μmol/L的葡萄糖的酶量定义为一个酶活单位,以1μmol/min表示,即1 U/mL。
1.3.3 产GOD菌株的紫外-硫酸二乙酯复合诱变
将复筛菌株在斜面培养基上培养长满孢子后,用适量的无菌生理盐水洗脱斜面培养基上的孢子,置于三角瓶中,180 r/min振荡20 min后用脱脂棉过滤菌丝从而得到分散的单孢子悬液,血球计数法计算孢子数。
将孢子悬液均匀地铺于已灭菌7cm表面皿中,制成1mm左右的薄层,于超净工作台的紫外灯下照射15 s后,进行梯度稀释,稀释度为10-1~10-6。取10-4~10-63个稀释度的孢子悬液各0.2mL,涂布于斜面培养基平板上,30℃避光培养2~3 d。挑取平板上生长速度较快的单菌落接种到斜面培养基上,30℃培养至孢子产生,再通过发酵培养基测定菌株产GOD酶活。选取产酶活高的菌株进行保存。
以紫外线诱变所得产GOD酶活最高的菌株为出发菌株,进行硫酸二乙酯诱变。取5 mL经紫外线诱变的高产GOD酶活孢子悬液加入体积为25 mL的三角瓶中,再加入0.2 mL体积分数为50%的DES,振荡40 min,再加入0.5 mL的硫代硫酸钠(85%)终止反应。稀释梯度为10-1~10-6。取10-4~10-63个稀释度的孢子悬液各0.2 mL,涂布于斜面培养基平板上,30℃倒置培养2~3 d。挑取平板上生长速度较快的单菌落接种到斜面培养基上,30℃培养至孢子产生,再通过发酵培养基测定菌株产GOD酶活。选取产酶活高的菌株进行保存。
1.3.4 产GOD菌株的鉴定
采用5.8S rDNA-ITS区序列法对筛选到的产GOD酶性能较好的菌株进行鉴定,构建系统发育树。待测菌株培养3d后挑取菌至发酵培养基中,30℃、160 r/min振荡培养2 d,然后将菌丝过滤烘干,采用生工生物工程(上海)股份有限公司真菌基因组DNA快速抽提试剂盒提取待测菌的基因组总DNA。
采用引物ITS1与ITS4对5.8S rDNA-ITS区序列进行扩增,聚合酶链反应(polymerase chain reaction,PCR)扩增反应体系及反应条件详见参考文献[15]。将PCR扩增产物送北京博尚公司测序,在美国国家生物技术信息中心(national center of biotechnologyinformation,NCBI)中进行基本的局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,用DNAMAN 6.0软件进行多重序列比较,用MEGA 3.1构建系统发育树。
1.3.5 遗传稳定性测定
将经过紫外-硫酸二乙酯复合诱变筛选得到的产GOD酶活最高的菌株连续8代传代培养后,观察菌株的生长性能、菌落形态,测定各代菌株产GOD酶活。
2 结果与分析
2.1 土壤样品中产GOD菌株的筛选
对果园土壤样品初步筛选分离得到16株产GOD的菌株,挑取初筛平板中蓝色反应圈较大的6株菌至斜面培养基30℃培养产生黑色孢子后转接至发酵培养基进行复筛,30℃、180 r/min振荡培养5 d后,采用Underbofler滴定法测定菌株产GOD酶活力,结果如表1所示。

表1 分离菌株产GOD酶活测定结果Table 1 Determination results of GOD activity produced by isolated strains
由表1可知,以菌株LPA-4产GOD酶活力最高,发酵5 d后发酵液中GOD酶活可达6.750U/mL,因此选定菌株LPA-4进行后续诱变试验。
2.2 诱变筛选结果
2.2.1 紫外诱变筛选结果
对土壤样品中筛选得到菌株LPA-4进行紫外诱变,筛选得到8株菌进行发酵培养,其GOD酶活测定结果如表2所示。

表2 紫外诱变菌株产GOD酶活测定结果Table 2 Determination results of GOD activity produced by UV-light mutagenesis strains
由表2可知,大部分菌株紫外诱变后与原始株LPA-4相比,产GOD性能无明显提高,菌株编号为LPA4-7的产GOD酶活最高,为(7.550±0.283)U/mL,选定菌株LPA4-7孢子悬浮液进行DES诱变筛选。
2.2.2 复合诱变筛选结果
对菌株LPA4-7孢子悬浮液进行DES诱变,然后梯度稀释涂布斜面培养基平板30℃培养,挑取生长速度较快的8株菌至斜面保存,并将这8株菌接种至液体发酵培养基,30℃、180 r/min发酵5 d,检测GOD酶活结果如表3所示。
由表3可知,经诱变后,酶活力较菌株LPA4-7提高的菌株有LPA47-3、LPA47-5、LPA47-8 3株,酶活分别比原始菌株LPA-4提高38.76%、55.57%、38.01%。诱变筛选的菌株LPA47-5酶活最高,相同条件下产酶性能在(10.501± 0.254)U/mL,将其命名为菌株Bla-6进行后续试验。

表3 复合诱变筛选结果Table 3 Screening results of compound mutagenesis
2.3 诱变株Bla-6遗传稳定性
诱变株进行8次传代培养,将诱变得到的高产菌株Bla-6连续转接8代,每传一代用摇瓶发酵液测定酶活,结果如表4所示。

表4 诱变菌株Bla-6遗传稳定性试验结果Table 4 Genetic stability test results of mutant strain Bla-6
诱变菌株存在遗传性能不稳定的风险,随着传代次数的增加产酶性能可能会有所减弱。由表4可知,诱变株Bla-6在1~8代范围内产GOD酶活较稳定,维持在10.5 U/mL左右,说明诱变菌株具有较好的遗传稳定性。
2.4 诱变株Bla-6的鉴定
2.4.1 诱变株Bla-6的生长特性
将菌株Bla-6纯培养物挑至平板分离培养基上于30℃培养48 h,观察菌落形态和在显微镜下菌株形态,结果见图1。由图1可知,菌落生长较快,初白色,产孢后表面黑色,呈粉末状。分生孢子头呈球形或近球形,黑色放射状,分生孢子梗长短不一,布满整个顶囊,褐色球形。

图1 诱变菌株Bla-6的菌落特征(a)和菌株形态(b)Fig.1 Colony characteristics(a)and strain morphology(b)of mutant strain Bla-6
2.4.2 PCR扩增结果
利用引物ITS1和ITS4,菌株Bla-6的ITS区基因PCR扩增到目的片段,在500 bp左右有1条明显的电泳条带,如图2所示。将扩增得到的PCR产物送北京博尚生物技术有限公司进行测序。
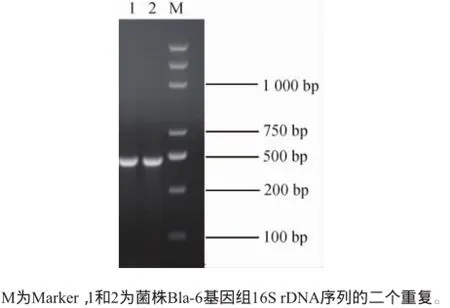
图2 菌株Bla-6的5.8S rDNA ITS区序列的PCR扩增产物电泳图Fig.2 PCR amplification product electrophoregram of 5.8 S rDNAITS sequence of strain Bla-6
2.4.3 目的菌株的系统发育分析
将目的菌株Bla-6的5.8S rDNA-ITS区序列在NCBI中进行BLAST分析,并下载相似性最大的序列和该属内代表种,利用MEGA3.1软件构建系统发育树(见图3)。

图3 菌株Bla-6的5.8S rDNA ITS区序列系统发育树Fig.3 Phylogenetic tree based on 5.8S rDNA ITS sequence of strain Bla-6
由图3可知,与GenBank数据库中曲霉菌相关菌株的ITS区基因序列JF838357.1、HQ850370.1等的5.8S rDNA-ITS区序列比较分析,发现其与曲霉属(Aspergillussp.)的黑曲霉菌(Aspergillus niger)亲缘关系最近,相似度达99%。综合菌株的菌落形态、生长特性、镜检形态及5.8S rDNA-ITS区序列系统进化分析,确定菌株Bla-6为黑曲霉(Aspergillus niger)。
3 结论
本研究采用平板显色法初筛和Underbofler滴定法进行复筛,从土壤样品中得到8株产葡萄糖氧化酶的菌株,通过紫外-硫酸二乙酯复合诱变筛选出一株产GOD酶活性能较好的诱变菌株Bla-6。经过8代传代培养,诱变菌株Bla-6具有产GOD酶性能较好的遗传稳定性。采用微生物发酵法生产酶具有在常温常压下完成,微生物容易培养、繁殖快,生产和设备投资较少,以及其设备泛用性较广的优点,故可在短时间内廉价的大量生产。该产葡萄糖氧化酶突变株遗传性状稳定,相同发酵条件下摇瓶产酶可达(10.501±0.254)U/mL,比原始菌株LPA-4(6.750 U/mL)提高了55.57%。该研究对产GOD菌株的筛选诱变方法的建立和对菌株产酶遗传稳定性的研究,为促进黑曲霉产葡萄糖氧化酶工业化生产,提高酶的应用质量,降低生产成本提供了科学依据。
[1]MULLER D.Oxidation von glukosemit extraktenausAspegillus niger[J]. Biochem Z,1928,199:136-170.
[2]FAROOQ A,ALI S,ABBAS N,et al.Comparative performance evaluation of conventional bleaching and enzymatic bleaching with glucose oxidase on knitted cotton fabric[J].J Clean Prod,2013,42(3):167-171.
[3]DEVARAJA G M,ANNAPUMA S S,RAO A,et al.Thermal inactivation of glucose oxidase:mechanism and stabilization using additives[J]. J Biol Chem,2003,278(27):24324-24333.
[4]WHITTINGTON H,WILLIAMS S K,BIDGOOD K,et al.Expression of theAspergillus nigerglucose oxidase gene inA.niger,A.nidulansand Sacchanomyces cerevisiae[J].Curr Cenet,1991,18(6):531-536.
[5]刘超,袁建国,王元,等.葡萄糖氧化酶的研究进展[J].食品与药品,2010,7(12):286-289.
[6]梅丛笑,方元超.葡萄糖氧化酶在食品及饮料中的应用[J].江苏食品与发酵,2003,3(1):22-25.
[7]李彤,姚子华.新型葡萄糖氧化酶电极用于临床血糖的测定[J].分析测试学报,2004,23(3):67-69.
[8]HATZINIKOLAOU D G,MACRIS B J.Factors regulating production of glucose oxidase byAspergillus niger[J].Enzyme Microb Tech,1995, 17(6):530-534.
[9]MIRON J,GONZALEZ M P,PASTRANA L,et al.Murado diauxic production of glucose oxidase byAspergillus nigerin submerged culture[J]. Enzyme Microb Tech,2002,31(5):615-620.
[10]周生民,赵伟.葡萄糖氧化酶活性变化的分析[J].中国酿造,2013,32(9):130-131.
[11]RAY S,BNAIK A K.Effect of ammonium and nitrate ratio on glucose oxidase activity during gluconic acid fermentation by a mutant strain of Aspergillus niger[J].Indian J Exp Biol,1999,37(4):391-395.
[12]朱洪菊.葡萄糖氧化酶产生菌的诱变育种及条件优化[D].济南:山东师范大学,2012.
[13]朱运平,褚文丹,李秀婷,等.产胞外葡萄糖氧化酶菌株的分离鉴定及其诱变育种研究[J].中国食品学报,2014,14(4):96-103.
[15]HOLLAND J T,HARPER J C,DOLAN P L,et al.Rational redesign of glucose oxidase for improved catalytic function and stability[J].PloS one,2012,7(6):e37924.
[15]辛国芹,徐海燕,汪孟娟,等.高产葡萄糖氧化酶菌株的分离鉴定及发酵条件优化[J].饲料广角,2015(5):34-38.
[16]张树政.酶制剂工业(下册)[M].北京:科学出版社,1984:558-591.
Mutation screening and genetic stability of glucose oxidase-producing strain
XIN Guoqin,DONG Peipei,WANG Xiangyan,ZHAO Ying,LIU Xiuxia,XU Haiyan*,GU Wei
(Shandong Baolai-leelai Bioengineering Co.,Ltd.,Taian 271000,China)
By preliminary screening of plate coloration,secondary screening of Underbofler titration method,a glucose oxidase-producing strain was obtained from Linyi orchard soil samples,and named as strain Bla-6.The glucose oxidase(GOD)activity produced by strain Bla-6 was(10.50±0.25) U/ml,which was 55.57%higher than that(6.75 U/ml)produced by original strain LPA-4.By the analysis of 5.8S rDNA-ITS gene sequence,colonial morphology,growth characteristics,and mycelial morphology,the results showed that the strain Bla-6 was identified asAspergillus niger.After subculture of 10 successive generations,the GOD activity maintained at about 10.5 U/ml,which showed that the strain had good genetic stability.
glucose oxidase;Aspergillus niger;mutation;genetic stability
Q939.97
0254-5071(2016)11-0069-04
10.11882/j.issn.0254-5071.2016.11.014
2016-05-24
国家高技术研究发展计划‘863计划'子课题(2013AA102806)
辛国芹(1985-),女,助理研究员,硕士,主要从事基础微生态研究工作。
*通讯作者:徐海燕(1975-),女,高级畜牧师,本科,主要从事微生态制剂研发工作。

