脑小血管病的候选基因研究进展
刘承浩 孙丽伟 周卫东
脑小血管病的候选基因研究进展
刘承浩 孙丽伟 周卫东
脑小血管病(cerebral small vessel disease,CSVD)是引起脑卒中、认知障碍及跌倒等神经系统病况的重要原因之一。目前研究显示,CSVD具有明显的遗传易感性,基因多态性是决定其遗传性易感性的重要因素之一。候选基因研究是探索某些基因对CSVD影响的一种研究方法,目前此方法已成为CSVD领域研究的一个新热点。候选基因是指疾病病理发生的各个环节中所涉及的与疾病表现相关的功能蛋白的对应基因中,与发病一致的基因突变。多个候选基因与CSVD的发生原因有关,这些发病原因主要包括血管危险因素、炎性反应及免疫作用、氧化应激反应、血脑屏障功能障碍相关等方面。本文将对各种病因相关的CSVD候选基因的研究进展进行综述。
脑小血管病;候选基因;基因多态性
脑小血管病(cerebral small vessel disease,CSVD)是指由于脑的穿支动脉、小动脉、毛细血管及小静脉的各种病变所导致的一系列临床、认知、影像及病理综合征[1]。CSVD在影像学上突出表现为腔隙性脑梗死(腔隙状态)、脑白质变性(脑白质疏松、白质高信号)、血管周围间隙扩大及微出血。CSVD是引起脑卒中、认知障碍及精神疾病的重要原因之一。在欧美人群中,约15%~26%的缺血性脑卒中由CSVD引发,在亚洲人群中该比例达25%~54%[2]。另外,CSVD还可以引起脑内出血,相当比例的CSVD还可发展为血管性痴呆。
CSVD的发病机制至今尚不明确,有研究表明它是血管性危险因素和遗传因素共同作用的结果[3]。目前候选基因研究已成为CSVD领域的一个新热点,研究多个候选基因与CSVD之间的因果关系,有助于更好地从分子生物的层面了解CSVD发病机制,从而提高该疾病的诊断和治疗。候选基因是候选基因法中的概念。候选基因法是指对疾病病理发生的各个环节进行详细调查后,确定一个或多个最有可能与疾病表现相关的功能蛋白,先对其基因和邻近的遗传标记做相关分析,进而找出与发病一致的基因突变,该突变基因为疾病的候选基因[4]。候选基因研究利用相关DNA 技术对病例组和无所研究疾病的对照组进行基因分型,分析基因型及基因频率在两组人群中的分布差异,并结合临床表型确定单核苷酸多态性(SNP)是否与疾病的发生相关。目前CSVD的候选基因的确定主要依据常见CSVD发病原因中所涉及的相关基因。CSVD发病原因包括血管危险因素、炎性反应及免疫作用、氧化应激反应、血脑屏障功能障碍以及其他有关因素。目前研究发现,上述发病因素相关的可能候选基因有36种(表1)[5-28]。本文将就上述CSVD的可能候选基因分别进行综述。
1 血管危险因素相关的候选基因
小动脉硬化是CSVD的发病原因之一,与之相关的候选基因,包括影响血压波动、血流变化、血管内皮功能及血管结构改变的候选基因,如肾素-血管紧张素-醛固酮系统(RAAS)相关基因〔肾素血管紧张素转换酶(ACE)基因、血管紧张素Ⅱ受体1型(AGTR1)基因、血管紧张素原(AGT)基因、醛固酮合酶基因(CYP11B2基因)〕、NOTCH3、Ⅳ型胶原蛋白α1基因(COL4A1)、蛋白激酶Cη的基因(PRKCH)、凝血因子3(F3)基因等,还包括影响物质代谢而造成血管损伤的候选基因,如载脂蛋白E(APOE)基因、胆固醇酯转运蛋白(CETP)基因、亚甲基四氢叶酸还原酶基因(MTHFR)、钙蛋白酶10(CAPN10)基因)等。
颅内小血管内皮细胞损伤、平滑肌增生、基底膜增厚造成管腔狭窄,最终导致皮层下组织慢性弥漫性或急性局限性缺血改变,后者在影像学表现为脑白质变性或腔隙性脑梗死[29],也可能会导致血管破裂而影像上表现为微出血。RAAS系统相关基因与该病理变化有关。两项关于ACE基因的Meta分析研究,其中一项纳入了37481例脑卒中患者[30],另一项纳入50组病例-对照研究(共纳入10070缺血性脑卒中患者和22103例非缺血性脑卒中对照组)[31],结果均显示,ACEI/D基因多态性对腔隙性脑梗死的影响较大。一项Meta分析研究发现AGTM235T基因多态性与白质高信号不相关[5]。而Henskens等[6]的研究显示,AGTR1 A1166C rs5186的CC型与皮质下白质高信号的体积呈正相关。CYP11B2是催化合成醛固酮不可或缺的合成酶。White等[32]的研究显示CYP11B2基因中-344位置的T等位基因代替C等位基因后会使CYP11B2合成酶生成减少。Verpillat等[7]的研究显示,CYP11B2基因的rs17799998基因多态性与白质高信号的发病风险相关。
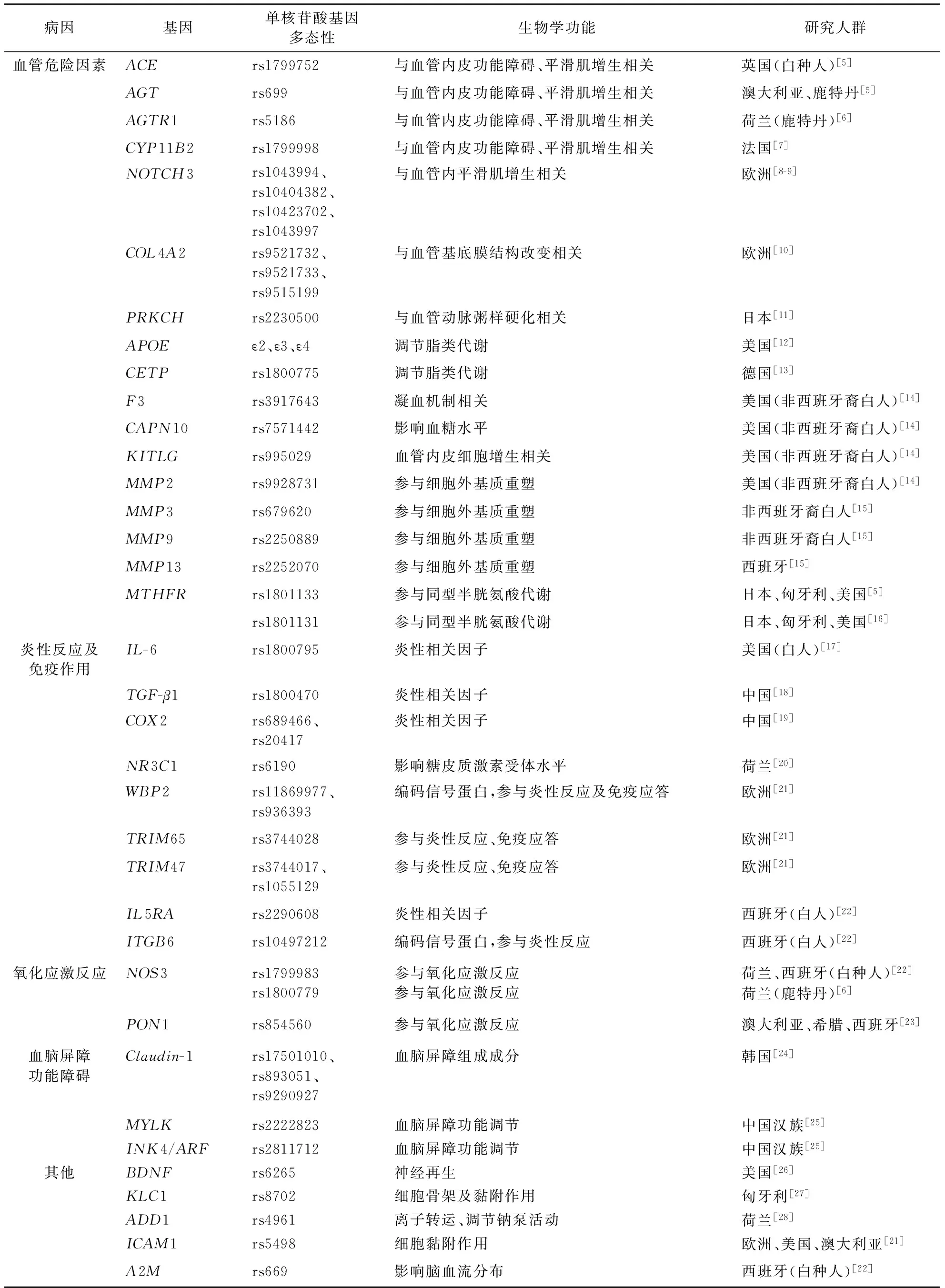
表1 CSVD各种病因相关的候选基因
NOTCH3与小动脉的平滑肌细胞增生密切相关。一项奥地利的有关脑卒中预防的群组研究(共纳入888例脑卒中患者)结果显示,NOTCH3的常见SNP及罕见SNP遍布整个基因,其中常见的SNP,包括rs1043994、rs10404382、rs10423702及rs1043997,并且上述4种基因多态性与白质高信号的发生及进展相关[8]。但2015年一项有关NOTCH3基因与CSVD是否相关的研究中,共纳入腔隙性脑梗死患者1350例、白质高信号患者3670例和非脑卒中对照组7397例分别进行分析,结果提示该基因的4个SNPs与腔隙性脑梗死和白质高信号发生均不相关[9]。造成以上两个研究结果不同的原因,目前推测可能是由于在实验设计中的人群选择及衡量是否患病的选择标准存在差异。
COL4A1/COL4A2基因是编码血管基底膜的主要成分,该基因发生突变后会引起血管基底膜结构改变,进而导致家族性CSVD、深部脑内出血、腔隙性脑卒中及白质高信号的改变。一项有关COL4A1/COLA2与CSVD相关性的meta分析研究显示,COL4A2基因中新发现的3个基因多态性rs9521732、rs9521733、rs9515199均与症状性CSVD,特别是与深部脑出血的发生相关[10]。
现有研究显示,下述候选基因可能通过影响脑内的血流分布引起CSVD的发生,但其具体机制尚不明确。PRKCH主要表达于发生动脉粥样硬化改变的血管内皮细胞和巨噬细胞,可以加重动脉粥样硬化病变。一项日本的病例-对照研究(共纳入491例腔隙性脑梗死和485名健康对照)显示,PRKCH1425G/A基因多态性与腔隙性脑梗死有关[11],但之后的一项日本研究(共纳入295例腔隙性脑梗死和496名健康对照)则表明PRKCH1425G/A基因多态性与腔隙性脑梗死无关[12]。两项研究结果存在差异,2011年的一项Meta分析研究纳入腔隙性脑梗死患者2195例、健康对照3192名,将该基因多态性与腔隙性脑梗死是否相关的研究进行整合分析,结果显示PRKCH1425G/A基因多态性与腔隙性脑梗死在日本人群和中国人群中均存在相关性[13]。Smith等[14]研究了包括F3基因、酪氨酸激酶受体配体(KITLG)基因、CAPN10基因及MMP2基因等多个基因的SNP及其相互作用CSVD发生的影响,发现其中F3、KITLG、CAPN10、MMP2等4个SNPs分别通过影响凝血机制、内皮细胞的增生及造血干细胞增殖、细胞外基质重塑及血糖水平等机制影响白质高信号的发生。Fornage等[15]的一项研究显示MMP3基因、MMP9基因及MMP13基因等基因突变均与白质高信号发生相关。
高脂血症是血管损伤的危险因素,目前研究较多的参与脂类代谢的候选基因有APOE基因和CETP基因。另有研究显示高同型半胱氨酸血症是CSVD的独立危险因素,目前已知与之相关的候选基因为MTHFR。一项包含10项研究纳入7351例脑微出血患者的Meta分析显示,与APOEε3/ε3比较,APOEε4增加了脑微出血,特别是脑叶微出血的风险[33]。Paternoster等[5]有关脑白质高信号与基因多态性关系的研究中,对样本例数超过2000例的基因,包括ACE(I/D)(样本量为2316例)、AGTM235T(样本量为2702例)、APOE(ε4+/-)(样本量为8546例)、MTHFRC677T(样本量为2796例)分别进行Meta分析发现,APOE(ε4+/-)基因多态性、MTHFRC677T及AGTM235T与白质高信号不相关,ACE(I/D)基因多态性与白质高信号发生相关。Szolnoki等[16]的半定量研究提示MTHFRC677T及年龄与白质高信号体积呈正相关,携带T等位基因者的白质变性损伤体积大于携带C等位基因者。Qureischie等[34]的研究显示候选基因CETPC629A基因多态性中的AA型相对于CC型及AC型,额叶白质高信号分值较低〔AA型为(2.88±0.45),CC型及AC型为(4.09±0.28),P=0.024〕,但对于整个头颅的白质高信号的分值来说,该结果差异无统计学意义〔AA型为(12.25±1.71)、CC型及AC为(15.41±1.05),P=0.12〕。此研究中的分值是指依据白质高信号的数量、大小及位置制定的分数,是半定量的计算方法。
2 炎性反应、免疫作用相关候选基因
脑组织发生缺血的病理改变后,病变的脑组织会出现继发炎性联级反应、自身免疫反应及细胞凋亡。这些病理过程均与CSVD发生相关,与之相关的候选基因,包括与炎性反应相关的候选基因,如白细胞介素6(IL-6)基因、肿瘤坏死因子α(TNF-α)基因、环氧化物酶2(COX2)基因,以及与自身免疫反应及细胞凋亡有关的候选基因,如糖皮质激素受体(NR3C1)基因、WW结合域结合蛋白2基因(WW domain binding protein 2 gene,WBP2基因)、三重基序蛋白65基因(tripartite motif-containing genes 65,TRIM65基因)、三重基序蛋白47基因(tripartite motif-containing genes 47,TRIM47基因)、白介素-5受体α亚基(IL5RA)基因、整合素β6(ITGB6)基因。
脑组织缺血/再灌注时,内皮细胞、神经元等局部被激活,通过释放如TNF-α和白细胞介素1β(IL-1β)等炎性因子触发炎性反应,引起其他细胞因子与炎性代谢产物共同促使白细胞迁移至组织损伤区,导致血管再闭塞,进而导致CSVD。Fornage等[17]的一项研究显示IL-6单倍体启动子上的基因多态性1510(-174 G/C)和3572均与白质高信号的发生相关。一项有关TGF-β1基因第10位密码子(T+29C)基因多态性与CSVD的相关性研究发现,TT基因型增加CSVD的发生风险,而且在进行亚组分析后还提示该基因多态性与白质高信号的发生相关[18]。Shan等[19]的关于COX2 1195G>A和-765G>C基因多态性与CSVD相关性的研究中发现,COX 21195A基因型与白质高信号的发生相关,但与腔隙性脑梗死发生无关;COX2 1195G>A 和-765G>C的基因多态性在该研究中呈连锁不平衡,A-1195-G-765单倍体可增加白质高信号但不增加腔隙性脑梗死的发生风险。van Rossum等[20]的一项有关痴呆和脑白质变性与NR3C1基因的研究中发现,NR3C1基因的ER22/23EK等位基因型可以减低白质高信号和痴呆的发生,是机体的一种保护基因。
CSVD导致的脑组织损伤可能会继续诱发神经元自身免疫反应、细胞凋亡以及神经再生等病理机制的发生[35]。目前研究发现与该病理过程相关的候选基因有WBP2基因、TRIM65基因、TRIM47基因。一项关于白质高信号研究的Meta分析纳入了来自7个不同社区的9361名欧裔人群,该分析发现在染色体17q25位点上的6个新的基因多态性,包括rs3744028、rs9894383、rs936393、rs11869977、rs3744017及rs1055129,分别分布在WBP2、TRIM65、TRIM47上,这些基因位点的突变可以增加白质高信号的发生风险,而且其中rs3744028和rs1055129两个SNP还分别在法国和冰岛两个不同人种中进行再次分析,结果仍提示这两个SNP可以增加白质高信号的患病风险[21]。此外,Fernandez等[22]的研究结果亦显示IL5RA基因的rs2290608 SNP和ITGB6基因的rs10497212 SNP均与白质高信号的发生相关。
3 氧化应激反应相关的基因
脑内的小血管病变可能会引起脑组织急性缺血/再灌注损伤,使脑内产生大量自由基,破坏生物膜,最终导致神经元自溶。脑组织发生缺血改变后一氧化氮(NO)增多,并与过氧化物反应后产生神经毒性物质,引起神经元结构损伤。与以上病理过程相关的可能候选基因,包括有一氧化氮合酶(NOS)基因和对氧磷脂酶1(PON1)基因。
NOS基因编码的NOS是NO合成的限速酶,其含量及活性的变化直接影响NO的生成量。目前两项研究均显示NOS3基因的SNP多态性与CSVD的白质高信号的发生相关。其中一项研究显示NOS3基因的 rs1800779与白质高信号的发生相关[22];另一项研究显示 NOS3基因的rs1799983的TT基因型与白质高信号体积大小呈正相关[6]。Schmidt等[23]从奥地利预防脑卒中研究中选取264例无神经精神疾病的社区人群进行脑白质高信号和PON1基因多态性关系的研究,结果显示PON1的L54M基因多态性的LL型与白质高信号的病变大小及进展相关。
4 血脑屏障功能障碍相关候选基因
血脑屏障功能障碍会引起小血管结构改变(血管壁增厚、结构破坏、破裂)以及血管周围异常改变(水肿、间隙扩大、组织受损),从而导致CSVD,与血脑屏障的组成和功能相关的CSVD候选基因,包括内皮细胞紧密连接蛋白(Claudin-1)基因、肌球蛋白轻链激酶基因(MYLK)和细胞周期素依赖性蛋白激酶抑制剂-2A(INK4/ARF)基因。
血脑屏障由紧密连接和黏附连接组成,内皮细胞Claudin-1是紧密连接的重要组成部分。Yadav等[24]的研究中发现了Claudin-1基因的3个SNP,包括rs17501010、rs893051和rs9290927,其中rs9290927基因多态性与白质高信号的发生相关。有研究显示,MYLK基因和INK4/ARF基因通过影响血脑屏障的调节功能使脑内小血管发生病理生理改变,前者可降低CSVD的发生风险,后者可增加CSVD的患病风险,但其具体发生机制尚不明确[25]。
5 其他相关候选基因
血管内皮细胞、血管周围细胞、神经元及神经胶质细胞构成神经血管单元,后者在结构和功能上维持大脑微环境的稳定,其中的任何细胞的结构和功能发生病理改变都可能会导致CSVD,这一类CSVD的可能候选基因,包括脑源性神经营养因子(BDNF)基因、驱动蛋白轻链-1(KLC1)基因、α-内收蛋白(α-adducin)基因(ADD1)、细胞间黏附因子-1(intercellular adhesion molecule 1,ICAM1)基因、α2巨球蛋白(alpha-2-macroglobulin,A2M)基因等。
Taylor等[26]用半定量的研究方法研究BDNF Val66Met基因多态性与白质高信号的关系,结果显示BDNF基因的ValMet66基因型与老年人的白质高信号体积大小呈正相关。
Szolnok等[27]的研究认为KLC1基因中 AA185-406TT单倍体可以增加高血压合并吸烟患者发生脑白质高信号的风险,而单独在高血压患者或吸烟患者中该AA185-406TT单倍体并未增加白质高信号患病风险。
ADD1编码α-内收蛋白(α-adducin),后者是细胞骨架的主要成分,可以促进细胞间的离子转运、调节钠-钾泵的活动,该基因发生突变后可能会导致CSVD的发生。van Rijn等[28]的研究结果提示ADD1 GT/TT突变增加腔隙性脑梗死的患病风险〔OR=1.36,95%CI(0.98,1.88),P>0.05〕,而且GT/TT型皮质下白质高信号体积〔(1.45±0.14)mL〕大于GG型〔( 1.24±0.10) mL,P=0.22)〕,但以上结果均差异无统计学意义,有待进一步深入研究。
ICAM-1是一种表达于内皮细胞和免疫细胞的糖蛋白,ICAM1基因突变后可能会导致CSVD的发生。有研究显示该基因多态性与CSVD发生有关系,但具体发生机制尚不清楚[21]。
A2M基因编码α2巨球蛋白,后者为蛋白酶抑制剂,可以抑制胰蛋白酶、凝血酶和胶原蛋白酶,有研究显示该基因可以通过影响脑内血流分布引起CSVD发生,具体病理过程尚不清楚[22]。
综上,本文综述了与CSVD相关的36种候选基因,其中仅2种基因突变为CSVD的保护因素,其余均为CSVD的致病因素,但由于样本量、种族差异等多种原因,目前结论尚存争议。CSVD相关的候选基因研究目前已成为神经科研究热点之一,随着精准医学概念的提出,促使遗传关联研究与临床医学紧密接轨。今后可以运用候选基因、全基因组关联研究以及全基因组外显子研究等多种方法寻找相关致病基因和保护基因,将有助于CSVD的早期预防、诊断和治疗。
[1]中华医学会神经病学分会,中华神经病学分会脑血管病组.中国脑小血管病诊治共识[J].中华神经科杂志,2015,48(10):838-844.
[2]Tsai CF, Thomas B, Sudlow CL. Epidemiology of stroke and its subtypes in Chinese vs. white populations: a systematic review[J].Neurology, 2013, 81(3):264-272.
[3]牛宝丰,周卫东,刘长春,等.椎-基底动脉系统短暂性脑缺血发作患者脑白质变性的危险因素研究[J].中国神经免疫学和神经病学杂志,2015,24(1):46-48.
[4]Jennifer MK,Alison MG.The candidate gene approach[J]. Alcohol Res Health,2000,24(3):164-168.
[5]Paternoster L, Chen W, Sudlow CL. Genetic determinants of white matter hyperintensities on brain scans: a systematic assessment of 19 candidate gene polymorphisms in 46 studies in 19 000 subjects[J]. Stroke, 2009, 40(6):2020-2026.
[6]Henskens LH, Kroon AA, van Boxtel MP, et al.Associations of the angiotensin II type 1 receptor A1166C and the endothelial NO synthase G894T gene polymorphisms with silent subcortical white matter lesions in essential hypertension[J].Stroke, 2005, 36(9): 1869-1873.
[7]Verpillat P, Alperovitch A, Cambien F, et al. Aldosterone synthase (CYP11B2) gene polymorphism and cerebral white matter hyperintensities[J].Neurology,2001,56(5): 673-675.
[8]Schmidt H, Zeginigg M, Wiltgen M, et al.Genetic variants of the NOTCH3 gene in the elderly and magnetic resonance imagingcorrelates of age-related cerebra small vessel disease[J]. Brain, 2011, 134(pt 11): 3384-3397.
[9]Rutten-Jacobs LC,Traylor M,Adib-Samii P,et al. Common NOTCH3 variants and cerebral small-vessel disease[J].Stroke, 2015,46(6):1482-1487.
[10]Rannikmäe K,Davies G,Pippa A,et al. Common variation in COL4A1/COL4A2 is associated with sporadic cerebral small vessel disease[J].Neurology, 2015, 84(9): 918-926.
[11]Kubo M, Hata J, Ninomiya T, et al. A nonsynonymous SNP in PRKCH (protein kinase Ceta) increases the risk of cerebral infarction[J]. Nat Genet, 2007, 39(2):212-217.
[12]Serizawa M, Nabika T, Ochiai Y, et al. Association between PRKCH gene polymorphisms and subcortical silent brain infarction [J].Atherosclerosis, 2008,199(2): 340-345.
[13]Li JX, Luo M,Xu XW, et al. Association between 1425G/A SNP in PRKCH and ischemic stroke among Chinese and Japanese populations: A meta-analysis including 3686 cases and 4589 controls [J]. Neurosci Lett, 2012, 506(1): 55-58.
[14]Smith JA, Turner ST, Sun YV, et al. Complexity in the genetic architecture of leukoaraiosis in hypertensive sibships from the GENOA Study[J].BMC Med Genomics,2009, 2: 16.
[15]Fornage M, Mosley TH, Jack CR, et al.Family-based association study of matrix metalloproteinase-3 and -9 haplotypes with susceptibility to ischemic white matter injury[J]. Hum Genet, 2007, 120(5), 671-680.
[16]Szolnoki Z, Szaniszlo I, Szekeres M, et al. Evaluation of the MTHFR A1298C variant in leukoaraiosis[J]. Mol Neurosci, 2012, 46(3), 492-496.
[17]Fornage M, Chiang YA, O′Meara ES, et al. Biomarkers of inflammation and MRI-defined small vessel disease of the brain: the Cardiovascular Health Study[J].Stroke,2008,39(7): 1952-1959.
[18]Tao HM, Chen GZ, Lu XD, et al. TGF-beta 1 Codon 10 polymorphism is associated with cerebral SVD[J]. Neurol, 2011, 38(6): 869-873.
[19]Shan XY,Chen GZ,Cheng GP.Cyclooxygenase 2 genetic polymorphism may increase the risk of developing leukoaraiosis in Chinese[J].Mol Neurosci, 2013, 51(2): 461-466.
[20]van Rossum EF, de Jong FJ, Koper JW,et al. Glucocorticoid receptor variant and risk of dementia and white matter lesions[J]. Neurobiol Aging, 2008, 29(5): 716-723.
[21]Fornage M, Debette S, Bis JC, et al. Genome-wide association studies of cerebral white matter lesion burden: the CHARGE consortium[J].Ann Neurol, 2011, 69(6): 928-939.
[22]Fernandez-Cadenas I, Mendioroz M, Domingues-Montanari S,et al. Leukoaraiosis is associated with genes regulating blood-brain barrier homeostasis in ischaemic stroke patients[J].Eur J Neurol, 2011,18(6): 826-835.
[23]Schmidt R, Schmidt H, Fazekas F, et al.MRI cerebral white matter lesions and paraoxonase PON1 polymorphisms: three-year follow-up of the Austrian Stroke Prevention Study[J].Arterioscler Thromb Vasc Biol,2000, 20(7): 1811-1816.
[24]Yadav BK,Shin BS. Single-Nucleotide Polymorphisms of tight junction component Claudin-1 associated with leukoaraiosis[J]. J Stroke Cerebrovasc Dis, 2015, 24(7): 1662-1670.
[25]Li W, Hu B, Li GL,et al. Heterozygote genotypes at rs2222823 and rs2811712 SNP loci are associated with cerebral small vessel disease in Han Chinese Population[J]. CNS Neurosci Ther, 2012,18(7): 558-565.
[26]Taylor WD, Zuchner S, McQuoid DR, et al. The brain-derived neurotrophic factor VAL66MET polymorphism and cerebral white matter hyperintensities in late-life depression[J]. Am J Geriatr Psychiatry, 2008,16(4): 263-271.
[27]Szolnoki Z, Kondacs A, Mandi Y, et al. Evaluation of the roles of the A185C and C406T kinesin lightchain 1 variants in the development of leukoaraiosis.[J]. Neurosci Lett, 2007:429(2-3): 101-104.
[28]van Rijn MJ, Bos MJ, Yazdanpanah M, et al. Alpha-adducin polymorphism, atherosclerosis, and cardiovascular and cerebrovascular risk[J]. Stroke, 2006, 37(12): 2930-2934.
[29]王君,任歆,周卫东.脑白质疏松的MRI表现和病理改变的对比研究[J].中华老年医学杂志,2015,34(8):914-917.
[30]Bentley P, Peck G, Smeeth L, et al. Causal relationship of susceptibility genes to ischemic stroke: comparison to ischemic heart disease and biochemical determinants[J]. PLoS One, 2010, 5(2): e9136.
[31]Zhang Z,Xu G,Liu D, et al. Angiotensin-converting enzyme insertion/deletion polymorphism contributes to ischemic stroke risk: a meta-analysis of 50 case-control studies[J]. PLoS One, 2012, 7(10): e46495.
[32]White PC, Slutsker L. Haplotype analysis of CYP11B2[J]. Endocrinol Res, 1995, 21(1-2): 437-442.
[33]Maxwell SS, Jackson CA, Paternoster L,et al. Genetic associations with brain microbleeds: Systematic review and meta-analyses[J].Neurology, 2011, 77(2): 158-167.
[34]Qureischie H, Heun R, Popp J, et al.. Association of CETP polymorphisms with the risk of vascular dementia and white matter lesions[J]. Neurol Transm, 2009,116(4), 467-472.
[35]Back SA, Han BH, Luo NL, et al. Selective vulnerability of late oligodendrocyte progenitors to hypoxia-ischemia[J]. J Neurosci, 2002, 22(2): 455-463.
(本文编辑:邹晨双)
10.3969/j.issn.1006-2963.2016.04.015
首都卫生发展科研专项(首发2011-6011-01)
063000华北理工大学研究生学院神经病学系(刘承浩);100028煤炭总医院神经内科(孙丽伟、周卫东)
周卫东,Email:mtzyyneuro@163.com
R743.9
A
1006-2963(2016)04-0293-06
2015-11-24)

