重症肌无力患者针电极肌电图肌源性受损表现的临床意义
井峰 王卫 陈玉萍 刘淑艳 王琳 魏东宁
重症肌无力患者针电极肌电图肌源性受损表现的临床意义
井峰 王卫 陈玉萍 刘淑艳 王琳 魏东宁
目的 分析重症肌无力(myasthenia gravis,MG)患者针电极肌电图(needle electrode electromyography,NEMG)检查结果的临床意义。方法 回顾性分析2011-01-01—2013-12-31期间在解放军第309医院神经内科住院治疗的335例确诊MG患者的NEMG检查结果和临床资料,根据NEMG检查是否出现肌源性受损表现将患者分为两组,对比分析两组患者的临床特点。结果 29例(8.7%)NEMG出现肌源性受损表现,异常NEMG均无自发电位,仅表现为运动单位电位(motor unit potential,MUP)波幅降低、时限缩短。NEMG检查有肌源性受损表现组临床绝对评分(20.8±7.3)高于无肌源性受损表现组(14.9±9.0,t=1.79,P<0.05)。 NEMG检查无肌源性受损表现者多以眼外肌无力为首发症状(85.62%),以肢体和球部肌肉起病者比例较低(14.38%);与无肌源性受损表现者相比,有肌源性受损表现者以眼外肌为首发症状者比例较低(55.17%),多以肢体和球部肌肉受累起病(44.83%),两组差异有统计学意义(χ2=9.79,P<0.01)。两组间比较,性别、发病年龄、病程、Osserman分型及胸腺病理类型差异均无统计学意义(均P>0.05)。结论 NEMG检测表现为肌源性受损者病情较无肌源性受损表现者重。电生理检查可在一定程度上提示MG病情的严重程度。
重症肌无力;肌电描记术; 针电极肌电图
重症肌无力(myasthenia gravis,MG)是一种自身免疫性疾病,病变主要累及神经肌肉接头(neuromuscular junction,NMJ),突触后膜受损为该病主要的病理改变,受累肌肉的病态疲劳和波动性无力为该病主要的临床特点[1]。根据受累肌肉的不同MG临床表现多样,诊断存在一定难度。在诊断MG时应与肌肉疾病相鉴别。神经电生理检查是诊断MG的重要技术方法,其中低频重复神经刺激(repetitive nerve stimulation,RNS)是目前最常用的电生理技术,针电极肌电图(needle electrode electromyography,NEMG)检查在鉴别MG与肌肉疾病时有重要作用。国内外文献均曾报道MG患者NEMG检查可出现肌源性受损表现[2-3],而且这一电生理现象在临床工作中也多次被观察到,但目前的研究大多仅关注报道这一现象本身,而并未更深入地探究其临床意义。本研究回顾性分析335例MG患者NEMG检查结果和临床特点,旨在进一步探索NEMG检测出现肌源性受损表现对于MG的临床意义。
1 对象和方法
1.1 观察对象 筛选自2011-01-01—2013-12-31期间在解放军第309医院神经内科住院治疗并确诊为MG的患者335例,其中男162例(48.4%),女173例(51.6%),年龄为5~88岁,平均年龄为(46.7± 19.7)岁。发病年龄1~88岁,中位数37岁,四分位间距16岁。其中早发型MG(发病年龄<50岁)189例(56.4%),其余146例(43.6%)为晚发型MG(发病年龄≥50岁)。病程范围15 d~50年,中位数19.6个月(四分位数间距12.7个月)。入组患者均无特殊家族史,未合并其他免疫相关性疾病。
所有入组患者均符合2012年版《重症肌无力诊断和治疗中国专家共识》[4]中的诊断标准。并符合以下条件:(1)均有典型的波动性无力症状,疲劳试验及新斯的明试验均为阳性。(2)入院后严格按照规范要求,由经验丰富的受训神经内科医生对入组患者使用MG临床绝对评分法[5]评估病情严重程度,并记录临床评分。(3)均在作者医院肌电图室进行神经电生理检查,检查前服用新斯的明者停药至少8 h;均进行低频(1、3、5 Hz)RNS和NEMG检查。NEMG检查主要取近端肌肉(肱二头肌、三角肌、股四头肌)为检测对象;对于远端肌肉受累明显者同时进行NEMG检测。RNS检查以复合肌肉动作电位(compound muscle action potential,CMAP)第4波较第1波波幅降低超过10%为阳性,入组者低频RNS检查均为阳性。
本组患者Osserman临床分型[4]:Ⅰ型44例(13.1%),Ⅱa型52例(15.5%),Ⅱb型175例(52.2%),Ⅲ型25例(7.5%),Ⅳ型39例(11.7%),Ⅴ型0例。278例(83.0%)以眼外肌受累为首发症状,35例(10.4%)以肢体无力为首发症状,22例(6.6%)以球部肌肉受累为首发症状。经胸部CT或病理学检查证实本组中胸腺正常121例(36.1%),胸腺增生119例(35.5%),合并胸腺瘤76例(22.7%),胸腺萎缩19例(5.7%)。本组患者肌酸激酶(CK)和肌酸激酶同工酶(CK-MB)均在正常范围。
1.2 方法 回顾性分析患者的临床资料,将入组者的性别、发病年龄、病程时间、症状首发部位、胸腺类型等进行详细记录、整理并建立数据库。根据NEMG是否有自发电位,运动单位电位(motor unit potential,MUP)时限及增减的百分比,MUP波幅,MUP多相波所占百分比,大力收缩时的募集相变化,将入组者分为有肌源性受损表现组和无肌源性受损表现组,分析比较两组各临床特点的差异。NEMG检查肌源性受损的表现定义为MUP时限缩短,波幅降低,多相波比例增多,募集相出现病理干扰相。
1.3 统计学处理 使用SPSS17.0软件进行分析。绝对临床评分符合正态性分布,使用均数±标准差的形式表示,两组间比较采用t检验。病程时间不符合正态性分布,使用中位数(四分位数间距)的形式表示,两组间比较采用M-W检验。性别、发病年龄、首发部位、胸腺类型和Osserman分型等的两组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
NEMG检测有肌源性受损表现组患者共 29例(8.7%),均未发现异常自发电位,MUP短时限,低波幅改变是NEMG出现肌源性受损的主要电生理表现;无肌源性受损表现组306例(91.3%),均NEMG未见异常。有肌源性受损表现组MG绝对临床评分(20.8±7.3)高于无肌源性受损表现组(14.9±9.0,t=1.79,P<0.05)。两组间病程比较差异无统计学意义(有肌源性受损表现组病程时间的中位数16个月,四分位间距11个月;无肌源性受损表现组病程时间的中位数18个月,四分位间距13个月,U=37.6,P=0.52)。无肌源性受损表现组多以眼外肌无力为首发症状(262例,85.62%),以肢体和球部肌肉起病者比例较低(44例,14.38%);与无肌源性受损表现者比较,有肌源性受损表现组以眼外肌为首发症状者比例较低(16例,55.17%),多以肢体和球部肌肉受累起病(13例,44.83%),差异具有统计学意义(χ2=9.79,P<0.01)。两组间性别、发病年龄、胸腺病理类型以及Osserman分型比较差异均无统计学意义(P>0.05),具体结果见表1。
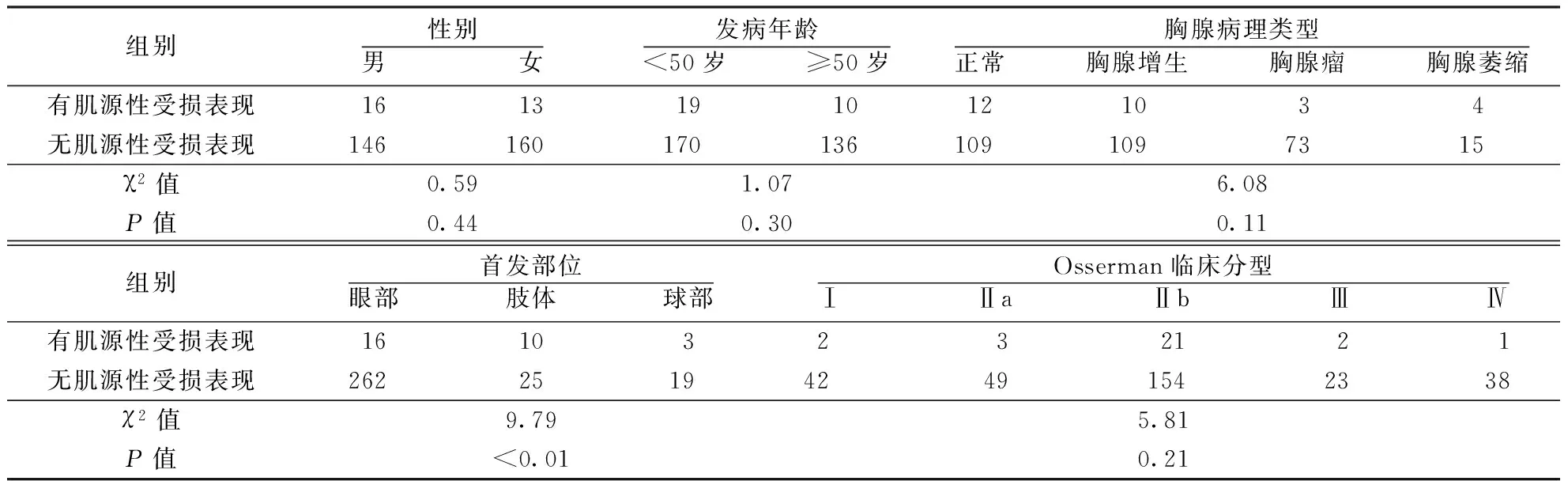
表1 两组性别、发病年龄、胸腺病理类型以及Osserman分型等临床特点比较
3 讨论
对MG患者进行常规NEMG检查有助于明确诊断,多数MG患者NEMG检查无特异性表现,然而部分MG患者NEMG检查也可出现肌源性受损表现。国外文献曾统计NEMG肌源性受损表现可见于10%~37.5%的MG患者[2],国内尚未有准确的统计数据报道。本研究中MG患者中NEMG检查显示有肌源性受损表现者所占比例(8.7%)略低于国外报道,这可能与本研究仅选择资料齐全的住院患者为研究对象有关。MG患者NEMG检查可出现肌源性受损表现,这一现象已得到广泛认同,但其出现原因仍有争议。推测其可能原因如下:首先,部分MG患者NEMG出现肌源性受损表现可能是由于合并肌肉病变,也有将肌肉病变误诊为MG的可能。以往研究发现MG患者可合并炎性肌病或线粒体肌病[6],而且MG与肌病鉴别诊断存在一定难度[7]。其次,NEMG肌源性受损表现也可能与MG本身的病理改变有关,可能是由于NMJ病变所致。Somnier等[8]对EMG出现肌源性受损表现的MG患者进行肌肉活检后仅发现“非特异性改变”。其他研究也通过肌肉活检证实MG患者萎缩肌肉的病理表现为非特异性改变或神经源性改变[9]。综合上述研究结果,推测NEMG有肌源性受损表现可能是由于NMJ传递障碍所致。
本研究中所有入组患者均确诊为MG,并无合并其他肌肉疾病的证据,因此可以推测NEMG肌源性受损表现的出现可能是由于MG本身的病理和电生理特点所致。其可能机制如下:运动神经兴奋后突触前膜释放乙酰胆碱(acetylcholine,ACh),并与突触后膜的乙酰胆碱受体(acetylcholine receptor,AChR)结合。AChR开放,离子内流,导致突触后膜局部去极化,产生终板电位(endplate potential,EPP)。当EPP超过兴奋阈值后便会导致突触后膜Na+通道开放,Na+大量内流入细胞产生动作电位,并沿肌细胞膜双向传播[10]。肌纤维的电活动可被NEMG所记录,MUP则是所记录到的同一运动单位电活动的总和。MG主要的病理改变为突触后膜破坏,突触后膜受到免疫攻击后会导致大量AChR丢失。而AChR受损严重的肌纤维所产生的EPP低于安全阈值,将导致这部分肌纤维不能产生动作电位。运动单位内去极化肌纤维数量的减少可使NEMG出现短时限、低波幅的MUP改变[11]。所以严重的NMJ传递障碍完全有可能导致NEMG出现肌源性受损的表现。因NMJ传递障碍所致的有肌源性受损表现的肌肉本身并无病变,故NEMG并不出现自发电位,仅表现为MUP短时限、低波幅改变。国内曾有文献报道过这一现象,并称之为“假性”肌源性损害[3]。近期也有研究支持将MUP短时限、低波幅改变归为非特异性改变,因为该电生理现象既可见于肌病也可出现于NMJ传递障碍疾病[12]。不过,上述解释这一电生理现象的推论,仍需通过对相关肌肉进行活检进一步证实。
MG病情严重程度与NMJ受损程度有关,如前文所述NEMG表现出肌源性受损可能提示严重的NMJ传递障碍,因此推测出现肌源性受损的表现可能与MG临床严重程度有一定相关性。在本研究中有肌源性受损表现组绝对临床评分高于无肌源性受损表现组,而且有肌源性受损表现组以肢体和球部肌肉为首发症状的患者比例远高于无肌源性受损组,这提示NEMG出现肌源性受损者症状较重。本组数据提示NEMG是否出现肌源性受损表现仅与病情严重程度及首发部位有关,而与其他临床特点无关。本文作者之前总结的一组数据中同样发现NEMG有肌源性受损表现的MG患者重症肌无力定量评分(QMG)和重症肌无力日常生活量表(MG-ADL)评分均高于无肌源性受损表现者[13]。这也支持NEMG出现肌源性受损表现可能提示MG病情较重这一推论。既往文献也曾报道电生理改变与MG临床严重程度相关这一现象[2, 14],这与本研究结果相一致。然而既往也有研究认为肌源性受损表现与性别、病程和胸腺病理类型有关[15],但在本研究中并未发现类似相关性。因此,MG患者NEMG出现肌源性受损表现的机制仍需进一步探索。
骨骼肌无力症状波动是MG主要临床特点,电生理检查和临床评分只能反应某一时间断面的情况,因此本研究结果只能从一定程度上反应电生理参数与病情严重程度的联系。本研究为回顾性分析,为保证临床数据的完整可信仅选择住院患者为对象进行研究,这可能会在一定程度上产生选择偏倚。在以后的研究中应针对性地设计相关前瞻性研究,进一步对此电生理现象的临床意义进行探索。此外,有肌源性受损表现者数量较少也可能会增加统计分析的误差。MG患者NEMG肌源性受损表现的临床意义仍需多中心、大样本的临床研究加以证实。此外,肌肉活检、抗体检测以及NEMG技术的应用也有助于从更深层次分析MG患者NEMG检查出现肌源性受损表现的原因。
综上所述,部分MG患者NEMG检查可出现肌源性受损表现。NEMG肌源性受损表现主要为MUP短时限、低波幅改变,无自发电位。严重的NMJ传递障碍可能是导致这一电生理现象出现的原因之一。MG患者NEMG肌源性受损表现的出现可能提示病情较重,而NEMG出现肌源性受损表现的机制仍需进一步探讨。
[1]Meriggioli MN, Sanders DB. Autoimmune myasthenia gravis: emerging clinical and biological heterogeneity[J]. Lancet Neurol, 2009,8(5):475-490.
[2]Odabasi Z, Kuruoglu R, Oh SJ. Turns-amplitude analysis and motor unit potential analysis in myasthenia gravis[J]. Acta Neurol Scand,2000,101(5):315-320.
[3]张兴文,崔丽英, 管宇宙, 等. 重症肌无力合并肌电图肌源性损害53例临床和电生理特点[J]. 中华神经科杂志, 2007,40(12):812-815.
[4]中华医学会神经病学分会神经免疫学组中国免疫学会神经免疫学分会. 重症肌无力诊断和治疗中国专家共识[J]. 中国神经免疫学和神经病学杂志, 2012,19(6): 401-408.
[5]王秀云,许贤豪,孙宏,等. 重症肌无力病人的临床绝对评分法和相对评分法[J]. 中华神经科杂志,1997,30(2):87-90.
[6]Martignago S, Fanin M, Albertini E, et al. Muscle histopathology in myasthenia gravis with antibodies against MuSK and AChR[J]. Neuropathol Appl Neurobiol,2009,35(1): 103-110.
[7]Barton JJ, Maguire J, Mezei M, et al. Mitochondrial pseu-domyasthenia[J]. J Neuroophthalmol, 2010,30(3): 248-251.
[8]Somnier FE, Skeie GO, Aarli JA, et al. EMG evidence of myopathy and the occurrence of titin autoantibodies in patients with myasthenia gravis[J]. Eur J Neurol, 1999,6(5): 555-563.
[9]Samuraki M, Furui E, Komai K, et al. Myasthenia gravis presenting with unusual neurogenic muscle atrophy[J]. Muscle Nerve, 2007,36(3):394-399.
[10]Plomp JJ, Morsch M, Phillips WD, et al. Electrophysiological analysis of neuromuscular synaptic function in myasthenia gravis patients and animal models[J]. Exp Neurol, 2015,270:41-54.
[11]Medicine AQACAAoE. Literature review of the usefulness of repetitive nerve stimulation and single fiber EMG in the electrodiagnostic evaluation of patients with suspected myasthenia gravis or Lambert-Eaton myasthenic syndrome[J]. Muscle Nerve, 2001,24(9): 1239-1247.
[12]Mongiovi PC, Elsheikh B, Lawson VH, et al. Neuromuscular junction disorders mimicking myopathy[J]. Muscle Nerve,2014,50(5): 854-856.
[13]Jing F, Cui F, Chen Z, et al. Clinical and electrophysiological markers in myasthenia gravis patients[J]. Eur Neurol,2015,74(1-2):22-27.
[14]Meekins GD, So Y, Quan D. American Association of Neuromuscular & Electrodiagnostic Medicine evidenced-based review: use of surface electromyography in the diagnosis and study of neuromuscular disorders[J]. Muscle Nerve, 2008,38(4): 1219-1224.
[15]Nicolle MW. Myasthenia gravis[J]. Neurologist, 2002, 8(1):2-21.
(本文编辑:邹晨双)
The clinical significance of myogenic damage in needle electrode electromyography for patients with myasthenia gravis
JINGFeng,WANGWei*,CHENYuping,LIUShuyan,WANGLin,WEIDongning.
*TheDepartmentofNeurology,the309thHospitalofChinesePLA,Beijing100091,China
WANG Wei, Email:13910581521@163.com
Objective To investigate the clinical significance of needle electrode electromyography (NEMG) test for myasthenia gravis (MG).Methods This retrospective study analyzed the results of NEMG and clinical data of 335 inpatients with definite MG who were treated at the 309th hospital of Chinese PLA between 2011 and 2013. The patients enrolled were divided into 2 groups according to whether the results of NEMG showed myopathic damage. And the clinical character of the 2 groups were compared.Results NEMG demonstrated that 29 patients (8.7%) showed myopathic changes, and none had spontaneous potentials. The myogenic damage only presented shorter durations and lower amplitude of motor unit potentials (MUP). Patients with myogenic damage had higher clinical absolute scores (20.8±7.3)than those without such changes(14.9±9.0,t=1.79,P<0.05). Patients without myogenic damage usually got initial symptoms only involving extraocular muscles(85.62%) but limbs and bulbar muscles (14.38%). While, the ratio of extraocular muscles onset was relatively low (55.17%) in patients with myogenic damage, and most patients involved limbs and bulbar muscles at the onset of the disease(44.83%). There was statistical difference between the 2 groups (χ2=9.79,P<0.01). Otherwise, there was no statistical difference in gender, ages at onset, course of disease, Osserman classification or thymus types. Conclusions Some patients with MG may show myogenic damage in NEMG test. Patients with myogenic damage showed more sever clinical symptoms. Electrophysiological tests can indicate MG severity to some extent.
myasthenia gravis; electromyography; needle electrode electromyography
10.3969/j.issn.1006-2963.2016.04.004
100091 解放军309医院神经内科
王卫,Email:13910581521@163.com
R746.1
A
106-2963(2016)04-244-04
2015-06-19)

