视神经脊髓炎谱系疾病单克隆抗体治疗新进展
李静 邱伟
视神经脊髓炎谱系疾病单克隆抗体治疗新进展
李静 邱伟
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)具有临床反复发作及发作后残疾叠加的特点,减少复发是NMOSD治疗的重点。在NMOSD免疫治疗策略选择中,与常规免疫抑制剂相比,生物制剂具有治疗高度选择性、起效快、长期副作用少等优点,目前单克隆抗体是治疗NMOSD最常用的生物制剂。不同单克隆抗体治疗NMOSD的靶点不同,疗效也有差异。探讨单克隆抗体在NMOSD治疗中的进展,有助于指导其在临床中的应用。基于此,本文对单克隆抗体在NMOSD治疗中的最新进展进行综述。
视神经脊髓炎谱系疾病;单克隆抗体;治疗
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)是一类累及视神经、脊髓和大脑,以体液免疫介导为主的中枢神经系统炎症性脱髓鞘病,包括视神经脊髓炎(neuromyelitis optica,NMO)、长节段横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM)、复发性或双侧同时发生的视神经炎(optic neuritis,ON),以及伴发系统免疫性疾病的ON/LETM、ON/LETM伴有其他NMO脑内典型病变(下丘脑、胼胝体、脑室旁、脑干)等。NMOSD具有临床反复发作及发作后残疾叠加的特点,因此减少复发是其治疗的重点。NMO与NMOSD在生物学特性上无明显差异,目前的免疫治疗策略也是完全相同的。既往有研究表明小剂量糖皮质激素联合硫唑嘌呤维持治疗NMO可减少复发[1]。然而部分NMOSD患者尽管使用了常规免疫抑制剂治疗,病情仍不能控制。生物制剂是指相对于化学制剂而言的一类生物制品,单克隆抗体是目前治疗NMOSD最常用的生物制剂之一。与常规免疫抑制剂相比,单克隆抗体具有治疗高度选择性、起效快、长期副作用少等优点。不同单克隆抗体治疗NMOSD的靶点不同,疗效也存在差异。本文就单克隆抗体治疗NMOSD的最新进展进行综述,希望有助于指导其在临床中的应用。
1 B细胞消耗治疗
利妥昔单抗(rituximab,RTX)是第一代通过基因重组技术生产的针对B细胞表面CD20抗原分子的人-鼠嵌合型单克隆抗体,可有效清除人体内的记忆性B细胞,最早被批准用于治疗非霍奇金淋巴瘤。近年来RTX在一些自身免疫性疾病,如类风湿性关节炎、系统性红斑狼疮、重症肌无力、多发性硬化的治疗中取得满意效果。2005年,Cree等[2]首次进行了RTX治疗NMO的开放性研究,该研究纳入了8例难治性NMO患者,平均随访1年,其中6例无复发,年复发率(annualized relapse rate,ARR)由2.6降为0(P<0.01),平均扩展致残状况评分(expanded disability status scale score,EDSS)由治疗前7.5降至5.5。随后,Jacob等[3]对25例接受RTX治疗的NMO患者进行回顾性分析,平均随访19个月,ARR由治疗前的1.7降为0(P<0.001),其中20例患者神经功能改善或稳定。此外,Bedi等[4]回顾性分析了23例接受RTX治疗的NMO患者,其中8例之前未接受过其他免疫抑制剂治疗,经RTX治疗后ARR由1.87降为0,而且所有患者的EDSS评分稳定或有改善。RTX已逐渐成为NMO/NMOSD的一线治疗药物,尤其是对传统免疫抑制剂反应不佳的患者[5]。
目前,RTX治疗NMOSD的用药方案有多种,通常有两种选择:按患者体表面积375 mg/m2静脉滴注,每周1次,持续4周;或1000 mg静脉滴注,共用2次(间隔2周)。上述方案治疗后,B细胞清除后续治疗存在争议。有研究认为在RTX
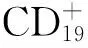
同时,目前也有关于RTX治疗失败的病例研究。Kim等[10]的研究发现FCGR3A基因多态性与NMOSD患者体内记忆B细胞清除不足及对RTX治疗反应差显著相关,该作者因此提出NMOSD患者RTX治疗个体化的重要性。另外,有的NMOSD患者复发出现在RTX治疗开始后1周内,这可能与促炎反应因子,如肿瘤坏死因子、白细胞介素6(IL-6)和B细胞激活因子等暂时升高有关,该研究同时发现RTX给药后水通道蛋白4(aquaporin-4,AQP4)-IgG会出现短暂升高[11]。
更多的作用于CD19或CD20的B细胞清除治疗药物正被研究用于治疗多发性硬化或其他自身免疫性疾病,如奥法木单抗(ofatumumab)及奥瑞珠单抗(ocrelizumab),二者均为完全人源化抗CD20单克隆抗体,与RTX相比,有更高的抗体依赖细胞的细胞毒性,可能在将来被应用到NMOSD的治疗中。新型抗CD20单克隆抗体ublituximab用于治疗NMOSD急性发作期的Ⅰ期试验也正在准备中。
2 IL-6受体阻滞剂
IL-6是一种促炎细胞因子,由多种淋巴细胞(包括B和T细胞)产生。近期研究表明NMOSD患者血清和脑脊液IL-6水平升高,并与病情的活动性和AQP4-IgG滴度相关[12],因此IL-6可以作为NMOSD治疗的靶点。
托珠单抗(tocilizumab,TCZ)为重组人源化抗人IL-6受体单克隆抗体,它可以特异性地与可溶性及膜性IL-6受体结合阻断信号传导,从而抑制IL-6活性,目前在类风湿关节炎的治疗中广泛应用。2013年,Kiesier等[13]首次报道1例经大剂量激素、血浆交换、米托蒽醌、RTX以及阿仑单抗治疗均无效的NMO患者,在使用TCZ治疗后病情改善。Araki等[14]治疗了7例NMO/NMOSD患者(男1例、女6例),经TCZ按体重8 mg/kg每月1次治疗、维持12个月后,他们的ARR由2.9±1.1降为0.4±0.8(P<0.005),EDSS评分由5.1±1.7降为4.1±1.6(P<0.005),并且NMO患者神经性疼痛以及疲劳症状明显改善。神经性疼痛是NMO最常见的并发症之一,目前使用抗癫痫药物治疗后仍有部分患者无改善,TCZ可能是通过与缓解类风湿关节炎关节痛的相同机制减轻患者的神经性疼痛。
3 补体阻滞剂
NMO的发病机制中,自身抗体与星形胶质细胞上的AQP4特异性结合,在补体辅助下,激活补体依赖和抗体依赖的细胞毒途径,导致星形胶质细胞坏死,引起NMOSD的各种病理改变,因此抑制补体的活性可能会降低AQP4-IgG阳性NMOSD患者的中枢神经系统损伤。
依库珠单抗(eculizumab)是一种人源化单克隆抗体,可抑制C5补体裂解为活性形式,防止多种下游促炎性补体成分的产生,临床上用于治疗阵发性睡眠性血红蛋白尿及非典型溶血尿毒综合征两种罕见的血液疾病。2013年,Pittock等[15]进行了一项开放性试验,该研究纳入14例AQP4-IgG血清阳性NMOSD患者,年龄≥18岁,既往6个月内至少2次发作或既往12个月内至少3次发作,在接受流脑疫苗注射2周后开始给予依库珠单抗治疗,前4周剂量为600 mg/周,第5周调整为900 mg/周,之后900 mg/2周,持续48周。结果显示在依库珠单抗治疗期间,14例患者中12例无复发,2例可能复发,平均ARR由3.0降至0(P<0.001),平均EDSS评分由4.3降至3.5(P<0.01)。该研究中,依库珠单抗停药后12个月内有5例患者被报道有8次发作。
4 其他单抗药物
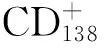
阿仑单抗(alemtuzumab)是抗CD52人源化单克隆抗体,可消耗淋巴细胞和单核细胞,已被用于治疗多发性硬化,可减少患者复发。Gelfand等[17]报道了1例61岁女性NMO患者,在使用阿仑单抗最初的19个月内,没有出现临床复发,也没有在影像学检查上出现强化的病灶,但是患者却出现了越来越严重的顽固性恶心、呕吐以及双侧视力下降,最终于使用阿仑单抗20个月后死亡。尸检中发现视神经和脊髓有急性、亚急性及慢性的脱髓鞘病灶,病灶中有显著的巨噬细胞浸润,但缺少淋巴细胞。作者分析认为随着阿仑单抗的治疗,患者体内适应性免疫反应受到了抑制,因此患者临床复发中止、影像学上病灶不强化,尸检时也发现淋巴细胞缺乏;然而,病理检查发现了大量巨噬细胞浸润,阻滞受到破坏,提示出现了更大的、影像学上不增强的新病灶。
2012年有一些新药临床实验的初步数据被公布,其中包括非致病性单克隆抗体aquaporumab,此药可与致病性AQP4-IgG抗体竞争性结合AQP4,从而达到疾病缓解的目的[18]。
综上可见,单克隆抗体在风湿性疾病、血液疾病等疾病中的应用已经较为广泛,而在神经免疫系统疾病的应用不多,目前已有的临床研究提示NMOSD患者,尤其是那些对常规免疫抑制疗效不好的患者,使用利妥昔单抗、托珠单抗、依库珠单抗等治疗都均显著疗效。但是现有研究多为回顾性分析,且研究病例数并不多,因此仍有必要进行前瞻性、随机对照研究。
[1]Qiu W, Kermode AG, Li R, et al. Azathioprine plus corticosteroid treatment in Chinese patients with neuromyelitis optica[J]. J Clin Neurosci, 2015, 22(7): 1178-1182.
[2]Cree BA, Lamb S, Morgan K, et al. An open label study of the effects of rituximab in neuromyelitis optica[J]. Neurology, 2005, 64(7): 1270-1272.
[3]Jacob A, Weinshenker BG, Violich I, et al. Treatment of neuromyelitis optica with rituximab: retrospective analysis of 25 patients[J]. Arch Neurol, 2008, 65(11): 1443-1448.
[4]Bedi GS, Brown AD, Delgado SR. Impact of rituximab on relapse rate and disability in neuromyelitis optica[J]. Mult Scler,2011,17(10):1225-1230.
[5]Trebst C, Jarius S, Berthele A, et al. Update on the diagnosis and treatment of neuromyelitis optica: recommendations of the Neuromyelitis Optica Study Group (NEMOS)[J]. J Neurol,2014, 261(1): 1-16.
[6]Greenberg BM, Graves D, Remington G, et al. Rituximab dosing and monitoring strategies in neuromyelitis optica patients: creating strategies for therapeutic success[J].Mult Scler, 2012, 18(7): 1022-1026.
[7]Mealy MA, Wingerchuk DM, Palace J, et al. Comparison of relapse and treatment failure rates among patients with neuromyelitis optica: multicenter study of treatment efficacy[J]. JAMA Neurology,2014,71(3):324-330.
[8]Kim SH, Kim W, Li XF, et al. Repeated treatment with rituximab based on the assessment of peripheral circulating memory B cells in patients with relapsing neuromyelitis optica over 2 years[J]. Arch Neurol, 2011, 68(11): 1412-1420.
[9]Yang CS, Yang L, Li T, et al. Responsiveness to reduced dosage of rituximab in Chinese patients with neuromyelitis optica[J]. Neurology, 2013,81(8):710-713.
[10]Kim SH, Jeong IH, Hyun JW, et al. Treatment outcomes with rituximab in 100 patients with neuromyelitis optica: influence of FCGR3A polymorphisms on the therapeutic response to Rituximab[J]. JAMA neurol, 2015, 72(9): 989-995.
[11]Chihara N, Aranami T, Sato W, et al. Interleukin 6 signaling promotes anti-aquaporin 4 autoantibody production from plasmablasts in neuromyelitis optica[J]. Proc Natl Acad Sci U S A, 2011, 108(9):3701-3706.
[12]Icoz S, Tuzun E, Kurtuncu M, et al. Enhanced IL-6 production in aquaporin-4 antibody positive neuromyelitis optica patients[J]. Int J Neurosci, 2010, 120(1): 71-75.
[13]Kieseier BC, Stuve O, Dehmel T, et al. Disease amelioration with tocilizumab in a treatment-resistant patient with neuromyelitis optica: implication for cellular immune responses[J]. JAMA neurol, 2013, 70(3): 390-393.
[14]Araki M, Matsuoka T, Miyamoto K, et al. Efficacy of the anti-IL-6 receptor antibody tocilizumab in neuromyelitis optica: a pilot study[J]. Neurology, 2014,82(15):1302-1306.
[15]Pittock SJ, Lennon VA, McKeon A, et al. Eculizumab in AQP4-IgG-positive relapsing neuromyelitis optica spectrum disorders: an open-label pilot study[J]. Lancet Neurol,2013, 12(6): 554-562.
[16]Kleiter I, Hellwig K, Berthele A, et al. Failure of natalizumab to prevent relapses in neuromyelitis optica[J]. Arch Neurol, 2012, 69(2): 239-245.
[17]Gelfand JM, Cotter J, Klingman J, et al. Massive CNS monocytic infiltration at autopsy in an alemtuzumab-treated patient with NMO[J]. Neurol Neuroimmunol Neuroinflamm, 2014, 1(3): e34.
[18]Tradtrantip L, Zhang H, Saadoun S, et al. Anti-aquaporin-4 monoclonal antibody blocker therapy for neuromyelitis optica[J]. Ann Neurol,2012, 71(3): 314-322.
(本文编辑:邹晨双)
10.3969/j.issn.1006-2963.2016.04.011
国家自然科学基金资助项目(81471218)
510630 广州中山大学附属第三医院神经病学科
邱伟,Email:qw9406@gmail.com
R744.5+2
A
1006-2963(2016)04-0277-04
2015-07-23)

