视神经脊髓炎患者血清神经丝重链SMI-35临床意义初探
张祥 陈向军 李翔 乔健 顾悦华
视神经脊髓炎患者血清神经丝重链SMI-35临床意义初探
张祥 陈向军 李翔 乔健 顾悦华
目的 探讨视神经脊髓炎(NMO)患者血液神经丝重链(NfH)的水平及其临床意义。方法 选取27例NMO患者、20例多发性硬化(MS)患者以及健康志愿者26名,采用ELISA法检测各组血清NfHSMI-35水平及NMO患者血清水通道蛋白抗体(AQP4-IgG)水平,观察NfH在NMO、MS和健康人群间以及在NMO患者AQP4-IgG阳性和阴性组间的差异,同时分析NMO患者NfH水平同NMO受累脊髓节段和临床神经功能缺损程度的相关性。结果 NMO组、MS组和健康对照组血清NfHSMI-35水平分别为(0.100±0.024)、(0.082±0.012)和(0.064±0.021)ng/mL,NMO组和MS组血清NfHSMI-35水平均高于健康对照组(P<0.05),且NMO组NfHSMI-35水平高于MS组(P<0.05);NMO患者AQP4-IgG阳性和阴性者间NfHSMI-35水平比较无统计学差异〔(0.106±0.029)ng/mνs.(0.091±0.013)ng/mL,P>0.05〕;NMO组NfHSMI-35水平与脊髓受累节段长度呈正相关(r=0.556,P<0.01),与临床扩展致残量表评分(EDSS)无相关性(r=0.214,P>0.05)。结论 NMO患者外周血NfHSMI-35明显升高,有可能成为NMO的生物标志物,并有可能成为与MS相鉴别的临床监测指标,但仍需要进一步观察和研究。
视神经脊髓炎;神经丝重链;生物标志物
视神经脊髓炎(neuromyelitis optica,NMO)是主要累及视神经和脊髓的中枢神经系统自身免疫性疾病,临床表现同多发性硬化(multiple sclerosis,MS)较为相似,曾被认为是后者的一种亚型,但目前认为两者病理机制、临床表现及治疗方案有别[1-3],故在临床诊疗中需谨慎甄别。
NMO和MS病灶均有脱髓鞘和轴索损害表现,但前者的轴索损害要重于后者[1]。轴索含有微管、神经丝(neurofilament)等结构,哺乳类的神经丝主要由3种蛋白组成:低分子量神经丝蛋白(NFL,相对分子质量68 000)、中等分子量神经丝蛋白(NFM,相对分子质量160 000)和高分子量神经丝蛋白(NfH,或简称“神经丝重链”,相对分子质量200 000)[4]。神经丝在体液中的水平可间接反映轴索损伤,有文献报道体液中神经丝水平在帕金森病、阿尔茨海默病、MS等多种神经变性疾病中有所升高[5-7]。本研究旨在探讨NMO患者血液中NfH的水平及其临床意义。
1 对象和方法
1.1 对象 (1)NMO组:选取2011—2013年复旦大学附属华山医院神经内科收治的NMO患者27例,其中男2例、女25例;年龄17~63岁,平均(38.5±14.1)岁。符合2015版Wingerchuk DM诊断标准[8],均行头颅及脊髓MRI检查和水通道蛋白4抗体(AQP4-IgG)检测,所有NMO患者均有脊髓病变,脊髓累及节段最少为3个节段,最多为13个节段;均行血清AQP4-IgG检测;采用扩展致残量表评分(EDSS)对NMO患者临床神经功能缺损程度进行评估。(2)MS组:选取同时期收治的MS患者20例,其中男2例、女18例;年龄18~69岁,平均(38.6±12.4)岁,符合2010版McDonald诊断标准[9]。(3)健康对照组:选取作者医院同期健康体检的健康志愿者26名、其中男6名、女20名;年龄18~69岁,平均(40.7±12.2)岁,无吸烟、酗酒等不良嗜好。NMO及MS患者在入组时均处于急性发病期。所有研究对象均空腹采静脉血2 mL,分离血清并置-20℃保存。3组间性别构成和年龄比较差异无统计学意义(均P>0.05)。
1.2 主要仪器和试剂 包括标准品牛脊髓NfH(N-2165-15B,US Biological)、鼠抗人NfHSMI-35单克隆抗体(SMI-35R-100,Convance)、AQP4-IgG ELISA检测试剂盒(英国RSR公司)、酶标仪(Multiskan Mk3,Thermo Electron Corporation公司)。
1.3 方法
1.3.1 血清NfH检测:采用ELISA方法进行检测。选用鼠抗人NfHSMI-35单克隆抗体作为包被蛋白,用包被缓冲液将鼠抗人NfHSMI-35单克隆抗体按1∶5000稀释后加入96孔酶标板,每孔100 μL,4℃过夜。第2天甩掉余液,洗板2次(以下每步骤孵育甩掉余液后均重复上述洗涤过程洗涤5次)。96孔酶标板每孔加入含3%(质量浓度)BSA的PBS 200 μL,4℃冰箱过夜;甩掉余液;将待检血清标本每孔加入50 μL,37℃孵育2 h;洗板后,将兔抗人NfH抗体1∶1000稀释后,每孔加入100 μL,37℃孵育1 h;洗板后,将生物素化山羊抗兔IgG 1∶2000稀释后,每孔加入100 μL,37℃孵育1 h,洗板后,加入1∶400稀释的ABC 100 μL,37℃孵育30 min;洗板后,加50 μL A液〔3,3′,5,5′-四甲基联苯胺(TMB)20 mg,无水酒精10 mL,加ddH2O至100 mL〕和50 μL B液(0.1 mol/L柠檬酸,0.2 mol/L Na2HPO4,pH 5.0),振荡混匀,37℃显色20 min,加入50 μL 2 mol/L H2SO4终止显色反应。采用酶标仪于450 nm处检测其吸光度值。同时采用上述方法制作标准曲线,利用标准曲线计算样品中NfHSMI-35蛋白浓度。
1.3.2 AQP4-IgG检测:采用AQP4-IgG ELISA检测试剂盒对NMO患者进行血清AQP4-IgG检测,具体流程如下:96孔酶标板每孔加入待检血清标本50 μL 及生物素标记AQP4,室温下孵育2 h,洗板后,每孔加入100 μL 链霉亲和素-过氧化物酶,室温下孵育20 min,洗板后,每孔加入100 μL TMB,室温下孵育20 min,加入100 μL 2 mol/L H2SO4终止显色反应。采用酶标仪于450 nm处检测其吸光度值。同时,利用标准样品制作标准曲线,根据标准曲线计算样品中AQP4-IgG蛋白浓度。
1.4 统计学处理 采用SPSS 17.0软件进行统计分析,符合正态分布的计量资料采用均数±标准差表示,多组均数间比较采用方差分析,两均数间比较采用t检验;计数资料采用率表示,采用Pearson Chi-square检验;NfHSMI-35水平同受累脊髓节段和EDSS评分的相关性分析采用Spearman相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组NfHSMI-35水平比较 NMO组、MS组和健康对照组血清NfHSMI-35水平分别为(0.100±0.024)、(0.082±0.012)和(0.064±0.021)ng/mL,3组间血清NfHSMI-35水平比较差异有统计学意义(F=19.381,P<0.01)。两两比较结果显示,NMO组和MS组血清NfHSMI-35水平均明显高于健康对照组(P<0.05),NMO组其水平高于MS组(P<0.05)。
2.2 NMO患者AQP4-IgG与NfHSMI-35的关系 AQP4-IgG阳性16例,阴性11例,AQP4-IgG阳性组和阴性组患者NfHSMI-35水平比较无统计学差异〔(0.106±0.029)ng/mLνs.(0.091±0.013) ng/mL;t=1.549,P=0.134〕。
2.3 相关性分析 NMO患者NfHSMI-35水平同EDSS评分无显著相关性(r=0.214,P=0.284)(图1),但同脊髓受累节段长度呈正相关(r=0.556,P=0.003)(图2)。
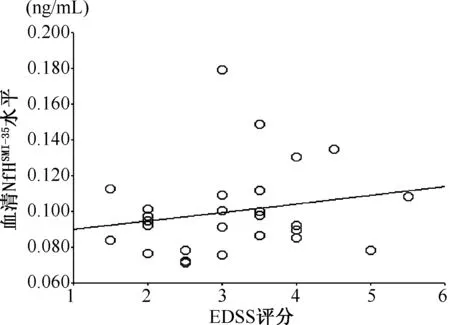
图1 NMO患者血清NfHSMI-35水平同EDSS评分的相关性分析
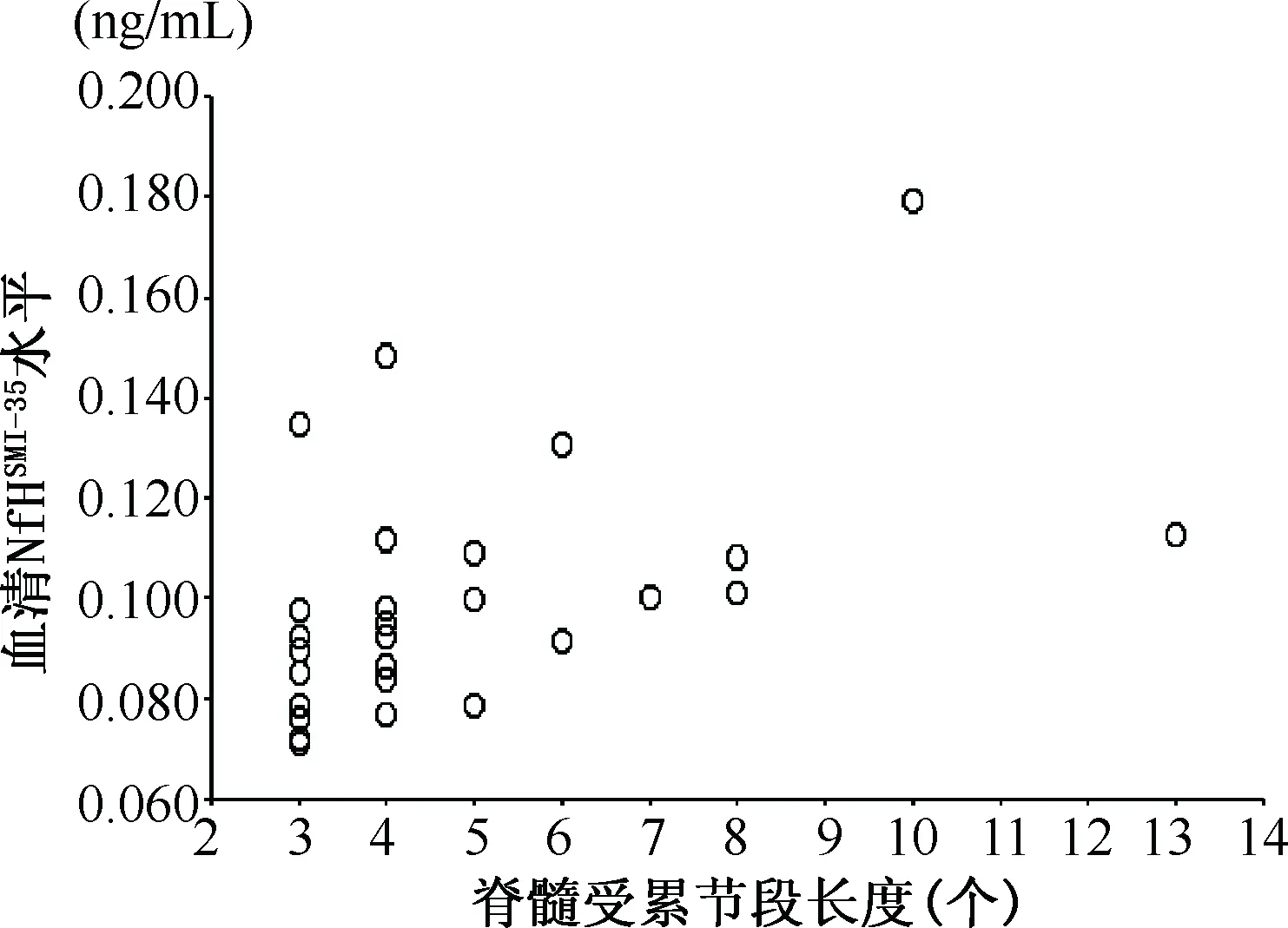
图2 NMO患者血清NfHSMI-35水平同脊髓受累节段长度的相关性分析
3 讨论
NMO以视神经炎和长节段脊髓炎为主要临床表现,常出现视力下降、肢体运动障碍等严重的神经功能障碍,同另外一种经典的神经免疫相关疾病MS临床和影像学表现有时较为相似,但两者病理机制及治疗方案存在差异[1,3],在临床诊疗中常常需要进行鉴别诊断。MS病理表现为静脉周围炎,伴淋巴细胞和单核细胞浸润,多发的髓鞘破坏以及胶质细胞及星形细胞增生;NMO主要病理则表现为炎性细胞浸润、白质脱髓鞘、补体沉积、星形胶质细胞AQP-4表达减少以及轴索损害等。NMO的轴索损害要重于MS[1]。
在组成轴索的多种结构中,神经丝是重要的组成部分,是有髓鞘轴突中最为丰富的骨架成分,与轴突形态的维持和轴浆运输有密切关系。神经丝在体内合成后,会立即被磷酸化,其结构、理化特性和抗原性则会发生很大变化,如磷酸化的NfH能促进微管蛋白组装成微管,但不与微管结合;去磷酸化的NfH失去对微管的聚合作用。另外,不同磷酸化状态还可影响轴突中神经丝的存在时间、轴浆转运速度以及轴突直径[10]。
神经丝异常表达与异常修饰导致某些神经系统疾病。神经丝在运动神经元胞体和轴突近端堆积,是肌萎缩性侧索硬化、脊肌萎缩症等神经变性疾病的早期病理表现[11]。衰老时神经丝的典型变化是出现神经纤维缠结,其主要成分是高度磷酸化的NfH和高度磷酸化的tau蛋白,缠结的数量可能与痴呆的程度呈正比。在阿尔茨海默病的神经丝缠结和帕金森综合征的路易小体中都发现有高度磷酸化的NfH存在[12]。另外,有报道MS患者血液或脑脊液中神经丝蛋白水平会有不同程度升高,可作为观察MS病理改变的生物标记物[7]。
羧基端磷酸化的NfH对轴索的直径、神经丝间距及轴浆运输具有重要意义,也就意味着其结构或功能的变化可能影响轴索的完整性和神经细胞胞体功能的维护[10]。另外,NfH在不同神经细胞和组织中的分布有所不同,如磷酸化的神经丝重链NfHSMI-35在神经元的含量远高于星形胶质细胞和小胶质细胞,在脊髓白质中的组成水平则远超过大脑白质和灰质[4]。因此,理论上体液中NfHSMI-35水平能够在一定程度上比较好地反映脊髓损害的程度,对具有脊髓炎表现的疾病(如MS、NMO等)的病情发展有一定的提示意义。虽然近年来已有对MS和NMO患者脑脊液中NfH含量的检测研究,但脑脊液标本的获取相对困难和繁琐,不利于临床随访和观察,而有关NfH外周血水平检测的研究报道尚少[13]。本研究选用鼠抗人NfHSMI-35单克隆抗体作为包被蛋白对NMO患者血液中的NfH水平进行观察,结果显示,NMO组和MS组患者血清NfHSMI-35水平均高于健康对照组,NMO组其水平高于MS组,提示NMO和MS均有轴索损伤,且前者轴索损害重于后者。这与NMO和MS病理学结果相一致。
AQP4-IgG是诊断NMO较为特异性的生物标记物,在NMO的病理机制中具有重要的作用[14]。AQP4-IgG可通过活化补体介导星形胶质细胞损伤,降低AQP4和兴奋性氨基酸转运体(EAAT)的表达,使中枢细胞间隙中谷氨酸蓄积,从而对少突胶质细胞及神经元等造成损害[15]。尽管AQP4-IgG在NMO患者血液中的检出率可达到90%,但仍有部分患者未能检测到该抗体,NMO可能存在异质性,AQP4-IgG阳性和阴性患者的病理机制可能有所不同[16-17]。本研究结果提示AQP4-IgG与轴索损伤标志物NfHSMI-35水平可能无相关性,其原因可能如有关研究所提示的AQP4-IgG可能主要影响少突胶质细胞的结构和功能,而非对神经元等细胞造成直接的损害。由于本研究样本量较小,且目前AQP4-IgG的检测方法仍可能出现假阴性结果,故AQP4-IgG与轴索损伤标志物的关系需要进一步研究。
NfH是有髓鞘轴突中重要的骨架成分,在神经元中含量最为丰富[4],NMO患者体液NfHSMI-35水平的升高反映了中枢轴索的损伤,同时也可能提示神经元结构和功能的破坏,而后者的严重程度会影响到患者的残障程度。本研究结果显示NMO患者血清NfHSMI-35水平同脊髓受累节段长度呈正相关,而与患者残障程度EDSS评分无统计学相关性。由于本研究尚未对患者在病程不同时间点NfH水平动态观察,有关NfH与EDSS评分以及脊髓受累节段长度的确切关系,以及其是否可作为疾病严重程度或进展的预测指标,仍需进一步研究。
综上所述,本文研究结果显示,NMO组和MS组患者血清NfHSMI-35水平均高于健康对照组,且NMO组其水平高于MS组,血清NfHSMI-35有可能成为诊断NMO的生物标志物。由于本研究样本量较少,且尚未对NMO患者进行动态观察,有关NfHSMI-35水平与NMO疾病严重程度的确切关系尚需进一步研究。。
[1]Kira J. Neuromyelitis optica and opticospinal multiple sclerosis: Mechanisms and pathogenesis[J]. Pathophysiology, 2011, 18(1): 69-79.
[2]Mata S, Lolli F. Neuromyelitis optica: an update[J]. J Neurol Sci,2011,303(1-2):13-21.
[3]牛会丛,张星虎. 视神经脊髓炎发病机制及治疗策略研究进展[J]. 中国神经免疫学和神经病学杂志,2013(03):208-211.
[4]Petzold A, Keir G, Green A J, et al. A specific ELISA for measuring neurofilament heavy chain phosphoforms[J]. J Immunol Methods,2003,278(1-2):179-190.
[5]Andersen AD, Binzer M, Stenager E, et al. Cerebrospinal fluid biomarkers for Parkinson’s disease—a systematic review[J]. Acta Neurol Scand,2016 [Epub ahead of print].
[6]Zetterberg H, Skillback T, Mattsson N, et al. Association of cerebrospinal fluid neurofilament light concentration with alzheimer disease progression[J]. JAMA Neurol,2016,73(1):60-67.
[7]Teunissen CE, Khalil M. Neurofilaments as biomarkers in multiple sclerosis[J]. Mult Scler,2012,18(5):552-556.
[8]Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology,2015,85(2):177-189.
[9]Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria[J]. Ann Neurol,2011,69(2):292-302.
[10]de Waegh SM, Lee VM, Brady ST. Local modulation of neurofilament phosphorylation, axonal caliber, and slow axonal transport by myelinating Schwann cells[J]. Cell,1992,68(3):451-463.
[11]Rouleau GA, Clark AW, Rooke K, et al. SOD1 mutation is associated with accumulation of neurofilaments in amyotrophic lateral sclerosis[J]. Ann Neurol,1996,39(1):128-131.
[12]Su JH, Cummings BJ, Cotman CW. Plaque biogenesis in brain aging and Alzheimer’s disease. II. Progressive transformation and developmental sequence of dystrophic neurites[J]. Acta Neuropathol,1998,96(5):463-471.
[13]Petzold A, Eikelenboom MJ, Keir G, et al. Axonal damage accumulates in the progressive phase of multiple sclerosis: three year follow up study[J]. J Neurol Neurosurg Psychiatry,2005,76(2):206-211.
[14]陈淑媛,吴哲,付贺飞,等. 水通道蛋白4抗体对视神经脊髓炎的诊断价值[J]. 中国神经免疫学和神经病学杂志,2014(05):332-334.
[15]Saikali P, Cayrol R, Vincent T. Anti-aquaporin-4 auto-antibodies orchestrate the pathogenesis in neuromyelitis optica[J]. Autoimmun Rev,2009,9(2):132-135.
[16]Jarius S, Ruprecht K, Wildemann B, et al. Contrasting disease patterns in seropositive and seronegative neuromyelitis optica: A multicentre study of 175 patients[J]. J Neuroinflammation,2012,9:14.
[17]中国视神经脊髓炎谱系疾病诊断与治疗指南[J]. 中国神经免疫学和神经病学杂志,2016,23(3):155-166.
(本文编辑:时秋宽)
The clinical significance of neurofilament heavy chain SMI-35 examination in patients with neuromyelitis optica
ZHANGXiang,CHENXiangjun*,LIXiang,QIAOJian,GUYuehua.
*DepartmentofNeurology,HuashanHospital,FudanUniversity;InstituteofNeurology,HuashanHospital,FudanUniversity,Shanghai200040,China
CHEN Xiangjun, Email: xiangjunchen@hotmail.com
Objective To investigate the level and clinical significance of neurofilament heavy chain SMI-35 (NfHSMI-35)in patients with neuromyelitis optica(NMO). Methods NfHSMI-35levels were tested in sera of 27 NMO patients, 20 multiple sclerosis(MS) patients and 26 healthy controls(HC) by ELISA method,AQP4-IgG levels were tested in all NMO patients. The NfHSMI-35levels were compared among NMO,MS and HC groups and between AQP4-IgG-positive and AQP4-IgG-negative patients with NMO. The correlation among NfHSMI-35levels and the involved spinal cord segments and Expanded Disability Status Scale(EDSS) were analyzed. Results The average NfHSMI-35levels in sera of the NMO,MS and HC groups were (0.100±0.024),(0.082±0.012) and (0.064±0.021)ng/mL respectively. The average NfHSMI-35levels in sera of the NMO and MS groups were higher than those of the HC group(P<0.05), while compared with the MS group, the level of NfHSMI-35was higher in the NMO group(P<0.05). For NMO patients, there were no statistical significances of NfHSMI-35levels in sera between AQP4-IgG-positive and AQP4-IgG-negative patients[(0.106±0.029)ng/mL vs. (0.091±0.013)ng/mL,P>0.05]. NfHSMI-35levels had significant correlation with the involved spinal cord segments (r=0.556,P<0.01) but not EDSS score(r=0.214,P>0.05). Conclusions NfHSMI-35in sera may be considered as one biomarker of NMO and clinical monitoring index to differentiate NMO from MS, but further observation and research are still needed.
neuromyelitis optica;neurofilament heavy chain; biomarker
10.3969/j.issn.1006-2963.2016.04.001
200040 复旦大学附属华山医院神经内科(张祥、陈向军、李翔);200040 复旦大学神经病学研究所(张祥、陈向军、李翔、乔健、顾悦华)
陈向军,Email: xiangjunchen@hotmail.com
R744.5+2
A
1006-2963(2016)04-0231-04
2016-04-19)

