利妥昔单抗治疗5例难治性视神经脊髓炎谱系疾病长期疗效观察
张隽 陈海 康海娟 刘诗蒙 刘峥 董会卿
利妥昔单抗治疗5例难治性视神经脊髓炎谱系疾病长期疗效观察
张隽 陈海 康海娟 刘诗蒙 刘峥 董会卿
目的 观察利妥昔单抗治疗难治性视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)的长期临床疗效及安全性。方法 回顾性分析作者医院神经内科应用利妥昔单抗治疗的5例难治性NMOSD患者(经糖皮质激素或丙种球蛋白治疗无效)的用药经过和临床情况,比较治疗前后年复发率(ARR)和扩展残疾状态量表评分(EDSS)的差异,评价利妥昔单抗的疗效和副作用。结果 应用利妥昔单抗治疗前,5例患者的EDSS和ARR中位数(四分位数)分别为8.5(1.25)分和1(2.12)次;经利妥昔单抗治疗后,随访期间(随访时间中位数为52个月)5例患者的EDSS和ARR中位数(四分位间距)分别为2.5(5.75)分和0(0.35)次,治疗前后患者的EDSS和ARR差异有统计学意义。治疗期间仅1例患者出现轻微不良反应,无严重不良反应发生。结论 利妥昔单抗可改善难治性NMOSD患者的长期临床症状,可能是一种治疗难治性NMOSD的有效药物。
利妥昔单抗;难治性视神经脊髓炎谱系疾病;脱髓鞘疾病;治疗
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSDs)特指一组潜在发病机制与视神经脊髓炎(neuromyelitis optica,NMO)相近,但临床症状局限,不完全符合NMO诊断的相关疾病[1]。自Wingerchuk等初次提出视神经脊髓炎谱系(neuromyelitis optica spectrum)的概念后,目前很多研究表明自身免疫B细胞和体液免疫机制影响NMOSD的发生发展[2-3],尤其CD20+细胞与NMOSD的复发有密切关联。CD20+是一种仅表达于B淋巴细胞,而在淋巴干细胞和浆细胞中不表达的抗原标记物,选择性清除CD20+B淋巴细胞可以改善NMOSD患者的预后,降低复发率[4-5]。利妥昔单抗(rituximab,RTX)是一种抗CD20+的单克隆嵌合抗体,可选择性地清除CD20+B淋巴细胞而不影响其再生和抗体生成。目前国外已有研究报道应用RTX治疗NMO及NMOSD,长期随访结果提示使用RTX治疗可显著改善预后并降低年复发率(ARR)[6-7]。而对于反复复发,经糖皮质激素(以下简称“激素”)或丙种球蛋白治疗无效的难治性NMOSD患者的长期疗效尚无明确报道。本研究对5例难治性NMOSD患者使用RTX后的长期疗效进行报道,以期为临床难治性NMOSD患者的治疗提供参考。
1 对象和方法
1.1 病例资料 收集2010—2014年作者医院神经内科经糖皮质激素或丙种球蛋白治疗无效的难治性NMOSD住院患者5例。入组标准:(1)患者诊断符合2006及2015年Wingerchuk等[1,8]诊断标准:必要条件:①视神经炎;②脊髓炎;支持条件:① 脊髓MRI异常延伸3个椎体节段以上;②头颅MRI不符合多发性硬化(MS)诊断标准;③血清水通道蛋白4抗体(AQP4-IgG)检测阳性。确诊NMO需要满足必要条件两项,支持条件中任意两项。(2)本次发作经激素或丙种球蛋白治疗大于1个月,症状无改善〔扩展残疾量表评分(EDSS)无变化〕。(3)使用RTX治疗时,患者或家属需签署知情同意书。排除标准:排除MS、血管炎、血管畸形、肿瘤等疾病。
1.2 方法
1.2.1 一般临床资料收集:收集患者性别、年龄、病程、EDSS评分、实验检查以及影像学检查结果等资料。
1.2.2 脑脊液及血清抗体检查:应用细胞间接免疫荧光转染法检测患者入院时血清及脑脊液AQP-4、寡克隆区带(OB)等抗体。抗体的检测由中国医学科学院北京协和医院检测。
1.2.3 影像学检查:应用德国Siemens 3.0T MRI扫描仪对所有入组患者行MRI常规序列T1WI、T2WI、液体衰减反转恢复序列(FLAIR)检查,部分患者行弥散加权成像(DWI)序列、钆喷酸葡胺强化检查。
1.2.4 给药方法:急性期静脉点滴RTX(豪夫迈-罗氏公司,瑞士)500 mg,1次/d,50 mg/h持续泵入,连续给药4次[9]。RTX给药前30 min予苯海拉明20 mg肌肉注射、地塞米松5 mg入小壶、对乙酰氨基酚650 mg口服,同时给予心电监护测量心率、呼吸、血压等生命体征变化。于RTX治疗前及治疗1周后检测外周循环淋巴细胞CD20+B细胞计数,如治疗1周其计数为零则停止RTX重复给药,经密切观察CD20+直至大于零可重复给药。
1.2.5 EDSS评分及随访 于RTX治疗前行EDSS评分,并于2015-01对5例患者进行电话随访,对患者目前状况进行EDSS评分。
1.2.6 ARR:统计RTX治疗前后的ARR。复发的定义为与上一次发作间隔时间大于30 d,出现新的神经系统恶化的症状,并且症状持续至少24 h,该症状可以使EDSS评分增加至少0.5分。ARR为平均每年复发的次数。
1.3 统计学处理 采用SPSS17统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,采用自身对照配对样本t检验;不符合正态分布的计量资料以中位数和四分位数间距表示,采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特点 患者均为女性,发病年龄22~56岁,平均(41.6±15.1)岁,用药前病程中位数为150 d,四分位间距为412 d。5例患者中,1例为脑干空间限定型(病灶部位局限在脑干,图1),余4例为长脊髓病变型(病灶部位局限在长节段脊髓,图2)。病例3患者抗SSA抗体、抗SSB及抗核抗体均为阳性,病例4抗SSA抗体和抗核抗体均为阳性,另3例未行自身抗体检测。患者的神经功能、用药、复发和随访情况见表1,脑脊液及影像学检查结果见表2。
2.2 疗效观察 5例患者于RTX治疗前EDSS评分中位数为8.5分,四分位数间距为1.25分;经RTX治疗后,随访时(2015-01)5例患者的最佳EDSS评分中位数为2.5分,四分位数间距为5.75分,治疗前后比较差异有统计学意义(P<0.05)。RTX治疗前,5例患者的ARR中位数为1次,四分位数间距为2.12次;随访期间5例患者的ARR中位数为0,四分位数间距为0.35次,治疗前后比较差异有统计学意义(P<0.05)。5例患者EDSS评分和ARR具体结果见表1。
2.3 随访及副作用 随访期间,病例3及病例4有复发,而余3例无再次复发。复发患者均为RTX治疗仅1次者,RTX治疗2次以上的另3例患者无复发。除病例1在首次使用时出现发热、寒战、皮疹,余4例均未出现不良反应。病例1在出现不适症状后,立即停止注射RTX,输注地塞米松、苯海拉明后,症状明显好转,恢复使用RTX后,再未出现不良反应。
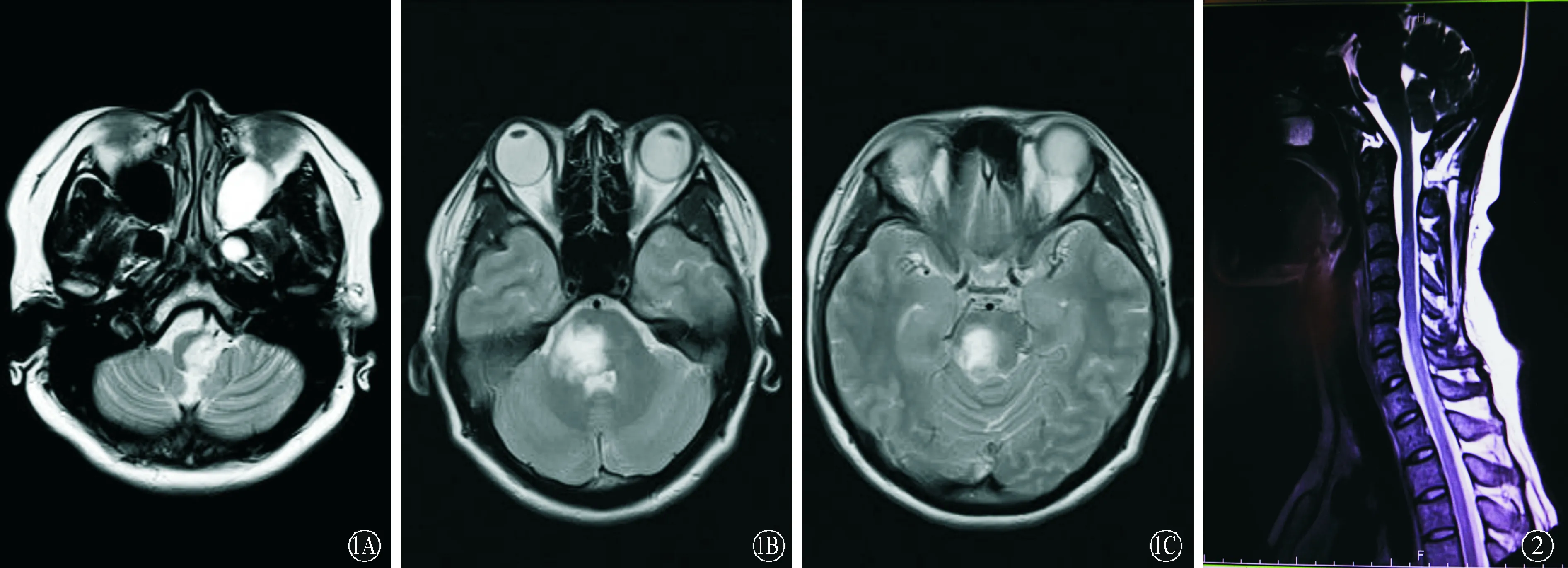
图1 病例1头颅MRI检查显示延髓(A,T2WI像)、脑桥(B,T1WI像)、中脑(C,T1WI像)部位见可见异常信号 图2 病例5胸椎MRI T2WI检查可见第6颈椎至第1胸椎水平异常信号
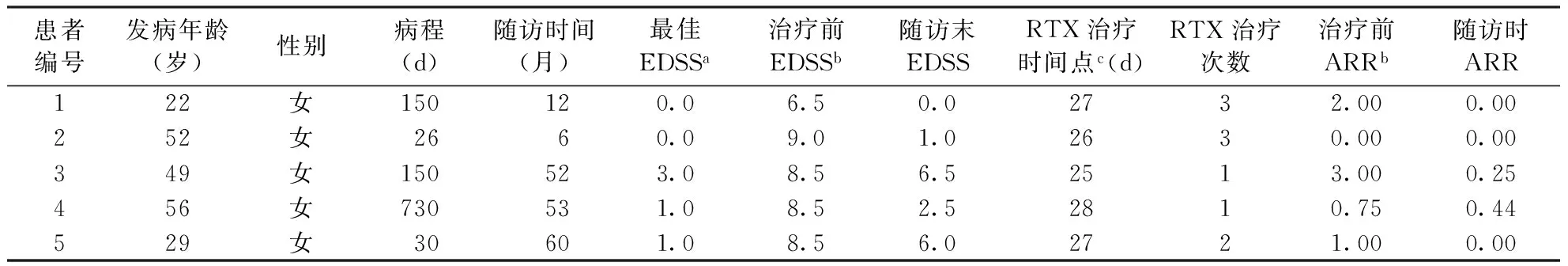
患者编号发病年龄(岁)性别病程(d)随访时间(月)最佳EDSSa治疗前EDSSb随访末EDSSRTX治疗时间点c(d)RTX治疗次数治疗前ARRb随访时ARR122女150120.06.50.02732.000.00252女2660.09.01.02630.000.00349女150523.08.56.52513.000.25456女730531.08.52.52810.750.44529女30601.08.56.02721.000.00
注:NMOSDs:视神经脊髓炎谱系疾病,表2同;EDSS:扩展残疾状态量表评分;RTX:利妥昔单抗;ARR:年复发率;a表示本次发作前的最佳EDSS;b表示使用RTX治疗前;c表示糖皮质激素治疗无效至RTX治疗的间隔时间
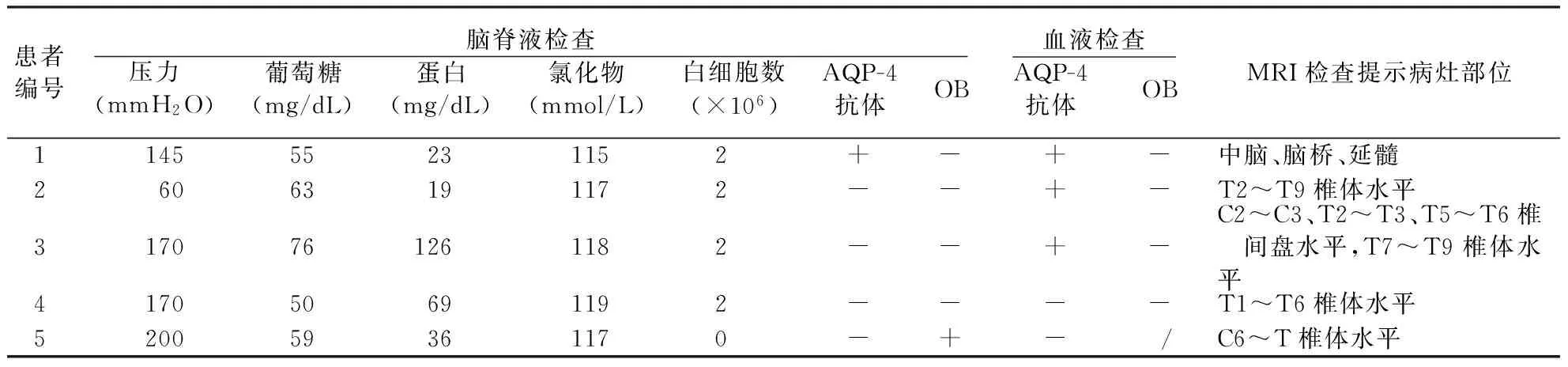
表2 5例NMOSDs患者入院时脑脊液、血液及MRI检查结果
注:脑脊液检查正常参考值:葡萄糖45~80 mg/dL,蛋白15~45 mg/dL,氯化物118~128 mmol/L;AQP-4:水通道蛋白4;OB:寡克隆区带;+:阳性;-:阴性;/:表示未检测
3 讨论
NMO疾病谱包括NMO、视神经炎(复发的或双侧同时发病)、特发的或复发的长节段脊髓炎(MRI上有≥3个椎体受累)、亚洲视神经-脊髓型MS(Asian optic-spinal multiple sclerosis,OSMS)、患有系统免疫疾病的视神经炎或长脊髓节段脊髓炎、视神经炎或脊髓炎并患有NMO典型脑部受损病灶(下丘脑、胼胝体、脑室周和脑干)[8]。NMOSD患者脑脊液检查除特异性抗体阳性外,无其他明显特异性[10],AQP-4抗体的发现证实了体液免疫在NMO疾病谱发生发展的重要作用。随着研究的进展,下列发现进一步表明B细胞在NMOSD的发生发展中起重要作用:(1)利用RTX选择性促使B细胞凋亡可减少疾病的复发风险;一些小型研究表明,血浆交换或通过免疫吸附选择性使免疫球蛋白减少也可降低疾病的复发。(2)将包括AQP-4抗体在内的相关抗体注射入大鼠体内,可导致中枢神经系统损害及加重自体免疫性脑脊髓炎的严重程度。(3)在NMO损害的活动期出现免疫球蛋白沉积和补体的激活[11]。因此,减少外周循环中B细胞可减轻疾病的发展,而RTX正是针对减少B细胞达到治疗的目的。RTX是一种嵌合式单克隆抗体,直接拮抗CD20+蛋白,可通过细胞介导的细胞毒性效应以及促进细胞凋亡的联合方式清除CD20+B细胞,从而影响抗体的产生、细胞因子网络和B细胞介导的抗原呈递反应和T细胞、巨噬细胞激活。此外,RTX可通过对CD20+B细胞的调理素作用激活内皮网状系统,促进凋亡B细胞的清除[12]。现有研究表明,RTX可清除外周血中100%和脑脊液中90%的CD20+细胞,而CD20+细胞的再生与疾病的活动性相关[5],使用RTX治疗后CD20+细胞再次出现的时间因人而异。因此,缓解期治疗方案应基于患者CD20+细胞再次出现的情况而制定。研究结果提示对于缓解期NMOSD患者每6~9个月再次使用RTX是安全和耐受的[13]。
本研究中病例1责任病灶仅限于脑干,属于NMOSD的脑干空间限定型,在两次大剂量激素冲击治疗无效后,连续使用RTX治疗3次,随访期间EDSS评分为0,且无复发。另4例患者责任病灶均在脊髓,且病灶长度均大于3个椎体,而头颅MRI检查未见异常。病例2在大剂量激素冲击治疗2次后,病情仍进展性加重,连续使用RTX治疗3次后,神经功能恢复较好,且随访期间无复发;病例5连续使用RTX 2次后,EDSS明显降低,随访期间无复发。病例3、病例4应用RTX治疗1次,随访期间病例4神经功能恢复良好,病例3虽然有复发,但均未加重病情,EDSS评分较RTX治疗前降低,提示RTX可能是一种治疗难治性NMOSD患者的有效药物。Ip等[2]通过对7例NMOSD和NMO患者的观察研究证实了上述观点。
近年来,国外研究报道NMO及NMOSD患者使用RTX治疗后可降低ARR,提高残疾功能的恢复[14]。Kim等[15]对30例经RTX治疗的NMOSD患者随访5年发现,26例患者的ARR显著降低,18例患者在使用RTX治疗后无复发,28例患者残疾功能提高或者保持稳定,随访期间没有因明显副作用而被终止观察的事件发生。Ip等[2]研究7例使用RTX治疗的患者(4例NMOSD和3例NMO),结果显示,RTX可显著减少复发率,降低EDSS评分;同时,在患者出现首发症状后,及早使用RTX治疗预后更好。Pellkofer等[16]研究9例使用5次RTX作为二线治疗的NMO患者,结果表明多次使用RTX可维持大多数患者的临床稳定性,且再一次证实疾病活动性和B细胞凋亡有关,但和AQP-4抗体相关性还不明确,患者可以耐受5次系统性的RTX治疗,且首次使用RTX治疗后,后续使用应在复发前注射效果更好。Jacob等回顾性分析25例NMO,结果提示使用RTX后可减低复发率和稳定或提高残疾功能[17]。Pawate等[18]对6例孤立的长脊髓节段脊髓炎患者的研究也证明这一点。本研究结果与上述研究结果一致。
此外,检测自身抗体的2例患者中,结果均为阳性。据文献报道AQP4抗体阳性者超半数患者ANA阳性,约1/5患者抗SSA抗体阳性。SSA抗原存在内皮细胞上,而SSA抗体会导致内皮细胞破损,故考虑SSA抗体与血-脑屏障破坏有关,继而激发AQP4抗体的产生[19]。ANA阳性患者脊髓损害节段相对较长,神经功能损伤重,且易复发。对于这类患者,在激素或丙球治疗无明显改善后,应及早使用RTX治疗。
目前国内外关于RTX治疗NMOSD的标准方案仍在探索中,比较认可的方案为:急性期每周注射1次,每次使用剂量按375 mg/m2计算,连续使用4次或者每次使用1000 mg,间隔2周使用两次[20]。缓解期每6~9个月重复注射可以降低复发率,并且患者可耐受[20]。但由于RTX价格昂贵,且患者依从性不一致,本研究中只有3例患者连续使用RTX大于2次,且无缓解期复查病情而继续使用RTX治疗的相关资料。因此,有关RTX治疗的确切疗效以及方案仍需继续研究。
综上可见,对于难治性NMOSD患者,无论是脑干空间限定型还是长脊髓节段型,在经过反复的激素冲击治疗无效或症状缓解不明显时,抗CD20+RTX可能是一种既安全又有效的疗法。但目前本文观察研究病例数少,尚需大样本、多中心的研究及长时间随访。
[1]Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology, 2015,85(2):177-189.
[2]Ip VH, Lau AY, Au LW, et al. Rituximab reduces attacks in Chinese patients with neuromyelitis optica spectrum disorders[J]. J Neurol Sci, 2013,324(1-2):38-39.
[3]Flanagan EP, Weinshenker BG. Neuromyelitis optica spectrum disorders[J]. Curr Neurol Neurosci Rep, 2014,14(9):483.
[4]Biswas A, Mukherjee A. Therapy of NMO spectrum disorders[J]. Ann Indian Acad Neurol, 2015,18(Suppl 1):S16-23.
[5]Akaishi T, Nakashima I. Rituximab (anti-CD20) in neurological disorders[J]. Brain Nerve, 2014,66(10):1167-1178.
[6]Zephir H, Bernard-Valnet R, Lebrun C, et al. Rituximab as first-line therapy in neuromyelitis optica: efficiency and tolerability[J]. J Neurol, 2015,262(10):2329-2335.
[7]Sherman E, Han MH. Acute and chronic management of neuromyelitis optica spectrum disorder[J]. Curr Treat Options Neurol, 2015,17(11):48.
[8]Wingerchuk DM, Lennon VA, Lucchinetti CF, et al. The spectrum of neuromyelitis optica[J]. Lancet Neurol, 2007,6(9):805-815.
[9]陈海, 董会卿, 刘峥, 等. 利妥昔单抗治疗长脊髓损害的初步分析[J].中国神经免疫学和神经病学杂志,2012,19(2):82-85.
[10]Kashipazha D, Mohammadianinejad SE, Majdinasab N, et al. A descriptive study of prevalence, clinical features and other findings of neuromyelitis optica and neuromyelitis optica spectrum disorder in Khuzestan Province, Iran[J]. Iran J Neurol, 2015,14(4):204-210.
[11]Krumbholz M, Meinl E. B cells in MS and NMO: pathogenesis and therapy[J]. Semin Immunopathol, 2014,36(3):339-350.
[12]Gürcan HM, Keskin DB, Stern JNH, et al. A review of the current use of rituximab in autoimmune diseases[J]. Int Immunopharmacol,2009,9(1),10-25.
[13]Stuve O, Leussink VI, Frohlich R, et al. Long-term B-lymphocyte depletion with rituximab in patients with relapsing-remitting multiple sclerosis[J]. Arch Neurol, 2009,66(2):259-261.
[14]Stuve O, Cepok S, Elias B, et al. Clinical stabilization and effective B-lymphocyte depletion in the cerebrospinal fluid and peripheral blood of a patient with fulminant relapsing-remitting multiple sclerosis[J]. Arch Neurol, 2005,62(10):1620-1623.
[15]Kim SH, Huh SY, Lee SJ, et al. A 5-year follow-up of rituximab treatment in patients with neuromyelitis optica spectrum disorder[J]. JAMA Neurol, 2013,70(9):1110-1117.
[16]Pellkofer HL, Krumbholz M, Berthele A, et al. Long-term follow-up of patients with neuromyelitis optica after repeated therapy with rituximab[J]. Neurology, 2011,76(15):1310-1315.
[17]Jacob A, Weinshenker BG, Violich I, et al. Treatment of neuromyelitis optica with rituximab: retrospective analysis of 25 patients[J]. Arch Neurol, 2008,65(11):1443-1448.
[18]Pawate S, Sriram S. Isolated longitudinal myelitis: a report of six cases[J]. Spinal Cord, 2009,47(3):257-261.
[19]武雷,黄德晖,杨扬,等.血清抗核抗体在视神经脊髓炎谱系疾病和多发性硬化中的分布[J].中国神经免疫学和神经病学杂志,2011,18(4):243-245,249.
[20]Zephir H, Bernard-Valnet R, Lebrun C, et al. Rituximab as first-line therapy in neuromyelitis optica: efficiency and tolerability[J]. J Neurol, 2015,262(10):2329-2335.
(本文编辑:时秋宽)
A long-term follow-up of 5 patients with refractory neuromyelitis optica spectrum disorder after rituximab treatment
ZHANGJun,CHENHai,KANGHaijuan,LIUShimeng,LIUZheng,DONGHuiqing*.
*DepartmentofNeurology,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China
DONG Huiqing, Email: shshtt@sina.com
Objective To observe the long-term effect and safety in 5 refractory neuromyelitis optica spectrum disorder(NMOSD) patients treated with rituximab(RTX). Methods The clinical course and neurological function of 5 refractory NMOSD patients treated with RTX were retrospectively analyzed. These patients had no response to steroids or immunoglobulin in our department of neurology, Xuanwu Hospital. Annualized relapse rate (ARR) and the expanded disability status scale score(EDSS) were recorded and compared before and after treatment. And the efficacy and side effects of RTX were valued. Results Before RTX treatment, the median and interquartile range of EDSS and ARR were 8.5(1.25) and 1(2.12) times respectively. In the follow-up period(the medium time is 52 months), the median and interquartile range of EDSS and ARR were 2.5(5.75) and 0(0.35) times respectively, with significant reduction in ARR and improvements in EDSS. Mild side effect occurred in one case, no severe side effects occurred. Conclusions RTX can improve the clinical symptoms among refractory NMOSD patients in long-term observation, and could be an effective and safe therapy.
rituximab; refractory neuromyelitis optica specturm disorder; demyelinating disease; treatment
10.3969/j.issn.1006-2963.2016.04.002
北京市科委首都市民健康项目培育(Z131100006813020)
100053首都医科大学宣武医院神经内科
董会卿,Email:shshtt@sina.com
R744.5+2
A
1006-2963(2016)04-0235-05
2015-12-17)

