肌萎缩侧索硬化患者的脑脊液蛋白及髓鞘碱性蛋白相关研究
张洁 邢岩 崔丽英
肌萎缩侧索硬化患者的脑脊液蛋白及髓鞘碱性蛋白相关研究
张洁 邢岩 崔丽英
目的 探讨肌萎缩侧索硬化(ALS)患者的脑脊液蛋白、髓鞘碱性蛋白(MBP)水平及脑脊液蛋白与临床特征之间的关系。方法 回顾性研究行腰穿查脑脊液的29例确诊ALS患者,检测其脑脊液蛋白及MBP水平,并按性别、年龄、病程、起病部位及临床功能评分〔肌萎缩侧索硬化功能分级量表(ALS-FRS)评分〕等不同临床特征分组,分析不同临床特征对脑脊液蛋白水平的影响。结果 29例ALS患者脑脊液蛋白水平为(0.43±0.15)g/L,其中脑脊液蛋白轻度增高患者9例(31%),最高为0.89 g/L;不同性别〔男(0.42±0.15)g/L,女(0.45±0.18)g/L,t=0.501,P=0.620〕、年龄〔<60岁组(0.43±0.17)g/L,≥60岁(0.44±0.13)g/L,t=0.141,P=0.889〕、病程〔<1年组(0.37±0.11)g/L,≥1年(0.49±0.17)g/L,t=-2.23,P=0.054〕、起病部位〔球部起病组(0.38±0.11),肢体起病组(0.45±0.17),t=0.330,P=0.743〕、ALS-FRS评分〔>30分组(0.42±0.16)g/L,≤30分组(0.44±0.16)g/L,t=0.092,P=0.928〕分组间比较,脑脊液蛋白水平差异均无统计学意义。29例患者中13例进行了脑脊液MBP检测,MBP水平(1.66±0.78) nmol/L,13例患者MBP水平均增高,最高达3.39 nmol/L。MBP水平与脑脊液蛋白水平无相关性(R=0.198,P= 0.517)。结论 ALS患者脑脊液蛋白增高多见。部分ALS患者脑脊液MBP水平增高,但与脑脊液蛋白水平无相关性。
肌萎缩侧索硬化;脑脊液;蛋白;髓鞘碱性蛋白
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是进行性累及上、下运动神经元而导致肌肉无力萎缩,最终因呼吸肌受累而致死亡的一种神经系统变性病。临床发现,ALS患者脑脊液中蛋白及髓鞘碱性蛋白(myelin basic protein,MBP)水平均可增高,但国内外均报道较少。本研究观察ALS患者脑脊液蛋白、MBP升高水平,并初步探讨脑脊液蛋白水平与年龄、性别、起病部位、病程、临床功能评分之间是否存在相关性,期望对临床有所帮助。
1 对象和方法
1.1 观察对象 2000-07—2013-07期间在北京协和医院神经内科病房及航空总医院神经内科住院的ALS确诊患者29例,其中男19例、女10例,年龄范围17~69岁,平均年龄(47.7±11.8)岁,病程5个月至9年(中位数11个月,四分位数间距17个月)。患者均根据E1 Escorial标准[1]诊断,并于住院期间行腰穿查脑脊液。29例患者病前均体健,无特殊个人史及家族史。
1.2 方法
1.2.1 脑脊液检测:脑脊液蛋白检查采用氯化苯丙胺盐法检测[2]。MBP检测采用酶联免疫法检测[3]。
1.2.2 神经功能测评:肌萎缩侧索硬化功能分级量表评分(ALS-FRS)是目前临床试验中最常用的神经功能评分方法,有10项功能检查,包括4个球部功能(言语、流涎、吞咽、呼吸)、两个下肢功能(行走和爬楼梯)和两个其他功能(穿衣和洗漱、床上翻身和整理被服)。评分从0分(完全不能完成任务)至40分(正常),分值越低,神经功能缺损越严重。
1.2.3 分组及分析:根据年龄将患者分为≥60岁组(11例)和<60岁组(18例),按起病方式将其分为球部起病组(不论是否发展为全身,8例)和肢体起病组(21例),按病程分为<1年组(14例)和≥1年组(15例),按ALS-FRS评分分为>30分组(19例)和≤30分组(10例)。比较不同性别、年龄、病程、起病部位、临床功能评分分组间脑脊液蛋白水平,并对脑脊液MBP与脑脊液蛋白水平进行相关分析。
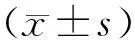
2 结果
2.1 脑脊液蛋白及MBP检测 29例患者脑脊液蛋白水平为(0.43±0.15)g/L〔正常参考值范围(0~0.45)g/L〕,其中9例(31%)轻度增高,最高为0.89 g/L。脑脊液MBP水平(1.66±0.78)nmol/L(正常参考值范围≤0.55 nmol/L),29例ALS患者有13例行MBP检查,行MBP检测的13例MBP水平全部增高,最高为3.39 nmol/L。
不同性别〔男(0.42±0.15)g/L,女(0.45±0.18)g/L,t=0.501,P=0.620〕、年龄〔<60岁组(0.43±0.17)g/L,≥60岁(0.44±0.13)g/L,t=0.141,P=0.889〕、病程〔<1年组(0.37±0.11)g/L,≥1年组(0.49±0.17)g/L,t=-2.23,P=0.054)〕、起病部位〔球部起病组(0.38±0.11)g/L,肢体起病组(0.45±0.17)g/L,t=0.330,P=0.743〕、ALS-FRS评分〔>30分组(0.42±0.16)g/L,≤30分组(0.44±0.16)g/L,t=0.092,P=0.928〕分组间脑脊液蛋白含量比较差异均无统计学意义。
2.3 脑脊液MBP与脑脊液蛋白水平的相关性分析 13例患者同时行脑脊液蛋白和MBP水平差检测,并对两者进行Pearson相关分析,结果显示二者无相关性(R=-0.198,P=0.517)。
3 讨论
现认为ALS是神经系统的变性疾病,以大脑皮质、脑干、脊髓前角运动神经元选择性丢失为特征,其发病机制目前仍不清楚,但胶质细胞在ALS发病中的作用日益受到关注[4]。本研究主要就ALS患者脑脊液中的蛋白,尤其是MBP蛋白水平与临床相关指标的相关性进行探讨,初步探讨MBP的神经元毒性及产生MBP的少突胶质细胞的功能紊乱在ALS发病中的可能作用。
本文中对29例ALS患者进行回顾性分析,结果显示:(1)ALS患者脑脊液蛋白增高并非罕见。(2)29例中所检13例ALS患者全部存在MBP明显增高。(3)脑脊液蛋白水平与性别、年龄、起病部位、病程、ALS功能评分无明显相关性。
本组ALS患者脑脊液中部分患者〔31%(9/29)〕蛋白可以轻度增高,与国外Leonardi等[5]的报道比例相当。现已发现ALS患者脑脊液中可以有包括血浆铜蓝蛋白前体蛋白、Tar DNA结合蛋白43抗体(TDP-43)、C反应蛋白(CRP)、神经纤维丝蛋白,tau蛋白等多种蛋白增高[6-8],ALS患者存血脑屏障破坏和免疫反应异常[5,9],可能是其蛋白水平增高的原因。研究者们一直试图从脑脊液中发现对ALS诊断有帮助的蛋白标志物,但都没有特异性的发现。本研究将脑脊液蛋白水平与性别、年龄、起病部位、病程进行了相关性分析,分组间未发现差异有统计学意义,提示脑脊液蛋白升高在疾病发生发展过程中可能是非特异性的。
有关ALS患者MBP明显增高的发现国内尚未见报道,国外目前也仅有1篇报道[8]。该文献报道ALS患者脑脊液中MBP水平可以升高,该作者认为似乎是非特异性的[8]。但本研究29例ALS患者中13例检测了脑脊液的MBP水平,该指标全部升高,说明MBP水平的升高并非偶然,很可能是ALS疾病发展过程中的一个必然的产物。
MBP是中枢神经系统髓鞘的主要蛋白质,占中枢神经系统髓鞘蛋白含量的30%,是髓鞘中惟一的膜蛋白[9]。MBP由少突胶质细胞合成。少突胶质细胞对维持轴突(AXONS)代谢和神经元存活起重要作用,少突胶质细胞的功能紊乱导致轴突变性及神经元死亡[11]。研究发现在ALS患者及超氧化物歧化酶1(SOD1)转基因鼠中均发现少突胶质细胞变性[12]。少突胶质细胞的变性在ALS疾病早期即可出现,随着少突胶质细胞逐渐死亡,其前体细胞不断增殖分化,这些新合成的少突胶质细胞是不成熟的,存在功能紊乱,导致其分泌MBP功能异常。脑脊液MBP水平的升高提示存在少突胶质细胞的功能紊乱。脑脊液中MBP水平越高提示不成熟少突胶质细胞数量越多。MBP具有神经毒性作用,脑脊液MBP水平的升高会造成离子紊乱及细胞内容物外漏,最终导致神经元及胶质细胞死亡[13]。其中少突胶质细胞死亡会造成MBP继续升高,从而形成恶性循环。
综上可见,少突胶质细胞功能紊乱导致的MBP改变可能参与了ALS的疾病过程,这也可能是ALS的发病环节之一,尚需进一步研究证实。今后应将重点致力于开展ALS运动神经元死亡与MBP神经毒性之间关系及神经元与胶质细胞相互作用方面的研究,期待能够发现新的ALS治疗靶点。
[1]Brooks BR,Miller RG,Swash M,et al. World Federation of Neurology Research Committee on Motor Neuron Diseases. Revised criteria for the diagnosis of amyotrophic lateral sclerosis[J]. Amyotroph Lateral Scler Other Motor Neuron Disord,2000,1(5): 293-300.
[2]唐晓霞.氯化苯丙胺盐比浊法检测脑脊液蛋白质方法学评价[J].检验医学与临床,2013,10(12):1553-1554.
[3]丁美萍,闻树群.多发性硬化与髓鞘抗体及髓鞘碱性蛋白[J].中国神经免疫学和神经病学杂志,1999,6(1):32-35.
[4]Clement AM, Neuyen MD, Roberts EA, et al. Wild-type noneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice[J]. Science, 2003, 302(5642): 113-117.
[5]Leonardi A, Abbruzzese G, Arata L,et al. Cerebrospinal fluid (CSF) findings in amyotrophic lateral sclerosis[J]. J Neurol, 1984, 231(2): 75-78.
[6]Ryberg H, An J, Darko S, et al. Discovery and verification of amyotrophic lateral sclerosis biomarkers by proteomics[J]. Muscle Nerve, 2010, 42(1): 104-111.
[7]Rohan Z, Matej R, Rusina R,et al. Oligodendroglial response in the spinal cord in TDP-43 proteinopathy with motor neuron involvement[J]. Neurodegener Dis, 2014, 14(3): 117-124.
[8]Reijn TS, Abdo WF, Schelhaas HJ, et al. CSF neurofilament protein analysis in the differential diagnosis of ALS[J]. J Neurol, 2009, 256(4):615-619.
[9]Younger DS, Rowland LP, Latov N, et al.Lymphoma, motor neuron diseases, and amyotrophic lateral sclerosis[J]. Ann Neurol, 1991, 29(1):78-86.
[10]Sternber NH, Itoyama Y, Kies MW, et al. Myelin basic protein demonstrated immuncytochemically in oligodendroglia prior to myelin sheath formation[J]. Proc Natl Acad Sci,1978, 75(5):2521-2524.
[11]Lee Y, Morrison BM, Li Y, et al.Oligodendroglia metabolically support axons and contribute to neurodegeneration[J]. Nature, 2012,487(7408):443-448.
[12]Philips T, Bento-Abreu A, Nonneman A, et al.Oligodendrocyte dysfunction in the pathogenesis of amyotrophic lateral sclerosis[J]. Brain, 2013, 136(Pt2): 471-482.
[13]Boggs JM. Myelin basic protein: a multifunctional protein[J]. Cell Mol Life Sci, 2006,63(17):1945-1961.
(本文编辑:邹晨双)
The levels of cerebrospinal fluid protein and myelin basic protein in amyotrophic lateral sclerosis patients
ZHANGjie,XINGYan,CUILiying*.
*DepartmentofNeurology,PekingUnionMedicalCollegeHospital,Beijing100730,China
CUI Liying, Email:pumchcuily@sina.com
Objective To investigate the correlation between the clinical features and the levels of cerebrospinal fluid(CSF) protein and myelin basic protein(MBP) in patients with amyotrophic lateral sclerosis(ALS). Methods Retrospective study was adopted among 29 hospitalized patients diagnosed as ALS, undergoing lumbar puncture. According to the different clinical characteristics of ALS, the CSF protein and MBP of the patients were detected. The patients were categorized according to gender, age, course of disease, the onset site, ALS-FRS, and the effects of clinical features on the CSF protein levels was discussed. Results CSF protein mildly increased in 9 patients(31%). The average CSF protein level of 29 patients was (0.43±0.15)g/L. The highest level was 0.89 g/L.There were no significant differences in levels of CSF protein between the groups of the course of disease [<1 year(0.37±0.11)g/L, ≥1year(0.49±0.17)g/L,t=-2.23,P=0.054], disease onset[bulbar onset(0.38±0.11),limb onset(0.45±0.17),t=0.330,P=0.743], age[<60 years old(0.43±0.17)g/L,≥60 years old(0.44±0.13)g/L,t=0.141,P=0.889] and gender[male(0.42±0.15)g/L,female(0.45±0.18)g/L,t=0.501,P=0.620], ALS-FRS[>30 scores(0.42±0.16)g/L, ≤30 scores(0.44±0.16)g/L,t=0.092,P=0.928]. The MBP levels were detected in 13 patients and all of them significantly increased. The highest level was 3.39 nmol/L (normal value≤0.55 nmol/L), the average level was(1.66±0.78)nmol/L. There was no correlation between the levels of CSF protein and MBP(R=0.198,P=0.517). Conclusions The CSF protein increasing is common in patients with ALS. The MBP levels increased in some of the ALS patients. It indicates that the MBP may play a role in the pathogenesis of ALS,but there is no correlation between MBP and CSF protein level.
amyotrophic lateral sclerosis; cerebrospinal fluid; protein; myelin basic protein
10.3969/j.issn.1006-2963.2016.04.005
100023 航空总医院神经内科(张洁、邢岩)100730中国医学科学院 北京协和医院神经内科(崔丽英)
崔丽英,Email:pumchcuily@sina.com
4.8
A
1006-2963(2016)04-0248-03
2015-10-20)

