苦瓜总黄酮的提取及其体外抗氧化活性分析
张宏梅,昌盛,崔佰吉,李晓光
(吉林医药学院药学院,吉林吉林132013)
苦瓜总黄酮的提取及其体外抗氧化活性分析
张宏梅,昌盛,崔佰吉,李晓光*
(吉林医药学院药学院,吉林吉林132013)
研究苦瓜中总黄酮提取工艺及其体外抗氧化作用。采用乙醇回流提取法提取苦瓜中总黄酮,利用紫外分光光度法对其进行鉴定,采用正交试验设计优化苦瓜中总黄酮的提取工艺;通过其清除1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH自由基)、羟自由基(·OH)、超氧阴离子自由基(O2-·)效果来考察苦瓜总黄酮的体外抗氧化能力。最佳提取工艺条件为:温度80℃,时间3 h,乙醇浓度80%,料液比1∶30(g/mL),提取次数3次。总黄酮平均含量为4.12mg/g。苦瓜总黄酮对DPPH自由基、·OH、O2-·均有较强的清除能力,呈现出量效关系,其IC50值分别为0.79、0.49、0.54mg/mL,表明苦瓜总黄酮具有较强的体外抗氧化能力。
苦瓜;黄酮;提取;体外抗氧化
苦瓜(Momordica charantia L.),又称癞瓜、凉瓜,癫葡萄、锦荔枝等,是葫芦科苦瓜属植物,苦瓜属一年生攀援草本苦瓜的果实。它味苦性寒,具有利尿、消暑解热、明目解毒、滋养强壮、降压、降血脂、舒张血管、抗心率失常、抗癌等作用,对提高机体的免疫能力,防治湿疹等皮肤病,抑制正常细胞的癌变和促进突变细胞的回复过程[1-2]。
黄酮类化合物广泛分布于自然界,为植物多酚类的代谢物[3]。具有治疗人类疾病及营养保健功效,对人类健康有着不可低估的作用[4]。黄酮类化合物的基本骨架由15个碳原子组成(C6-C3-C6)[5-7]。具有降血脂、降低血糖、降血压,抗菌、抗炎,免疫,保肝,清除氧自由基,抗衰老等作用[8-11]。因此,建立苦瓜中总黄酮的最佳提取工艺及其体外抗氧化的研究意义重大。本试验采用回流提取法提取苦瓜中的总黄酮,优化其最佳的提取工艺条件,并考察其体外抗氧化的能力,旨在为苦瓜总黄酮的进一步研究开发,提供理论参考。
1 材料与方法
1.1 原料
苦瓜:市售。
1.2 试剂
浓盐酸(批号:20120801):哈尔滨试剂化工厂;邻苯三酚(批号:20121225):天津市瑞金特化学品有限公司;亚硝酸钠(批号:20130604):沈阳市华东试剂厂;硝酸铝(批号:20121204)、氢氧化钠(批号:20080528)、邻二氮菲(批号:20140702):天津市大茂化学试剂厂;双氧水(批号:20150109)、硫酸亚铁(批号:20130111):天津市永大化学试剂有限公司;磷酸二氢钾(批号:20091212):天津市恒兴化学试剂制造有限公司;二苯代苦味肼自由基(DPPH·)(批号:WM0510EA14):上海源叶生物科技有限公司;三羟甲基氨基甲烷(Tris)(批号:TM0311CA14):上海源叶生物科技有限公司;抗坏血酸(VC)(批号:20120618)上海实验试剂有限公司;均为AR试剂;芦丁对照品(100080-201409):中国食品药品检定研究院。
1.3 仪器设备
RE-3000旋转蒸发仪:郑州市亚荣仪器有限公司;UV1800紫外分光光度计:日本岛津;CAP225D电子天平:Sartorius;Scientz-12SN冷冻干燥机:宁波生物科技股份有限公司。
1.4 方法
1.4.1 原料处理
取新鲜苦瓜,洗净后晾干,去掉瓜籽,切成小块,在55℃的恒温干燥箱中烘干,粉碎,过80目筛,称取一定量处理好的苦瓜粉末,用滤纸包包好,置于索氏提取器中,加入石油醚(30℃~60℃),置水浴锅中索氏提取,将温度控制在55℃左右,直至索氏提取器中有机溶剂变为无色,然后取出滤纸包并打开,将物料上的石油醚自然风干,备用。
1.4.2 苦瓜总黄酮含量测定[12-16]
精密称取芦丁对照品16.42mg,置10mL量瓶中,加甲醇溶解,并稀释至刻度,得对照品储备液。精密吸取对照品储备液1.0、2.0、4.0、6.0、8.0、10.0mg置于10mL容量瓶中,加甲醇稀释至刻度,定容。分别精密吸取各对照品溶液1.0mL置25mL量瓶中,分别加入30%乙醇5mL,混匀,加入1mL浓度为5%的亚硝酸钠溶液,混匀,放置室温6min,加入1mL浓度为5%的硝酸铝溶液,混匀,放置室温6min,再分别加入浓度为4%的氢氧化钠溶液10.0mL,混匀,用30%乙醇稀释至刻度,混匀,室温放置15min后于波长510 nm处测定吸光度。芦丁对照品的浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线,得回归方程A=0.481 8C+ 0.056 2(R=0.9993),表明芦丁在0.16mg/mL~0.64mg/mL的范围内线性关系良好。
供试品制备:取供试品溶液适量加入30%乙醇溶液5mL,后续操作与标准曲线的测定过程相同。
1.4.3 苦瓜总黄酮的提取及供试品的制备
取一定量预先处理好的苦瓜小颗粒,置于三颈瓶中,加入一定量某一浓度的乙醇溶液。浸泡过夜,将温度控制在一定条件,在水浴锅中进行回流提取,回流提取结束后,提取液抽滤,得到提取液,提取液减压浓缩,冷冻干燥,得苦瓜总黄酮提取物粉末。
取提取物粉末适量,置25mL量瓶中,加80%乙醇20mL,超声提取30min,防冷置室温,用80%乙醇定容至刻度,过滤,取续滤液即得。
1.4.4 正交试验优化苦瓜总黄酮的提取工艺
按照预试验的试验结果,选取提取时间、乙醇浓度、料液比、提取温度和提取次数5个因素,采用五因素四水平进行L16(45)正交设计表进行试验设计,以苦瓜提取液中的总黄酮含量为考察指标,优选最佳提取工艺条件,因素水平表见表1。

表1 因素与水平Table1 Factorsand levels
1.4.5 体外抗氧化活性测定
取苦瓜总黄酮提取物适量,加甲醇制成含有总黄酮为0.1、0.2、0.3、0.4 mg/mL的溶液作为供试品溶液,取VC粉末适量,加甲醇制成VC溶液(0.1、0.2、0.3、0.4mg/mL)作为参比溶液。
1.4.5.1 对羟基自由基的清除
取0.5mL 0.75mmol/L邻二氮菲无水乙醇溶液置试管中,依次加入1 mL 0.15mol/L磷酸盐缓冲液(PBS,pH7.4)和0.5mL水,充分混匀后,加入0.5mL 0.75 mmol/L硫酸亚铁溶液(FeSO4),混匀后,加入0.5mL 0.01%双氧水(H2O2),于37℃水浴保温60min,测定吸光度A损;未损伤:以0.5mL水代替双氧水,同法测定吸光度A未;样品管:0.5mL样品代替0.5mL水,同法测定吸光度A样。

1.4.5.2 对DPPH自由基的清除
取不同浓度的样品0.1mL,加入1×10-4mol/LDPPH乙醇溶液2.8mL,混匀后在室温下避光反应20min,
4 000 r/min离心10min,取上清液测定吸光度A1,空白组以等体积乙醇代替DPPH溶液,同法操作,测定吸光度Aj。对照组以等体积蒸馏水代替样品溶液,同法操作,测定吸光度A0。
调零空白液:蒸馏水+乙醇溶液(1∶1)
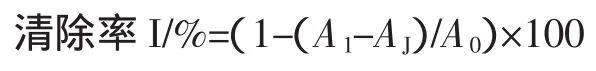
1.4.5.3 对超氧阴离子自由基的清除
取0.1molLpH8.2Tris-HCL缓冲液2.8mL(其中含有2mmol/L EDTA),加0.1mL不同浓度的样品溶液,混合均匀,于25℃水浴中保温10min,然后加入25℃保温状态的3mmol/L的邻苯三酚0.1mL,混匀后迅速于干燥的石英比色皿中,在320 nm下每30 s测定一次吸光度值,测定3min结束。
调零液:0.1mol/L pH8.2Tris-HCL缓冲液2.8mL(其中含有2mmol/LEDTA)
对照组:等体积水代替样品。
方法:做吸光度-时间曲线,求回归方程,斜率即为邻苯三酚自氧化速率V。

2 结果与分析
2.1 乙醇回流法提取工艺研究
正交试验结果表见表2。

表2 正交试验设计及结果Table2 Resultsof orthogonalarray design
从表2分析可知,各因素对苦瓜总黄酮得率影响的主次顺序为:B>C>D>A>E,即5种因素中,乙醇浓度对苦瓜总黄酮提取率的影响最大,其次是料液比、提取温度、提取时间、提取次数。而对于每一个单因素的极差分析可知,提取时间(A):k3>k2>k4>k1,乙醇浓度(B):k3>k4>k2>k1,料液比(C):k4>k3>k2>k1,提取温度(D):k3>k4>k2>k1,提取次数(E):k3>k4>k2>k1。因此,得出最优因素水平组合为A3B3C4D3E3,即提取时间:3 h,乙醇浓度:80%,料液比:1∶30(g/mL),提取温度:80℃,提取次数:3次。
按照最佳的提取条件进行工艺验证试验,工艺验证试验表明,本方法重现性良好,总黄酮平均含量为4.12mg/g,可以用作苦瓜总黄酮的提取方法。
2.2 对羟基自由基的清除作用
由试验结果可知不同浓度的苦瓜总黄酮提取物,其清除羟基自由基的能力具有明显的量效关系,在低浓度情况下,苦瓜总黄酮和VC的清除能力相差不大,随着浓度的升高,二者的清除能力都有所增加,但苦瓜总黄酮的清除能力均没有超过VC,经计算其纯化前后的IC50值均为:0.49mg/mL,测定结果见图1。

图1 苦瓜总黄酮、VC对羟基自由基的清除作用Fig.1 Scavenging activity effectsof flavonoids from balsam pear and VCagainsthydroxyl radical
2.3 对DPPH自由基的清除作用
由试验结果可知,苦瓜总黄酮和VC清除DPPH自由基的能力有差异,苦瓜总黄酮的清除能力明显低于VC溶液,但清除能力也表现出一定的量效关系,但是随着浓度的增加,二者清除能力的差异性也越来越大,经计算其纯化前后的IC50值分别为:0.79mg/mL,测定结果见图2。
2.4 对超氧阴离子自由基的清除作用
由试验结果可知,苦瓜总黄酮与VC清除超氧阴离子自由基的能力相当,虽然苦瓜总黄酮的清除能力没有VC的作用强,但是在一定的范围内二者的差异性较
小,且在范围内苦瓜总黄酮的清除能力也存在明显的量效关系,经计算其纯化前后的IC50值分别为:0.54mg/mL,测定结果见图3。

图2 苦瓜总黄酮、VC对DPPH自由基的清除作用Fig.2 Scavenging activity effectsof flavonoids from balsam pear and VCagainstDPPH radical

图3 苦瓜总黄酮、VC对超氧阴离子自由基的清除作用Fig.3 Scavenging activity effectsof flavonoids from balsam pear and VCagainst superoxideanion radical
3 结论
乙醇回流法提取苦瓜中总黄酮的最佳工艺为:提取时间3 h,乙醇浓度80%,料液比1∶30(g/mL),提取温度80℃,提取次数3次。按照最佳的提取条件进行工艺验证试验,总黄酮平均含量为4.12mg/g。乙醇浓度对苦瓜总黄酮提取率的影响最大,其次是料液比、提取温度、提取时间、提取次数。
苦瓜总黄酮的体外抗氧化研究表明,苦瓜总黄酮对DPPH自由基、·OH均有一定的清除能力,但清除能力与同浓度的VC溶液相比,还有一定的差距,但在一定的范围内呈现明显的量效关系,且随着浓度的升高,清除能力逐渐增强;苦瓜总黄酮对O2-·的清除能力与同浓度的VC差异不是很大,但是随着浓度的增加,清除能力的增加没有VC增加的幅度大,但是对比苦瓜总黄酮和VC清除DPPH自由基、·OH清除能力发现,随着浓度的增加,苦瓜总黄酮与VC的清除能力的差别相对较小,说明苦瓜总黄酮清除O2-·的能力要高于清除DPPH自由基和·OH的能力,但是总体来说清除能力低于同等浓度下Vc的清除能力,经过计算苦瓜总黄酮清除DPPH自由基、·OH和O2-·的IC50值分别为0.79、0.49、0.54mg/mL,整体的量效关系比较明显,随着浓度的增加,对3种自由基的清除能力逐渐增加,说明苦瓜总黄酮具有一定的体外抗氧化的能力。科学已经证明,与自由基有关的疾病有上百种之多,苦瓜为药食同源类植物,开发其有效成分的提取对于医疗和保健产品的开发必将具有一定的积极作用,特别是对于疾病的预防,日常保健有着重要的意义。
[1]文良娟,刘苇芬.苦瓜黄酮的提取条件及其抗氧化活性研究[J].食品科学2007,28(9):183-186
[2]申湘忠,杨民生,刘志成.苦瓜植株各部分黄酮的提取与粗黄酮含量的测定[J].食品与生物技术学报,2007,26(1):60-64
[3]王长远,吴洪奎,于长青,等.黄酮类化合物研究进展[J].黑龙江八一农垦大学学报,2007,19(2):75-78
[4]马森林,陈四平.天然黄酮类化合物分离方法研究进展[J],中国医药导报,2011,8(21):8-10
[5] 陈颢,李丽娟,李良,等.中药材中黄酮类化合物的提取及药理作用研究进展[J].云南化工,2011,38(4):50-53
[6]计红芳,张令文,孙科祥.苦瓜总黄酮的提取工艺[J].食品工艺与开发2009,30(9):77-80
[7]万明,宋永钢,杨菠.黄酮类化合物的药理作用及其在食品工业中的应用[J],江西食品工业,2007(3):49-52
[8]阮俊,黄永林.野菊花总黄酮提取方法研究[J].中成药,2004,26(2): 153-155
[9]张纪宁,欧阳艳.黄酮类化合物的提取工艺研究进展[J].伊犁师范学院学报(自然科学版),2008(6):27-28
[10]魏朝良,于德红,安利佳.黄酮类化合物及清除自由基机制的探究[J].中成药,2005,27(2):239-241
[11]申湘忠,杨民生,刘志成.苦瓜植株各部分黄铜的提取与粗黄酮含量的测定[J].食品与生物技术学报,2007,26(1):60-64
[12]李淑玲,凌爱霞.表面活性剂协同提取苦瓜中总黄酮的研究[J].济宁医学院学报,2012,35(5):325-327
[13]李宪平,申湘忠.微波法提取苦瓜叶中总黄酮[J].邵阳学院学报(自然科学版),2007,4(3):86-89
[14]李洪雄,彭志远,邹海英.葛根黄酮的提取与应用[J].吉首大学学报(自然科学版),2006,27(3):113-116
[15]谢建华,单斌,彭云.超临界CO2流体萃取苦瓜总黄酮工艺及其抗氧化活性[J].生物加工过程,2010,8(1):66-71
[16]李星彩.微波萃取苦瓜中黄酮类化合物的工艺研究[J].安徽农业科学,2010,38(21):11472-11473
Extraction and Antioxidant Activity in vitro of Flavonoids from Balsam Pear
ZHANGHong-mei,CHANGSheng,CUIBai-ji,LIXiao-guang*
(CollegeofPharmacy,Jilin MedicalUniversity,Jilin 132013,Jilin,China)
To investigate the extraction and antioxidanteffectsof flavonoids from balsam pear.Flavonoidswere extracted from balsam pearwith ethanol.The extractwasanalyzed qualitatively by UV-visible absorption spectroscopy.Theoptimum extraction conditionswere determined by orthogonalarray design.The antioxidantactivity of flavonoids from balsam pear investigated by comparing the reducing power and radical scavenging effects againstDPPH,hydroxyland superoxide anion radicalswith those of VCin vitro.The optimum extraction conditionswereas follows:ethanolconcentration 80%,solid/solventratio1∶30(g/mL),extraction time3 hours,temperature 80℃and 3 times.Under the optimized conditions,the yield of total flavonoids from balsam pearwas 4.12mg/g in one extraction cycle.Theextracted flavonoidshad potent radical scavengingactivity in a dose-dependentmanneragainstDPPH,hydroxyland superoxideanion radicals,and its IC50was0.79、0.49、0.54mg/mL,respectively.Flavonoids from balsam pearhad strongantioxidanteffects in vitro.
balsam pear;flavonoids;extraction;antioxidanteffects in vitro
10.3969/j.issn.1005-6521.2016.23.015
2016-07-31
张宏梅(1982—),女(汉),讲师,硕士,研究方向:中药新剂型及保健食品的开发。
*通信作者:李晓光(1963—),女(汉),教授,本科,研究方向:天然药物及保健食品的开发。

