近海沉积物DlPCBs对斑马鱼胚胎EROD和cyp1a mRNA的影响
聂芳红,蔡吉榛,王小宁,林红英,Ravi Gooneratne,Anthony Hay,马驿,巨向红,郑锦庆,陈进军,*
1. 广东海洋大学食品科技学院,湛江 524088 2. 广东海洋大学农学院,湛江 524088 3. 林肯大学农业与生命学院,基督城 7647,新西兰 4. 康奈尔大学农业与生命科学学院,伊萨卡 14853,美国
近海沉积物DlPCBs对斑马鱼胚胎EROD和cyp1a mRNA的影响
聂芳红1,蔡吉榛2,王小宁2,林红英2,Ravi Gooneratne3,Anthony Hay4,马驿2,巨向红2,郑锦庆2,陈进军2,*
1. 广东海洋大学食品科技学院,湛江 524088 2. 广东海洋大学农学院,湛江 524088 3. 林肯大学农业与生命学院,基督城 7647,新西兰 4. 康奈尔大学农业与生命科学学院,伊萨卡 14853,美国
为探究湛江近海域海洋沉积物中类二噁英多氯联苯(dioxin-like polychlorinated biphenyls, DlPCBs)的生物学毒性效应,选取湛江近海域2个地点(近工业区TS和近生活区JSW)采集沉积物样品,制备近海域沉积物DlPCBs提取物,将斑马鱼胚胎暴露于不同浓度的DlPCBs提取物,测定斑马鱼胚胎7-乙氧基异吩恶唑脱乙基酶(ethoxyresorufin-O-deethylase, EROD)活性和cyp1a mRNA相对表达量。结果发现,JSW采样点DlPCBs提取物染毒组EROD酶活性变化与TS采样点DlPCBs提取物一致,在各染毒浓度下,斑马鱼仔鱼EROD酶活性为对照组的1.1~1.8倍。TS和JSW采样点不同浓度DlPCBs提取物暴露斑马鱼胚胎96 h后,使斑马鱼仔鱼cyp1a mRNA相对表达量是对照组的3.36~19.45倍。说明一定浓度的近海沉积物DlPCBs能诱导斑马鱼仔鱼EROD酶活性和cyp1a mRNA表达量升高,且呈现浓度-效应关系。
类二噁英多氯联苯;斑马鱼胚胎;EROD酶;cyp1a mRNA;近海沉积物
类二噁英多氯联苯(dioxin-like polychlorinated biphenyls, DlPCBs)来源广泛,具有强毒性、生物蓄积性、全球迁移性等特点,未来很长时间内将是动物和人类健康安全的巨大隐患。海洋沉积物是DlPCBs的重要蓄积地,经过生物富集而大量存在于鱼类体内,污染蛋白类饲料原料,最终通过食物链污染进入动物及人体内[1-2]。斑马鱼(Danio rerio)是毒理学与药理学的优良模式实验动物[3-4]。本研究提取净化近海域沉积物中DlPCBs,利用斑马鱼胚胎活体EROD酶活性测定法和荧光定量PCR技术,探索DlPCBs提取物对斑马鱼胚胎EROD酶活性和cyp1a mRNA相对表达量的影响,为利用斑马鱼胚胎CYP1A进行DlPCBs污染的生物检测提供试验依据。
1 材料与方法 (Materials and methods)
1.1 仪器与试剂
气相色谱仪(GC-ECD,6890N型,配有电子捕获检测器,美国Agilent公司),真空冷冻干燥机(LGJ-10B型,北京四环科学仪器厂有限公司),医用数控超声波清洗器(KQ3200DE型,昆山超声仪器有限公司),玻璃层析柱(1997A型,上海子期实验设备有限公司),氮吹仪(LBM-1J型,北京莱伯曼公司);PCR仪(德国Eppendorf公司),核酸蛋白检测仪(BioPhotometer plus型,德国Eppendorf公司),ChemiDoc XRS凝胶成像系统、荧光定量PCR仪(美国Bio-Rad公司)。
正己烷(色谱纯,美国Burdick & Jackon公司),丙酮(色谱纯,美国J.T. Baker公司),佛罗里土(60~100目,美国Sigma公司),无水硫酸钠,PCB77、PCB81、PCB105、PCB114、PCB118、PCB123、PCB126、PCB156、PCB157、PCB167、PCB169、PCB170、PCB180、PCB189(美国o2si公司);总RNA提取试剂盒(TRIZOL Reagent)、一般PCR试剂盒(TaqTM)、DL 2000 DNA Marker、反转录试剂盒(PrimeScript RT reagent Kit With gDNA Eraser)、SYBR Premix Ex TaqTM Ⅱ(Perfect Real Time)均为Takara公司产品。
1.2 近海沉积物DlPCBs提取物的制备
以Khim等[5]和Koh等[6]所述方法为依据,将采集于湛江调顺岛(TS)和金沙湾(JSW)的近海域沉积物样品冷冻干燥,研碎,过80目筛。称取30 g于500 mL三角烧瓶中,加入300 mL正己烷和丙酮1∶1(V∶V),另加1 g铜粉脱硫,超声波提取30 min,静置后分离有机溶剂层,重复上述步骤一次,合并2次提取液。转移至旋转蒸发仪50 ℃浓缩至5 mL左右,加入10 mL正己烷继续浓缩至2 mL,待净化。净化方法为:用正己烷润湿层析柱,在柱内加入10 g已活化的佛罗里硅土,再加10 mm厚的无水硫酸钠,排出过量正己烷至刚淹没无水硫酸钠层,关闭活塞。将样品提取液移入柱内,用100 mL正己烷进行淋洗,将洗脱液在旋转蒸发仪下浓缩至10 mL左右,转移至浓缩管,用氮气浓缩至2 mL,1 mL用于气相色谱法仪器分析,另外1 mL用于后续斑马鱼胚胎试验。
1.3 试验动物
斑马鱼(Danio rerio),购自湛江花鸟鱼市场,由广东海洋大学水产学院进行品种鉴定。在水族箱适应性饲养1个月后用于繁殖试验,养殖用水为自然曝气3 d的自来水,水温控制在26~28 ℃。挑选体长为3.5 cm左右的斑马鱼(雌∶雄=1∶2)置于繁殖用水族箱中,每天饲喂2次,光照与黑暗周期控制在14 h/10 h,试验当天早上以光照刺激斑马鱼配对并产卵,0.5 h内用胚胎收集器收集斑马鱼胚胎。
1.4 斑马鱼胚胎染毒
近海沉积物DlPCBs提取物的最终染毒浓度依据斑马鱼胚胎急性毒性试验96 h的LC50配制,分别以DlPCBs提取物对斑马鱼胚胎的LC50为最高浓度,二倍递减进行稀释,配制5个浓度(TS采样点DlPCBs提取物的染毒浓度为60、30、15、7.5、3.75 mg·mL-1;JSW采样点DlPCBs提取物的染毒浓度为70、35、17.5、8.75、4.375 mg·mL-1),设空白对照组和0.1% DMSO对照组。斑马鱼胚胎染毒试验按照OECD(2012)方法进行[7],试验期为96 h,每天定时更换一半染毒溶液。
1.5 斑马鱼胚胎EROD酶活性测定
采用胚胎活体EROD酶测定法测EROD酶活性,综合Liu和Marit的方法[2,8]改良后进行。最终的分析结果为5条仔鱼荧光强度的平均值。
1.6 斑马鱼胚胎cyp1a mRNA相对表达量的测定
将20个染毒96 h后的斑马鱼仔鱼收集于离心管后,马上放入-80 ℃保存至提取RNA。用Trizol总RNA提取试剂盒提取斑马鱼仔鱼总RNA。用TaKaRa公司的反转录试剂盒PrimeScript RT reagent Kit With gDNA Eraser(Perfect Real Time)进行总RNA反转录,反转录产物于-20 ℃下保存。cyp1a基因和内参基因β-actin序列从Genebank获得,其序列号分别为AF210727和AF057040,利用软件Prime 5.0 设计引物。cyp1a基因上游引物为:AGGACAACATCAGAGACATCACCG,下游引物为:CACTAGATAGACAACCGCCCAGG,产物片段大小179 bp;β-actin上游引物为:GATGCGGAAACTGGCAAAGG,下游引物为:GAGGAGGGCAAAGTGGTAAACG,产物片段大小为116 bp。荧光定量PCR反应按设定条件进行,0.5 ℃增值进行熔解曲线分析,以检验产物的特异性。最终利用Fold = 2-△△Ct计算基因的相对表达量[9]。
1.7 数据统计分析

2 结果(Results)
2.1 斑马鱼胚胎EROD酶活性
荧光生物显微镜可观察到各DlPCBs提取物染毒组斑马鱼仔鱼的肠道、眼睛、卵黄囊积累了荧光产物(resorufin),其荧光强度均强于对照组,而0.1% DMSO对照组仔鱼荧光强度很低(图1F1)。TS采样点DlPCBs提取物最高浓度组(60 mg·mL-1)仔鱼可观察到心包水肿,在荧光显微镜下可观察到肠道和卵黄囊明显的荧光产物积累(图1A1)。
利用光密度分析软件对肠道和卵黄囊荧光产物进行荧光强度分析,与对照组比较,可得不同染毒浓度的仔鱼EROD活性相对大小(图2)。7.5 mg·mL-1染毒组的斑马鱼EROD活性为对照组的1.1倍(P<0.05),15 mg·mL-1、30 mg·mL-1、60 mg·mL-1染毒组EROD活性分别为对照组的1.2、1.8和1.5倍(P<0.01)。JSW采样点DlPCBs提取物染毒组EROD酶活性变化与TS采样点DlPCBs提取物类似,染毒浓度达17.5 mg·mL-1时,斑马鱼仔鱼EROD酶活性为对照组的1.26倍(P<0.05),35 mg·mL-1和70 mg·mL-1的DlPCBs提取物染毒组EROD活性分别为对照组的1.38和1.42倍(P<0.01)。
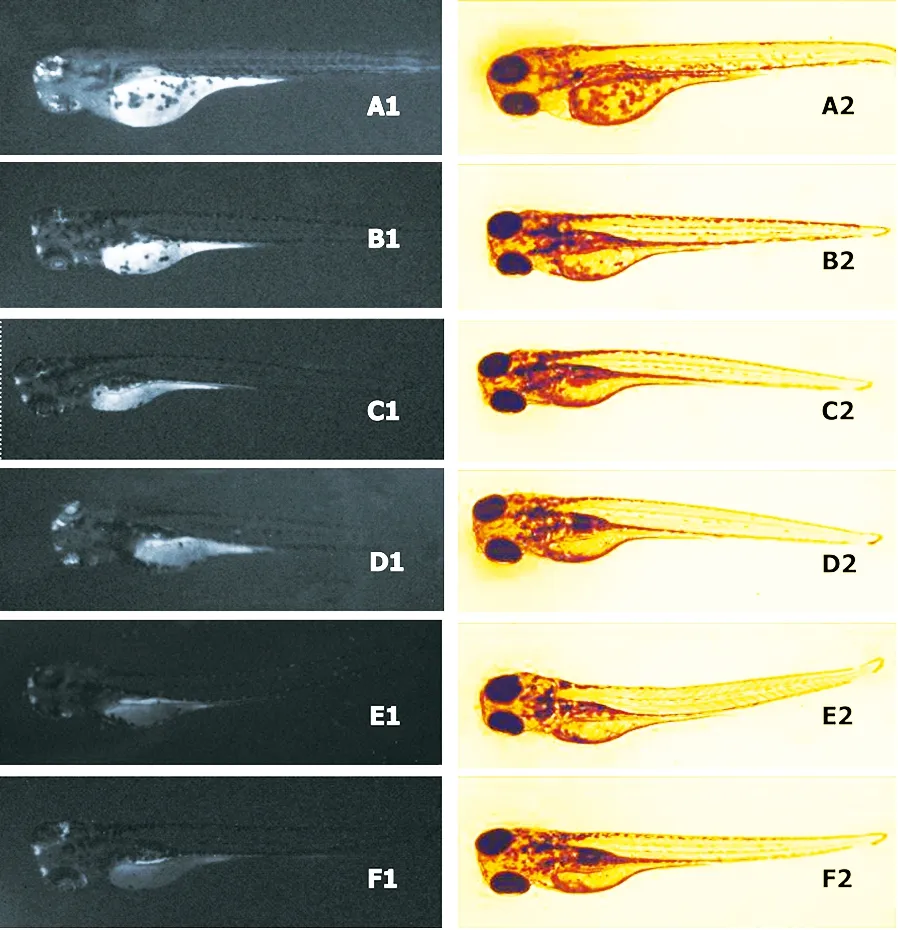
图1 TS采样点DlPCBs提取物染毒斑马鱼胚胎96 h后的荧光图和普通显微镜图(100×) 注:A1~F1为荧光图,A2~F2为普通显微镜图;A、B、C、D、E分别为60 mg·mL-1、30 mg·mL-1、15 mg·mL-1、7.5 mg·mL-1、3.75 mg·mL-1 DlPCBs提取物组,F为0.1% DMSO对照组。Fig. 1 Fluorescent and digital images of zebrafish larvae exposed to different concentrations of TS sediment DlPCBs extracts for 96 h (100×)Note:A1-F1 indicate fluorescent microscopic images of the zebrafish larvae; A2-B2 indicate light microscopic images of the zebrafish larvae. A, B, C, D, E were zebrafish larvae treated with 60 mg·mL-1, 30 mg·mL-1, 15 mg·mL-1, 7.5 mg·mL-1, 3.75 mg·mL-1 of DlPCBs extract, F were zebrafish larvae in the control.
2.2 DlPCBs提取物对斑马鱼仔鱼cyp1a mRNA相对表达量的影响
不同浓度的DlPCBs提取物暴露斑马鱼胚胎96 h后,使斑马鱼仔鱼cyp1a mRNA表达发生变化(图3)。TS采样点3.75 mg·mL-1、7.5 mg·mL-1浓度组的斑马鱼仔鱼cyp1a mRNA相对表达量是对照组的3.36、3.37倍(P<0.05),15 mg·mL-1、30 mg·mL-1、60 mg·mL-1浓度组的斑马鱼仔鱼cyp1a mRNA相对表达量为对照组4.87、7.11和7.59倍(P<0.01);JSW采样点4.375 mg·mL-1的DlPCBs提取物对仔鱼cyp1a mRNA的表达量与对照组相比差异不显著(P>0.05),8.75 mg·mL-1浓度组的斑马鱼仔鱼cyp1a mRNA相对表达量与对照相比差异具有统计学意义(P<0.05),17.5 mg·mL-1、35 mg·mL-1和70 mg·mL-1的JSW采样点DlPCBs提取物浓度组的斑马鱼仔鱼cyp1a mRNA相对表达量为对照组的8.39、18.82和19.45倍(P<0.01)。DlPCBs提取物与斑马鱼仔鱼cyp1a mRNA表达量呈现浓度-效应关系。
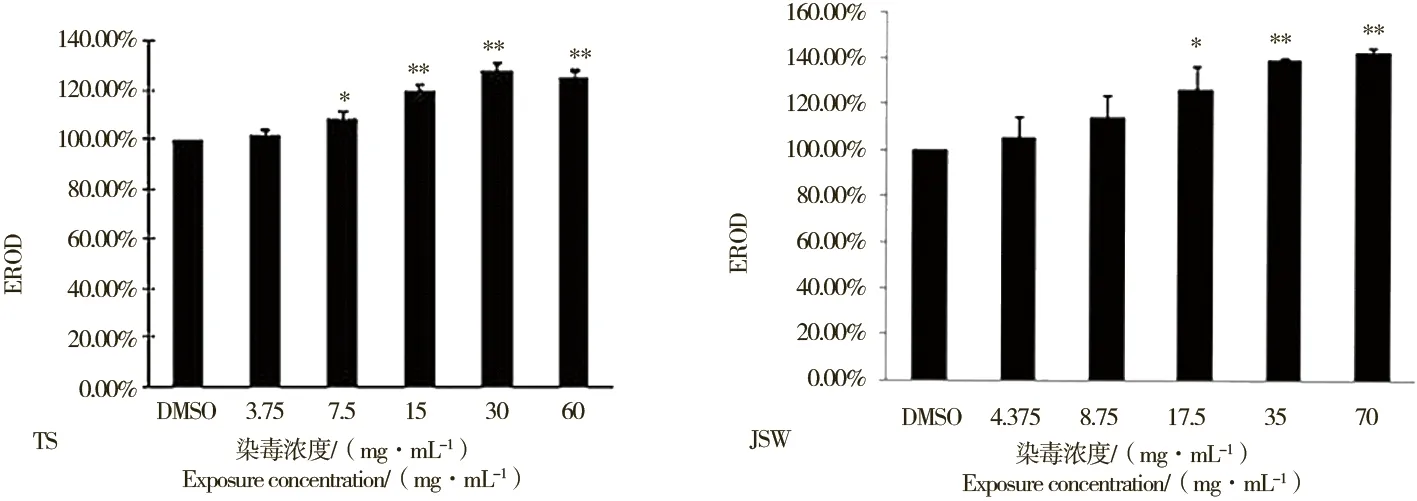
图2 TS和JSW采样点的DlPCBs提取物染毒斑马鱼胚胎96 h后活体EROD酶相对活性变化 注:n=5;*与对照组比,P<0.05,**与对照组比较,P<0.01。Fig. 2 In vivo EROD activity in zebrafish larvae exposed to DlPCBs extracts from TS and JSW for 96hNote: Mean±SEM, n=5. * P<0.05, **P<0.01, compared with control.
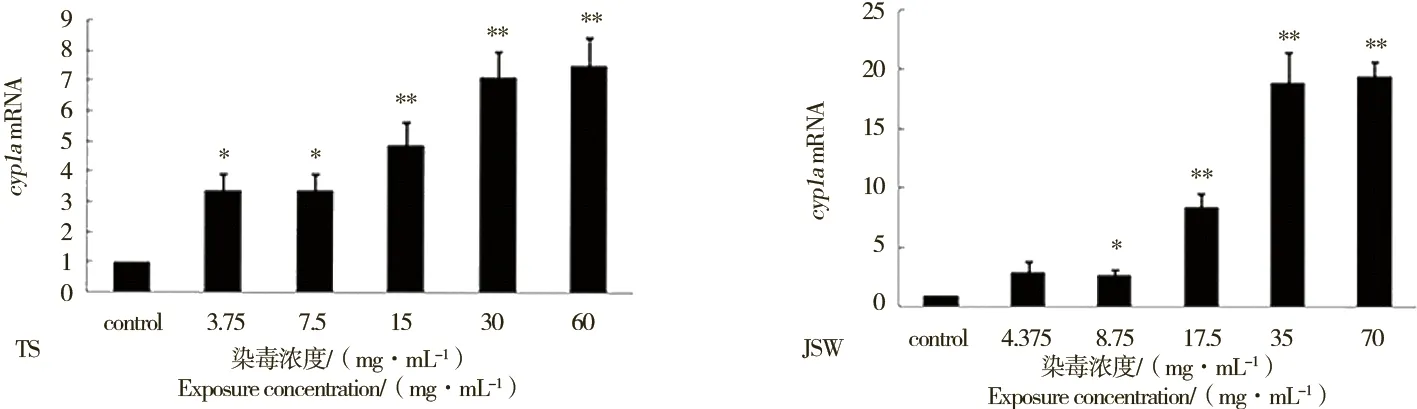
图3 TS和JSW采样点DlPCBs提取物染毒96 h对供试斑马鱼胚胎cyp1a基因mRNA相对表达量的影响 注:n=3;与对照组相比,*P<0.05,**P<0.01。Fig. 3 Fold-change in cyp1a mRNA expression in zebrafish embryos exposed to different concentrations of TS and JSW sediment DlPCBs extracts for 96 h Note: Mean±SEM (n=3). *P<0.05, **P<0.01, compared with control.
3 讨论(Discussion)
3.1 DlPCBs提取物使斑马鱼仔鱼EROD酶活性增加
哺乳动物的EROD酶是由CYP1A1介导的,是二噁英类污染物的生物标志物[10]。Tsang等[11-12]利用EROD法检测了水体、沉积物、鱼肉和鸡蛋的二噁英类化合物污染水平。斑马鱼胚胎EROD酶活性的检测方法有2种。一种是基于荧光分光光度计或多功能酶标仪的检测方法;另外一种方法称为胚胎活EROD酶检测法,利用荧光显微镜或激光共聚焦显微镜测定resorufin的荧光强度,反映EROD酶活性大小[12]。Liu等[2]和Tsang等[12]利用斑马鱼胚胎活体EROD酶检测法研究发现,一定剂量的DlPCBs、TCDD或PAHs能诱导斑马鱼胚胎EROD酶活性升高。本研究结果表明,DlPCBs提取物能诱导胚胎EROD酶活性升高,通过荧光显微镜可观测到resorufin主要分布于斑马鱼胚胎的肠道、眼睛、卵黄囊和血管,这与Otte利用激光共聚焦显微镜观测到的结果基本一致[13]。
Khim等[5]和Koh等[6]用正己烷和丙酮1:1(V/V)进行浸提,再用佛罗里硅土柱层析法净化,将沉积物中的PCBs与PAHs、OCPs和PCDD/Fs分离,有效提高了仪器和生物学分析的特异性。本研究将沉积物用正己烷和丙酮1:1(V/V)结合超声波进行提取和佛罗里土柱层析净化得到DlPCBs提取物,染毒斑马鱼胚胎96 h后发现一定浓度的DlPCBs提取物能使胚胎EROD酶活性增加,呈现明显的浓度-效应关系,这与PCB126对斑马鱼胚胎EROD酶活性的影响相类似[2]。由此说明,斑马鱼仔鱼EROD活性对DlPCBs敏感,能有效指示沉积物DlPCBs污染,胚胎活体EROD酶测定方法简单方便,具有一定的应用前景。
3.2 DlPCBs提取物上调斑马鱼仔鱼cyp1a mRNA表达量
生物体cyp1a mRNA的基底表达量很低,一定浓度的DlPCBs可通过AhR途径使cyp1a mRNA表达量呈浓度依赖升高。因此cyp1a基因的表达量常用于指示DlPCBs等二噁英类化合物污染的生物标志物[14-15]。本研究将斑马鱼胚胎暴露于DlPCBs提取物中96 h,发现TS采样点不同浓度的DlPCBs提取物均能显著诱导cyp1a mRNA表达量升高(P<0.05),JSW采样点除最低浓度(4.375 mg·mL-1)外,其他浓度的DlPCBs提取物均能显著诱导cyp1a mRNA表达量升高(P<0.05),cyp1a mRNA表达量的变化与EROD酶活性的变化一致,呈现浓度-效应关系。可见通过测定斑马鱼胚胎cyp1a mRNA表达量能反映沉积物DlPCBs的污染水平[16]。
[1] Jartun M, Ottesen R T, Steinnes E, et al. Painted surfaces important sources of polychlorinated biphenyls (PCBs) contamination to the urban and marine environment [J]. Environment Pollution, 2009, 157(1): 295-302
[2] Liu H, Nie F H, Lin H Y, et al. Developmental toxicity, EROD, and CYP1A mRNA expression in zebrafish embryos exposed to dioxin-like PCB126 [J]. Environmental Toxicology, 2014, 31(2): 201-210
[3] Henner H, Steffen K, Natalie K, et al. A new sediment contact assay to assess particle-bound pollutants using zebrafish(Danio rerio) embryos [J]. Journal of Soils and Sediments, 2003, 3(3): 197-207
[4] Hallare A V, Kosmehl T, Schulze T, et al. Assessing contamination levels of Laguna Lake sediments (Philippines) using a contact assay with zebrafish (Danio rerio) embryos [J]. Science of the Total Environment, 2005, 347(1-3): 254-271
[5] Khim J S, Kannan K, Villeneuve D L, et al. Characterization and distribution of trace organic contaminants in sediment from Masan Bay, Korea: Instrumental analysis [J]. Environmental Science and Technology, 1999, 32(23): 4199-4205
[6] Koh C H, Khim J S, Kannan K, et al. Polychlorinated dibenzo-p-dioxins (PCDDs), dibenzofurans (PCDFs), biphenyls (PCBs), and polycyclic aromatic hydrocarbons (PAHs) and 2,3,7,8-TCDD equivalents (TEQs) in sediment from the Hyeongsan River, Korea [J]. Environmental Pollution, 2004, 132(3): 489-501
[7] OECD. Guideline for the testing of chemicals: Draft proposal for a new guideline fish embryo toxicity (FET) test [S]. Paris, France: OECD, 2012
[8] Jordsn S M, Weber L P. Persistent effects on adult swim performance and energetic in zebrafish developmentally exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin [J]. Aquatic Toxicology, 2012, 106-107(1): 131-139
[9] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408
[10] 黎雯, 徐盈, 吴文忠, 等. 鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标[J]. 水生生物学报, 2000, 24(3): 201-207
Li W, Xu Y, Wu W Z, et al. Induction of EROD activity in fish liver as a bio-indicator dioxin-like compounds in aquatic system [J]. Acta Hydrobiologica Sinica, 2000, 24(3): 201-207 (in Chinese)
[11] Otte J C, Andersson C, Abrhamson A, et al. A bioassay approach to determine the dioxin-like activityin sediment extracts from the Danube River ethoxyresorufin-O-deethylaseinduction in gill filaments and liver of three-spined sticklebacks [J]. Environment International, 2008, 34(8): 1176-1184
[12] Tsang H L, Wu S C, Wong C C, et al. Risk assessment of PCDD/Fs levels in human tissues related to major food items based on chemical analyses and micro-EROD assay [J]. Environment International, 2009, 35(7): 1040-1047
[13] Jens C O, Annette D S, Hollert H, et al. Spatio-temporal development of CYP1 activity in early life-stages of zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2010, 100(1): 38-50
[14] Jönsson M E, Kubota A, Timme-Laragy A R, et al. AhR2-dependence of PCB126 effects on the swim bladder in relation to expression of CYP1 and cox-2 genes in developing zebrafish [J]. Toxicology and Applied Pharmacology, 2012, 265(2): 166-174
[15] An L H, Hu J Y, Yang M, et al. CYP1A mRNA expression in redeye mullets (Liza haematocheila) from Bohai Bay, China [J].Marine Pollution Bulletin, 2011, 62(4): 718-725
[16] Liu H, Nie F H, Lin H Y, et al. Developmental toxicity, oxidative stress, and related gene expression induced by dioxin-like PCB 126 in zebrafish (Danio rerio)[J]. Environmental Toxicology, 2014, 31(3): 295-303
◆
EROD Activity andcyp1amRNA Expression in Zebrafish Embryo Exposed to Marine Sediment DlPCBs Extract
Nie Fanghong1, Cai Jizhen2, Wang Xiaoning2, Lin Hongying2, Gooneratne Ravi3, Hay Anthony4, Ma Yi2, Ju Xianghong2, Zheng Jinqing2, Chen Jinjun2,*
1. Food Sci-Tech College, Guangdong Ocean University, Zhanjiang 524088, China 2. Agricultural College, Guangdong Ocean University, Zhanjiang 524088, China 3. Faculty of Agriculture & Life Sciences, Lincoln University, Christchurch 7647, New Zealand 4. College of Agriculture and Life Sciences, Cornell University, Ithaca 14853, USA
Received 9 July 2015 accepted 31 August 2015
To study the bio-toxicity of dioxin-like polychlorinated biphenyls (DlPCBs) in marine sediment, the sediments from Zhanjiang industrial and living area (TS and JSW) were collected and extracted focusing on DlPCBs, respectively. Then a range of zebrafish embryos were exposed to different concentrations of the sediment DlPCBs extracts to examine the ethoxyresorufin-O-deethylase (EROD) activity and the expression of cyp1a mRNA. The results showed that the DlPCBs extract from TS and JSW sediments had similarity to cause marked induction of EROD in the zebrafish embryos.The EROD activities in zebrafish embryos induced by different concentrations of the DlPCBs extract were 1.1 to 1.8 times higher than that in the control embryos, respectively, and after the zebrafish embryos were exposed to different concentrations of the DlPCBs for 96 h, the juvenile cyp1a mRNA relative expressions were significantly enhanced by 3.36 to 19.45 times of that in the control group, respectively. It is indicated that certain concentrations of the DlPCBs extract increased EROD activity and cyp1a mRNA in zebrafish larvae, with a concentration-effect relationship.
dioxin-like polychlorinated biphenyls; zebrafish embryo; EROD; cyp1a mRNA; marine sediment
10.7524/AJE.1673-5897.20150709001
广东省科技计划国际合作项目(2010B050600004,2016A050502062)
聂芳红(1969-),女,硕士,高级实验师,研究方向为食品毒理学,E-mail:15913577717@163.com;
*通讯作者(Corresponding author), E-mail: jjchen777@aliyun.com
2015-07-09 录用日期:2015-08-31
1673-5897(2016)2-364-05
X171.5
A
简介:陈进军( 1967-),男,动物毒理学博士,三级教授,主要研究方向为动物毒理学和环境健康,发表学术论文80 余篇。
聂芳红, 蔡吉榛, 王小宁, 等. 近海沉积物DlPCBs对斑马鱼胚胎EROD和cyp1a mRNA的影响[J]. 生态毒理学报,2016, 11(2): 364-368
Nie F H, Cai J Z, Wang X N, et al. EROD activity and cyp1a mRNA expression in zebrafish embryo exposed to marine sediment DlPCBs extract [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 364-368 (in Chinese)

