羟基化多溴联苯醚(OH-PBDEs)在小鼠肝脏微粒体的体外代谢及对CYP450酶活性的影响
张易曦,张圣虎,吴永贵,刘济宁,石利利
1. 贵州大学 资源与环境工程学院,贵阳 550025 2. 环境保护部南京环境科学研究所,南京 210042
羟基化多溴联苯醚(OH-PBDEs)在小鼠肝脏微粒体的体外代谢及对CYP450酶活性的影响
张易曦1,2,张圣虎2,*,吴永贵1,刘济宁2,石利利2
1. 贵州大学 资源与环境工程学院,贵阳 550025 2. 环境保护部南京环境科学研究所,南京 210042
羟基化多溴联苯醚(OH-PBDEs)是一类具有内分泌干扰效应的酚类化合物,生物毒性要高于母体多溴联苯醚(PBDEs),研究OH-PBDEs的体外代谢行为对于理解其在生物体内的富集转化具有重要意义。以小鼠肝脏微粒体作为研究对象,考察了3-OH-BDE-47、5-OH-BDE-47、6-OH-BDE-47和2’-OH-BDE-68在小鼠肝脏中的体外代谢,并分别研究了浓度为0.1、0.2、0.4、0.6、1.0 μmol·L-1条件下4种OH-PBDEs对细胞色素P450酶系中7-乙氧基香豆素-O-脱乙基酶(ECOD)、7-乙氧基异吩唑酮-O-脱乙基酶(EROD)和苯胺4-羟基化酶(ANH)活性的影响。结果表明,4种OH-PBDEs在小鼠肝脏微粒体中均能够快速代谢,代谢率分别为80% (3-OH-BDE-47)、42% (5-OH-BDE-47)、86% (6-OH-BDE-47)和63% (2’-OH-BDE-68)。实验所设OH-PBDEs各浓度对微粒体的ECOD活性无显著性抑制作用,但对EROD的活性均表现出相同的显著抑制作用;4种OH-PBDEs表现出不同的ANH活性影响,即3-OH-BDE-47对ANH活性具有抑制作用,5-OH-BDE-47具有诱导作用,而6-OH-BDE-47和2’-OH-BDE-68对ANH活性无显著性影响。
OH-PBDEs;肝微粒体;体外代谢;CYP450酶活
羟基化多溴联苯醚(OH-PBDEs)是一类具有内分泌干扰性质的酚类化合物[1],在环境介质[1-4]与生物样品[5-6]中普遍检出。由于OH-PBDEs与甲状腺激素(T4)具有相似的结构,可以与T4竞争结合在甲状腺转移蛋白(TTR)上[7-8],进而产生比母体多溴联苯醚(PBDEs)更大的生物毒性[9]。研究还发现OH-PBDEs同分异构体间结构的不同将导致毒性的差异,Canton等[10]研究表明,6-羟基-2,2’,4,4’-四溴联苯醚(6-OH-BDE-47)、4-OH-BDE-49和6-OH-BDE-99对CYP17的活性具有不同程度的抑制,进一步研究[11]发现羟基、溴原子和醚键三者之间的位置最终决定了对酶活性的影响。此外,OH-PBDEs对氧化磷酸化反应和神经系统都具有一定的干扰作用[3,7,12]。因此,考虑OH-PBDEs的生物毒性及一定的持久性,研究其在生物体内的代谢转化具有重要意义。
肝脏是外源性化合物在生物体内转化的重要器官,富含参与物质代谢的重要酶系细胞色素P450混合功能氧化酶(CYPs)。CYPs可通过单加氧作用使脂溶性外源物质失活,溶于水后排出细胞,再经尿液排出体外[13]。目前,关于OH-PBDEs的肝脏代谢研究还相对较少,赖永权等[12]研究了OH-PBDEs在大鼠肝微粒体中的体外代谢,结果表明OH-PBDEs可以进一步转化为溴酚和二羟基的多溴联苯醚,且不同的溴取代数量表现出较大差异的代谢率。外源化合物在被CYP450酶代谢转化的过程中,其本身也对某些CYP450酶产生诱导或抑制作用[14],从而影响外源性化合物的代谢转化。
本文用小鼠肝微粒体对普遍检出的4种OH-PBDEs进行体外代谢研究。通过探讨4种OH-PBDEs对CYP450酶系的ECOD(7-乙氧基香豆素-O-脱乙基酶)、EROD(7-乙氧基异吩唑酮-O-脱乙基酶)和ANH(胺4-羟基化酶)活性的影响,有助于为评价OH-PBDEs在生物体内的代谢行为提供实验依据。
1 实验部分(Experimental section)
1.1 仪器与试剂
高效液相色谱-串联质谱仪(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500,美国);AG-285电子天平(瑞士Mettle公司);2-16PK台式离心机(Sigma公司);Avanti J-26XPI系列高效离心机(美国Beckman Coulter公司);UVmini-1240紫外分光光度计(日本Kyoto公司);Tecan Infinite 200酶标仪(Tecan公司);振荡培养箱(INNOVA 43R,NBS公司)。
3-羟基-2,2’,4,4’-四溴联苯醚(3-OH-BDE-47)、5-羟基-2,2’,4,4’-四溴联苯醚(5-OH-BDE-47)、6-羟基-2,2’,4,4’-四溴联苯醚(6-OH-BDE-47)、2’-羟基-2,3’,4,5’-四溴联苯醚(2’-OH-BDE-68)、三(羟甲基)氨基甲烷、二硫苏糖醇(DTT)、乙二胺四乙酸二钠盐二水合物(Na2EDTA)、牛血清蛋白(BSA)、考马斯亮蓝G250、7-乙氧基试卤灵、试卤灵、甘氨酸、7-乙氧基香豆素、7-羟基香豆素、盐酸苯胺、4-氨基苯酚均购自百灵威公司;烟酰胺腺嘌呤二核苷酸磷酸(NADPH)购自美国Sigma Aldrich公司;甲醇和乙腈(色谱纯,德国Merck公司);氨水(色谱纯,国药集团药业股份有限公司);二甲基亚砜(DMSO,药检专用,国药集团化学试剂有限公司);氯化钾、苯酚(分析纯,国药集团化学试剂有限公司)。
匀浆缓冲液:20%甘油、0.15 mol·L-1KCl、1 mmol·L-1Na2EDTA、0.1 mmol·L-1DTT,以0.1 mol·L-1Tris-HCl(pH 7.4)配制。
重悬缓冲液:20%甘油、1 mmol·L-1Na2EDTA、0.1 mmol·L-1DTT,以0.1 mol·L-1Tris-HCl(pH 7.4)配制。
1.2 肝微粒体的制备
SPF级ICR小白鼠(体重18~22 g,6周)购买自上海杰思捷实验动物有限公司,采用颈椎脱臼法处死小鼠,迅速取出肝脏,在冰浴中用冰冷的0.9%生理盐水冲洗肝脏,用滤纸拭干后称重,将肝脏剪成小块,加入3倍重量的匀浆缓冲液(20%甘油、0.15 mol·L-1KCl、1 mmol·L-1Na2EDTA、0.1 mmol·L-1DTT,以0.1 mol·L-1Tris-HCl(pH 7.4)配制)在冰浴中进行匀浆;匀浆后的肝脏组织在4 ℃和9 000 g的条件下离心20 min,取上清液加入CaCl2,使最终浓度为8 mmol·L-1,混匀后在4 ℃和25 000 g的条件下离心15 min,弃去上清液,加入匀浆缓冲液再悬浮,于4 ℃和25 000 g的条件下离心15 min,弃去上清液,淡红色沉淀物即为肝脏微粒体[15-16]。每克肝脏加入0.5 mL重悬缓冲液(20%甘油、1 mmol·L-1Na2EDTA、0.1 mmol·L-1DTT,以0.1 mol·L-1Tris-HCl(pH 7.4)配制)制成匀浆,置于液氮中保存。用Bradford法测定微粒体的蛋白质含量[17],在595 nm下测定吸光值以确定蛋白质含量,以牛血清蛋白作为标准蛋白;蛋白浓度为7.069 mg·mL-1。
1.3 体外代谢实验
代谢反应总体积为2 mL,包含0.1 mol·L-1Tris-HCl、0.2 μmol·L-1OH-PBDE、0.3 mg·mL-1蛋白质,OH-PBDEs用DMSO助溶(反应体系中DMSO比例不大于1%),加入NADPH启动反应,37 ℃下分别振荡培养2 h,对照组为不含NADPH。
为优化反应条件,实验选用不同的NADPH使用量考察4种OH-PBDEs的代谢效率,代谢反应结束时加入2 mL冰乙腈,放入-20 ℃冰箱10 min后,取上清液过膜检测OH-PBDEs的含量,并根据代谢反应结束时OH-PBDEs的含量与初始含量比值计算代谢率。
样品测定采用高效液相色谱串联质谱(HPLC-MS/MS):质谱条件为电喷雾离子源(ESI-),多反应离子监测(MRM),负离子模式,离子源温度400 ℃,离子喷雾电压5 500 V,气帘气压力206 851.8 Pa,喷雾气压力241 327.1 Pa,辅助加热气压力275 802.4 Pa;色谱条件为ZORBAX Eclipse Plus C18色谱柱(150 mm×2.1 mm,3.5 μm),流动相0.02%(V/V)氨水(A)和乙腈(B),A与B的比例为3:7,柱温40 ℃,进样体积5 μL,外标法定量。具体参数见表1。
1.4 OH-PBDEs对微粒体活性影响
分别考察不同浓度的OH-PBDEs对小鼠肝脏微粒体CYP450相关亚系活性的影响。设定OH-PBDEs在代谢体系中浓度为0.1、0.2、0.4、0.6、1.0 μmol·L-1,于37 ℃条件下代谢30 min,终止反应后,测定ECOD、EROD和ANH的活性,对照组不添加OH-PBDEs。
1.5 酶活性测定
ECOD(7-乙氧基香豆素-O-脱乙基酶)活性测定方法[18]:反应体系包括0.1 mol·L-1Tris-HCl (pH 7.4)、1 mg·mL-1BSA、1 mmol·L-17-乙氧基香豆素、样品液,加入NADPH启动反应,37 ℃下反应10、20、40、60、120 min后,加入15%三氯乙酸终止反应,用2 mL三氯甲烷萃取产物,涡旋2 min后3 000 g离心5 min,取出1 mL下层有机相,加入5 mL 0.6 mol·L-1NaOH-甘氨酸缓冲液(pH 10.4),涡旋2 min后3 000 g离心5 min,上层水相用荧光酶标仪检测反应产物7-羟基香豆素的吸光度值,激发波长为370 nm,发射波长为450 nm,结果由产物7-羟基香豆素的生成量表示。
EROD (7-乙氧基异吩唑酮-O-脱乙基酶)活性测定方法[19]:反应体系包括0.1 mol·L-1Tris-HCl (pH 7.4)、1 mg·mL-1BSA、2 μmol·L-1乙氧基试卤灵、样品液,加入NADPH启动反应,37 ℃下分别10、20、30、40、60、120 min后,分别加入1 mL甲醇终止反应,5 000 r·min-1下离心15 min,离心后的上清液用荧光酶标仪检测反应产物试卤灵的吸光度值,激发波长为535 nm,发射波长为585 nm,结果由产物试卤灵的生成量表示。

表1 4种OH-PBDEs的质谱条件
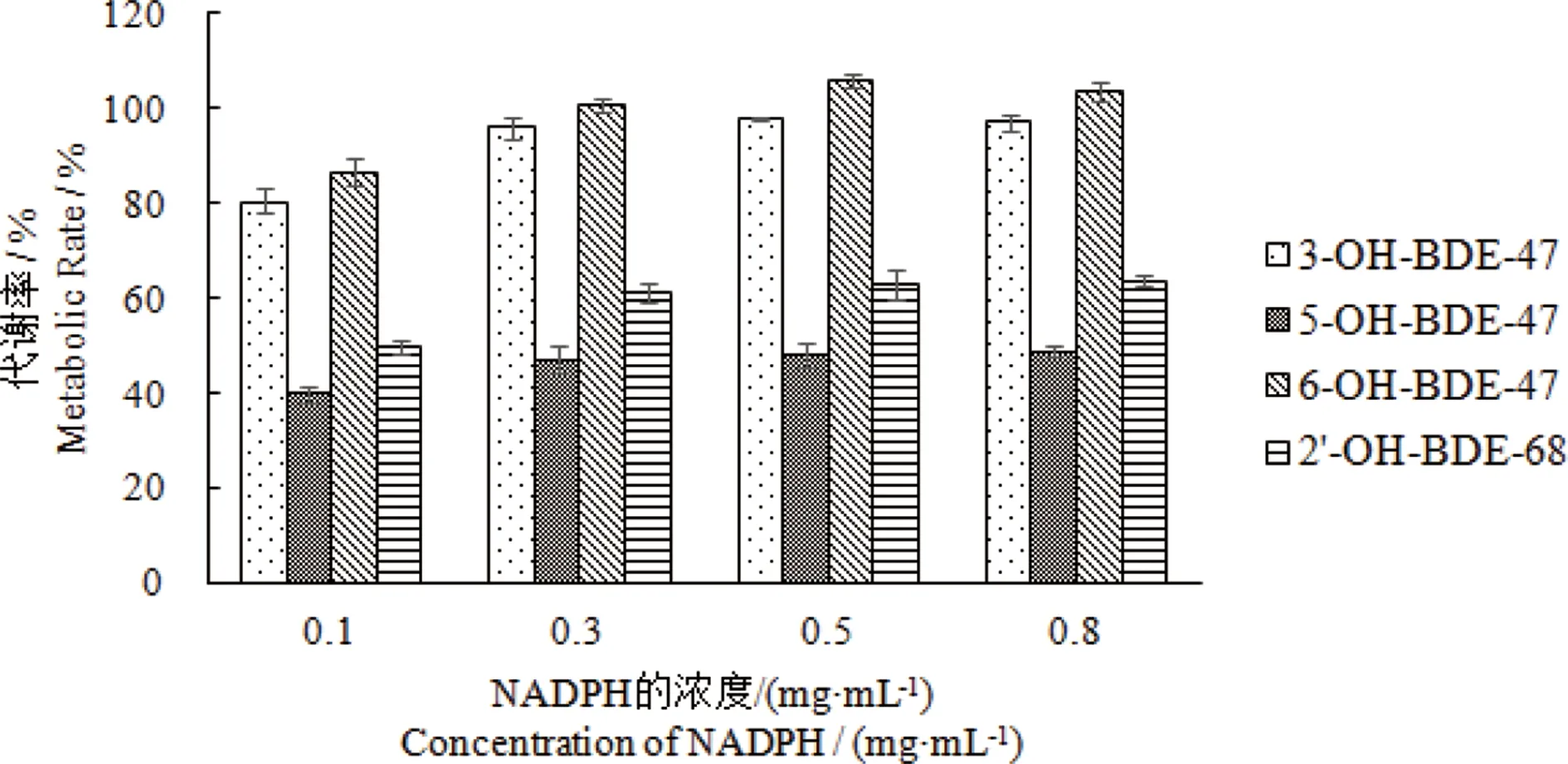
图1 不同NADPH浓度下小鼠肝微粒体代谢OH-PBDEsFig. 1 In vitro metabolism of OH-PBDEs by mice liver microsomes with different NADPH concentrations
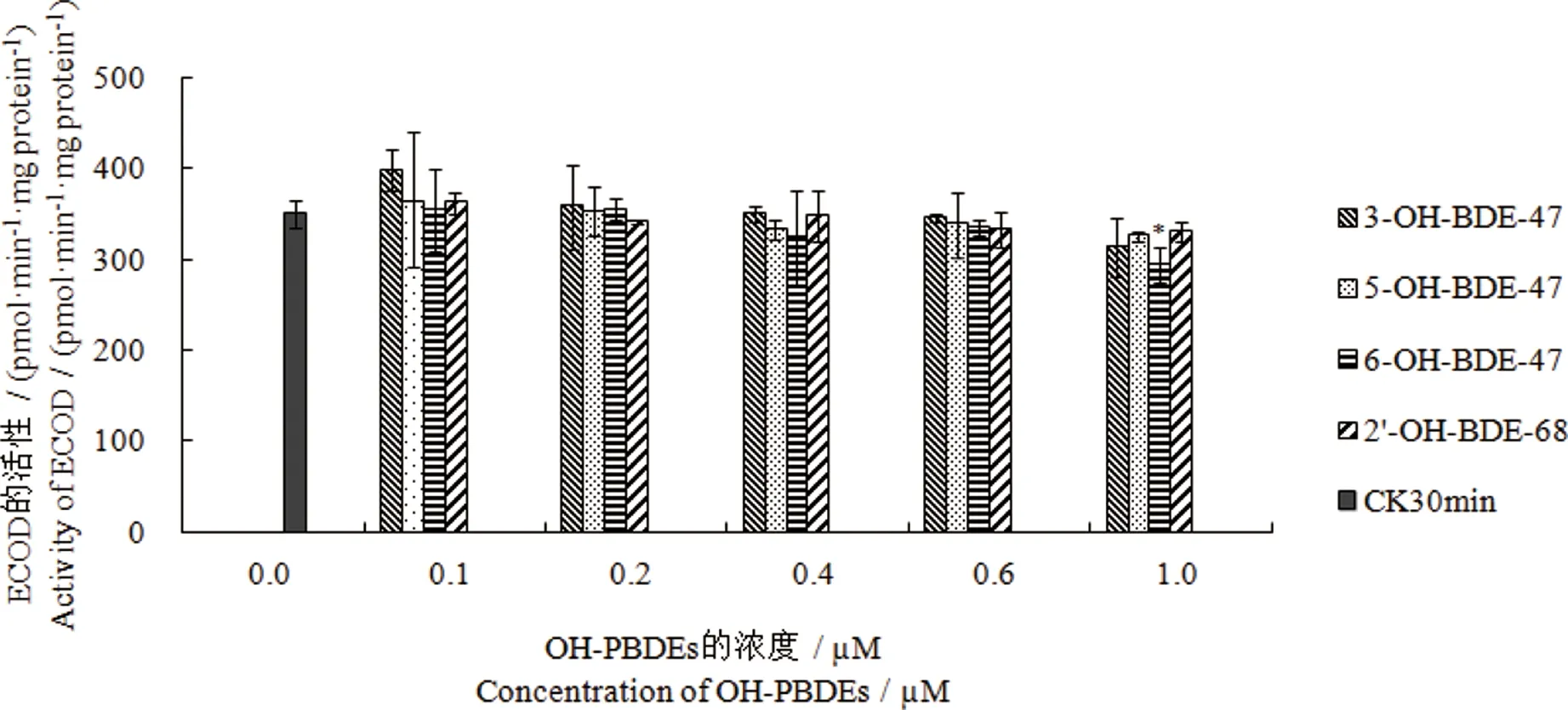
图2 不同浓度的OH-PBDEs与小鼠肝微粒体孵育30 min后对ECOD活性的影响 注:“CK30min”表示未添加OH-PBDEs时,孵育30 min后小鼠微粒体ECOD的活性;“*”表示处理组与对照组(CK30min)比较有显著性差异,P<0.05。Fig. 2 Effect of OH-PBDEs at different concentrations on the ECOD activity after incubation with mice liver microsomes for 30 min Note:“CK30min” indicate the ECOD activity in mice microsome after incubation for 30 minutes without the addition of OH-PBDEs. “*”indicate the significant difference between the treatment groups and the control group (CK30min), P<0.05.
ANH(苯胺4-羟基化酶)活性测定方法[20]:反应体系包括0.1 mol·L-1Tris-HCl (pH 7.4)、1 mg·mL-1BSA、1 mmol·L-1盐酸苯胺、样品液,加入NADPH启动反应,37 ℃下反应30 min。加入20%三氯乙酸终止反应,离心后取上清液加入1%苯酚(0.05 mol·L-1NaOH)和1 mol·L-1Na2CO3,混匀后室温放置30 min,用紫外可见分光光度计在630 nm处检测反应产物4-氨基苯酚的吸光度值,结果由产物4-氨基苯酚的生成量表示。
1.6 数据处理
酶活性测定的实验结果,用平均值±标准偏差(mean ± SD)表示。采用Windows SPSS 17.0和独立样本T检验,对各处理组与对照组数据进行差异显著性分析,P< 0.05为差异显著(*)。
2 结果(Results)
2.1 体外代谢NADPH量的优化
肝脏微粒体中富含丰富的CYPs同工酶,CYP450酶是异生物质代谢与解毒的重要酶系[21],需要NADPH提供电子启动代谢反应。为了保证代谢反应的进行,有必要优化NADPH的使用量。不同NADPH添加量下4种OH-PBDEs代谢率如图1所示。随着反应体系中NADPH添加量的增加,4种OH-PBDEs的代谢率随之增加,而当NADPH加入量大于0.3 mg·mL-1时,OH-PBDEs的代谢量基本保持不变,代谢率均能达到60%以上,因此选用0.3 mg·mL-1作为辅酶的添加量。
2.2 OH-PBDEs对CYP450酶系相关亚系酶活的影响
CYP450酶系中不同亚系对外源性化合物具有明显的特异性代谢,外源化合物在被CYP450酶代谢转化的过程中,其本身也对某些CYP450酶产生诱导或抑制作用[14]。ECOD、EROD、ANH是表征CYP450酶系主要代谢亚系活性的常用敏感酶学指标,其中,ECOD的活性常用于表征CYP1A1、CYP1A2、CYP2A6、CYP2B1、CYP2B6和CYP2E1等亚系的活性[22],EROD可以用于表征CYP1A亚系的活性[23],ANH可以用来表征CYP2E1的活性[24]。
2.2.1 不同浓度OH-PBDEs对ECOD活性的影响
在未添加OH-PBDEs时,微粒体孵育10 min后ECOD活性为(378.109±24.082) pmol·min-1·mg protein-1,孵育30 min后ECOD活性为(350.533±14.692) pmol·min-1·mg protein-1,ECOD活性无显著性变化(P>0.05),结果表明30 min孵育时间内微粒体ECOD活性基本保持稳定。不同OH-PBDEs浓度下ECOD活性结果如图2所示,随着反应体系中OH-PBDEs浓度的增加,各浓度组微粒体的ECOD活性均逐渐降低,但是与对照组相比不存在显著性差异(P>0.05)。由此可见,4种OH-PBDEs对于微粒体的ECOD活性影响不明显,不存在显著的抑制作用。
2.2.2 不同浓度OH-PBDEs对EROD活性的影响
在未添加OH-PBDEs时,微粒体孵育10 min后EROD的活性为(32.149±7.660) pmol·min-1·mg protein-1,孵育30 min后EROD活性为(27.435±2.830) pmol·min-1·mg protein-1,EROD活性无显著性变化(P>0.05),结果表明30 min孵育时间内微粒体EROD活性基本保持稳定。不同OH-PBDEs浓度下EROD活性结果如图3所示,各浓度组微粒体的ECOD活性与对照组相比具有显著的抑制作用(P<0.05),且随着反应体系中OH-PBDEs浓度的增加,各浓度组微粒体的EROD活性均逐渐降低,但是仅在添加浓度为0.1 μmol·L-1与1.0 μmol·L-1时具有显著性差异(P<0.05)。此外,在反应体系中添加相同浓度时,4种OH-PBDEs均表现出相同的抑制能力,即5-OH-BDE-47>3-OH-BDE-47>2’-OH-BDE-68>6-OH-BDE-47。
2.2.3 不同浓度OH-PBDEs对ANH活性的影响
在未添加OH-PBDEs时,微粒体孵育10 min后ANH的活性为(89.544±19.021) pmol·min-1·mg protein-1,孵育30 min后ANH活性为(27.422±3.511) pmol·min-1·mg protein-1,活性降低了60%以上(P<0.05)。不同OH-PBDEs浓度下ANH活性结果如图4所示,随着反应体系中OH-PBDEs浓度的增加,4种OH-PBDEs表现出不同的活性影响。3-OH-BDE-47在实验设置低浓度时具有显著抑制作用(P<0.05),但是随着添加浓度的不断增加,对微粒体中ANH活性的抑制作用逐渐降低;5-OH-BDE-47在实验设置浓度下具有诱导作用,且随着添加浓度的不断增加,对微粒体中ANH活性的诱导作用逐渐增加,在实验设置高浓度时具有显著抑制作用(P<0.05);6-OH-BDE-47和2’-OH-BDE-68对ANH活性影响不大。
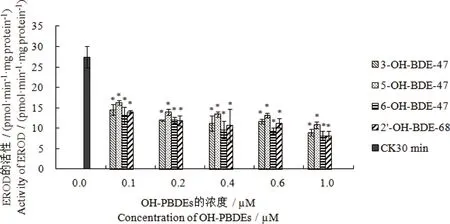
图3 不同浓度的OH-PBDEs与小鼠肝微粒体孵育30 min后对EROD活性的影响注:“CK30min”表示未添加OH-PBDEs时,孵育30 min后小鼠微粒体EROD的活性;“*”表示处理组与对照组(CK30min)比较有显著性差异,P<0.05。 Fig. 3 Effect of OH-PBDEs at different concentrations on the EROD activity after incubation with mice liver microsome for 30 min Note: “CK30min” indicate the EROD activity in mice microsome after incubation for 30 minutes without the addition of OH-PBDEs. “*”indicate the significant difference between the treatment groups and the control group (CK30min), P<0.05.
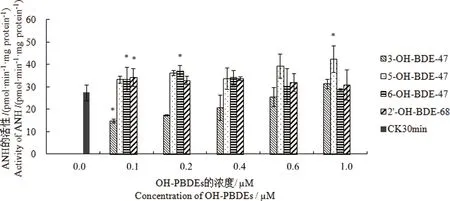
图4 不同浓度的OH-PBDEs与小鼠肝微粒体孵育30 min后对ANH活性的影响 注:“CK30min”表示未添加OH-PBDEs时,孵育30 min后小鼠微粒体ANH的活性;“*”表示处理组与对照组(CK30min)比较有显著性差异,P<0.05。Fig. 4 Effect of OH-PBDEs at different concentrations on the ANH activity after incubation with mice liver microsome for 30 min Note: “CK30min” indicate the ANH activity in mice microsome after incubation for 30 minutes without the addition of OH-PBDEs. “*”indicate the significant difference between the treatment groups and the control group (CK30min), P<0.05.
3 讨论 (Discussion)
研究表明,肝脏不仅是外源性化合物发挥毒性作用的主要靶器官,同时也是生物机体进行代谢转化作用的主要器官[25]。本研究结果发现,相对于母体PBDEs而言[26],4种OH-PBDEs更容易被肝脏微粒体所代谢,2 h后的代谢率分别为80% (3-OH-BDE-47)、42% (5-OH-BDE-47)、86% (6-OH-BDE-47)和63% (2’-OH-BDE-68)。Lai等[27]使用了大鼠肝脏微粒体代谢OH-PBDEs,孵育20 min后3’-OH-BDE-7、6’-OH-BDE-17、4’-OH-BDE-17和2’-OH-BDE-28代谢率就可达80%以上,6-OH-BDE-47、4’-OH-BDE-49、2’-OH-BDE-66和2’-OH-BDE-68孵育80 min后代谢率也可达到80%左右。这在一定程度上说明羟基官能团的引入提高了母体PBDEs的生物可用性,另一方面羟基、溴原子和醚键三者之间的位置也影响到OH-PBDEs的生物代谢,这与其对CYP450酶亚系酶活性的影响一致[18]。
微粒体氧化酶系存在于细胞的光面内质网上,其中细胞色素P450(CYPs)是重要的一族氧化酶系。一些CYP亚型会在特定的外源物质存在时诱导后才会表达[28],根据CYPs基因编码的蛋白质可分为构成型CYP亚型和诱导型CYP亚型[29],一般认为诱导型CYP亚型参与了外源性化合物的生物转化[30]。同时外源性化合物的代谢作用也影响CYPs的表达水平及诱导或抑制酶的活性。
在哺乳动物体内,ECOD可以被CYP1A、2A、3A等多种CYP450亚型酶系催化[31],因此ECOD活性一般可以作为表征CYP450总活性的指标。图2结果表明,随着4种OH-PBDEs浓度的增加,微粒体的ECOD活性呈降低趋势,但是数理统计结果不存在显著性差异。目前,对于OH-PBDEs对CYP450酶中各亚系的活性影响的研究报道较少,有文献报道了与OH-PBDEs相似的物质(2,4,4’-三氯-2’-羟基联苯醚)能在生物体内诱导ECOD的活性。Hanioka等[32]通过给大鼠喂食不同剂量的2,4,4’-三氯-2’-羟基联苯醚,发现其可显著诱导肝脏微粒体ECOD活性。虽然本实验中4种OH-PBDEs在体外对微粒体ECOD活性的抑制作用不大,且与2,4,4’-三氯-2’-羟基联苯醚在生物体内对ECOD活性的诱导作用不同,但在一定程度上仍然可以说明CYP1A、CYP2A等几种CYP450亚型很有可能参与到了4种OH-PBDEs的代谢过程,但具体参与亚型仍然需要进一步研究。
EROD酶属于细胞色素P4501A族(CYP1A),可以代谢许多具有共平面结构的芳香性外源化合物(如多环芳烃PAHs、多氯联苯PCBs),这些特异性底物可以明显诱导EROD活性,因此,常被作为指示环境污染状况的敏感生物标志物[33]。图3结果表明,4种OH-PBDEs不能诱导EROD活性,反而显著抑制微粒体EROD的活性。这在母体BDE-47对EROD活性影响的研究中也得到类似结果,Olsvik等[34]研究表明BDE-47暴露可以显著降低大西洋鳕幼鱼肝脏CYP1A基因的表达水平[32];周科等[33]研究发现BDE-47不能诱导铜锈环棱螺肝脏EROD活性,且高剂量还能导致EROD活性显著降低。吴若函等[26]和沈梦楠[16]发现母体BDE-47对EROD活性的抑制作用可能是通过抑制CYP1A亚系的催化活性产生的,并已经通过抑制剂实验证明了CYP1A是微粒体代谢BDE-47的关键酶系。本研究所显示的EROD活性显著降低也很大可能是4种OH-PBDEs与EROD的反应产物(乙氧基试卤灵)产生了竞争性结合,抑制了CYP1A亚系对酶活底物的代谢,从而表现出EROD活性降低。据此可以认为,4种OH-PBDEs可能并不通过激活芳香烃受体来诱导EROD活性,这种竞争性抑制作用也说明4种OH-PBDEs可能也是CYP1A亚系的反应产物。
ANH可以用来表征CYP2E1的活性,而肝脏是其主要表达器官[25],目前研究发现CYP2E1参与脂类物质氧化,它在肝脏中的过度表达可以导致脂质过氧化损伤[35],可能对CYP2E1酶蛋白有直接的抑制作用,进而造成CYP2E1酶活性的下调,这可能也是本实验中微粒体ANH活性在孵育30 min后降低60%以上的原因之一,吴若函等[26]研究中也出现类似结果。图4结果表明,随着反应体系中OH-PBDEs浓度的增加,4种OH-PBDEs表现出不同的ANH活性影响,由于CYP2E1的活性主要是由转录后蛋白的稳定性来调节[24,36],CYP2E1与底物结合后会出现构象改变[37],4种OH-PBDEs结构的差异将导致CYP2E1酶蛋白结构稳定性的不同,这可能就是4种OH-PBDEs表现出不同活性的原因之一。
综上所述,本文通过研究4种OH-PBDEs在小鼠肝微粒体中的代谢及其对表征微粒体中细胞色素P450酶主要亚系酶活的影响,结果表明4种OH-PBDEs均能够在小鼠肝微粒体中快速代谢,代谢率分别为80% (3-OH-BDE-47)、42% (5-OH-BDE-47)、86% (6-OH-BDE-47)和63% (2’-OH-BDE-68);实验中各个浓度(0.1、0.2、0.4、0.6、1 μmol·L-1)对ECOD的活性影响不大,但是均能显著抑制EROD活性,此外,4种OH-PBDEs表现出不同的ANH活性影响,即3-OH-BDE-47对ANH活性具有抑制作用,5-OH-BDE-47具有诱导作用,而6-OH-BDE-47和2’-OH-BDE-68对ANH活性无显著性影响。因此,对于确定哪种CYP450酶系的亚型在4种OH-PBDEs的代谢中起作用,还需要进一步研究。
[1] Zhao H X, Zhang G L, Liu S S, et al. Bioaccumulation and elimination kinetics of hydroxylated polybrominateddiphenyl ethers (2'-OH-BDE 68 and 4-OH-BDE 90) and their distribution pattern in common carp (Cyprinuscarpio) [J]. Journal of Hazardous Materials, 2014, 274: 16-23
[2] Wiseman S B, Wan Y, Chang H, et al. Polybrominateddiphenyl ethers and their hydroxylated/methoxylatedanalogs: Environmental sources, metabolic relationships, and relative toxicities [J]. Marine Pollution Bulletin, 2011, 63: 179-188
[3] Sun J T, Liu J Y, Liu Q, et al. Hydroxylated polybrominateddiphenyl ethers (OH-PBDEs) in biosolids from municipal wastewater treatment plants in China [J]. Chemosphere, 2013, 90: 2388-2395
[4] Wang S, Zhang S Z, Huang H L, et al. Characterization of polybrominated diphenyl ethers (PBDEs) and hydroxylated and methoxylated PBDEs in soils and plants from an e-waste area, China [J]. Environmental Pollution, 2014, 184: 405-413
[5] Liu X T, Jiao Y, Lin C Y, et al. PBDEs, hydroxylated PBDEs and methoxylated PBDEs in bivalves from Beijing markets [J]. Chemosphere, 2014, 110: 97-103
[6] Dahlberg A K, Norrgran J, Hovander L, et al. Recovery discrepancies of OH-PBDEs and polybromophenols in human plasma and cat serum versus herring and long-tailed duck plasma [J]. Chemosphere, 2014, 94: 97-103
[7] Rydén A, Nestor G, Jakobsson K, et al. Synthesis and tentative identification of novel polybrominated diphenyl ether metabolites in human blood [J]. Chemosphere, 2012, 88: 1227-1234
[8] Hallgren S, Darnerud P O. Polybrominated diphenyl ethers (PBDEs), polychlorinated biphenyls (PCBs) and chlorinated paraffins (CPs) in rats - Testing interactions and mechanisms for thyroid hormone effects [J]. Toxicology, 2002, 117: 227-243
[9] 施玉泉, 闻胜, 李敬光, 等. 固相萃取-超高效液相色谱-电喷雾离子源-串联质谱法测定人血中羟基化多溴联苯醚[J]. 中国食品卫生杂志, 2012, 4(24): 317-321
Shen Y Q, Wen S, Li J G, et al. Determination of hydroxylated polybrominated diphenyl ethers in human blood by using solid-phase extraction and ultra performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Food Hygiene, 2012, 4(24): 317-321 (in Chinese)
[10] Cantón R F, Sanderson T, Nijmeijer S, et al. In vitro effects of brominated flame retardants and metabolites on CYP17 catalytic activity: A novel mechanism of action? [J]. Toxicology and Applied Pharmacology, 2006, 216: 274-281
[11] Cantón R F, Scholten D E, Marsh G, et al. Inhibition of human placental aromatase activity by hydroxylated polybrominated diphenyl ethers (OH-PBDEs) [J]. Toxicology and Applied Pharmacology, 2008, 227: 68-75
[12] 赖永权, 陈学国, 蔡宗苇. 羟基多溴联苯醚(3'-OH-BDE-7)的大鼠体外肝代谢研究[J]. 环境化学, 2011, 30(1): 346-350
Lai Y Q, Chen X G, Cai Z W. In vitro metabolism study of 3’-OH-BDE-7 in rat liver S9 fraction [J]. Environmental Chemistry, 2011, 30(1): 346-350 (in Chinese)
[13] 任彭, 刘兆平. 细胞色素P450研究概况及其应用[J]. 食品与药品, 2006, 8(10A): 8-13
Ren P, Liu Z P. The research and application status of cytochrome P450 [J]. Food and Drug, 2006, 8(10A): 8-13 (in Chinese)
[14] 鞠美华. 细胞色素P450同工酶在外源物代谢中的作用[J]. 国外医学药学分册, 1998, 25(4): 218-224
Ju M H. The role of cytochrome P450 in xenobiotic metabolism [J]. Foreign Medical Sciences Section on Pharmacy, 1998, 25(4): 218-224 (in Chinese)
[15] 肖功华. 用钙沉淀法制备微粒体[J]. 国外医学卫生学分册, 1981, 5: 273-275
Xiao G H. Preparation of microsomal by calcium precipitation method [J]. Foreign Medical Sciences Section Hygiene, 1981, 5: 273-275 (in Chinese)
[16] 沈梦楠. 典型溴代阻燃剂在鲫鱼体内与体外代谢研究[D]. 南京: 南京大学, 2012
Shen M N. Metabolism of typical brominated flame retardants by crucian carp in vivo and in vitro [D]. Nanjing: Nanjing University, 2012 (in Chinese)
[17] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248-254
[18] Greenlee W F, Poland A. An improved assay of 7-ethoxycoumarin-O-deethylase activity: Induction of hepatic enzyme activity in C57BL/6J and DBA/2J mice by phenobarbital, 3-methylcholanthrene and 2,3,7,8-tetrachlorodibenzo-p-dioxin [J]. Journal of Pharmacology and Experimental Therapeutics, 1978, 205(3): 596-605
[19] Brunström B. Mono-ortho-chlorinated chlorobiphenyls: Toxicity and induction of 7-ethoxyresorufin O-deethylase (EROD) activity in chick embryos [J]. Archives of Toxicology, 1990, 64: 188-192
[20] Schenkman J B, Remmer H, Estabrook R W. Spectral studies of drug interaction with hepatic microsomal cytochrome [J]. Molecular Pharmacology, 1967, 3: 113-123
[21] 李丹, 韩永龙, 余涛, 等. 体外肝代谢模型的优缺点及其应用[J].中国临床药理学与治疗学, 2011, 16(6): 688-694
Li D, Han Y L, Yu T, et al. Advantages, disadvantages and applications of in vitro hepatic metabolic models [J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2011, 16(6): 688-694 (in Chinese)
[22] Langsch A, Bader A. Longterm stability of phase I and phase II enzymes of porcine liver cells in flat membrane bioreactors [J]. Biotechnology and Bioengineering, 2001, 76(2): 115-125
[23] Oliva M, Gravato C, Guilhermino L, et al. EROD activity and cytochrome P4501A induction in liver and gills of Senegal sole Solea senegalensis from a polluted Huelva Estuary (SW Spain) [J]. Comparative Biochemistry and Physiology, Part C, 2014, 116: 134-144
[24] 许钟, 谢斌, 吴小翎. CYP2E1在肝细胞癌中的作用研究进展[J]. 国际消化病杂志, 2009, 29(4): 271-285
Xu Z, Xie B, Wu X L. The role of CYP2E1 in hepatocellular carcinoma is reviewed [J]. International Journal of Digestive Diseases, 2009, 29(4): 271-285 (in Chinese)
[25] Cheung C, Yu A M, Ward A M, et al. The cyp2e1-humanized transgenic mouse: Role of cyp2e1 in acetaminophen hepatotoxicity [J]. Drug Metabolism and Disposition, 2005, 33(3): 449-457
[26] 吴若函, 沈梦楠, 张圣虎, 等. 猪肝微粒体体外代谢2,2’,4,4’-四溴联苯醚[J]. 环境科学与技术, 2012, 35(11): 50-55
Wu R H, Shen M N, Zhang S H, et al. In vitro metabolism of 2,2’,4,4’-tetrabromo diphenyl ether by pig liver microsomes [J]. Environmental Science & Technology, 2012, 35(11): 50-55 (in Chinese)
[27] Lai Y Q, Cai Z W. In vitro metabolism of hydroxylatedpolybrominated diphenyl ethers and their inhibitory effects on 17 β-estradiol metabolism in rat liver microsomes [J]. Environmental Science and Pollution Research, 2012, 19: 3219-3227
[28] 李栓美. CYP450 3A及其等位基因在体外药物代谢和药物相互作用中的对比研究[D]. 西安: 西北大学, 2009
Li S M. Comparative study of drug metabolisms and drug: Drug interactions of human cytochrome P450 3A and its alleles in vitro [D]. Xi’an: Northwestern University, 2009 (in Chinese)
[29] 贾娴. 恩诺沙星在异育银螂肝微粒体中代谢及对p450主要亚酶影响的初步研究[D]. 成都: 四川农业大学, 2009
Jia X. Preliminary studies on metabolism and impact on main P450 isoenzymes of enrofloxacin in Carasius auratus gibelio liver microsome [D]. Chengdu: Sichuan Agricultural University, 2009 (in Chinese)
[30] Stegcman J J, Woodin B R, Smolowilz R M. Structure, function and regulation of cytochrome P-450 forms in fish [J]. Biochemical Society transactions, 1990, 18(l): 19-21
[31] Yamazaki H, Inoue K, Mimura M, et al. 7-ethoxycoumarin O-deethylation catalyzed by cytochromes P450 1A2 and 2E1 in human liver microsomes [J]. Biochemical Pharmacology, 1996, 51(3): 313-319
[32] Hanioka N, Jinno H, Nishimura T, et al. Effect of 2,4,4’-trichloro -2-hydroxydiphenyl ether on cytochrome P450 enzymes in the rat liver [J]. Chemosphere, 1997, 34(4): 719-730
[33] 周科, 马陶武, 朱程, 等. 2,2’, 4,4’-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 2010, 30(8): 1666-1673
Zhou K, Ma T W, Zhu C, et al. Effects of 2,2’,4,4’-tetrabromo diphenyl ether (BDE-47)-contaminated sediments on SOD, CAT and EROD activities in the hepatopancreas of Bellamya aeruginosa [J]. Acta Scientiae Circumstantiae, 2010, 30(8): 1666-1673 (in Chinese)
[34] Olsvik P A, Lie K K, Sturve J, et al. Transcriptional effects of nonylphenol, bisphenol A and PBDE-47 in liver of juvenile Atlantic cod (Gadus morhua) [J]. Chemosphere, 2009, 75(3): 360-367
[35] Carolina V O A, Julio M, Rafael C C, et al. CYP2E1 induction leads to oxidative stress and cytotoxicity in glutathione-depleted cerebellar granule neurons [J]. Toxicology in Vitro, 2014, 28: 1206-1214
[36] Novak R F, Woodcroft K J. The alcohol-inducible form of cytochrome P450 (CYP2E1): Role in toxicology and regulation of expression [J]. Archives of Pharmacal Research, 2000, 23(4): 267-282
[37] 刘晨晖, 乐江. 细胞色素P450 CYP2E1酶构型特征及其表达调控机制的研究进展[J]. 中国药理学与毒理学杂志, 2010, 24(2): 155-160
Liu C H, Le J. Progress of research on characteristics of cytochrome P-450 CYP2E1 in protein structure and regulation mechanisms [J]. Chinese Journal of Pharmacology and Toxicology, 2010, 24(2): 155-160 (in Chinese)
◆
InvitroMetabolism and Effects of Hydroxylation Polybrominated Diphenyl Ether (OH-PBDEs) within Mice Hepatic CYP450 Enzymes
Zhang Yixi1,2, Zhang Shenghu2,*, Wu Yonggui1, Liu Jining2, Shi Lili2
1. College of Resources and Environmental Engineering, Guizhou University, Guiyang 550025, China 2. Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China
Received 14 December 2015 accepted 4 March 2016
Hydroxylation polybrominateddiphenyl ethers (OH-PBDEs) are a class of phenolic compounds that have been found to be endocrine disruption, and their biological toxicity is higher than the polybrominateddiphenyl ethers (PBDEs). It is of great significance to investigate metabolic behavior of OH-PBDEs in vitro for a better understanding of their enrichment and transformation in vivo. The in vitro metabolism of 3-OH-BDE-47, 5-OH-BDE-47, 6-OH-BDE-47 and 2’-OH-BDE-68 was investigated using mouse liver microsome. In addation,the effects of four OH-PBDEs (0.1, 0.2, 0.4, 0.6 and 1 μmol·L-1) on activities of 7-ethoxycoumarin O-deethylase (ECOD), 7-ethoxyresorufin O-deethylase (EROD) and aniline phydroxylase (ANH) were also evaluated. The results showed that four OH-PBDEs can be metabolized rapidly with the rate of 80% (3-OH-BDE-47)、42% (5-OH-BDE-47)、86% (6-OH-BDE-47) and 63% (2’-OH-BDE-68), respectively. Under these experimental conditions, four OH-PBDEs had no significant effect on ECOD activity, but all OH-PBDEs had inhibitory effect on EROD activity. In addition, four OH-PBDEs showed different effect on ANH activity. Specifically, 3-OH-BDE-47 had inhibitory effect on ANH activity, 5-OH-BDE-47 had induced effect on ANH activity, and 6-OH-BDE-47 and 2’-OH-BDE-68 had no significant effect, respectively.
OH-PBDEs; liver microsome; in vitro metabolism; CYP450 enzyme activity
10.7524/AJE.1673-5897.20151125004
国家自然科学基金(21407055);江苏省自然科学基金(BK20140115)
张易曦(1989),女,硕士研究生,研究方向为环境毒理,E-mail: zhangyixi1021@icloud.com
*通讯作者(Corresponding author), E-mail: zsh@nies.org
2015-12-14 录用日期:2016-03-04
1673-5897(2016)2-693-09
X171.5
A
简介:张圣虎(1984-),男,博士,助理研究员,主要从事环境污染物暴露评估和风险评价研究。
张易曦, 张圣虎, 吴永贵, 等. 羟基化多溴联苯醚(OH-PBDEs)在小鼠肝脏微粒体的体外代谢及对CYP450酶活性的影响[J]. 生态毒理学报,2016, 11(2): 693-701
Zhang Y X, Zhang S H, Wu Y G, et al. In vitro metabolism and effects of hydroxylation polybrominated diphenyl ether (OH-PBDEs) within mice hepatic CYP450 enzymes [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 693-701 (in Chinese)

