环境孕激素和糖皮质激素的生态毒理效应:进展与展望
赵砚彬,胡建英
北京大学城市与环境学院,北京 100871
环境孕激素和糖皮质激素的生态毒理效应:进展与展望
赵砚彬,胡建英
北京大学城市与环境学院,北京 100871
孕激素和糖皮质激素的环境行为和生态毒理效应是即环境雌激素和雄激素之后近年来国内外环境激素研究的又一热点课题。由于广泛应用于临床医疗等,这两类物质通过污水处理厂不完全处理和人类农业或畜牧业活动的直接排放从而进入水体环境,进而对生态系统和人类健康产生潜在危害。环境监测数据显示,在地表水中,多种物质存在ng·L-1浓度水平;在污水处理厂进出水中,浓度水平更高,甚至达到数百ng·L-1。孕激素和糖皮质激素类物质主要通过激素受体途径发挥毒性效应,如孕激素受体(PR), 糖皮质激素受体(GR)和盐皮质激素受体(MR)。对水生脊椎动物的内分泌系统干扰作用是目前研究的焦点。这两类物质能够影响脑垂体性腺轴转录水平和相应激素合成,影响性腺发育以及导致繁殖能力损伤。这一毒性效应甚至发生在环境浓度水平之下。除此之外,随着组学技术的广泛应用,更多的潜在毒性终点不断被发掘,如对昼夜节律系统和免疫应答的干扰作用。这些研究引导着对环境孕激素和糖皮质激素生态毒理学效应更加深入的理解。
孕激素;糖皮质激素;环境行为;生态毒理效应;内分泌干扰;昼夜节律;免疫反应
内分泌干扰物在较低浓度下能够干扰生物体内源激素的合成、释放、转运、结合、或代谢, 从而影响机体的内稳态环境、干扰生物体发育以及繁殖过程,因此其环境污染问题已经成为联合国需要全球共同应对的环境主题[1]。内分泌干扰物质种类繁多,其中天然和人工合成的五大类类固醇激素类物质是被认为活性最强,因此最为关注的[2-3]。污水处理厂的不完全处理和人类农业或畜牧业活动的直接排放都会导致水环境的污染,进而危及生态系统和人类健康[2-4]。
环境雌激素和雄激素类物质的环境行为和生态毒理学效应近年来已有广泛报道[5-7]。与此相比,对环境孕激素和糖皮质激素的生态毒理学的研究则相对较少。天然和人工合成的孕激素类物质如孕酮和炔诺酮等广泛用于人类和动物医疗,包括人类避孕、辅助生殖、癌症治疗以及动物繁殖育种控制和生长调节[8];而糖皮质激素如氢化可的松和倍他米松主要用于抗炎反应,免疫抑制和抗休克等[9]。由于这两类物质作为医药品的广泛使用,环境介质中已经检出这些物质,其浓度处于ng·L-1水平[10-12]。有研究已经报道环境孕激素能够对水生生物尤其是鱼类的内分泌系统造成损伤,如改变脑-垂体-性腺轴转录水平,影响性腺发育,改变体内激素浓度和降低繁殖能力[10-11]。目前对糖皮质激素的毒性研究虽然较少,有文献也表明其能够影响鱼类体内的激素浓度,造成精巢发育迟缓,精子质量下降以及繁殖损伤[13]。由于对环境孕激素和糖皮质激素的关注尚处于起步阶段,目前还缺少有关环境行为和生态毒理效应的系统性研究。
本文在简述当前孕激素和糖皮质激素的环境来源及其水环境污染现状的基础上,从转录水平,组织学,生理学和繁殖能力损伤角度系统综述了这两类激素对水生生物内分泌系统的干扰作用。并对近年来通过组学(Omics)等报道的孕激素和糖皮质激素新毒性终点和潜在的研究方向进行了归纳总结和展望,期望能对环境孕激素和糖皮质激素类物质的生态毒理学效应研究发展和环境风险评价提供一定的参考。
1 环境污染现状(Sources and concentrations in the environment)
1.1 环境来源
由于目前的城市污水处理工艺并没有将环境激素类物质作为主要去除目标,和雌雄激素类物质类似,仍有相当部分的孕激素和糖皮质激素未能去除而进入水环境[2-3]。畜牧养殖场的养殖废水直接排放是导致水环境中孕激素和糖皮质激素残留的另一重要途径,尤其是在发展中国家。中国国家环保总局在全国23个省市进行的调查发现,全国90%的规模化畜禽养殖场未经过环境影响评价,60%的养殖场缺乏必要的污染防治措施[14]。即使在大型畜禽养殖场中,也有大约20%~30%的养殖场废水是直接排向地表水体的[15]。考虑到孕激素广泛用于动物繁殖育种控制和作为生长促进剂,糖皮质激素类物质则用于抗炎反应,免疫抑制等疾病治疗过程,养殖场废水的直接排放必然会成为一个重要的污染源。近年来相关报道显示养殖场废水中往往含有超高浓度水平的激素类物质,如国内部分地区的养殖场废水中分别含有高达14.9 μg·L-1和180 ng·L-1的孕激素和糖皮质激素类物质[16]。总体而言,人工合成的孕激素和糖皮质激素类物质的使用量要远高于合成雌激素和雄激素类物质[11]。目前国内关于孕激素和糖皮质激素类物质使用量和排放并没有详细的报道,但是瑞士相关数据显示,孕激素物质使用量每年达到700 kg左右,其中孕酮(P4)为495 kg,其他合成类孕激素为213 kg左右[11]。英国和法国的每年孕激素物质消费量分别高达到1 700 kg和13 000 kg[17-18]。另外,英国2006年糖皮质激素的消费量也高达4 400 kg,几乎是雌激素(490 kg)和雄激素类物质(310 kg)消费量的10倍之多[18]。
1.2 污水处理厂浓度水平
城市污水处理厂(STP)承接着绝大部分市政生活污水的处理,因此在其进水中往往会检测出高浓度的孕激素和糖皮质激素类物质的残留。目前已经有多个文献报道了其在STP进水中的浓度水平,范围涵盖北美、欧洲和亚太多个国家和地区。2007年,在加拿大4个STP进水样品的激素浓度调查中,Fernandez等[19]发现孕激素炔诺酮(NET)和甲基炔诺酮(NOR)存在非常高的检出率,并且浓度分别高达224 ng·L-1和48 ng·L-1。Pauwels等[20]在比利时STP进水中广泛检出孕激素P4,浓度水平在5~33 ng·L-1左右,并显示出季节性变化的规律。我国城市污水处理厂进水中对7种孕激素类物质进行检测,发现孕激素P4浓度水平最高,达到33 ng·L-1。其次是17α-羟基孕酮(17-OHP),浓度水平达到14 ng·L-1[21]。在我国广东地区多个STP进水中,同样检测到多种孕激素类物质,其中以P4和炔諾酮(NGT)为主,浓度水平在5~59 ng·L-1之间[22-23]。
和孕激素类似,环境糖皮质激素类物质检测也显示出相近浓度水平的STP进水残留。Chang等[25]于2007年首次在环境中检出了多种糖皮质激素类物质。在对北京7处污水处理厂6种糖皮质激素类物质的监测中发现绝大数水样中均存在多种糖皮质激素残留。其中CRL的浓度水平最高,达到120 ng·L-1,其次是CRN,达到86 ng·L-1[25]。之后Piram等[24]在2008年在法国里昂STP进水中检出了8种糖皮质激素类物质,多数物质浓度范围在十数个ng·L-1左右,其中可的松(CRN)和氢化可的松(CRL)分别高达174 ng·L-1和53 ng·L-1。Fan等[26]于2011年对北京一污水处理厂7种糖皮质激素类物质进行质量平衡计算,研究物质在城市污水处理厂的环境行为。发现CRL和CRN的浓度水平最高,平均浓度达到 15~22 ng·L-1。在我国广东地区多个STP进水检测中也同样检出多种糖皮质激素类物质,其中以CRN、CRL和地塞米松(DEX)为主,CRN和CRL浓度水平分别达到50 ng·L-1和29 ng·L-1[22]。总体来说,STP进水中一般存在着数个至数百个ng·L-1浓度水平的孕激素和糖皮质激素类物质残留。
污水处理工艺一般能有效去除这两类激素,去除率达到73%~99%左右,特别是天然糖皮质激素较容易被城市污水处理厂中的生物处理单元去除[26],因此其在STP出水中浓度一般处于较低水平。Vulliet等[27]分析了2006年4~6月法国里昂STP的多个出水样品,其中P4、NET和左炔诺孕酮(LNG)的浓度水平稳定在十数个ng·L-1范围。Chang等[3]在北京STP出水中,共检出了6种孕激素类物质,浓度水平多在数个ng·L-1以下。Fan等[26]在2011年同样对北京STP出水的激素检测中观察到了类似浓度水平,其中P4最高浓度为5.0 ng·L-1。同样,广东STP出水中孕激素类物质浓度水平和北京接近,在数个ng·L-1左右[22]。和孕激素环境行为类似,STP出水检出的环境糖皮质激素类物质也大体稳定在数个ng·L-1浓度水平。如在北京STP出水中,7种糖皮质激素类物质浓度水平多小于数个ng·L-1,其中浓度水平最高的CRL和CRN,浓度分别约为3.2 ng·L-1和2.6 ng·L-1[3,26]。尽管如此,STP出水中检出高浓度的孕激素和糖皮质激素类物质残留也有过多次报道,如Fernandez等[19]在加拿大STP出水中检测到孕激素NOR最高浓度高达126 ng·L-1。Al-Odaini等[28]在马来西亚STP出水中检测到NET浓度高达188 ng·L-1。Piram等[24]对法国一STP出水检测显示,8种检出的糖皮质激素类物质中CRN浓度高达229 ng·L-1,这是目前报道中浓度最高的数据。
1.3 地表水浓度水平
多个国家如美国、法国、瑞士和中国等已经对地表水中孕激素和糖皮质激素类物质残留浓度进行过相关研究报道。2011年,Vulliet等[29]分析了法国南部71个地表水样品激素残留,发现P4几乎存在于所有检测水样中,浓度范围在0.4~11 ng·L-1左右。平均浓度最高的孕激素类物质是LNG,浓度达到3.6 ng·L-1。Velicu等[30]分析了美国宾州地区21个地点的地表水中激素浓度,其中P4浓度为7.3~11.8 ng·L-1。Ammann等[31]分析了瑞士河流中近30种孕激素和糖皮质激素及其代谢产物,发现绝大部分物质存在数个ng·L-1左右浓度水平。其中P4和CRL呈现出较高的浓度水平,分别达到10 ng·L-1和6 ng·L-1。国内地表水中孕激素和糖皮质激素类物质残留浓度与国外报道浓度类似。Chang等[3,21]在2009年和2011年分别分析了北京地区多条河流水体的类固醇激素浓度,发现大部分水样都能够检测出数个ng·L-1浓度水平的孕激素和糖皮质激素类物质。其中孕激素MGA、MPA和糖皮质激素COR浓度分别高达34 ng·L-1、34 ng·L-1和22 ng·L-1。我国广东多条河流中孕激素NOR和糖皮质激素CRN浓度最高也可分别达到22 ng·L-1和1.9 ng·L-1[22]。
本文进一步对近年来发表的25篇环境孕激素和12篇糖皮质激素的环境检出浓度数据进行归纳和整理,系统比较了典型环境孕激素和糖皮质激素类物质在城市污水处理厂进出水和地表水体中的浓度水平(图1),其中包括6种孕激素(P4、NET、NOR、MPA、MGA、LNG)和5种糖皮质激素类物质(CRN、CRL、PRE、PREL、DEX)。从图中可以看出,在城市污水处理厂进水中,3种孕激素NET、LNG和P4的浓度水平一般是最高的,其中NET的浓度水平甚至高达224 ng·L-1。而在出水中NET、NOR和LNG的浓度水平最高,NET最高为188 ng·L-1。在地表水中浓度水平最高的是P4、NOR和LNG,一般为数个ng·L-1,P4的最高浓度值约为47 ng·L-1。目前报道的地表水中NET的浓度一般较低,可能和其易降解性有关。在城市污水处理厂进水样品中,糖皮质激素类CRN和CRL的浓度水平最高,一般为数十至数百ng·L-1,最高值分别达到285 ng·L-1和270 ng·L-1。而其他3种物质PRE、PREL和DEX浓度水平一般低于10 ng·L-1。STP也能有效去除糖皮质激素类物质,在STP出水中糖皮质激素类物质都处于较低的浓度水平,一般低于1 ng·L-1。值得注意的是在北京地表水中6种糖皮质激素类物质的平均浓度均高于STP出水浓度,一般在几个ng·L-1浓度水平左右,显示有可能存在未经STP处理的废水直接排放。
考虑到类固醇激素类物质往往具有极高的生物活性,如数个ng·L-1浓度水平的雌激素类物质EE2即能造成鱼类繁殖能力损伤和种群水平的下降[5],目前环境水平的孕激素和糖皮质激素类物质是否影响水生生物的内分泌系统及相应毒理学效应是亟待研究阐释的重点课题。
2 内分泌干扰效应(Endocrine disruptions)
2.1 繁殖能力损伤与组织生理学变化
现有研究已经表明多种孕激素类物质如P4、NET、LNG、DDG(去氢孕酮)和DRS(屈螺酮)能够显著抑制水生生物性腺发育过程并抑制其繁殖能力。Zeilinger等[32]将黑头呆鱼雌鱼连续21 d暴露LNG或DRS,观察是否影响产卵能力。结果发现LNG在0.8 ng·L-1环境浓度水平下,雌鱼卵巢发育和卵细胞结构发生显著改变,近70%的产卵能力损失。Runnalls等[33]将黑头呆鱼暴露于100 ng·L-1LNG和孕二烯酮(gestodene),发现这两类物质能够立即使雌鱼停止产卵,孕二烯酮对繁殖能力损伤的最低有效作用浓度(LOEC)为1 ng·L-1。1.2 ng·L-1的NET也能够显著损伤黑头呆鱼的繁殖能力[34]。孕激素对鱼卵繁殖能力的影响,存在显著的种间差异。如相同暴露条件下的青鳉鱼,25 ng·L-1的NET才能显著降低青鳉鱼的繁殖能力[34],显示黑头呆鱼比青鳉鱼对环境孕激素类物质更加敏感。和青鳉鱼相比,斑马鱼对孕激素的敏感性更低,连续21 d暴露742 ng·L-1的P4才能显著抑制雌鱼产卵,MGA为666 ng·L-1,DDG为1 263 ng·L-1,DRS则为2 763 ng·L-1[35-37]。考虑到实际水环境中LNG和NET等孕激素浓度水平一般在数个至数十个ng·L-1,由此可能产生敏感鱼种的繁殖毒性,从而在种群水平上影响生态系统。孕激素繁殖毒性的分子机理目前尚缺乏深入的研究报道,一般认为与影响鱼体相关激素水平和雌鱼卵巢结构的改变有关,如抑制卵泡刺激激素(FSH)和黄体生成素(LH)的合成,抑制卵巢发育,造成卵原细胞退化等可能是造成繁殖能力下降的主要因素[10-11]。

图1 典型孕激素和糖皮质激素类物质环境浓度注:In. 污水处理厂进水;Ef. 污水处理厂出水;Sur. 地表水。Fig. 1 Concentrations of progestogens and glucocorticoids in the aqueous environmentNote: In. STP influents; Ef. STP effluents; Sur. Surface water. P4, progesterone; NET, norethindrone; NOR, norgestrel; MPA, medroxyprogesterone acetate; MGA, megestrol acetate; LNG, levonorgestrel; CRN, cortisone; CRL, cortisol; PRE, prednisone; PREL, prednisolone; DEX, dexamethasone.
和繁殖能力损伤这一毒性终点相比,有更多研究围绕环境孕激素类物质对鱼类组织生理学的影响,特别在精卵巢发育和鱼体类固醇激素浓度水平作为毒性作用靶点的研究已经积累较多。研究发现1 ng·L-1的LNG能够显著抑制黑头呆鱼雌鱼体内雄激素11-KT的浓度水平[38],相类似的31 ng·L-1的LNG能够显著抑制斜齿鳊雄鱼体内11-KT浓度水平[39]。1 ng·L-1的醋酸环丙孕酮(CPA)能够同时显著抑制雄性和雌性底鳉体内雄激素TTR和雌激素17β-E2浓度水平[40];10 ng·L-1的NET同样能够显著抑制黑头呆鱼雌鱼体内17β-E2浓度水平[34]。类似的鱼体类固醇激素水平改变同样存在于其他孕激素类物质如DRS、MGA和desogestrel的暴露研究[33,37]。性腺组织学变化也是孕激素类物质主要作用终点。抑制雌鱼卵巢发育,改变卵细胞构成和造成卵巢退化是最常观察到的孕激素毒性作用现象。在雄鱼精巢中,干扰精子发育过程和改变成熟精子和未成熟精细胞比例同样在多种孕激素类物质暴露实验中被观察到。如Zhao等[36]将斑马鱼连续21 d暴露于不同浓度的P4或DRS,发现这两类孕激素都能够显著改变雌鱼卵巢结构,造成卵原细胞的退化。与此同时,雄鱼精巢中成熟精子的比例显著增加。在DDG以及DDG和MPA联合暴露实验中,斑马鱼精卵巢也出现同样的变化特征[35]。
目前关于环境糖皮质激素类物质对鱼类繁殖能力影响的相关报道较少。2012年,LaLone等[41]报道了短期暴露地塞米松对黑头呆鱼繁殖能力的影响。发现在高浓度地塞米松(500 μg·L-1)暴露下,能够造成约50%的产卵能力损失。与此同时,还造成雌鱼体内17β-E2浓度水平以及相关基因如VTG表达水平的显著降低。类似的组织生理学变化同样发现于其他多种鱼类暴露研究中。如Consten等[42]证明饮食暴露于高浓度CRL的雄性鲤鱼体内11-KT浓度水平受到显著的抑制;Guiloski等[43]发现DEX能显著降低脂鲤体内睾酮TTR浓度水平;Shankar等[44]将雄性弓背魚暴露于CRL后,发现对其精巢发育能够造成显著损伤,如增加TSI指数和抑制精子发生过程等。虽此类研究发现的糖皮质激素毒性都是在高于环境浓度下的实验暴露结果,最近的一个研究发现低浓度下(100 ng·L-1)的合成糖皮质激素beclomethasone dipropionat可以导致黑头呆鱼的繁殖毒性,如抑制卵黄蛋白原的合成和改变雄鱼第二性征[45]。虽然目前环境中并未检测该合成糖皮质激素,考虑到相似的GR结合机制,环境中的糖皮质激素可能导致鱼类特别是敏感物质的繁殖毒性,有必要展开系统的研究。
2.2 脑垂体性腺轴基因转录水平
尽管环境孕激素内分泌干扰效应研究已不断扩展和深入,但对其分子机理的理解目前还十分欠缺。一般认为,孕激素能够通过受体途径调控众多脑垂体性腺轴相关基因表达水平,进而改变体内类固醇激素水平和性腺发育过程。现有鱼类暴露实验数据表明fshβ、lhβ、cyp11b和hsd17b3等多个HPG轴激素调控或合成基因是环境孕激素类物质的潜在作用靶点。fshβ和lhβ基因编码鱼类脑垂体分泌的多肽类促性腺激素,两者协同作用刺激卵巢中卵泡细胞的生长和发育过程[46]。暴露于较高浓度LNG的鳊鱼和暴露于MGA的斑马鱼脑中,fshβ和lhβ的表达水平都呈现显著抑制[37,39]。毒理基因组学数据还揭示,短期暴露于P4和DRS的斑马鱼雌鱼鱼脑中gnrh2和cyp19b基因同样能够被显著抑制[47]。gnrh2作为一种多肽类的促性腺激素释放激素,主要功能是使垂体释放FSH和LH[46]。Cyp19b则主要负责鱼脑内雌激素17β-E2的合成过程[48]。因此上述研究结果表明,孕激素类物质能够显著抑制鱼脑相关激素合成基因的表达。在鱼类性腺中,类固醇激素合成基因cyp11b、cyp17、hsd11b2和hsd17b3是被广泛报道的孕激素作用靶点。当斑马鱼暴露于P4、MPA、DDG或者MGA等多种孕激素类物质中,上述一种或者多种基因的表达水平一般都能够被显著抑制[35,37,49]。因为上述基因主要参与鱼体孕激素,雄激素和雌激素的合成和转化过程[50],因而孕激素的显著抑制作用有可能进一步改变鱼体内的类固醇激素水平,并从而影响到鱼类的性腺发育和繁殖能力。
糖皮质激素类物质对脑垂体性腺轴基因表达的影响与孕激素类似,研究表明两者有着十分相近的作用靶点。长期暴露于CRL的雄性鲤鱼脑垂体发育受到显著的抑制,其sGNRH,fshβ和lhβ基因的表达水平同时存在显著的下降[42]。类似的作用模式同样出现在DEX暴露下的鲤鱼脑垂体发育过程[42]。在日本鳗鲡中,CRL不仅可以显著降低鱼体雄激素11-KT浓度水平,并能够显著改变相应雄激素合成酶基因hsd11b基因表达[51]。除了对脑垂体性腺轴的影响,CRL暴露同样能够对稀有鮈鲫脑垂体肾上腺轴产生作用,造成现脑垂体中肾上腺皮质激素释放激素(CRF)等发生显著的上调[52]。总体而言,糖皮质激素类物质对HPG轴相关基因表达研究报道相对较少,主要关注于单一物质CRL,且相关暴露研究往往关注于高浓度水平。
2.3 鱼类早期发育影响
除了对成鱼的影响,环境类固醇激素同样能够影响幼鱼激素合成调控基因的表达和干扰鱼类早期性别分化和发育过程。多种环境雌激素类物质如炔雌醇(EE2)不仅可以激活雌激素受体显示雌激素活性,而且还能够在鱼类胚胎发育过程中影响类固醇激素合成酶基因的表达,因此能在较低的浓度下诱导雌雄同体的发生,甚至改变雌雄性别[53-55]。环境雄激素类物质如甲基睾酮(MT)和群勃龙(17β-trenbolone)等对鱼类早期发育的影响也被广泛报道,如对HPG轴基因表达水平的影响以及鱼类雄性化现象[56-57]。除了雌雄激素类物质之外,最近的研究表明孕激素类物质也能够影响鱼类脑垂体性腺轴基因表达及其早期发育过程。Zucchi等[58]分析了P4、NET和LNG等多种孕激素类物质对斑马鱼早期胚胎发育的影响,发现3种物质均能够显著改变激素受体基因PR、AR和雄激素合成酶基因hsd17b3的表达水平。其展现出相互类似的基因变化规律,并呈现出一定的时间依赖型的动态调控特征,甚至在环境浓度水平下(2 ng·L-1)就能改变相关基因的表达。同样,Liang等[50,59]对P4和NOR暴露的斑马鱼胚胎发育过程的详细研究也阐释了相同的现象。环境浓度暴露下,斑马鱼HPG、HPA和HPT轴众多激素合成相关基因以及激素受体基因表达水平均呈现显著的动态变化规律。类似现象同样发生在黑头呆鱼(fathead minnow)早期发育过程中。Overturf等[60]评估了多种暴露条件下LNG对黑头呆鱼早期胚胎发育的影响,发现LNG显著抑制芳香化酶基因CYP19a1和其他多种类固醇激素合成酶基因如20β-hsd、3β-hsd等,并且能够显著抑制幼鱼生长发育过程。目前环境孕激素对鱼类早期发育的影响仍然主要集中于P4和LNG等少数物质,人们对环境中为数众多的人工合成孕激素类物质的早期胚胎发育毒性仍然知之甚少。
环境糖皮质激素对鱼类早期发育影响相关报道主要集中在CRL和DEX。目前研究主要关注于胚胎早期生长发育过程及相应形态学变化,对性别分化发育以及相关基因表达水平的影响目前并没有相关报道。如Hillegass等[61]发现将斑马鱼胚胎暴露于高浓度的CRL和DEX,其金属蛋白酶基因表达受到显著抑制,并造成胚胎发育异常现象,如颅面畸形、心包水肿和骨骼弯曲。黑头呆鱼胚胎在高浓度DEX暴露下,其生长发育过程受到显著的抑制,幼鱼体长体重明显低于对照组水平[62]。目前尚无环境浓度水平糖皮质激素类物质对鱼类早期生长发育毒性的报道。
2.4 初步环境风险评估
研究进一步整理和分析了多种典型孕激素和糖皮质激素类物质内分泌干扰效应的最低有效作用浓度(LOEC)数据(包括繁殖能力损伤、体内激素水平和性腺组织学变化以及基因转录水平的改变),并与相应环境水体浓度数据进行了比较(图2)。在6种孕激素类物质中,NOR、P4和LNG的环境地表水浓度水平与其LOEC最为接近,显示存在潜在生态风险。值得注意的是尽管地表水中NOR的浓度水平并不高,通常在10 ng·L-1左右,但在与此相近浓度下,已经能够造成斑马鱼性别比失调,HPG轴和HPA轴基因转录水平的显著变化[63]。在糖皮质激素类物质中,目前仅有CRL和DEX两类物质的较系统的内分泌干扰毒性研究数据,其最低有效作用浓度(LOEC)一般较高,在数百ng·L-1至数百μg·L-1左右。考虑到其地表水环境浓度一般低于10 ng·L-1,可见其目前内分泌干扰效应的环境风险相对较低 (图2)。
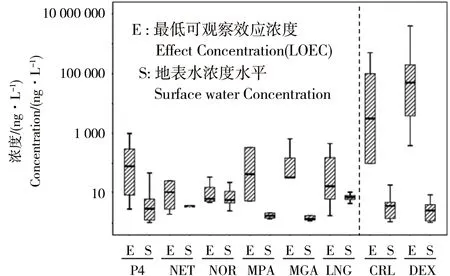
图2 孕激素和糖皮质激素类物质初步环境风险评估注:E,最低有效作用浓度(LOEC)(包含繁殖、生理、组织及转录水平毒性效应);S,地表水浓度水平。Fig. 2 Tentative risk assessment of progestogens and glucocorticoidsNote, E, Lowest observed effect concentrations (LOEC) in vertebrates. All effects (reproductive, physiological, histological and transcriptional effects) are included. S, Surface water concentrations.
3 新的毒性作用终点 (Novel Endpoints)
3.1 毒性数据分析
随着对环境类固醇激素毒理效应研究的不断深入,以及各种组学“omics”技术的应用,近年来不断有关于其新毒性作用靶点的相关报道,而且这些毒性作用也不再局限于内分泌系统干扰效应。本文分析整理了近10年来(2005—2015年)环境孕激素和糖皮质激素类物质生态毒理效应研究相关文献报道,对共计83篇报道的物质类型和毒性作用终点进行了归纳和解析。在43篇孕激素类物质毒性相关报道中,有约77% (33/43)关注于内分泌干扰效应 (图3A),其中主要包括繁殖能力损伤,激素水平和性腺组织学变化,以及HPG 轴等相关基因表达水平的改变。孕激素物质中对P4、LNG和NET的毒理学研究最多,相关文献报道占总报道的69.2%(图3B)。和环境孕激素相关研究类似,在40篇糖皮质激素类物质毒性相关报道中,有约55% (22/40)关注于内分泌干扰效应 (图3D),其主要包括干扰精卵巢发育,HPG 轴基因表达变化以及雌鱼雄性化效应。其中,研究大多集中在CRL和DEX这两类物质,相关文献报道占总报道的92.3%(图3E)。
除内分泌干扰效应这一毒性终点之外,近年来一些新的毒性作用终点不断被发现,其中昼夜节律(circadian rhythm)、免疫反应(immune response)、代谢过程(metabolism)和细胞周期(cell cycle)是目前最为关注的孕激素类物质毒性靶点,占总文献报道数的73.3%(11/15)(图3C)。而免疫反应(immune response)、代谢过程(metabolism)和离子传递(ion transport)则是环境糖皮质激素类物质的主要研究的重点,占总文献报道的83.3%(15/18)(图3F)。
3.2 昼夜节律
有研究发现孕激素类物质能够显著改变斑马鱼昼夜节律。Zucchi等[64]于2013年通过毒理基因组学技术最早鉴定出了一系列内分泌系统之外潜在的P4毒性作用靶点,包括昼夜节律、细胞周期、DNA损伤修复以及细胞分化过程。其中,昼夜节律相关基因变化最大。一些典型昼夜节律分子生物标记物基因,如per1b和nr1d1,在较高浓度P4暴露下基因表达水平的改变甚至达到十几倍,而且这种变化也能发生在环境浓度水平之下(3.5 ng·L-1P4)。之后,在2014年对DRS以及DRS和P4联合暴露研究中,Zucchi等[47]进一步发现DRS同样可以显著改变斑马鱼成鱼的昼夜节律相关基因,且对基因表达水平的影响要较P4更为强烈,进一步表明这可能是环境孕激素类物质的潜在毒性作用靶点。在DRS和P4联合暴露实验中,昼夜节律相关基因变化水平普遍高于单物质暴露,显示存在显著的毒性加和效应(additive effect)。
对昼夜节律分子信号的干扰作用也适用于其他多种不同类型的孕激素类物质。Zhao等[35]于2015年分析了MPA和DDG对斑马鱼成鱼和胚胎发育过程昼夜节律的影响,发现这两类物质均能够显著改变昼夜节律相关分子标记物基因表达。在成鱼中,显著性改变主要发生在雌雄鱼脑和肝脏,而在性腺中(精巢和卵巢)中则没有发现这一现象。在斑马鱼胚胎发育过程中,基因显著性改变出现在96 h和144 h,而没有出现在更早的48 h,这可能是由于胚胎发育早期感应光线等外界环境信号节律系统尚未发育完全。Zhao等[36]随后通过斑马鱼基因组数据库检索等方式构建了完整的斑马鱼昼夜节律调控分子网络,其中包含13组共41个相关基因。在斑马鱼成鱼短期暴露P4和DRS的实验中发现,两类物质均能够显著影响斑马鱼的昼夜节律调控分子网络,如per1b、cry5、rorcb和nr1d1等核心调控基因,以及ciart、dec2、dbpa和nfil3等近年来新发现的昼夜节律重要调控因子,并且绝大部分基因表达呈现出明显的剂量效应关系。和对照组相比,暴露组中这些基因的表达水平的变化甚至高达数十倍。这些研究表明昼夜节律分子信号很可能是环境孕激素类物质的普遍作用靶点。虽然目前并没有从蛋白水平,生理学以及行为学等相关作用终点的详细研究报道,但是Zhao等[36]发现这些昼夜节律调控基因的表达模式和脑垂体性腺轴(HPG-axis)激素合成相关基因的表达呈现出显著的相关性,并有可能进而影响鱼类的繁殖能力。考虑到昼夜节律能够调控众多细胞和生理学过程,如细胞周期、能量代谢、糖平衡、胰岛素分泌、激素合成以及繁殖过程,对昼夜节律相关研究有助于深入揭示孕激素类物质的生态毒理效应及其风险评价过程。
3.3 免疫反应
类固醇激素的免疫调节作用是近年来兴起的一个新的研究方向。一般认为,类固醇激素能够通过核受体和膜受体途径调控分子信号,影响免疫反应相关基因表达,从而起到对免疫系统的调控作用[65-66]。水环境中较高浓度的类固醇激素类物质可能会改变野生动物的体内免疫相关细胞因子水平,从而干扰生物体正常免疫功能。2009年,Pietsch等[67]报道了P4、MPA和LNG等多种孕激素类物质对鲤鱼白细胞的免疫抑制作用。在in vitro暴露实验中发现MPA和P4能够显著抑制脑和肾脏细胞中NO的产生,而相同浓度下的LNG作用并不明显;基因表达分析揭示较高浓度P4和MPA显著抑制免疫反应相关分子标记物基因iNOS的表达水平。这一现象在MPA和LNG的in vivo鲤鱼暴露实验中也得到进一步证实:在21 d的暴露后,MPA和LNG均能显著抑制NO的产生。并且LNG能够显著影响精氨酸酶活性,从而对NO产生以及免疫功能起到潜在干扰作用[68]。
相比于环境孕激素类物质,糖皮质激素对水生生物免疫系统干扰效应研究更为深入。糖皮质激素有着广泛的临床应用,如在严重急性感染,器质性炎症,肾上腺皮质机能减退以及自身免疫性疾病中用于抑制免疫应答、抗炎、抗毒、抗休克等。鉴于糖皮质激素的上述药用,科学家因此推测环境中高浓度的糖皮质激素同样会影响水生生物的免疫应答过程。Pietsch等[68]研究发现,DEX和CRL对鲤鱼白细胞均有显著免疫抑制作用,其能够抑制脑和肾脏白细胞中NO产生并能够显著影响精氨酸酶活性。Huang等[69]在研究斑马鱼心脏损伤再生过程中的免疫应答时发现,糖皮质激素倍氯米松能够显著抑制斑马鱼心脏再生初期免疫应答,干扰炎症反应,从而阻碍白细胞招募,抑制血管形成和细胞增殖,抑制心脏再生过程。CRL也能够显著抑制黄颡鱼头肾吞噬细胞的呼吸暴发功能以及血清补体旁路溶血活性(ACH50),且呈现出显著的剂量效应关系[70]。在黄颡鱼幼鱼中,CRL能使其外周血白细胞数量显著减少、淋巴细胞比例显著降低,减少肠道黏膜皱褶和促进糖异生作用从而使黄颡鱼幼鱼生长受到抑制[71]。与其内分泌干扰效应类似,目前对糖皮质激素类物质免疫反应研究主要关注于CRL和DEX等少数物质的高浓度暴露研究,在环境浓度水平是否产生生态毒理效应值得关注。
环境孕激素和糖皮质激素类物质的生态毒理效应是环境雌激素和雄激素之后近年来又一研究热点。除少数天然物质外,为数众多且不同类型的人工合成孕激素和糖皮质激素类物质目前广泛存在于各种环境水体之中。考虑到目前毒理学研究主要集中于少数物质的内分泌干扰效应,未来有必要在进一步阐释这些物质的环境污染的基础上,展开系统的生态毒理学研究,并进行全面的生态风险评价。另外,目前生态毒理学研究主要关注于这两类物质对鱼类的毒理学效应,是否对其他类型的水生生物,如低等无脊椎动物也存在潜在的毒性风险,同样是需要密切关注的问题。
[1] United Nations Environment Programme and the World Health Organization. State of the Science of Endocrine Disrupting Chemicals 2012 [R]. WHO/UNEP, 2013
[2] Liu J L, Wong M H. Pharmaceuticals and personal care products (PPCPs): A review on environmental contamination in China [J]. Environment International, 2013, 59: 208-224
[3] Chang H, Wan Y, Hu J Y. Determination and source apportionment of five classes of steroid hormones in urban rivers [J]. Environmental Science & Technology, 2009, 43(20): 7691-7698
[4] Fent K, Weston A A, Caminada D. Ecotoxicology of human pharmaceuticals [J]. Environmental Science & Technology, 2006, 76(2): 122-159
[5] Nash J P,Kime D E, Van der Ven L T, et al. Long-term exposure to environmental concentrations of the pharmaceutical ethynylestradiol causes reproductive failure in fish [J]. Environmental Health Perspectives, 2004, 112(17): 1725-1733
[6] Vajda A M, Barber L B, Gray J L, et al. Reproductive disruption in fish downstream from an estrogenic wastewater effluent [J]. Environmental Science & Technology, 2008, 42(9): 3407-3414
[7] Milla S, Depiereux S, Kestemont P. The effects of estrogenic and androgenic endocrine disruptors on the immune system of fish: A review [J]. Ecotoxicology, 2011, 20(2): 305-319
[8] Sitruk-Ware R. Pharmacological profile of progestins [J]. Maturitas, 2004, 47(4): 277-283
[9] van der Laan S, Meijer O C. Pharmacology of glucocorticoids: Beyond receptors [J]. European Journal of Pharmacology, 2008, 585(2-3): 483-491
[10] Kumar V, Johnson A C, Trubiroha A, et al. The challenge presented by progestins in ecotoxicological research: A critical review [J]. Environmental Science & Technology, 2015, 49(5): 2625-2638
[11] Fent K. Progestins as endocrine disrupters in aquatic ecosystems: Concentrations, effects and risk assessment [J]. Environment International, 2015, 84: 115-130
[12] Kugathas S, Williams R J, Sumpter J P. Prediction of environmental concentrations of glucocorticoids: the River Thames, UK, as an example [J]. Environment International, 2012, 40: 15-23
[13] Milla S, Wang N, Mandiki S N, et al. Corticosteroids: Friends or foes of teleost fish reproduction? [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 153(3): 242-251
[14] 国家环境保护总局. 2000年中国环境状况公报[R]. 北京: 中国环境保护总局, 2000
State Environmental Protection Administration. State of the Environment Report in China, 2000 [R]. Beijing: State Environmental Protection Administration of China, 2000 (in Chinese)
[15] 中国环境科学研究院. 《畜禽养殖业水污染物排放标准》(征求意见稿) 编制说明[R]. 北京: 中国环境科学研究院, 2011
Chinese Research Academy of Environmental Sciences. Discharge Standard of Pollutants for Livestock and Poultry Breeding (Draft Standards for Comment) Description for Drawing up [R]. Beijing: Chinese Research Academy of Environmental Sciences, 2011(in Chinese)
[16] Liu S, Ying G G, Zhang R Q, et al. Fate and occurrence of steroids in swine and dairy cattle farms with different farming scales and wastes disposal systems [J]. Environmental Pollution, 2012, 170: 190-201
[17] Besse J P, Garric J. Progestagens for human use, exposure and hazard assessment for the aquatic environment [J]. Environmental Pollution, 2009, 157(12): 3485-3494
[18] Runnalls T J, Margiotta-Casalucia L, Kugathasa S. Pharmaceuticals in the aquatic environment: Steroids and anti-steroids as high priorities for research [J]. Human and Ecological Risk Assessment, 2010, 16: 1318-1338
[19] Fernandez M P, Ikonomou M G, Buchanan I. An assessment of estrogenic organic contaminants in Canadian wastewaters [J]. Science of the Total Environment, 2007, 373(1): 250-269
[20] Pauwels B, Noppe H, De Brabander H, et al. Comparison of steroid hormone concentrations in domestic and hospital wastewater treatment plants [J]. Journal of Environmental Engineering, 2008, 134(11): 933-936
[21] Chang H, Wan Y, Wu S, et al. Occurrence of androgens and progestogens in wastewater treatment plants and receiving river waters: Comparison to estrogens [J]. Water Research, 2011, 45(2): 732-740
[22] Liu S, Ying G G, Zhao J L, et al. Trace analysis of 28 steroids in surface water, wastewater and sludge samples by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry [J]. Journal of Chromatography A, 2011, 1218(10): 1367-1378
[23] Liu S S, Ying G G, Liu S, et al. Analysis of 21 progestagens in various matrices by ultra-high-performance liquid chromatography tandem mass spectrometry (UHPLC-MS/MS) with diverse sample pretreatment [J]. Analytical and Bioanalytical Chemistry, 2014, 406(28): 7299-7311
[24] Piram A, Salvador A, Gauvrit J Y, et al. Development and optimisation of a single extraction procedure for the LC/MS/MS analysis of two pharmaceutical classes residues in sewage treatment plant [J]. Talanta, 2008, 74(5): 1463-1475
[25] Chang H, Hu J, Shao B. Occurrence of natural and synthetic glucocorticoids in sewage treatment plants and receiving river waters [J]. Environmental Science & Technology, 2007, 41(10): 3462-3468
[26] Fan Z, Wu S, Chang H, et al. Behaviors of glucocorticoids, androgens and progestogens in a municipal sewage treatment plant: Comparison to estrogens [J]. Environmental Science & Technology, 2011, 45(7): 2725-2733
[27] Vulliet E, Baugros J B, Flament-Waton M M, et al. Analytical methods for the determination of selected steroid sex hormones and corticosteriods in wastewater [J]. Analytical and Bioanalytical Chemistry, 2007, 387(6): 2143-2151
[28] Al-Odaini N A, Zakaria M P, Yaziz M I, et al. Multi-residue analytical method for human pharmaceuticals and synthetic hormones in river water and sewage effluents by solid phase extraction and liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2010, 1217(44): 6791-6806
[29] Vulliet E, Cren-Olivé C. Screening of pharmaceuticals and hormones at the regional scale, in surface and groundwaters intended to human consumption [J]. Environmental Pollution, 2011, 159(10): 2929-2934
[30] Velicu M, Suri R. Presence of steroid hormones and antibiotics in surface water of agricultural, suburban and mixed-use areas [J]. Environmental Monitoring and Assessment, 2009, 154(1-4): 349-359
[31] Ammann A A, Macikova P, Groh K J. et al. LC-MS/MS determination of potential endocrine disruptors of cortico signalling in rivers and wastewaters [J]. Analytical and Bioanalytical Chemistry, 2014, 406(29): 7653-7665
[32] Zeilinger J, Steger-Hartmann T, Maser E, et al. Effects of synthetic gestagens on fish reproduction [J]. Environmental Toxicology and Chemistry, 2009, 28(12): 2663-2670
[33] Runnalls T J, Beresford N, Losty E, et al. Several synthetic progestins with different potencies adversely affect reproduction of fish [J]. Environmental Science & Technology, 2013, 47(4): 2077-2084
[34] Paulos P, Runnalls T J, Nallani G, et al. Reproductive responses in fathead minnow and Japanese medaka following exposure to a synthetic progestin, norethindrone [J]. Aquatic Toxicology, 2010, 99(2): 256-262
[35] Zhao Y B, Castiglioni S, Fent K. Synthetic progestins medroxyprogesterone acetate anddydrogesterone and their binary mixtures adversely affect reproduction and lead to histological and transcriptional alterations in zebrafish (Danio rerio) [J]. Environmental Science & Technology, 2015, 49(7): 4636-4645
[36] Zhao Y B, Castiglioni S, Fent K. Environmental progestins progesterone and drospirenone alter the circadian rhythm network inzebrafish (Danio rerio) [J]. Environmental Science & Technology, 2015, 49(16): 10155-10164
[37] Han J, Wang Q, Wang X, et al. The synthetic progestin megestrol acetate adversely affects zebrafish reproduction [J]. Aquatic Toxicology, 2014, 150: 66-72
[38] Overturf M D, Overturf C L, Carty D R, et al. Levonorgestrel exposure to fathead minnows (Pimephales promelas) alters survival, growth, steroidogenic gene expression and hormone production [J]. Aquatic Toxicology, 2014, 148: 152-161
[39] Kroupova H K, Trubiroha A, Lorenz C, et al. The progestin levonorgestrel disrupts gonadotropin expression and sex steroid levels in pubertal roach (Rutilus rutilus) [J]. Aquatic Toxicology, 2014, 154: 154-162
[40] Sharpe R L, MacLatchy D L, Courtenay S C, et al. Effects of a model androgen (methyl testosterone) and a model anti-androgen (cyproterone acetate) on reproductive endocrine endpoints in a short-term adult mummichog (Fundulus heteroclitus) bioassay [J]. Aquatic Toxicology, 2004, 67(3): 203-215
[41] LaLone C A, Villeneuve D L, Olmstead A W, et al. Effects of a glucocorticoid receptor agonist, dexamethasone, on fathead minnow reproduction, growth, and development [J]. Environmental Toxicology and Chemistry, 2012, 31(3): 611-622
[42] Consten D, Lambert J G, Komen H, et al. Corticosteroids affect the testicular androgen production in male common carp (Cyprinus carpio L.) [J]. Biology of Reproduction, 2002, 66(1): 106-111
[43] Guiloski I C, Ribas J L, Pereira Lda S, et al. Effects of trophic exposure to dexamethasone and diclofenac in freshwater fish [J]. Ecotoxicology and Environmental Safety, 2015, 114: 204-211
[44] Shankar D S, Kulkarni R S. Effect of cortisol on testis of freshwater fish Notopterus notopterus (Pallas) [J]. Indian Journal of Experimental Biology, 2000, 38(12): 1227-1230
[45] Kugathas S, Runnalls T J, Sumpter J P. Metabolic and reproductive effects of relatively low concentrations of beclomethasone dipropionate, a synthetic glucocorticoid, on fathead minnows [J]. Environmental Science & Technology, 2013, 47(16): 9487-9495
[46] Levavi-Sivan B, Bogerd J, Maanós E L, et al. Perspectives on fish gonadotropins and their receptors [J]. General and Comparative Endocrinology, 2010, 165(3): 412-437
[47] Zucchi S, Mirbahai L, Castiglioni S, et al. Transcriptional and physiological responses induced by binary mixtures of drospirenone and progesterone in zebrafish (Danio rerio) at environmental concentrations [J]. Environmental Science & Technology, 2014, 48(6): 3523-3531
[48] Menuet A, Pellegrini E, Brion F, et al. Expression and estrogen-dependent regulation of the zebrafish brain aromatase gene [J]. Journal of Comparative Neurology, 2005, 485(4): 304-320
[49] Blüthgen N, Sumpter J P, Odermatt A, et al. Effects of low concentrations of the antiprogestin mifepristone (RU486) in adults and embryos of zebrafish (Danio rerio): 2. Gene expression analysis and in vitro activity [J]. Aquatic Toxicology, 2013, 144-145: 96-104
[50] Liang Y Q, Huang G Y, Ying G G, et al. The effects of progesterone on transcriptional expression profiles of genes associated with hypothalamic-pituitary-gonadal and hypothalamic-pituitary-adrenal axes during the early development of zebrafish (Danio rerio) [J]. Chemosphere, 2015, 128: 199-206
[51] Ozaki Y, Higuchi M, Miura C, et al. Roles of 11beta-hydroxysteroid dehydrogenase in fish spermatogenesis [J]. Endocrinology, 2006, 147(11): 5139-5146
[52] 杨丽华, 张小艳, 李伟, 等. 氢化可的松对雄性稀有鮈鲫肾上腺激素调节功能基因的干扰作用[J]. 环境科学学报, 2009(4): 802-807
Yang L H, Zhang X Y, Li W, et al. Roles of cortisol exposure on functional genes in the HPA axis in male Chinese rare minnow (Grobiocypris rarus) [J]. Acta Scientiae Circumstantiae, 2009(4): 802-807 (in Chinese)
[53] Schiller V, Wichmann A, Kriehuber R, et al. Transcriptome alterations in zebrafish embryos after exposure to environmental estrogens and anti-androgens can reveal endocrine disruption [J]. Reproductive Toxicology, 2013, 42: 210-223
[54] Zhao Y, Wang C, Xia S, et al. Biosensor medaka for monitoring intersex caused by estrogenic chemicals [J]. Environmental Science & Technology, 2014, 48(4):2413-2420
[55] Parrott J L, Blunt B R. Life-cycle exposure of fathead minnows (Pimephales promelas) to an ethinylestradiol concentration below 1 ng/L reduces egg fertilization success and demasculinizes males [J]. Environmental Toxicology, 2005, 20(2): 131-141
[56] Fenske M, Segner H. Aromatase modulation alters gonadal differentiation in developing zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2004, 67(2): 105-126
[57] Morthorst J E, Holbech H, Bjerregaard P. Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations [J]. Aquatic Toxicology, 2010, 98(4): 336-343
[58] Zucchi S, Castiglioni S, Fent K. Progestins and antiprogestins affect gene expression in early development in zebrafish (Danio rerio) at environmental concentrations [J]. Environmental Science & Technology, 2012, 46(9): 5183-5192
[59] Liang Y Q, Huang G Y, Ying G G, et al. Progesterone and norgestrel alter transcriptional expression of genes along the hypothalamic-pituitary-thyroid axis in zebrafish embryos-larvae [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2015, 167: 101-107
[60] Overturf M D, Huggett D B. Responses to various exposure durations of levonorgestrel during early-life stages of fathead minnows (Pimephales promelas) [J]. Aquatic Toxicology, 2015, 161: 33-40
[61] Hillegass J M, Villano C M, Cooper K R, et al. Glucocorticoids alter craniofacial development and increase expression and activity of matrix metalloproteinases in developing zebrafish (Danio rerio) [J]. Toxicological Sciences, 2008, 102(2): 413-424
[62] LaLone C A, Villeneuve D L, Olmstead A W, et al. Effects of a glucocorticoid receptor agonist, dexamethasone, on fathead minnow reproduction, growth, and development [J]. Environmental Toxicology and Chemistry, 2012, 31(3): 611-622
[63] Liang Y Q, Huang G Y, Liu S S, et al. Long-term exposure to environmentally relevant concentrations of progesterone and norgestrel affects sex differentiation in zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2015, 160: 172-179
[64] Zucchi S, Castiglioni S, Fent K. Progesterone alters global transcription profiles at environmental concentrations in brain and ovary of female zebrafish (Danio rerio) [J]. Environmental Science & Technology, 2013, 47(21): 12548-12556
[65] McKay L I, Cidlowski J A. Molecular control of immune/inflammatory responses: Interactions between nuclear factor-kappa B and steroid receptor-signaling pathways [J]. Endocrine Reviews, 1999, 20(4): 435-459
[66] Buttgereit F, Scheffold A. Rapid glucocorticoid effects on immune cells [J]. Steroids, 2002, 67(6): 529-534
[67] Pietsch C, Neumann N, Knopf K, et al. Progestogens cause immunosuppression of stimulated carp (Cyprinus carpio L.) leukocytes in vitro [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 150(1): 16-24
[68] Pietsch C, Neumann N, Preuer T, et al. In vivo treatment with progestogens causes immunosuppression of carp Cyprinus carpio leucocytes by affecting nitric oxide production and arginase activity [J]. Journal of Fish Biology, 2011, 79(1): 53-69
[69] Huang W C, Yang C C, Chen I H, et al. Treatment of glucocorticoids inhibited early immune responses and impaired cardiac repair in adult zebrafish [J]. PLoS One, 2013, 8(6): e66613
[70] 刘小玲, 葛海燕, 田珍, 等. 皮质醇对黄颡鱼头肾巨噬细胞呼吸爆发活动的影响[J]. 华中农业大学学报, 2008, 27(6) : 749-754
Liu X L, Ge H Y, Tian Z, et al. Effects of cortisol on respiratory burst of head kidney macrophages in Pelteobagrus fulvidraco [J]. Journal of Huazhong Agricultural University, 2008, 27(6): 749-754 (in Chinese)
[71] 葛海燕, 刘小玲, 罗贤奎, 等. 皮质醇混饲投喂对黄颡鱼幼鱼生长及外周血细胞的影响[J]. 淡水渔业, 2007(1): 43-47
Ge H Y, Liu X L, Luo X K, et al. The effects of dietary intake of cortisol on the growth and circulating blood cells in fingerling yellow catfish (Pelteobagrus fulvidraco) [J]. Freshwater Fisheries, 2007(1): 43-47 (in Chinese)
◆
Ecotoxicology of Environmental Progestogens and Glucocorticoids: A Short Review
Zhao Yanbin, Hu Jianying*
College of Urban and Environmental Sciences, Peking University, Beijing 100871, China
Received 27 November 2015 accepted 22 December 2015
Environmental behavior and ecotoxicological effects of progestogens and glucocorticoids are of increasing concern in recent years. They are used in a range of medical conditions, and reach aquatic ecosystem due to the incomplete removal by wastewater treatment plant (WWTP) and agricultural run-off, then cause the potential hazard to the ecological system and human health. A few ng·L-1of progestogens and glucocorticoids were widely detected in surface water while in the influents and effluents of WWTP the concentrations were up to several hundred ng·L-1. They exert toxic effects primarily via binding to nuclear hormone receptors, for instance, the progesterone receptor (PR), glucocorticoid receptor (GR) and mineralocorticoid receptor (MR). Endocrine disrupts of aquatic vertebrates are of mainly concern. They alter the transcriptional levels of genes involved in hypothalamic-pituitary-gonadal axis and blood hormone concentrations, impact gonadal histology and disrupt fish reproduction, even at environmental relevant levels. Besides, novel targets are uncovered recently by use of “Omics” technology, such as the alterations on circadian rhythm signals and immune responses. These provide us novel insights of potential ecotoxicological effects of progestogens and glucocorticoids.
progestogens; glucocorticoids; environmental behavior; ecotoxicology; endocrine disruption; circadian rhythm; immune response
10.7524/AJE.1673-5897.20151127008
国家自然科学基金项目(No. 41330637)
赵砚彬 (1984-),男,博士,研究方向为环境毒理学,Email: zhaoyb@pku.edu.cn
*通讯作者(Corresponding author), E-mail: hujy@urban.pku.edu.cn
2015-11-27 录用日期:2015-12-22
1673-5897(2016)2-006-12
X171.5
A
简介:胡建英(1965—),女,博士,教授,博士生导师,主要从事环境中微量有害化学物质的环境行为研究及化学物质的环境风险评价。
赵砚彬, 胡建英. 环境孕激素和糖皮质激素的生态毒理效应: 进展与展望[J]. 生态毒理学报,2016, 11(2): 6-17
Zhao Y B, Hu J Y. Ecotoxicology of environmental progestogens and glucocorticoids: a short review [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 6-17 (in Chinese)

