十溴二苯乙烷对草鱼幼鱼肝脏和肌肉组织氧化应激效应的影响
韩倩,张丽娟,胡国成,*,于云江,甘炼,崔科,黄楚珊
1. 环境保护部华南环境科学研究所,广州 510655 2. 华南农业大学,广州 510642 3. 国家环境保护饮用水水源地管理技术重点实验室 深圳市饮用水水源地安全保障重点实验室, 深圳市环境科学研究院,深圳 518001
十溴二苯乙烷对草鱼幼鱼肝脏和肌肉组织氧化应激效应的影响
韩倩1,3,张丽娟1,胡国成1,*,于云江1,甘炼2,崔科2,黄楚珊1
1. 环境保护部华南环境科学研究所,广州 510655 2. 华南农业大学,广州 510642 3. 国家环境保护饮用水水源地管理技术重点实验室 深圳市饮用水水源地安全保障重点实验室, 深圳市环境科学研究院,深圳 518001
十溴二苯乙烷(DBDPE)是目前在全球范围内广泛使用的新型溴代阻燃剂,其环境风险已引起广泛关注,但目前仍缺乏针对水生生物的毒性研究数据。作者通过饲料中添加十溴二苯乙烷暴露的方式对草鱼幼鱼进行长期暴露实验,研究500、1 000和3 000 mg·kg-1三个饲料添加剂量暴露组和1个对照组长期暴露对草鱼幼鱼肝脏和肌肉组织中氧化应激酶(SOD、CAT和GSH-PX)活性和抗氧化物质(GSH)含量的影响。结果显示:暴露8周后,随着DBDPE暴露水平的升高,草鱼幼鱼肝脏组织中氧化应激酶(SOD、CAT和GSH-PX)和抗氧化物质(GSH)均表现出低浓度诱导及高浓度抑制的效应。500和1 000 mg·kg-1剂量组草鱼幼鱼肝脏组织中SOD、CAT和GSH-PX活性和GSH含量均显著高于对照组(P< 0.05),且均在500 mg·kg-1剂量组达到最高。3 000 mg·kg-1剂量组SOD、CAT和GSH-PX活性和GSH含量低于500和1 000 mg·kg-1暴露组,但与对照组无显著性差异(P >0.05)。草鱼幼鱼肌肉组织中氧化应激酶活性变化甚微,3个浓度剂量组肌肉组织中SOD、CAT活性和GSH含量以及500 mg·kg-1剂量组GSH-PX活性与对照组均无显著性差异(P >0.05)。研究成果表明DBDPE暴露影响草鱼幼鱼肝脏组织的抗氧化防御系统,可以诱导草鱼幼鱼产生氧化应激效应。
十溴二苯乙烷;草鱼幼鱼;氧化应激;肝脏;肌肉
Received 15 July 2015 accepted 17 September 2015
十溴二苯乙烷(decabromodiphenyl ethane, DBDPE)是一种结构和理化特性与十溴联苯醚(decabromodiphenyl ether, BDE-209)类似的新型高效溴代阻燃剂,被广泛应用在电子电器、电线电缆、纺织等纤维和聚酯材料中[1-2]。随着BDE-209在欧美市场的逐步退出,DBDPE作为BDE-209的替代品将有可能成为世界溴系阻燃剂市场上的主力军[3-4]。已有研究证实DBDPE在全球水、大气、土壤和沉积物等环境介质中广泛存在且在生物体内累积[4-8]。DBDPE的结构类似物BDE-209具有甲状腺干扰毒性、生殖毒性及内分泌干扰效应[9-14]。目前,关于DBDPE对生物体的毒性效应还不完全清楚,其环境毒理学方面的研究资料非常有限,尤其缺乏针对水生生物的毒性效应研究资料[15]。因此,本研究选取草鱼幼鱼作为试验对象,通过饵料摄入DBDPE,研究DBDPE长期暴露对草鱼幼鱼肝脏和肌肉组织氧化应激的作用,为进一步研究DBDPE的生态毒理效应及其生态风险评价提供理论依据。
1 材料与方法 (Materials and methods)
1.1 试验材料
试验草鱼幼鱼由中山大学水生经济动物研究所鱼类营养研究室育苗场提供。草鱼幼鱼运回实验室后,用5 μL·L-1甲醛溶液浸浴消毒8 min;选取健康幼鱼放至室内循环水族缸中驯化2周以适应试验条件,暂养期间投喂商品饲料。试验用水经曝气、珊瑚砂和生化棉过滤,以除去氯气、固体废物,同时采用低压鼓风机提供氧气,以增加试验水体的溶解氧含量。光周期为自然光周期,大约为12 h光: 12 h暗。
DBDPE(纯度>98%)购自美国Acuustandard公司;二甲基亚砜(DMSO)购自美国Amresco公司。
1.2 试验方法
1.2.1 试验设计
本试验设置3个饲料添加剂量,分别为500 mg·kg-1(T1)、1 000 mg·kg-1(T2)和3 000 mg·kg-1(T3),同时设置对照组(T0)。根据草鱼的生长规律及营养需求,制定草鱼幼鱼饲料配方,饲料成分如表1所示。饲料原料主要包括:面粉、豆粕、菜籽粕、鱼粉、棉粕、米糠粕、豆油、大豆磷脂等。所有原料粉碎后,再过40目筛,按照饲料配方表,添加不同剂量的DBDPE,然后用商用饲料搅拌机(A-200T Mixer Bench Model unit, Russel Food Equipment Ltd., Ottawa, Ont. Canada)充分混匀30 min,边搅拌边慢慢加入豆油和水分,最后用单螺杆膨化机制成粒径为1.5 mm的颗粒状饲料,自然风干至水分含量少于10%,然后用封口塑料袋分装,储存于-20 ℃的冰柜中备用。
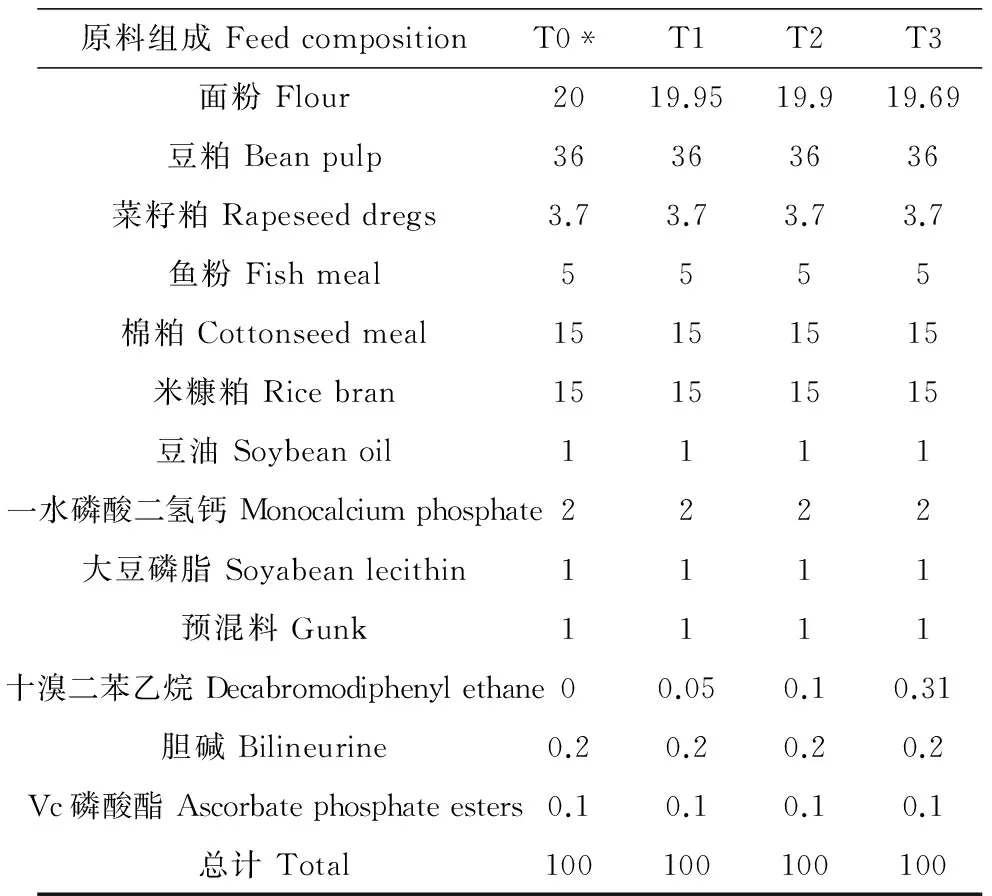
表1 草鱼幼鱼暴露试验饲料配方(%)
注:*T0,对照组;T1,低剂量组(500 mg·kg-1);T2,中剂量组(1 000 mg·kg-1);T3,高剂量组(3 000 mg·kg-1)。
Note:*T0, Control group; T1, Low-dose group (500 mg·kg-1); T2, Medial-dose group (1 000 mg·kg-1); T3, High-dose group (3 000 mg·kg-1).
草鱼幼鱼暂养结束后开始正式实验。挑选规格一致的480尾健康幼鱼,放养在16个水族缸中,每缸放30尾。每组饲料随机投喂给4个水族缸。试验开始时草鱼幼鱼体重3.40 g左右。每天分别在10:00和16:00投喂自行配制的饲料2次(含不同浓度DBDPE),投饲量为草鱼幼鱼体重的5%。每2周称鱼体重1次跟踪其生长情况,并相应调整投喂量。试验过程中每2天换水1次。溶解氧、温度、pH等水质参数符合鱼类正常生长需求。暴露时间为8周。DBDPE暴露期内,尽量避免草鱼幼鱼死亡。如有死亡现象,及时捞出并补充。
图1 试验结束时不同DBDPE剂量暴露组草鱼幼鱼体长Fig. 1 The final body length of juvenile grass carp in different DBDPE exposure groups
图2 试验开始和试验结束时不同DBDPE剂量暴露组草鱼幼鱼体重Fig. 2 The initial and final body weight of juvenile grass carp in different DBDPE exposure groups
1.2.2 样品处理及氧化应激酶(SOD、CAT和GSH-PX)活性和抗氧化物质(GSH)含量测定
暴露试验结束后,每组随机挑选6尾草鱼幼鱼,置于50 mg·L-1MS222溶液中30秒,麻醉后迅速捞出,测量草鱼幼鱼体重和体长,结果如图1和图2所示。然后解剖草鱼幼鱼,取其肌肉和肝脏等组织。草鱼幼鱼肌肉和肝脏组织液氮速冻后保存于-80 ℃冰箱,用于氧化应激酶活性分析。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)和谷胱甘肽(GSH)测定参照南京建成生物科技有限公司的试剂盒说明书进行。
1.3 数据统计与分析
实验结果均采用平均数±标准差(mean±SD)表示,测定数据采用SPSS19.0 (SPSSInc., Chicago, IL, USA)进行统计分析。采用ANOVA方法分析DBDPE暴露组与对照组之间的差异,分析的差异显著性水平为0.05。
2 结果与分析(Results and analysis)
2.1 DBDPE对草鱼幼鱼肝脏和肌肉组织中SOD活性的影响
研究结果如图3所示,DBDPE暴露8周后,不同剂量DBDPE暴露对草鱼幼鱼肝脏和肌肉组织中SOD活性的影响不同。DBDPE对草鱼幼鱼肝脏组织中SOD活性呈现先诱导后抑制的作用,T1组和T2组草鱼幼鱼肝脏组织中SOD活性分别为345.0 U·g-1和321.3 U·g-1,是对照组的2.52和2.35倍,显著高于对照组(P<0.05)。T3组草鱼肝脏组织中SOD活性(109.8 U·g-1)则显著低于T1和T2暴露组,稍低于对照组,但与对照组无显著性差异(P>0.05)。DBDPE对草鱼幼鱼肌肉组织中SOD活性影响甚微,3个暴露组SOD活性与对照组均无显著性差异(P>0.05)。
2.2 DBDPE对草鱼幼鱼肝脏和肌肉组织中CAT活性的影响
DBDPE暴露对草鱼幼鱼肝脏组织中CAT活性的影响与其对SOD活性的影响相似,也是呈现中低浓度暴露诱导高浓度暴露抑制的趋势(图3)。T1和T2暴露组草鱼幼鱼肝脏组织中CAT活性相比对照组显著升高(P<0.05),CAT活性分别为0.112和0.099 U·g-1。T3暴露组草鱼幼鱼肝脏组织中CAT活性则受到抑制,最终降低至0.049 U·g-1,与对照组相比抑制率为7.9%,但无显著性差异(P>0.05)。草鱼幼鱼暴露组肌肉组织中CAT活性与对照组相比没有显著性差异(P>0.05)。
2.3 DBDPE对草鱼幼鱼肝脏和肌肉组织中GSH-PX活性的影响
DBDPE暴露8周后,草鱼幼鱼肝脏组织GSH-PX活性在T1和T2暴露组表现为诱导,应激性升高,在T3暴露组酶活性降低,呈现抑制作用。T1暴露组中草鱼肝脏GSH-PX活性最高(128.8 pmol·g-1),显著诱导了GSH-PX活性(P<0.05),比对照组升高204.5%;T2暴露组GSH-PX活性(95.4 pmol·g-1)虽显著低于T1暴露组(P<0.05),但仍显著高于对照组(42.3 pmol·g-1)(P<0.05)。T3暴露组GSH-PX活性降低为36.0 pmol·g-1,与对照组相比抑制率为15.0%,但是无显著性差异(P>0.05)。草鱼幼鱼肌肉组织中GSH-PX活性随着DBDPE暴露浓度的升高呈现降低的趋势。T1暴露组GSH-PX活性和对照组无显著性差异(P>0.05),而T2和T3暴露组GSH-PX活性低于对照组,抑制率分别为14.7%和11.4%(P<0.05)。
2.4 DBDPE对草鱼幼鱼肝脏和肌肉组织中GSH含量的影响
DBDPE暴露使草鱼幼鱼肝脏组织中GSH的含量呈现先升高后降低的趋势(图3)。T1和T2暴露组草鱼幼鱼肝脏组织中GSH含量比对照组显著升高了130.4%和121.8%(P<0.05),而T3暴露组中GSH含量降低,显著低于T1暴露组(P<0.05),但与对照组相比没有显著性差异(P>0.05)。草鱼幼鱼肌肉组织中,对照组GSH含量为1.12 ng·g-1,暴露组(T1、T2、T3)GSH含量分别为1.09 ng·g-1、1.12 ng·g-1和1.10 ng·g-1,对照组和暴露组之间没有显著差异(P>0.05)。
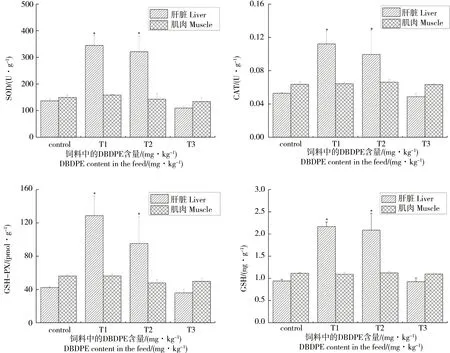
图3 不同DBDPE暴露水平对草鱼幼鱼肝脏和肌肉组织中氧化应激酶(SOD、CAT和GSH-PX)和抗氧化物质(GSH)的影响Fig. 3 Effect of exposure to DBDPE on SOD, CAT, GSH-PX activities and GSH level in liver and muscle of juvenile grass carp
3 讨论(Discussion)
目前国内外针对DBDPE毒理学研究较少,且已有的研究结果不一致,DBDPE对水生生物的危害机理至今还没有明确的结论[1,15-17]。如Hardy等[1]研究表明110 mg·L-1DBDPE暴露不会对3种水生生物(鱼、海藻、水蚤)产生急性毒性,但Nakari和Huhtala[15]则发现DBDPE暴露不仅可对水蚤造成急性毒性,还会影响斑马鱼的生殖生理机制。鉴于其在环境中的稳定性和持久性,开展DBDPE对水生生物危害研究具有重要意义。
外源性化学物质进入机体,在正常生理条件下,机体会产生相应抗氧化防御机制,来对抗活性中间体的损伤,使活性中间体和自由基在不断产生的同时也被不断的清除,维持机体平衡。但是如果活性中间代谢物在体内过度积累,就会造成有机体防御功能紊乱。抗氧化防御系统的活性成分或含量会因污染物的胁迫而发生改变,因而可间接反映环境中污染物的存在[18]。氧化应激酶活性与生物的免疫水平密切相关[19]。SOD、CAT、GSH-PX和GSH是机体内最主要的抗氧化酶和抗氧化物质。SOD可催化超氧阴离子自由基转化为H2O2和O2,在维持生物体内的自由基产生和消除的动态平衡中起重要作用。CAT可催化细胞内H2O2分解为水和氧分子,在减轻活性氧对机体细胞的氧化损伤中起着重要的调节作用。GSH-PX也可分解H2O2,当机体内CAT含量很少或是在H2O2很低的组织中可代替CAT清除H2O2,不仅可以清除脂类氢过氧化物,还可广泛的清除有机氢过氧化物[20]。SOD、CAT和GSH-PX活性的变化可以间接反应生物体在环境的改变下体内的抗氧化状态,均可作为机体受到胁迫的生物标志物。
本文研究结果表明,DBDPE的暴露会影响草鱼幼鱼肝脏和肌肉组织的抗氧化防御系统。随着DBDPE暴露水平的升高,草鱼幼鱼肝脏组织中氧化应激酶(SOD、CAT和GSH-PX)和抗氧化物质(GSH)均表现出低浓度诱导及高浓度抑制效应。肌肉组织中GSH-PX酶活性则在高浓度DBDPE暴露下受到抑制。这可能是由于机体可以通过有效的抗氧化防御机制来调节氧自由基的平衡。当生物体受到环境轻度污染胁迫时,鱼体内产生活性氧自由基,抗氧化酶活性升高,发挥作用,抵御和适应过氧化对机体的不利影响;而当受到环境重度污染胁迫时,机体产生大量氧自由基,超过了机体抗氧化酶的清除能力,抗氧化酶活性受到抑制,导致肝组织损伤使生物体内积累过量的活性氧,从而使生物体受到损害[21-22]。上述现象在以往的研究中也有发现。有研究报道DBDPE的结构类似物BDE-209可以诱导紫红笛鲷产生氧化应激效应。研究发现2、10、50及250 μg·L-14个暴露浓度条件下,BDE-209可以显著促进紫红笛鲷鳃组织中SOD和CAT活性,且随着暴露时间延长CAT活性呈现逐渐增加的趋势[19]。聂凤琴等[23-24]采用5.6~100.0 mg·L-1的BDE-209处理鲫鱼肝脏组织30 min,发现各试验组SOD、CAT和GSH-PX活性随着BDE-209暴露浓度的增加而下降。王桂燕等[25]则发现草鱼肝胰脏SOD活性在四氯乙烯胁迫时呈现低浓度诱导高浓度抑制的效应,而肾脏SOD活性则在暴露24 h和48 h时低浓度时受到抑制高浓度时被诱导。孙梦蝶等[26]研究表明暴露于10 μg·L-1多氯联苯中的大弹涂鱼SOD活性明显大于对照组和100 μg·L-1剂量组(P<0.05),且多氯联苯暴露组中的大弹涂鱼CAT活性均高于对照组;该研究还发现暴露于100 μg·L-1剂量组的大弹涂鱼GSH-PX活性明显高于其他组,表明较高浓度多氯联苯对大弹涂鱼GSH-PX活性有较好的诱导作用。Feng等[16]研究发现DBDPE暴露可影响鲫鱼肝脏组织的抗氧化防御系统,且氧化应激酶活性的改变和染毒剂量及暴露时间有关。10 mg·kg-1DBDPE暴露7、14、30 d和50 mg·kg-1暴露7、30 d以及100 mg·kg-1暴露7、14 d均可造成鲫鱼肝脏组织中SOD和CAT活性明显降低(P<0.01);而50 mg·kg-1暴露14 d和100 mg·kg-1暴露30 d的鲫鱼肝脏组织中SOD活性则显著升高(P<0.01)。本文研究结果与Feng等的研究结果不完全一致,可能与受试物种及暴露方式不同有关。Feng等的研究是将DBDPE溶于玉米油中配成不同的浓度,再通过腹腔注射的方式对鲫鱼进行DBDPE暴露,DBDPE更容易被鱼体吸收,而本试验是以饲料添加的方式对草鱼幼鱼进行暴露。另外,试验结束后,血清学指标检测结果显示:T3剂量暴露组(3 000 mg·kg-1)草鱼幼鱼血清中低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、胆固醇(TC)及葡萄糖(GLU)等浓度最低,随着DBDPE暴露浓度的增加,上述血清学指标有逐渐下降的趋势。肝脏组织切片结果显示:T3剂量暴露组(3 000 mg·kg-1)草鱼幼鱼肝脏细胞直径最大,肝细胞出现肿大现象,这说明DBDPE对草鱼幼鱼肝脏毒性比较明显。综上所述,本研究研究成果在一定程度上证实了DBDPE对草鱼幼鱼产生氧化胁迫效应,而且肌肉和肝脏组织表现完全不同的胁迫效应,肝脏毒性效应明显。草鱼幼鱼肝脏组织中SOD、CAT和GSH-PX活性以及GSH含量可以较好的表征其受到的DBDPE胁迫效应。
[1] Hardy M L, Krueger H O, Blankinship A S, et al. Studies and evaluation of the potential toxicity of decabromodiphenyl ethane to five aquatic and sediment organisms [J]. Ecotoxicology and Environmental Safety, 2012, 75(1): 73-79
[2] Kierkegaard A, Sellstrom U, McLachlan M S. Environmental analysis of higher brominated diphenyl ethers and decabromodiphenyl ethane [J]. Journal of Chromatography A, 2009, 1216(3): 364-375
[3] Venier M, Hites R A. Flame retardants in the atmosphere near the Great Lakes [J]. Environmental Science & Technology, 2008, 42(13): 4745-4751
[4] Covaci A, Harrad S, Abdallah M A E, et al. Novel brominated flame retardants: A review of their analysis, environmental fate and behavior [J]. Environment International, 2011, 37(2): 532-556
[5] Law K, Halldorson T, Danell R, et al. Bioaccumulation and trophic transfer of some brominated flame retardants in a Lake Winnipeg (Canada) food web [J]. Environmental Toxicology and Chemistry, 2006, 25(8): 2177-2186
[6] Gauthier L T, Potter D, Hebert C E, et al. Temporal trends and spatial distribution of non-polybrominated diphenyl ether flame retardants in the eggs of colonial populations of Great Lakes herring gulls [J]. Environmental Science & Technology, 2009, 43(2): 312-317
[7] Zhang X L, Luo X J, Chen S J, et al. Spatial distribution and vertical profile of polybrominated diphenyl ethers, tetrabromobisphenol A, and decabromodiphenyl ethane in river sediment from an industrialized region of South China [J]. Environmental Pollution, 2009, 157(6): 1917-1923
[8] Tian M, Chen S J, Wang J, et al. Atmospheric deposition of halogenated flame retardants at urban, e-waste, and rural locations in Southern China [J]. Environmental Science & Technology, 2011, 45(11): 4696-4701
[9] Li W, Zhu L, Zha J, et al. Effects of decabromodiphenyl ether (BDE-209) on mRNA transcript ion of thyroid hormone pathway and spermatogenesis associated genes in Chinese rareminnow (Gobiocypris rarus) [J]. Environmental Toxicology, 2014, 29(1): 1-9
[10] Noyes P D, Hinton D E, Stapleton H M. Accumulation and debromination of decabromodiphenylether (BDE-209) in juvenile fathead minnows (Pimephales promelas) induces thyroid disruption and liver alterations [J]. Toxicological Sciences, 2011, 122(2): 265-274
[11] Qin X, Xia X, Yang Z, et al. Thyroid disruption by technical decabromodiphenyl ether (DE-83R) at low concentrations in Xenopus laevis [J]. Journal of Environmental Sciences, 2010, 22(5): 744-751
[12] Wang F X, Wang J, Dai J Y, et al. Comparative tissue distribution, biotransformation and associated biological effects by decabromodiphenyl ethane and decabrominated diphenyl ether in male rats after a 90-day oral exposure study [J]. Environmental Science &Technology, 2010, 44(14): 5655-5660
[13] Tseng L H, Li M H, Tsai S S, et al. Developmental exposure to decabromodiphenyl ether (BDE-209): Effects on thyroid hormone and hepatic enzyme activity in male mouse offspring [J]. Chemosphere, 2008, 70(4): 640-647
[14] Lee E, Kim T H, Choi J S, et al. Evaluation of liver and thyroid toxicity in Sprague-Dawley rats after exposure to polybrominated diphenyl ether BDE-209 [J]. The Journal of Toxicological Sciences, 2010, 35(4): 535-545
[15] Nakari T, Huhtala S. In vivo and in vitro toxicity of decabromodiphenyl ethane, a flame retardant [J]. Environmental Toxicology, 2010, 25(4): 333-338
[16] Feng M, Li Y, Qu R, et al. Oxidative stress biomarkers in freshwater fish (Carassius auratus) exposed to decabromodiphenyl ether and ethane, or their mixture [J]. Ecotoxicology, 2013, 22(7): 1101-1110
[17] Feng M, Qu R, Wang C, et al. Comparative antioxidant status in freshwater fish (Carassius auratus) exposed to six current-use brominated flame retardants: A combined experimental and theoretical study [J]. Aquatic Toxicology, 2013, 140-141(9): 314-323
[18] Diguiseppi J L, Fridovich I. Induction of superoxide dismutases in Escheriehia coli by manganese and iron [J]. Journal of Bacteriology, 1984, 160(1):137-142
[19] 张喆, 王学锋, 马胜伟, 等. 十溴联苯醚(BDE-209)对紫红笛鲷鳃抗氧化酶活性的影响[J]. 生态毒理学报, 2013, 8(1): 42-48
Zhang Z, Wang X F, Ma S W, et al. Effects of decabromodiphenyl ether (BDE-209) on antioxidant enzyme activities in gills of Lutjanus argentimaculatus [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 42-48 (in Chinese)
[20] 亢玉静, 郎明远, 赵文. 水生生物体内抗氧化酶及其影响因素研究进展[J]. 微生物学杂志, 2013, 33(3): 75-80
Kang Y J, Lang M Y, Zhao W. Advance in antioxidant enzymes and its effect factors in aquatic organisms [J]. Journal of Microbiology, 2013, 33(3): 75-80 (in Chinese)
[21] Zhang X, Yang F X, Zhang X L, et al. Induction of hepatic enzymes and oxidative stress in Chinese rare minnow (Gobiocypris rarus) exposed to waterborne hexabromocyclododecane (HBCDD) [J]. Aquatic Toxicology, 2008, 86(1): 4-11
[22] Li Z H, Zlabek V, Velisek J, et al. Modulation of antioxidantdefence system in brain of rainbow trout (oncorhynchus mykiss) after chronic carbamazepine treatment [J]. Comparative Biochemistry and Physiology, 2010, 151(1): 137-141
[23] 聂凤琴, 瞿建宏, 杨光, 等. 离体条件下十溴联苯醚暴露对鲫鱼肝脏线粒体的氧化损伤[J]. 安全与环境学报, 2008, 8(5): 5-8
Nie F Q, Qu J H, Yang G, et al. Oxidative damage of decabromodiphenyl ether to the mitochondria from the liver of Carassius auratus in vitro [J]. Journal of Safety and Environment, 2008, 8(5): 5-8 (in Chinese)
[24] 吴伟, 聂凤琴, 瞿建宏. 多溴联苯醚对鲫鱼离体肝脏组织中CAT和GSH-PX的影响[J]. 生态环境学报, 2009, 18(2): 408-413
Wu W, Nie F Q, Qu J H. The in vitro effects of tetrabromodiphenyl ether and decabromodiphenyl ether on the activities of catalase and glutathione peroxidase in the liver of Carassius auratus [J]. Ecology and Environmental Sciences, 2009, 18(2): 408-413 (in Chinese)
[25] 王桂燕, 李锋, 史济月, 等. 四氯乙烯胁迫对草鱼抗氧化酶活性的影响及其机理[J]. 中国环境科学, 2014, 34(6): 1579-1585
Wang G Y, Li F, Shi J Y, et al. Effect of perchloroethylene on activities of antioxidant enzyme in grass carp and its mechanism [J]. China Environmental Science, 2014, 34(6): 1579-1585 (in Chinese)
[26] 孙梦蝶, 马满华, 张倩, 等. 多氯联苯对大弹涂鱼的急性毒性以及氧化应激[J]. 河北渔业, 2010, 6: 1-3
Sun M D, Ma M H, Zhang Q, et al. Effects of PCBs on acute toxication and oxidative stress in Boleophthalmus pectinirostris [J]. He-Bei Fisheries, 2010, 6: 1-3 (in Chinese)
◆
Oxidative Stress Effects of Decabromodiphenylethane on the Liver and Muscle Tissues of Juvenile Grass Carp (Ctenopharyngodonidellus)
Han Qian1,3, Zhang Lijuan1, Hu Guocheng1,*, Yu Yunjiang1, Gan Lian2, Cui Ke2, Huang Chushan1
1. South China Institute of Environmental Sciences, Ministry of Environmental Protection, Guangzhou 510655, China; 2. South China Agricultural University, Guangzhou 510655, China 3. State Environmental Protection Key Laboratory of Drinking Water Source Management and Technology, Shenzhen Key Laboratory of Water Source Protection, Shenzhen Academy of Environmental Sciences, Shenzhen 518001, China
The risk of decabromodiphenyl ethane (DBDPE) has become a raising concern due to its wide use as a brominated flame retardant, however, the toxicity of DBDPE on aquatic species was rarely studied. The effects of DBDPE on the activities of SOD, CAT, and GSH-PX and GSH content in liver and muscle tissues of juvenile grass carp (Ctenopharyngodon idellus) were investigated by feeding the fish with food contaminated at three concentration of 500, 1 000 and 3 000 mg·kg-1. In addition, a control group was also included. Results showed that the activities of SOD, CAT, and GSH-PX and GSH content in the tissues of fish were all enhanced at low concentration but inhibited at high concentration after 8-week exposure to DBDPE. The activities of SOD, CAT, and GSH-PX and GSH content in the liver tissues of the grass carp being exposed to DBDPE at 500 and 1 000 mg·kg-1were significantly higher than the control (P<0.05), and the highest activities were observed at the exposure concentration of 500 mg·kg-1. Conversely, the activities of SOD, CAT, and GSH-PX and GSH content in the liver tissues of the fish being exposed to 3 000 mg·kg-1were not significantly different from the control (P>0.05). The effects of DBDPE on the activities of SOD, CAT, and GSH-PX and GSH content in the muscle tissues were limited. There was no significant difference between the activities of DBDPE-exposed and control groups (P>0.05). It was concluded that DBDPE exposure would induce oxidative stress in the liver tissues of juvenile grass carp.
decabromodiphenyl ethane; juvenile grass carp; oxidative stress; liver; muscle
10.7524/AJE.1673-5897.20150715004
国家自然科学基金青年基金(21107028,31202007);国家自然科学基金面上项目(21377045);广东省自然科学基金(2014A030310002)
韩倩(1986-),女,博士,助理研究员,研究方向为环境与健康,E-mail:hanqian@scies.org
*通讯作者(Corresponding author), E-mail: huguocheng@scies.org
2015-07-15 录用日期:2015-09-17
1673-5897(2016)2-680-07
X171.5
A
简介:胡国成(1978—),男,生态学博士,高级工程师,主要研究方向为水生生态毒理学、环境与健康、环境健康风险评价,发表学术论文30余篇。
韩倩, 张丽娟, 胡国成, 等. 十溴二苯乙烷对草鱼幼鱼肝脏和肌肉组织氧化应激效应的影响[J]. 生态毒理学报,2016, 11(2): 680-686
Han Q, Zhang L J, Hu G C, et al. Oxidative stress effects of decabromodiphenylethane on the liver and muscle tissues of juvenile grass carp (Ctenopharyngodon idellus) [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 680-686 (in Chinese)

