电子垃圾拆解地区人体双酚A内暴露及与氧化应激效应的关联研究
杨巧云,邱兴华,李克秋,李光,#
1. 天津医科大学 公共卫生学院,天津 300070 2. 北京大学 环境科学与工程学院,北京 100871 3. 天津医科大学 基础医学院,天津 300070
电子垃圾拆解地区人体双酚A内暴露及与氧化应激效应的关联研究
杨巧云1,2,邱兴华2,,李克秋3,李光3,#
1. 天津医科大学 公共卫生学院,天津 300070 2. 北京大学 环境科学与工程学院,北京 100871 3. 天津医科大学 基础医学院,天津 300070
中国已成为全球电子垃圾的主要回收地之一,电子垃圾拆解造成的污染物人体暴露及健康效应备受关注。尤其是在粗放的拆解方式下,释放的双酚A (bisphenol A,BPA)等污染物暴露以及对拆解地区人群的健康影响是重要的科学问题。选取中国北方某电子垃圾拆解地区(即暴露地区)人群为研究对象(包括29名电子垃圾拆解从业者和24名当地居民),以40 km外无电子垃圾拆解地区的人群(N=53)作为参照。暴露地区人群尿液中BPA浓度(中值:10.7 μg·g-1肌酐)显著高于参照地区人群(中值:0.66 μg·g-1肌酐;P < 0.01),提示电子垃圾拆解活动可能造成当地人群对BPA的高暴露。暴露地区人群的尿液8-羟基脱氧鸟苷(8-OHdG;中值:236 μg·g-1肌酐)高于参照人群(中值:142 μg·g-1肌酐),统计结果接近显著(P = 0.055)。暴露地区人群血清中谷胱甘肽S转移酶(GSH-ST)与铜/锌-超氧化物歧化酶(Cu/Zn-SOD)含量较参照组显著降低;而谷胱甘肽过氧化物酶(GSH-Px)显著高于参照组(P < 0.01)。BPA与8-OHdG显著正相关(P < 0.05)、与GSH-ST负相关(P < 0.01);多元回归结果显示,尿液中BPA浓度每上升1倍,8-OHdG升高34.9%(95%CI:19.4%~52.3%),而GSH-ST下降5.46%(95%CI:1.17%~9.56%)。本研究显示,电子垃圾拆解可导致该地区人群对BPA的高暴露,这种暴露可导致氧化应激包括对DNA的氧化损伤。
双酚A;氧化损伤;8-羟基脱氧鸟苷;抗氧化酶;电子垃圾拆解;健康风险
Received 26 November 2015 accepted 29 January 2016
电子垃圾(electronic waste,e-waste)拆解所导致污染物的人体暴露及相应的健康效应备受关注。据估计,目前全球电子垃圾的年产生量可达到2 000~5 000万吨,年增长速率约为3%~5%。尽管“巴塞尔”等国际公约明确禁止有害废物的跨国转运,但每年仍有大约72%的电子垃圾进入中国,使得中国成为重要的电子垃圾回收地[1]。前期研究表明,粗放的拆解回收方式中,阻燃剂和多环芳烃等环境污染物释放,并可能通过呼吸道和皮肤接触进入电子垃圾拆解地区人群的体内,并造成不利的健康影响[2-3]。
双酚A(bisphenol A,BPA)是一种典型的环境内分泌干扰物,主要用于生产环氧树脂和聚碳酸醋,并广泛应用于电路印刷版、塑料制品、食品罐内壁涂层等。BPA也是产量最大的有机化工原料之一,全世界年均产量超过27万吨,其中有100余吨被排放进入大气环境[4]。尤其是在电子垃圾拆解地区大气中BPA浓度极高,如Bi等[5]发现在电子垃圾拆解地区大气颗粒物中BPA浓度达(1.11±0.16) μg·m-3。但目前关于拆解地区人群的BPA暴露水平仍少见报道。
BPA可能导致慢性疾病的发生,如糖尿病[6]、肥胖[7]、内分泌系统紊乱[8]、心血管疾病[9]等。研究表明,内分泌干扰、线粒体功能障碍以及氧化应激可能是BPA导致健康效应的潜在机制[4],其中氧化应激损伤是研究关注的焦点。BPA能够促进体内活性氧簇(reactive oxygen species,ROS)的产生,ROS进而攻击生物大分子包括脂质、蛋白质和核糖核酸等,并激活或抑制相关的信号通路。此外,BPA还可能导致抗氧化系统紊乱,从而破坏体内的氧化还原平衡[10-11]。研究表明,小鼠胚胎、脑、肾和睾丸暴露于BPA后,硫代巴比妥酸反应物质上升,维生素C联合给药后可逆转BPA对大鼠肝和脑组织的氧化损伤[12]。流行病学结果显示,人群尿液中的BPA浓度分别与丙二醛(malondialdehyde,MDA)[13]、8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)[13-14]呈正相关,提示BPA暴露与氧化应激的关联。在这些指示氧化损伤的标志物中,MDA是不饱和脂肪酸的过氧化产物,主要用于评价脂质氧化损伤水平[15]。8-OHdG是DNA中碱基受到自由基(如·OH)的攻击,在不同碳位上形成羟基,并与脱氧核糖核酸或核糖核酸结合后导致配对过程中发生错配或DNA链断裂。8-OHdG是细胞核内、线粒体中反映自由基诱导的氧化损伤形成的主要生物标志物[16-17]。尿液中MDA、8-OHdG或血清中抗氧化物酶,如谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD),不仅是机体受外源污染物暴露诱导氧化应激水平改变的标志物,同时也与疾病发生、发展存在密切的联系[18-19]。
本研究中,选取北方某电子垃圾拆解地区人群作为研究对象,以尿液中BPA作为内暴露标志物,评价电子垃圾拆解对人体BPA暴露的影响;以尿液MDA和8-OHdG以及血清中抗氧化物酶浓度评价该人群的氧化损伤。通过建立BPA内暴露与氧化应激标志物之间的关联,探索电子垃圾拆解造成的BPA人群暴露风险,为其潜在的健康效应提供流行病学证据。
1 材料与方法(Materials and methods)
1.1 研究对象
2009~2010年期间,在天津市招募53名居住在电子垃圾拆解地区(38.825°N,116.777°E)的人群作为暴露组,其中包括29名从事电子垃圾拆解的工人和24名居住在该地区但并未从事拆解工作的普通居民。以53名居住在40 km外地区(38.363°N,117.135°E)的健康人群为参照。使用15 mL聚丙烯采样管收集当日晨尿,使用非抗凝分离胶真空采血管采集空腹外周血,670 g离心10 min分离出血清。所有尿液和血清当天运回实验室,并于-20 ℃保存以待分析。
所有研究对象在采样前均签署知情同意;医学伦理由天津医科大学批准。通过调查问卷进行面对面访问,内容包括研究对象的年龄、性别、体重指数(body mass index,BMI)、职业、生活习惯、饮食习惯、生育健康及可能的接触史等。
1.2 实验材料
实验用丙酮、正己烷、二氯甲烷、甲醇和纯水等试剂均为农残或以上级别,均购自Thermo Fisher Scientific公司(Fair Lawn, NJ, USA)。氢氧化钠、氯化钾购、硅胶、无水硫酸钠和葡萄糖醛酸-硫酸酯酶均购自Sigma-Aldrich公司(St. Louis, MO, USA),其中硅胶使用前经150~160 ℃烘烤过夜,无水硫酸钠经马弗炉450 ℃烘烤4 h。分析纯的磷酸、醋酸等购自天津科密欧化学试剂开发中心和北京化工厂。
XTerra RP-C18反相色谱柱(5 μm,3.9 mm×150 mm)和RP-C18反相色谱柱(5 μm,4.6 mm×250 mm)均购自Waters公司(Milford,MA,USA)。C18固相萃取柱(Bond Elut-Certify,500 mg,6 mL)和DB-5MS毛细管色谱柱(0.25 μm,0.25 mm×30 m)购自Agilent公司(St. Clara,CA,USA)。
BPA标准品购自AccuStandard公司(New Haven, CT, USA)。MDA、GSH和SOD等抗氧化物酶所用试剂盒均购自南京建成科技公司(江苏,中国);8-OHdG的标准品购自Sigma-Aldrich公司。
1.3 尿液BPA分析方法
移液管取2 mL尿液,加入d16-BPA作为回收率指示物。滴入适量0.5 mol·L-1HCl和1 mol·L-1的CH3COOH-CH3COONa缓冲溶液,调节pH至5.5,加入葡糖糖醛酸-硫酸酯酶并在37 ℃下水浴振荡12 h酶解。每次以2 mL 9:1 (V:V)正己烷与甲基叔丁基醚混合溶剂提取,振荡、离心,重复3次。合并上清液并使用高纯氮气吹扫浓缩至近干,加入100 μL甲醇和1 mL新制重氮甲烷乙醚溶液,30 ℃恒温避光衍生5 h。衍生及氮吹浓缩后,转移至硅胶层析柱(0.6 cm i.d.×6 cm,上部填充0.5 cm的无水硫酸钠),依次用8 mL正己烷、8 mL正己烷-二氯甲烷(3:2,V/V)混合溶剂、以及8 mL二氯甲烷淋洗层析柱,BPA在第3个组分中。将洗脱液浓缩并转移至进样瓶中,加入内标并利用气相色谱-质谱联用(Agilent 7890-5975)进行分析。
以高纯氦气为载气,流速1.0 mL·min-1。进样口和传输线温度分别设定为250 ℃和280 ℃,无分流进样模式,进样体积1 μL。使用30 m DB-5MS色谱柱,升温程序如下:50 ℃保留1 min,以8 ℃·min-1升至250 ℃,以5 ℃·min-1至280 ℃并保留5 min。使用电子轰击电离(EI)源,离子源、四级杆温度分别为230 ℃和150 ℃。
d16-BPA的回收率为(78.1±10.6)%。空白加标的回收率为(73.9±1.5)%。
1.4 尿液MDA、8-OHdG分析方法
尿液MDA、8-OHdG和肌酐的检测方法详见已发表的论文[2]。BPA、MDA及8-OHdG尿液浓度均经尿肌酐校正。
1.5 血清中抗氧化物酶浓度测定
采用试剂盒的方法定量分析血清中GSH、谷胱甘肽S转移酶(glutathione S-transferase, GSH-ST)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、SOD和铜/锌-超氧化物歧化酶(Cu/Zn-superoxide dismutase, Cu/Zn-SOD)。
1.6 数据统计与分析
使用SPSS17.0(SPSS Inc.)进行数据分析。数据经正态性检验,符合正态分布的数据采用T检验方法比较均值,不符合正态分布的数据采用Mann-Whitney检验。相关性分析采用Pearson或Spearman检验;经对数转换后的污染物与氧化应激损伤指标采用线性回归模型(逐步回归)进行进一步分析。检验显著水平为0.05。
2 结果(Results)
2.1 尿液中BPA及其氧化应激损伤标志物
106名研究对象中(见表1),从事电子垃圾拆解工作者29人,平均工作年限7.1年;未从事拆解活动的暴露地区居民24人。暴露组与参照组人群性别、是否吸烟、是否饮酒、BMI等因素均无显著差异。年龄上的显著差异,将在后续的分析中作为混杂因素进行剔除。根据BPA的主要暴露来源,本研究调查了聚碳酸酯材质水杯使用及补牙情况等,水杯材质调查在两组人群中未见差异。
本研究对尿液中BPA的检出率为100%,暴露地区人群尿液BPA水平为10.7 μg·g-1肌酐,显著高于参照地区人群(中值:0.66 μg·g-1肌酐;P < 0.01)。暴露地区,拆解工人与普通居民尿液BPA无显著差异(P = 0.183;如图2),但均显著高于参照地区。两组BPA与氧化应激指标的分布特征如表2,两组人群的尿液MDA存在显著差别,但参照组水平高于暴露组。暴露地区拆解工人与普通居民的尿液8-OHdG无显著差异(P = 0.347),二者略高于参照人群,统计结果接近显著(P = 0.055;如图2)。GSH-ST与Cu/Zn-SOD均为暴露地区人群含量较参照组显著降低;而前者的血清GSH-Px均值为67.8 U·mL-1,高于参照(均值:50.9 U·mL-1),P < 0.01。
2.2 BPA与两种氧化应激损伤标志物的相关关系
如表3所示,尿液BPA与8-OHdG、MDA均显著相关。其中BPA与8-OHdG呈正相关(P < 0.01);与MDA呈负相关(P < 0.05)。年龄分别与BPA、GSH-Px显著正向关联,而与MDA、GSH-ST呈负相关。氧化损伤指标与抗氧化物酶中,仅MDA与GSH-ST显著相关(P < 0.01)。
线性回归分析中(见表4),纳入性别、年龄、BMI、饮酒等混杂因素后,尿液8-OHdG水平与BPA仍呈线性相关,随BPA暴露水平的上升,8-OHdG随之升高(β:0.43;95%CI:0.26~0.61);GSH-ST则随BPA的上升而下降(β:-0.081;95%CI:-0.15~0.017)。逐步回归模型中,未发现MDA、GSH、GSH-Px、SOD及Cu/Zn-SOD与BPA之间具有统计学意义的关联。
3 讨论(Discussion)
3.1 电子垃圾拆解地区人群BPA的高暴露
目前,关于电子垃圾地区污染物多集中于持久性有机污染物,如多溴联苯醚(polybrominated biphenyl ethers, PBDEs)和多氯联苯(polychlorinated biphenyls, PCBs)等,或印制电路板(printed circuit boards, PCBs)等释放的铅(Pb)、铜(Cu)、锌(Zn)等重金属。电子垃圾拆解地区BPA的环境浓度报道较少,且缺乏人群内暴露水平的研究。大气环境目前仅Bi等[5]采集广东省贵屿地区电子垃圾拆解区域总悬浮颗粒物,其中BPA浓度高达(1.11±0.16) μg·m-3,比其他地区高2~3个数量级(Li和Wang[20]研究表明,中国城市地区大气颗粒物中BPA浓度为1.0~2.0 ng·m-3)。其他环境介质中,中国南部典型拆解地区的水体中也能够检出BPA,平均浓度是4.0×102ng·L-1;沉积物中BPA浓度均值为1.0×102ng·g-1[21]。由于BPA是合成聚碳酸酯(polycarbonate,PC)和环氧树脂(epoxy resins)的主要原料,这些聚合材料广泛用于电子设备中;而研究表明,印制电路板或其他含PC或环氧树脂的电子垃圾可经热解和水解致聚碳酸酯链断裂,从而释放BPA[22]。此外,BPA还可能来自于阻燃剂四溴双酚A (tetrabromobisphenol A,TBBPA)的脱溴降解[21]。同样在广东贵屿地区,新生儿脐带血BPA浓度(6.4 μg·L-1)是参照地区的2~3倍[23]。上述研究表明,电子垃圾拆解可能导致大气、水、土壤等BPA环境浓度的上升,并可能造成当地人群的高暴露。

图1 暴露地区(拆解工人、周边普通居民)与参照地区人群尿液BPA、8-OHdG的浓度分布 注:箱式图上下边线分别为25th %和75th %分位数,箱式外上下短横线为10th %和90th %分位数。箱式内黑色实线为中位数、虚线为均值。括号内数字为有检出的样本数。Fig. 1 Difference of urinary concentrations of BPA and 8-OHdG among e-waste dismantling workers, local residents and reference populationsNote: The boundary of the box represent the 25th and 75th percentiles, respectively. The whiskers represent the 10th and 90th percentiles, respectively. The black horizontal line within box represents the median. The black dash line represents the mean. Numbers in parentheses are the sample size.

表1 人群基本信息
注:a. Chi-square test; b. Mann-Whitney test; c. Student’s t-test。
Note: a. Chi-square test; b. Mann-Whitney test; c. Student’s t-test.
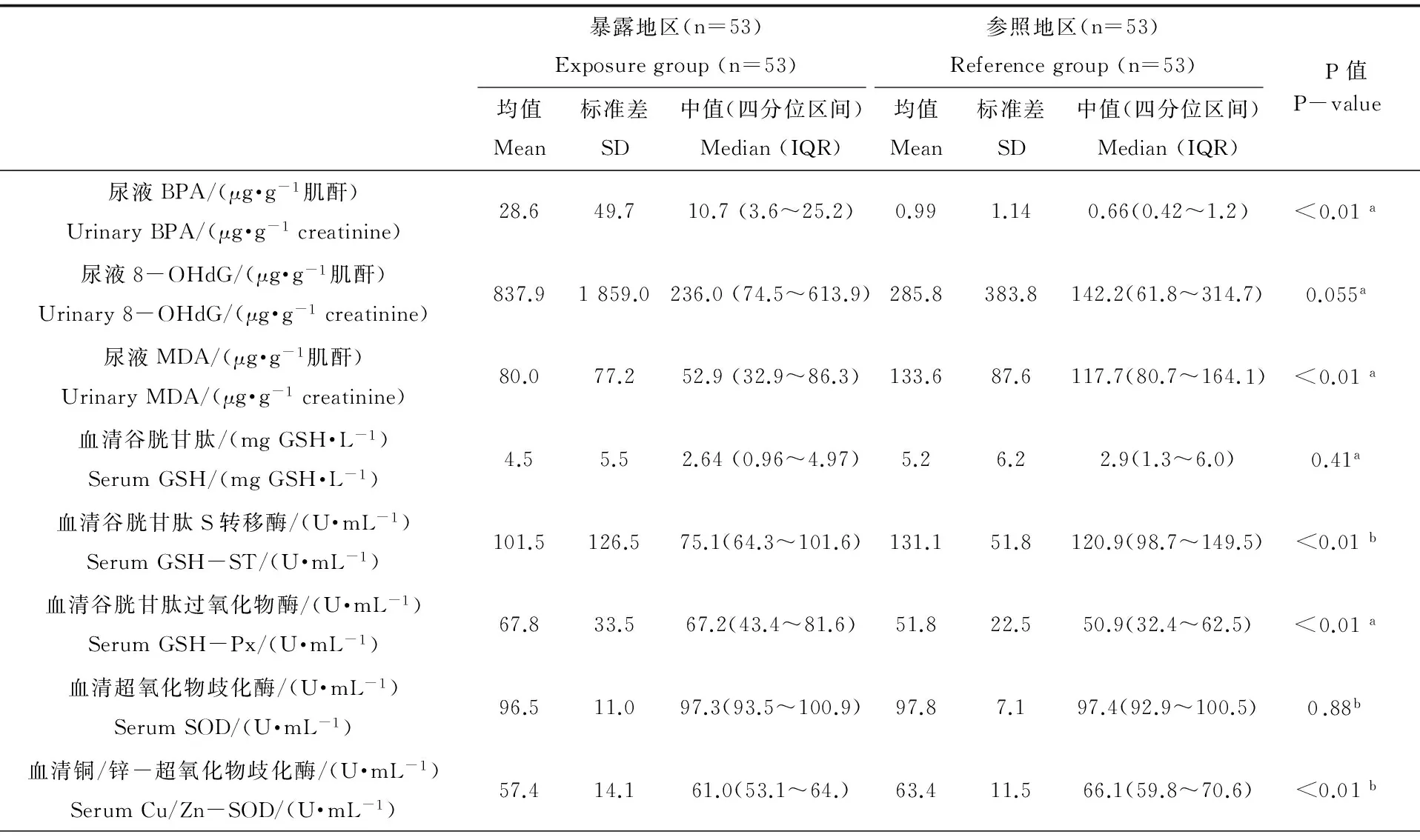
表2 两组人群尿液中BPA以及其他氧化应激指标的特征
注:a. Student’s t-test;b. Mann-Whitney test。
Note: a. Student’s t-test; b. Mann-Whitney test.
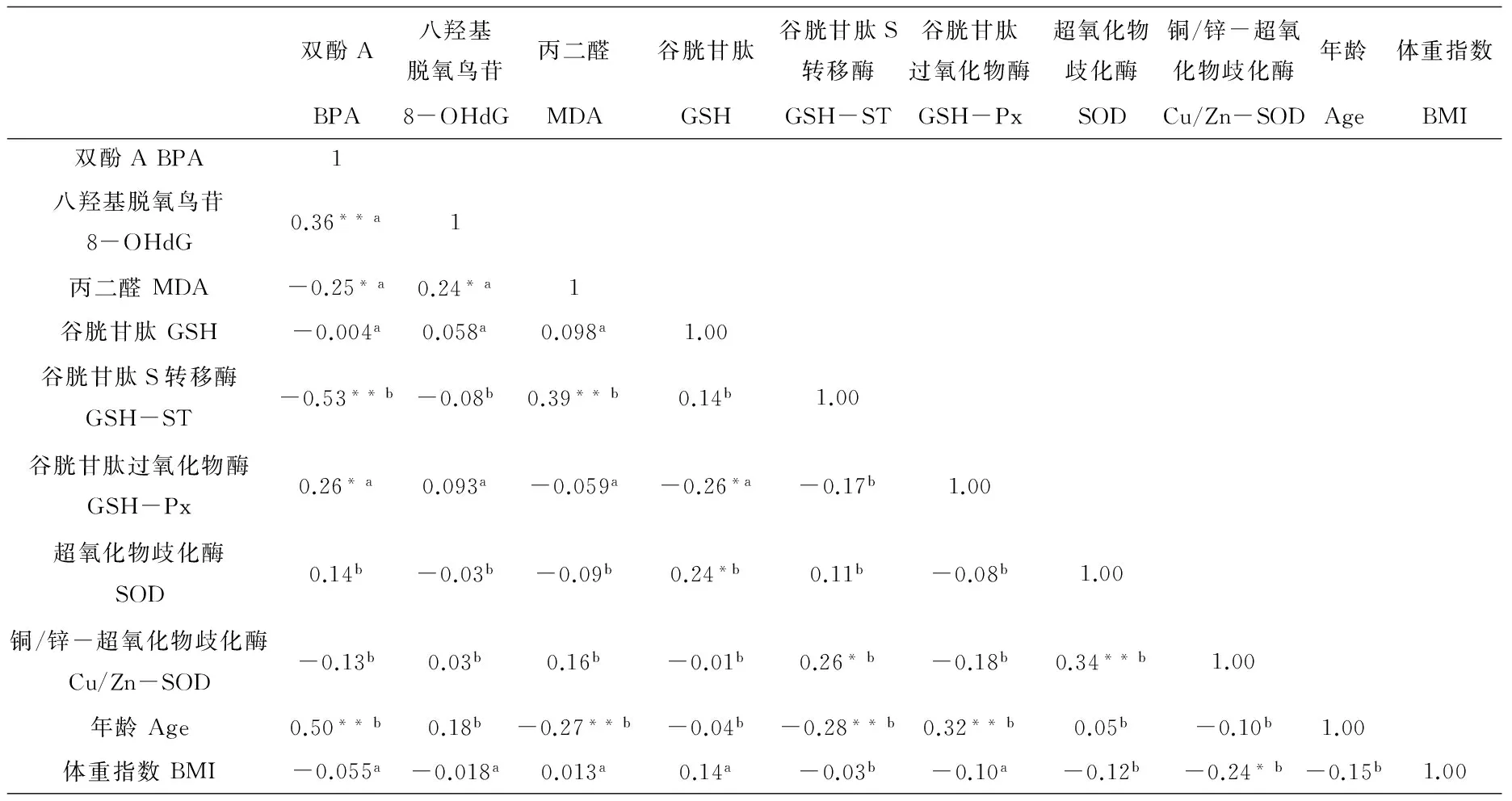
表3 BPA与年龄、BMI、MDA、8-OHdG相关关系
注:* P < 0.05,** P < 0.01,a. Pearson相关系数,b. Spearman相关系数。
Note: * P < 0.05, ** P < 0.01, a. Pearson correlation coefficient, b. Spearman correlation coefficient.

表4 BPA作为自变量,氧化损伤标志物及抗氧化酶作为应变量的多重线性逐步回归模型a
注:a. GSH作为应变量的模型无统计学意义(未列出);b. 混杂因素均包括性别、年龄、BMI、吸烟、饮酒、职业、水杯材质等;c. BPA未进入模型。
Note: a. No statistical significance was observed in the final model using GSH as dependent variable (not shown); b. All models were adjusted by gender, age, BMI, smoking, alcohol drinking, occupation (e-waste worker or not) and using polycarbonate plastics containers or not; c. Bisphenol A as the independent variable was excluded from the final models.
本研究以尿液中BPA作为暴露的标志物,发现电子垃圾拆解场地区人群尿液中BPA水平显著高于参照地区人群。经混杂因素校正,暴露地区人群尿液BPA浓度是参照的2.4倍(95%CI:1.3~4.5)。暴露地区人群浓度(未经肌酐校正的中值:11.7 μg·L-1)还较美国(2010-2014年)、日本等其他国家或地区普通人群(0.36~2.07 μg·L-1)显著高出1个量级以上[24],表明电子垃圾拆解可能是该地区BPA的主要暴露来源,并能导致对拆解工人甚至该地区居民的BPA高暴露。当然需要指出的是,由于BPA在日常生产生活中的广泛应用,在含BPA物质的接触或使用过程中,都可能存在BPA的溶出,这部分BPA亦可通过皮肤、消化道等途径进入人体,从而增加BPA的内暴露水平。本研究中由于调查数据获得有限,仍需要在后续的研究中排除其他暴露途径对电子垃圾拆解人群内暴露水平上升的影响。
3.2 BPA暴露与氧化应激损伤
BPA暴露影响人体健康的机制尚不清楚。作为一种典型的内分泌干扰物,与雌激素受体(如ERα/β)结合是研究较多的机制之一。但也有研究认为,氧化应激也是连接BPA与健康效应的重要环节。体外实验发现,BPA能够诱发人体胚胎肝L-02细胞的DNA氧化损伤;与此同时降低抗氧化物酶活性和抗氧化物质在体内的水平[25]。BPA在P450酶的作用下,可在苯环第5个碳上加羟基,进而在第4、5位之间形成醌。据此,BPA可能与其他外源性污染物(如PAHs)类似,通过P450的作用参与了ROS的诱导过程[26]。ROS进而可能攻击生物分子,如多不饱和脂质,进而产生脂质氧化损伤标志物——MDA;或攻击DNA产生8-OHdG。本研究未发现BPA与MDA之间的关联;一方面可能是由于年龄等混杂因素的影响(MDA与年龄负相关,而本研究中暴露组与参照组人群年龄未能很好匹配)。另一方面,体内MDA水平还会受到饮食等外源性脂质分子的氧化产物影响[27]。前期研究发现,该暴露地区人群血液白细胞中ROS水平显著高于参照人群[28],结合尿液8-OHdG,尤其是暴露地区拆解工人与周边普通居民的8-OHdG接近,且均略高于参照人群(如图1),提示电子垃圾拆解导致该地区人群的普遍性的DNA氧化损伤。控制混杂因素后,尿液8-OHdG仍和BPA正相关,BPA内暴露水平每增加1倍,8-OHdG上升34.9% (95%CI:19.4%~52.3%)。
外源性污染物暴露对人体抗氧化物酶系统能够产生胁迫作用,而抗氧化物酶活性与机体氧化应激密切相关[29]。虽然此前在广东贵屿地区电子垃圾拆解地人群的研究中并未发现8-OHdG及GSH、SOD等氧化应激指标与参照人群的差异[30],但本研究观察到血清中GSH-ST和Cu/Zu-SOD在暴露人群中的显著下降以及GSH-Px的显著升高。SOD是机体抗氧化系统的首道防线,人体的细胞或组织内主要为Cu/Zn-SOD (包括extracellular SOD,es-SOD)和Mn-SOD[31]。本研究中总SOD在暴露和参照组无显著差异,而Cu/Zn-SOD在暴露人群的下降可能是由于不同辅基的SOD在受到外源污染物暴露时,其中一种形式的抑制可诱导其同工酶的表达[32]。因此,本研究中暴露组人群Cu/Zn-SOD被抑制,但血清SOD未观察到改变。结合相关性分析,电子垃圾拆解释放的BPA可能抑制了研究对象体内GSH-ST活性,使得体内抗氧化能力发生改变,从而引发氧化损伤的发生。控制混杂因素后,BPA内暴露水平每增加一倍,血清GSH-ST下降5.46%(95%CI:1.17%~9.56%)。GST-Px是体内广泛存在的、催化过氧化氢和消除过氧化物的酶。GSH-Px活性升高可能导致脂质过氧化产物的总量下降(即体内产生速率低于清除速率),这也与暴露组人群MDA低于参照组的结果一致。与MDA相似,SOD、Cu/Zu-SOD及其他谷胱甘肽抗氧化物酶可能受到年龄的影响。
本研究仅采用横断面对电子垃圾拆解地区BPA人群内暴露及氧化损伤效应进行研究,未考虑污染物与效应标志物关联之间可能存在的时间效应。此外,本研究的样本量有限,可能影响到部分氧化损伤指标在不同暴露水平的人群间差异,如8-OHdG,以及抗氧化物酶与BPA多重线性回归的结果。考虑电子垃圾拆解还可产生人群多种污染物如溴代阻燃剂等的暴露,多种污染物的总体暴露水平及氧化损伤效应值得进一步的探讨。
总之,本研究以中国北方某电子垃圾拆解地区人群为研究对象,发现尿液中BPA的显著上升,与体内谷胱甘肽类抗氧化酶(如GSH-ST)的抑制及尿液中8-OHdG的上升正相关。提示电子垃圾拆解可能释放出BPA并导致该地区人群的高暴露,并进一步引起氧化应激并导致对DNA的氧化损伤。
[1] Breivik K, Armitage J M, Wania F, et al. Tracking the global generation and exports of e-waste. Do existing estimates add up [J]. Environmental Science & Technology, 2014, 48(15): 8735-8743
[2] Yang Q Y, Qiu X H, Li R, et al. Polycyclic aromatic hydrocarbons (PAHs) exposure and oxidative stress for a rural population from the North China Plain [J]. Environmental Science and Pollution Research, 2015, 22 (3): 1760-1769
[3] Yang Q Y, Qiu X H, Li R, et al. Exposure to typical persistent organic pollutants from an electronic waste recycling site in Northern China [J]. Chemosphere, 2013, 91(2): 205-211
[4] Rezg R, El-Fazaa S, Gharbi N, et al. Bisphenol A and human chronic diseases: Current evidences, possible mechanisms, and future perspectives [J]. Environment International, 2014, 64: 83-90
[5] Bi X H, Simoneit B R T, Wang Z Z, et al. The major components of particles emitted during recycling of waste printed circuit boards in a typical e-waste workshop of South China [J]. Atmospheric Environment, 2010, 44(35): 4440-4445
[6] Sabanayagam C, Teppala S, Shankar A. Relationship between urinary bisphenol A levels and prediabetes among subjects free of diabetes [J]. Acta Diabetologica, 2013, 50: 625-31
[7] Garwile J L, Michels K B. Urinary bisphenol A and obesity: NHANES 2003-2006 [J]. Environmental Research, 2011, 111: 825-830
[8] Zhou Q, Miao M, Ran M, et al. Serum bisphenol-A concentration and sex hormone levels in men [J]. Fertility & Sterility, 2013, 100: 478-482
[9] Melzer D, Osborne N J, Henley W E, et al. Urinary bisphenol A concentration and risk of future coronary artery disease in apparently healthy men and women [J]. Circulation, 2012, 125: 1482-1490
[10] Chen M J, Xu B, Ji W L, et al. Bisphenol A alters n-6 fatty acid composition and decreases antioxidant enzyme levels in rat testes: A LC-QTOF-based metabolomics study [J]. PLoS One, 2012, 7(9): e44754
[11] Chepelev N L, Enikanolaiye M I, Chepelev L L, et al. Bisphenol A activates the Nrf1/2-antioxidant response element pathway in HEK 293 cells [J]. Chemical Research in Toxicology, 2013, 26(3): 498-506
[12] Aydogan M, Korkmaz A, Barlas N, et al. The effect of vitamin C on bisphenol A, nonylphenol and octylphenol induced brain damages of male rats [J]. Toxicology, 2008, 249: 35-39
[13] Yang Y J, Hong Y C, Oh S Y, et al. Bisphenol A exposure is associated with oxidative stress and inflammation in postmenopausal women [J]. Environmental Research, 2009, 109: 797-801
[14] Asimakopoulos A G, Xue J C, Carvalho B P D, et al. Urinary biomarkers of exposure to 57 xenobiotics and its association with oxidative stress in a population in Jeddah, Saudi Arabia [J]. Environmental Research, 2015. doi: dx.doi.org/10.1016/j.envres.2015.11.029
[15] Del Rio D, Stewart A J, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition, Metabolism and Cardiovascular Diseases, 2005, 15(4): 316-328
[16] Pilger A, Rüdiger H. 8-Hydroxy-2′-deoxyguanosine as a marker of oxidative DNA damage related to occupational and environmental exposures [J]. International Archives of Occupational and Environmental Health, 2006, 80(1): 1-15
[17] Huang W, Wang G, Lu S E, et al. Inflammatory and oxidative stress responses of healthy young adults to changes in air quality during the Beijing Olympics [J]. American Journal of Respiratory and Critical Care Medicine, 2012, 186(11): 1150-1159
[18] Mena S, Ortega A, Estrela J M. Oxidative stress in environmental-induced carcinogenesis [J]. Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 2009, 674(1): 36-44
[19] Peter Stein T, Scholl T O, Schluter M D, et al. Oxidative stress early in pregnancy and pregnancy outcome [J]. Free Radical Research, 2008, 42(10): 841-848
[20] Li J J, Wang G H. Airborne particulate endocrine disrupting compounds in China: Compositions, size distributions and seasonal variations of phthalate esters and bisphenol A [J]. Atmospheric Research, 2015, 154: 138-145
[21] Xiong J K, An T C, Zhang C S, et al. Pollution profiles and risk assessment of PBDEs and phenolic brominated flame retardants in water environments within a typical electronic waste dismantling region [J]. Environmental Geochemistry and Health, 2015, 37(3): 457-473
[22] Evangelopoulos P, Kantarelis E, Yang W H. Investigation of thermal decomposition of printed circuit boards (PCBs) via thermogravimetric analysis (TGA) and analytical pyrolysis (Py-GC/MS) [J]. Journal of Analytical and Applied Pyrolysis, 2015, 115: 337-343
[23] 纪旻晖, 邱少汕, 徐锡金, 等. 电子垃圾污染地区双酚A暴露水平评估以及双酚A暴露对亲吻素基因KiSS-1表达水平的影响[J]. 汕头大学医学院学报, 2012, 25(2): 72-74
Ji M H, Qiu S S, Xu X J, et al. Evaluation of bisphenol A exposure level and effects of bisphenol A exposure on expression of Kisspeptin-encoding gene Kiss-1 in electronic waste recycling area [J]. Journal of Shantou University Medical College, 2012, 25(2): 72-74 (in Chinese)
[24] Ye X Y, Wong L Y, Kranmer J, et al. Urinary concentrations of bisphenol A and three other bisphenols in convenience samples of U.S. adults during 2000-2014 [J]. Environment Science & Technology, 2015, 49(19): 11834-11839
[25] 刘燕婕, 张艳红, 吕斌. 双酚A对纳米二氧化钛理化特性及其DNA损伤效应的影响[J]. 生态毒理学报, 2015, 10(2): 224-229
Liu Y J, Zhang Y H, Lu B. Impacts of bisphenol A on physicochemical properties and DNA damage effects of titanium dioxide nanoparticles on human embryo liver cell [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 224-229 (in Chinese)
[26] Sadowski R N, Park P, Neese S L, et al. Effects of perinatal bisphenol A exposure during early development on radial arm maze behavior in adult male and female rats [J]. Neurotoxicology and Teratology, 2014, 42: 17-24
[27] Niki E. Lipid peroxidation: Physiological levels and dual biological effects [J]. Free Radical Biology and Medicine, 2009, 47(5): 469-484
[28] Li R, Yang Q Y, Qiu X H. Reactive oxygen species alternation of immune cells in local residents at anelectronic waste recycling site in northern China [J]. Environmental Science & Technology, 2013, 47(7): 3344-3352
[29] 付宇, 王慧玉, 可尘娟, 等. 双酚A对小鼠肝脏和肾脏细胞的氧化损伤[J]. 生态毒理学报, 2012, 7(4): 360-366
Fu Y, Wang H Y, Ke C J, et al. Oxidative damage ofbisphenol A to mouse hepatic and nephric cells in vivo [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 360-366 (in Chinese)
[30] Yuan J, Chen L, Chen D H, et al. Elevated serum polybrominated diphenyl ethers and thyroid-stimulating hormone associated with lymphocyticmicronuclei in Chinese Workers from e-waste dismantling site [J]. Environmental Science & Technology, 2008, 42(6): 2195-2200
[31] Kourouma A, Peng D, Chao Q, et al. Increase activity of superoxide dismutase in adults sprague-dawley rats liver after exposure to bisphenol A [J]. IOSR Journal of Environmental Science, Toxicology and Food Technology, 2014, 8(5): 83-88
[32] Wu S, Ji W, Liu J, et al. TBBPA induces development toxicity, oxidative stress, and apoptosis in embryos and zebrafish larvae (Danio rerio) [J]. Environmental Toxicology, 2015. doi: 10.1002/tox.22131
◆
Exposure to Bisphenol A and the Oxidative Damage for Local Residents at an E-waste Dismantling Area
Yang Qiaoyun1,2, Qiu Xinghua2,*, Li Keqiu3, Li Guang3,#
1. School of Public Health, Tianjin Medical University, Tianjin 300070, China 2. College of Environmental Sciences and Engineering, Peking University, Beijing 100871, China 3. Basic Medical College, Tianjin Medical University, Tianjin 300070, China
China has become one of the major recycling sites for the electronic waste (e-waste) from worldwide. Pollutants emerged from the e-waste dismantling and the subsequent health effects to populations are of great concern. Typically, exposure to organic pollutants, such as bisphenol A (BPA) especially generated from primitive dismantling, is an important scientific issue for their adverse health effects to local residents. In this study, 29 e-waste dismantling workers and 24 local residents from a dismantling area in North China were recruited as the exposure group. Residents (N=53) living 40 km away from this e-waste area were selected as the reference. The median concentration of urinary BPA of the exposure group was 10.7 μg·g-1creatinine, which was significantly higher than that of the
(0.66 μg·g-1creatinine; P < 0.01), indicating that working and/or living in the e-waste area caused the elevated body burden of BPA. Urinary 8-hydroxy-2’-deoxyguanosine (8-OHdG) of the exposure group (median: 236 μg·g-1creatinine) was higher than that of the references (median: 142 μg·g-1creatinine) with a marginal significance (P = 0.055). Meanwhile, serum levels of glutathione S-transferase (GSH-ST) and Cu/Zn-Superoxide dismutase (Cu/Zn-SOD) were significantly lower in the exposure group, while glutathione peroxidase (GSH-Px) was higher when compared to the references (P < 0.01). Significantly positive association between urinary BPA and 8-OHdG was found (P < 0.05); however, significantly negative association was found between BPA and serum GSH-ST (P < 0.01). After controlling for confounders, 34.9% (95%CI: 19.4%—52.3%) increment of urinary 8-OHdG and 5.46% (95%CI: 1.17%—9.56%) decrement of serum GSH-ST per one-fold increase of BPA were estimated. Those results provided evidence on high exposure level of BPA among the populations from the e-waste dismantling area and a high risk of oxidative damage to DNA.
Bisphenol A; oxidative damage; 8-hydroxy-2’-deoxyguanosine; antioxidant enzyme;electronic-waste dismantling; health risk
10.7524/AJE.1673-5897.20151126005
国家自然科学基金(21322705,41421064,21190051)
杨巧云(1986-),女,讲师,研究方向为污染物暴露与人群健康,E-mail: victoryyqy@sina.com
*通讯作者(Corresponding author), E-mail: xhqiu@pku.edu.cn
2015-11-26 录用日期:2016-1-29
1673-5897(2016)2-238-09
X171.5
A
简介:邱兴华(1977—),男,环境科学博士,研究员,主要研究方向污染物的人体暴露与健康效应,发表学术论文三十余篇。
共同通讯作者简介:李光(1959—),女,生物学学士,教授,主要研究方向医学遗传学,发表学术论文二十余篇。
杨巧云, 邱兴华, 李克秋, 等. 电子垃圾拆解地区人体双酚A内暴露及与氧化应激效应的关联研究[J]. 生态毒理学报,2016, 11(2): 238-246
Yang Q Y, Qiu X H, Li K Q, et al. Exposure to bisphenol A and the oxidative damage for local residents at an e-waste dismantling area [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 238-246 (in Chinese)
#共同通讯作者,(Co-corresponding author), E-mail: lig@tmu.edu.cn

