磁珠吸附法定量检测乙型肝炎病毒的效能
张程 王宇 聂棱 马红
·论 著·
磁珠吸附法定量检测乙型肝炎病毒的效能
张程 王宇 聂棱 马红
目的 建立磁珠吸附定量检测HBV DNA的方法,并评价该方法的检测效率。方法 将病毒载量为107IU/mL的血清样本,倍比稀释成不同浓度的HBV DNA作为血清标准品(理论值),分别用磁珠吸附定量法(试剂1)、磁珠法(试剂2)、煮沸法(试剂3)3种方法提取HBV DNA,从灵敏度、定量线性关系方面比较本实验方法与国产磁珠法核酸自动提取法和传统煮沸法的提取效果,并对本实验方法进行稳定性验证。结果 灵敏度:HBV DNA定量的检测下限理论值为101IU/mL,试剂1为3.520×101IU/mL,试剂2为9.123×103IU/mL,试剂3为6.195×101IU/mL。相关性:试剂1、试剂2、试剂3提取HBV DNA定量与理论值相关性分析的r值分别为0.986、0.950、0.979(均P<0.01)。稳定性:3种方法检测的相对偏差均值分别为0.243±0.405(试剂1)、1.189±0.855(试剂2)、-0.439±0.618(试剂3),试剂1对同一样本在不同时间检测结果的相对偏差均值为0.505±0.659。结论 本实验所设计的血清HBV DNA提取方法灵敏,定量线性关系好,结果稳定准确,为定量检测HBV DNA奠定了基础。
HBV DNA;提取;效率
HBV DNA定量检测可用于慢性HBV感染的诊断和治疗适应证的选择,反映病毒复制水平,为抗病毒治疗提供依据及判断其疗效[1]。PCR是一项非常敏感的技术,能检测到10个HBV基因组/mL[2],但是PCR扩增的效果可能受到提取的HBV DNA载量的影响。因此,随着患者病毒载量的逐渐下降,需要更高效的提取方法。目前,临床上所用的HBV DNA定量检测试剂盒中,进口检测试剂较国产检测试剂更敏感[3],检测下限为20 IU/mL,线性范围为20~1.7×108IU/mL,但是价格较贵,而普通国产试剂的灵敏度为200~1000 IU/mL,线性范围为1000~1×108IU/mL,其检测效能相对进口试剂较差[4]。本研究采用纳米磁珠吸附的方法定量检测HBV DNA,并与已上市的国产提取试剂盒进行比较,建立敏感、稳定、经济的提取方法。
资料和方法
一、标本来源
HBV DNA阳性及阴性对照血清均来自北京友谊医院肝病中心2015年临床检测样品;阳性血清样本及稀释用阴性血清标准:应用瑞士罗氏公司COBAS AmpliPrep-COBAS TaqMan(CAP-CTM) 实时荧光PCR HBV DNA定量检测试剂盒,严格按照说明书中的步骤操作,用Agilent MX3000p实时荧光定量PCR仪扩增和检测核酸。该定量试剂对HBV中 DNA的最低检出限为20 IU/mL。
二、仪器与试剂
Agilent MX3000p实时荧光定量PCR仪;Premix Ex Taq TM(Probe qPCR)、SYBR Premix Ex Taq Ⅱ购自北京六合通经贸有限公司;蛋白酶K购自Amresco公司(美国);HBV引物及探针由本实验设计,由上海生工生物技术有限公司合成。HBV上游引物:5′-ACATC AGGAT TCCTA GGACC-3′;HBV下游引物:5′-GGTGA GTGAT TGGAG GTTG-3′;HBV Probe(探针):FAM-5′-CAGAG TCTAG ACTCG TGGTG GACTT C-3′-TAMRA。
三、 建立方法
阳性血清全部混合在一起(约1.167×107IU/mL),将混合后阳性血清与混合后阴性血清震荡混匀,倍比稀释(10倍)成106IU/mL、105IU/mL、104IU/mL、103IU/mL、102IU/mL、101IU/mL。实验步骤如下:取1.5 mL的离心管(无RNA酶污染)依次加入1000 μL阳性血清,100 μL 蛋白酶K(10 mg/mL),吹打混匀,56 ℃加热孵化60 min;取100 μL上述血清依次加入400 μL裂解液,300 μL结合液,12 μL磁珠吹打混匀;70 ℃加热结合10 min,隔2~3 min混匀1次;用磁铁吸附纳米磁珠,弃掉上清;200 μL washing buffer Ⅰ清洗1遍,弃上清;200 μL washing buffer Ⅱ清洗1遍,弃上清;200 μL washing buffer Ⅲ清洗1遍,弃上清;短时离心,弃残液;30 μL DEPC-H2O 洗脱,70 ℃ 加热5 min,磁铁吸附取上清转管。
PCR反应体系:HBV PCR反应液28 μL/人份+5 μL模板。
四、对比试验
取1.5 mL的离心管(无RNA酶污染)依次加入1000 μL阳性血清,100 μL 蛋白酶K(10 mg/mL),吹打混匀,56 ℃加热孵化60 min;分别按照试剂2、试剂3两种试剂盒操作说明书进行核酸提取,将提取液移至PCR反应管中,盖上管盖,转移到扩增检测区;将反应管放入荧光PCR扩增仪进行扩增检测,参照各仪器使用说明书进行设置循环参数。
五、统计学分析
采用SPSS 19.0统计软件进行统计学分析,检测3种提取方法的测量值与理论值的相关性,并依据3种检测方法的测量值与理论值的相对偏差评价各检测方法的稳定性。
结 果
一、3种不同试剂的检测结果
3种不同的国产试剂盒对不同浓度梯度的HBV DNA载量的检测结果,以评价3种试剂检测的敏感度,见表1。试剂1与试剂2同为磁珠法,试剂2为临床中常用方法,与本实验所设计的磁珠法相比,所需待测样本量、扩增体系以及模板量均较大。结果显示,试剂1(本方法)的HBV DNA定量为3.520×101IU/mL,相比其他方法(试剂2为9.123×103IU/mL、试剂3为6.195×101IU/mL),与理论值(101IU/mL)最接近。此外,由表1可知试剂2对于高浓度HBV DNA载量的检测结果准确,试剂3对于低浓度HBV DNA载量的检测结果准确。
二、不同试剂提取HBV DNA的测量值与理论值的相关性分析
采用3种试剂对不同浓度梯度的HBV DNA进行检测,对测量值与理论值的相对偏差进行相关性分析,以评价3种试剂的相关性及稳定性,见表2。分别计算各测量值与理论值的相对偏差,试剂1、试剂2、试剂3的相对偏差均值分别为0.243±0.405、1.189±0.855、-0.439±0.618,提示试剂1的相对偏差均值最小,说明试剂1的结果稳定、准确。3种试剂提取HBV DNA定量与理论值相关性好(试剂1r=0.986,试剂2r=0.950,试剂3r=0.979,均P<0.01),并用散点图进行描述,见图1。通过计算各组数据的相对偏差得出试剂1的检测结果更稳定。此外,通过对同一血清样本在不同时间进行检测,相对偏差均值为0.505±0.659,提示试剂1稳定性好,见表3。
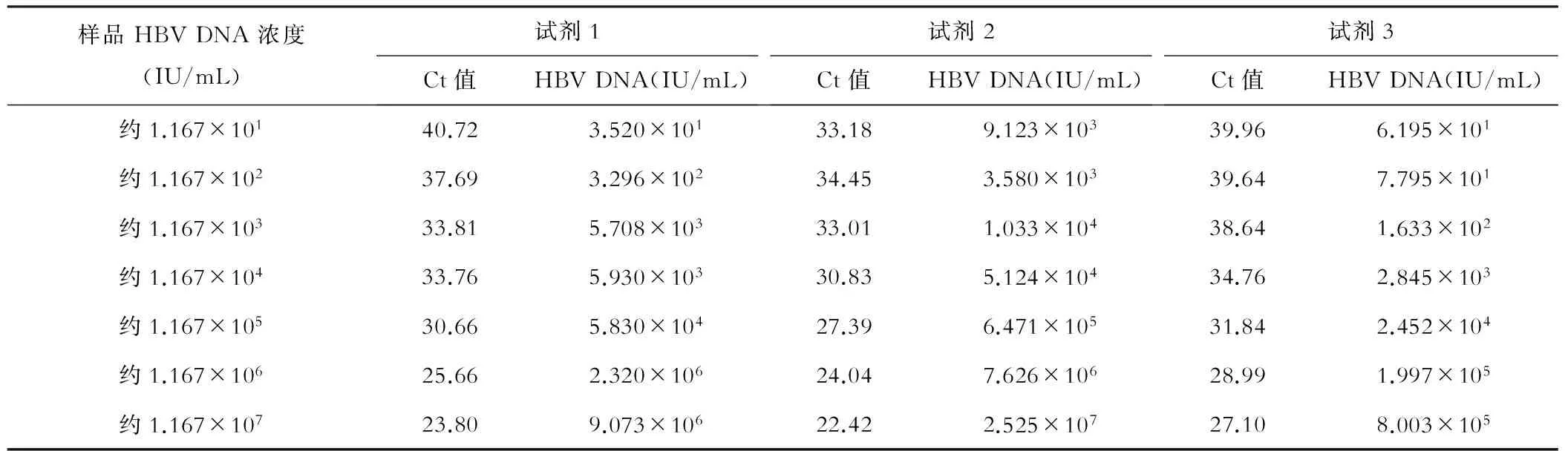
表1 3种不同试剂提取HBV DNA的结果比较
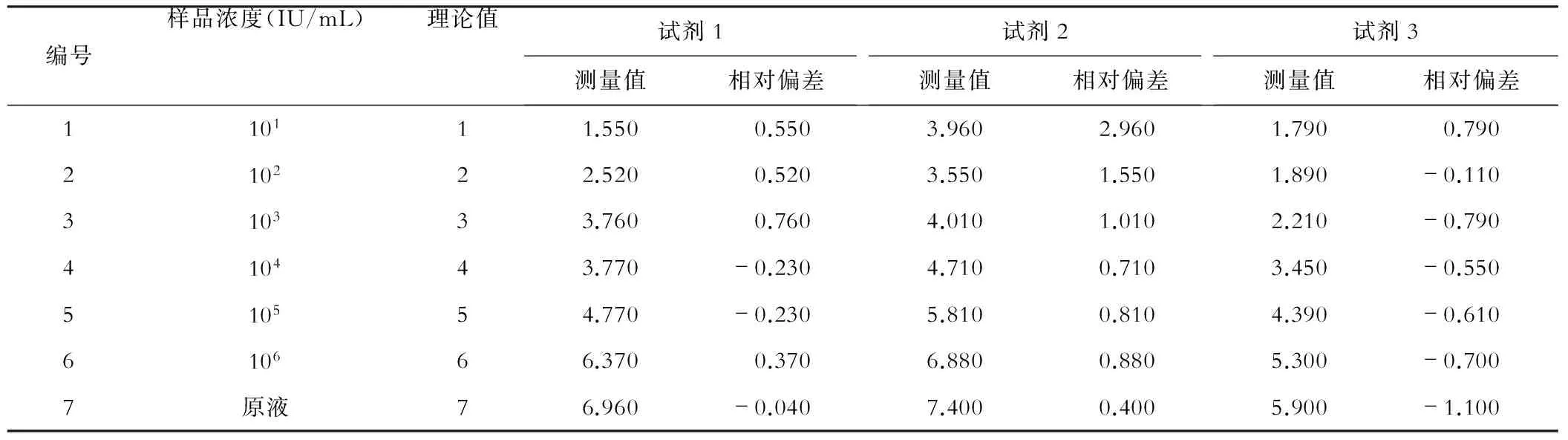
表2 不同浓度梯度HBV DNA载量的检测结果分析(log10 IU/mL)
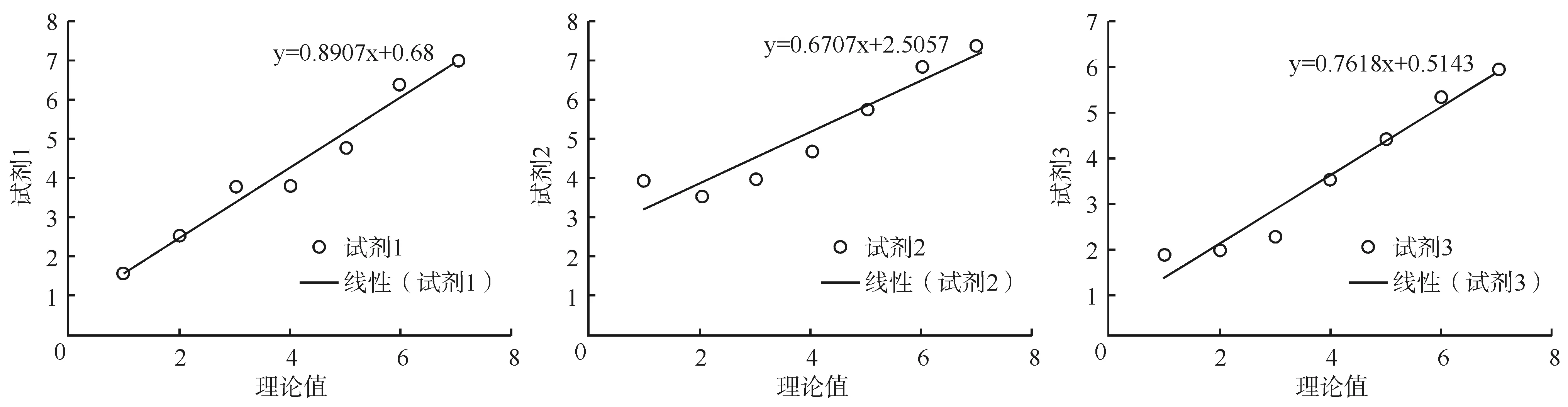
图1 测量值与理论值的相关分析
注:用散点图描述3种试剂的测量值与理论值的相关性分析,相关方程分别为试剂1:y=0.8907x+0.68,试剂2:y=0.6707x+2.5057,试剂3:y=0.7618x+0.5143,提示试剂1的相关性较好
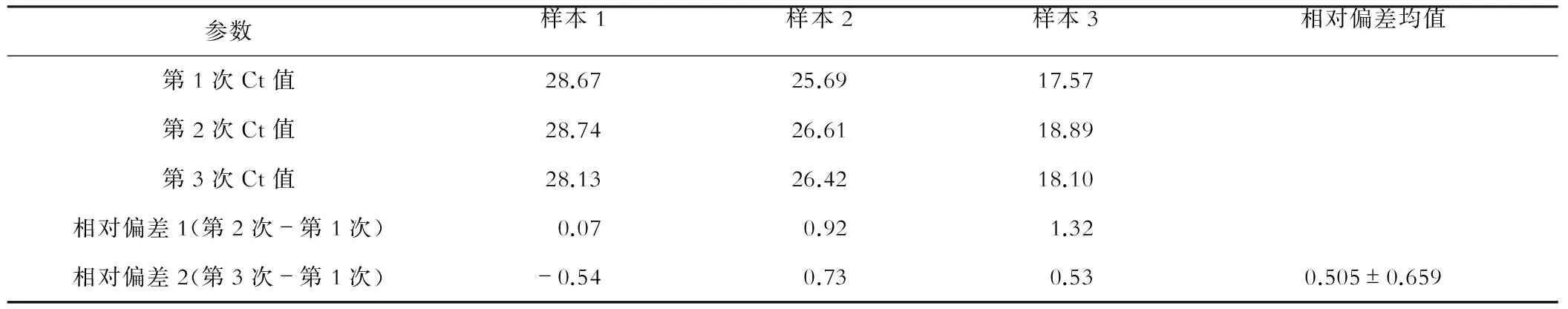
表3 同一样本不同时间的检测结果分析
讨 论
目前,国内应用最广的HBV DNA提取方法为煮沸法,但其操作复杂,包括对样本的煮沸、裂解、高速离心富集DNA反复吸取溶液等多个步骤,在整个操作过程中容易导致DNA的丢失,裂解不充分、回收不完全以及交叉污染均会影响HBV DNA的提取效力;而磁性纳米颗粒表面积大,高效吸附病毒DNA颗粒,提取充分而快捷,灵敏度高,且可实现高通量自动化病毒DNA提取[5],因此磁珠法优于煮沸法,但磁珠法所需的样本量及模板量较大,且操作步骤相对复杂、耗时长。本实验通过对磁珠法的改进[6],结果发现,其检测下限为3.520×101IU/mL与理论值(101IU/mL)接近,灵敏度最佳;并且对同一批血样进行重复检测,Ct值相差较小,说明实验设计稳定性好;与国产磁珠法核酸自动提取法和传统的煮沸法相比,本实验中所用磁珠尺寸较小,为30~50 nm,避免了因磁珠较大致吸附不充分的可能;与进口试剂的20 IU/mL相比虽仍有差距,但罗氏系统用于检测的每份血清标本量较大,每份血清量达650 μL,而本实验中的样本量为100 μL,但二者提取到的待测HBV DNA产物容积相同,且由于反应管体积的限制,进行PCR检测时只能再取其中的2~5 μL的HBV DNA提取产物作为PCR检测的模板。因此,在血清HBV DNA含量较低时,进入检测体系的血清标本量越多,荧光仪捕捉到荧光信号的概率也就越高,反之,标本量越少,检出概率越低,漏诊率也就越高,从而导致本方法的检测效果较进口试剂稍差,但差别并不大。由此可知,本实验不但所需体系量少,而且与大体系的进口试剂检测结果接近。本实验设计增加了清洗洗脱步骤,所得DNA纯度高,可将洗脱液移至PCR反应管中以备扩增,便于保存,对于检测结果可疑的可实现重复验证,优于国产磁珠法核酸自动提取法及进口试剂的一次性检测;整个实验相对于国产磁珠法核酸自动提取法及传统煮沸法操作步骤简便、反应时间短,20元/人份、耗时30 min/6个样本(试剂1);72元/人份、耗时60 min/6个样本(试剂2);20元/人份、耗时40 min/6个样本(试剂3);检测成本及操作过程较进口试剂经济、快速。
通过多方面优化条件,本实验中提取所用磁珠价格便宜,操作过程简便,检测结果与理论值相关性最好,且灵敏度较进口试剂的20 IU/mL差别并不大。此外,鉴于我国大多数乙型肝炎患者经济能力有限,普遍推广使用高灵敏度、高成本的进口试剂盒存在难度,因此综合评价本实验中的HBV DNA定量检测方法更适合应用于临床。
随着抗病毒药物的广泛使用,提高国产试剂的检测灵敏度有重要意义。HBV DNA的定量检测不仅是一种检测工具,也是一种诊断方法,更准确的检测结果在抗病毒疗效的监测中能更有效地反映患者实际HBV DNA的下降程度。此外,还可以利用纳米磁珠颗粒的表面修饰,对纳米磁珠进行特异性抗体标记,与特异的抗-HBs结合,从而提高检测的特异性及灵敏度。
[1] 张斌. HBV DNA定量检测方法研究进展. 现代诊断与治疗, 2002, 13: 150-152.
[2] Bréchot C. Polymerase chain reaction for the diagnosis of viral hepatitis B and C. Gut, 1993, 34(2 Suppl):39-44.
[3] 楼滨, 张杰, 崔大伟,等. 基于磁珠核酸提取方法对现有国产HBV DNA试剂盒分析灵敏度的改进. 中华检验医学杂志, 2010, 33:913-917.
[4] Ciotti M, Marcuccilli F, Guenci T, et al. Evaluation of the Abbott RealTime HBV DNA assay and comparison to the Cobas AmpliPrep/Cobas TaqMan 48 assay in monitoring patients with chronic cases of hepatitis B. J Clin Microbiol, 2008, 46: 1517-1519.
[5] 陈定虎,邓从良,李明福,等. 运用纳米磁珠技术结合RT-PCR方法检测李豆病毒.植物检疫, 2010, 24: 17-19.
[6] Sun N, Deng C, Liu Y, et al. Optimization of influencing factors of nucleic acid adsorption onto silica-coated magnetic particles: Application to viral nucleic acid extraction from serum. J Chromatogr A, 2014, 1325: 31-39.
(本文编辑:钱燕)
The efficiency of magnetic bead adsorption for quantitative detection of hepatitis B virus DNA
ZHANGCheng,WANGYu,NIELeng,MAHong.
LiverResearchCenter,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China
Correspondingauthor:MAHong,Email:mahongmd@aliyun.com
Objective To establish a magnetic bead adsorption method to quantitatively detect hepatitis B virus (HBV) DNA, and to evaluate its efficiency. Methods Serum template of 107IU/ml HBV virus was diluted into different concentrations as serum standard panels (theoretical value), HBV DNA in which were extracted by our magnetic bead adsorption method (reagent 1), domestic automatic nucleic acids extraction with magnetic beads (reagent 2) and boiling method (reagent 3), respectively. Comparisons in extraction efficiency among those 3 methods were carried out by analyzing sensitivity, quantitative linear relationship and stability. Results Theoretical value of lower HBV DNA detection limit was 101IU/mL, and the extraction results were 3.520×101IU/mL by reagent 1, 9.123×103IU/mL by reagent 2 and 6.195×101IU/mL by reagent 3. Correlation analysis between extraction results and theoretical values showed r values as 0.986 (reagent 1,P<0.001), 0.950 (reagent 2,P=0.001) and 0.979 (reagent 3,P<0.001), respectively, which revealed statistically significant differences. Average relative deviations of the 3 methods were 0.243±0.405 (reagent 1), 1.189±0.855 (reagent 2), -0.439±0.618 (reagent 3), respectively. In addition, the average relative deviation of reagent 1 for same sample at different times was 0.505±0.659. Conclusion Magnetic bead adsorption method for HBV DNA extraction has good sensitivity, quantitative linear relationship, stability and accuracy, which might be a reliable method for the quantitative detection of HBV DNA.
HBV DNA; Extraction; Efficiency
王宝恩肝纤维化基金(2011029);首都卫生发展科研专项(2011-1003-02);2015年度北京市卫生系统高层次卫生技术人才学科骨干资助项目(2005-3-003)
100050 首都医科大学附属北京友谊医院肝病中心(张程,王宇,马红);武汉哇哇噻纳技术开发有限公司北京生物技术研究所(聂棱)
马红,Email: mahongmd@aliyun.com;王宇,Email:wangyuliver@126.com
2016-08-04)

