运动改善衰老内皮祖细胞功能活性的机制研究
夏文豪贾敏张小勤李琰何江余冰波陶军
1中山大学附属第一医院高血压血管病科(广州 510080)2中山大学附属第一医院肾内科
运动改善衰老内皮祖细胞功能活性的机制研究
夏文豪1贾敏2张小勤1李琰1何江1余冰波1陶军1
1中山大学附属第一医院高血压血管病科(广州 510080)2中山大学附属第一医院肾内科
目的:探讨运动对衰老内皮祖细胞(endothelial progenitor cells,EPCs)功能活性的影响及机制。方法:入选30名健康老年人(年龄:64.3±5.6岁),排除主要的心血管危险因素、疾病史和临床证据,参与12周中等强度改良布鲁斯运动试验(每周3次,每次30 min,共12周)。运动前后抽取志愿者外周血20 ml提取分离培养EPCs,比较EPCs体外迁移、粘附能力变化;通过建立裸鼠颈动脉拉脱损伤模型,观察运动对EPCs修复裸鼠颈动脉内皮损伤能力的影响。检测运动前后EPCs表面基因和蛋白的表达情况。结果:12周的平板运动明显提高衰老EPCs体外的迁移、粘附及血管内皮损伤修复能力(运动前:33.1%±6. 2%;运动后:50.6%±7.1%;P<0.01)。EPCs表面的CXCR4信号通路明显上调(P<0.01)。结论:运动明显改善老年志愿者EPCs血管内皮损伤修复能力,其机制可能与EPCs表面的CXCR4信号通路密切相关。
运动;内皮祖细胞;内皮损伤;内皮修复;CXCR4信号通路
增龄所致血管内皮稳态的失衡是动脉粥样硬化血管疾病发生发展的始动环节之一[1,2]。因此,维护血管内皮结构和功能的完整性,是减少增龄相关心血管疾病发病率的重要治疗措施。研究表明,来源于骨髓存在于外周血中的内皮祖细胞(endothelial progenitor cells,EPCs)是一种内源性的血管内皮损伤修复细胞,对于维持血管内皮结构和功能的完整性起着重要作用[3,4]。然而,增龄、肥胖以及高脂血症等多种心血管疾病危险因素会导致循环中EPCs数量下降和功能受损,削弱其内源性的内皮修复能力[5,6]。运动改善血管内皮功能,是防治心血管疾病重要生活干预措施之一[7,8]。同时,我们既往的研究显示运动能上调人外周血中内皮祖细胞的数量[9]。然而,体育运动是否能够提高老年人内皮祖细胞的功能活性及其可能的分子机制有待进一步研究。
在前期研究的基础上,本研究探讨体育运动对老年人EPCs体外的迁移、粘附能力及在体内皮损伤修复能力的影响,研究其可能的分子机制,为体育锻炼作为一种有效防治心血管疾病生活方式措施提供新的理论证据。
1 对象与方法
1.1研究对象
本研究纳入30名无心血管临床证据、危险因素和不服用药物的老年(年龄:64.3±5.6岁)健康男性志愿者。具体临床特征总结于表1中。
1.2运动试验
所有志愿者参加改良布鲁斯跑步运动试验,运动强度依据美国心脏协会所制定的训练和测试标准执行[10]。受试者进行跑步训练每日30 min,每周3次,运动代谢当量为4.5,为期12周。所有研究对象受试前签署知情同意书。本研究方案经中山大学第一附属医院伦理委员会审核通过。
1.3EPCs的分离和培养
分别抽取健康志愿者外周静脉血20 ml,采用密度梯度离心法分离纯化出外周血单个核细胞,重悬于EGM-2培养基(含20%优质胎牛血清、青霉素100 U/ ml、链霉素0.1 mg/ml、VEGF 50 ng/ml),接种于预先包被好纤维连接蛋白(5 μg/cm2)的细胞培养瓶中,置于5%CO2,37℃培养箱中培养;3天后移除未贴壁悬浮细胞,换培养液继续培养;每3天换液,在倒置显微镜下动态观察细胞形态的变化,培养至7天左右的贴壁细胞即为实验所用的内皮祖细胞[11]。
1.4EPCs的体外迁移实验
培养7天之后,将内皮祖细胞消化后重悬,将2× 104个EPCs加入Boyden小室上室,置于24孔板中,在下室中加入500 μl的不含胎牛血清的EBM-2,然后加入100 ng/ml的SDF-1,将其置于5%CO2、37℃培养箱培养;24 h后取出Boyden小室,小心弃去上层液体,并用棉签小心擦掉小室滤膜孔上表面上未迁移的细胞;将Boyden小室置于4%多聚甲醛溶液中,固定10 min;荧光显微镜下观察,选择3个不同视野计数。
1.5EPCs的体外粘附实验
将培养的HUVECs消化、重悬,按3×105/孔接种到六孔板中,于37℃、5%CO2培养箱中培养;培养48 h后形成内皮细胞单层后,加入1 μg/ml CM-DiI染料的无血清EGM-2培养液37℃、5%CO2培养箱中培养;孵育10 min后,消化重悬;将消化重悬的内皮祖细胞按1× 105/孔加入上述准备好的内皮细胞单层中,37℃、5%CO2培养箱中培养。3 h后,弃去培养基,用4%多聚甲醛溶液固定细胞10 min,DAPI溶液染色10 min,荧光显微镜下观察,计算粘附于内皮细胞单层上的EPCs的数量。
1.6裸鼠颈动脉拉脱损伤模型
(1)手术:取8~10周的裸鼠,腹腔注射水合氯醛进行麻醉,颈部正中切口游离、暴露颈外动脉后,在其下穿2根5-0丝线,距离大约0.5 cm,结扎远端(靠近头部端)。在2根丝线间颈外动脉上剪开一小口,插入直径0.35 mm的金属导丝至颈总动脉,旋转进出3次,结扎颈外动脉近端。
(2)内皮祖细胞的移植:将运动前后培养7天的志愿者EPCs消化,PBS缓冲液重悬为密度5×105/100 μL的细胞悬液置于37℃(EPCs示踪实验时EPCs先用CM-DiI标记),拉脱手术约3 min后裸鼠苏醒,将上述内皮祖细胞悬液按5×105每只从尾静脉注入裸鼠体内,对照组用不含细胞的PBS缓冲液或HUVEs注射。(3)伊文思蓝染色:将手术3天后的裸鼠麻醉,经尾静脉注入100 μl的5%伊文思蓝溶液,10 min后打开颈部正中切口分离取出双侧颈总动脉,处死动物;将动脉条置于PBS缓冲液中漂洗干净后纵切开,内膜朝上置于载玻片上拍照[12]。
1.7基因检测
采用Realtime RT-PCR检测EPCs表面的趋化因子受体4(chemokine receptor 4,CXCR4)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等目的基因的表达水平。以Trizol以裂解细胞,常规提取RNA。按RT试剂盒说明配制10 μl体系反应液,置于梯度PCR仪中,37℃、15 min;85℃、5sec,将mRNA反转录成cDNA。所用引物序列设计及合成由上海生工生物科技有限公司完成。PCR反应体系为SYBR Premix ExTaq酶10 μl、ROX Reference Dye 0.4 μl、cDNA溶液5 μl、相关的基因引物及内参上、下游引物各0.4 μl。上述PCR反应液分装于96-well快速热循环板中,每孔
20 μl,实时定量PCR仪反应条件:95℃预变性10 s;95℃变性5 s、60℃退火/延伸30 s,扩增36个循环。反应结束后确认Real Time PCR的扩增曲线与融解曲线,进行实验结果分析。
1.8蛋白检测
采用Western blotting检测老年志愿者运动前后EPCs目的蛋白的表达情况。培养7天后的EPCs经预冷的PBS洗涤后,用细胞裂解液于4℃裂解5 min。将全细胞裂解产物经30×2 s超声后进行蛋白定量。取20 μg蛋白进行SDS-PAGE并转印至硝酸纤维素膜上,用CXCR4、JAK2及p-JAK2相应的特异性I抗[CXCR4(1:1000)、JAK2(1:1000)及p-JAK2(1:1000)单克隆抗体由Abcom公司提供]进行识别后,以相应的荧光II抗和ECF蛋白印迹分析仪检测目的蛋白。
1.9统计分析
统计分析采用SPSS19.0软件。所有数据以均数±标准差表示。运动前后两种之间比较采用配对t检验。P<0.05为有统计学意义。
2 结果
2.1老年志愿者运动前后基线资料比较
本研究共入组30名无心血管临床证据、危险因素和不服用任何药物的老年人健康男性志愿者。运动前后的基线资比较无统计学意义(P>0.05),见表1。
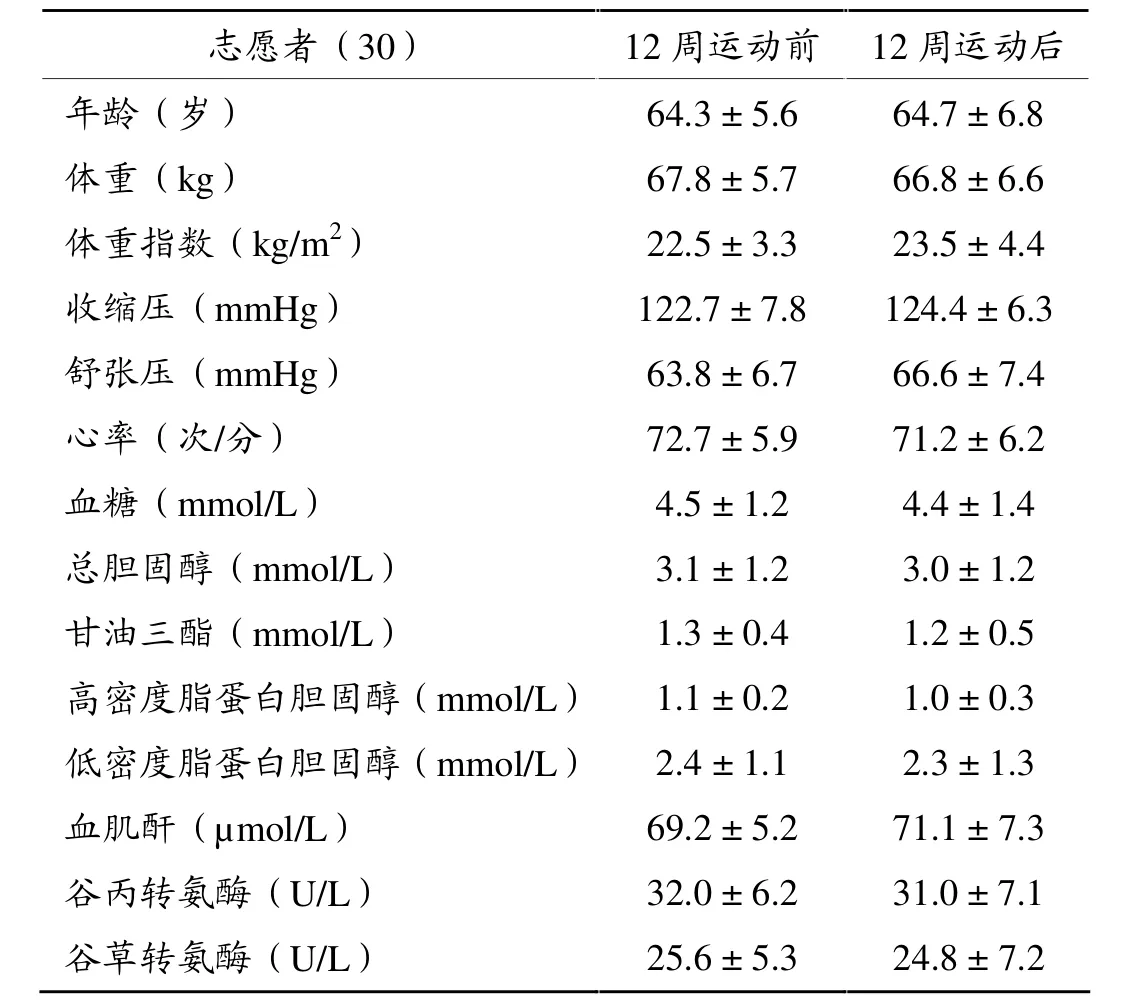
志愿者(30) 12周运动前 12周运动后年龄(岁) 64.3 ± 5.6 64.7 ± 6.8体重(kg) 67.8 ± 5.7 66.8 ± 6.6体重指数(kg/m2) 22.5 ± 3.3 23.5 ± 4.4收缩压(mmHg) 122.7 ± 7.8 124.4 ± 6.3舒张压(mmHg) 63.8 ± 6.7 66.6 ± 7.4心率(次/分) 72.7 ± 5.9 71.2 ± 6.2血糖(mmol/L) 4.5 ± 1.2 4.4 ± 1.4总胆固醇(mmol/L) 3.1 ± 1.2 3.0 ± 1.2甘油三醋(mmol/L) 1.3 ± 0.4 1.2 ± 0.5高密度脂蛋白胆固醇(mmol/L) 1.1 ± 0.2 1.0 ± 0.3低密度脂蛋白胆固醇(mmol/L) 2.4 ± 1.1 2.3 ± 1.3血肌酐(µmol/L) 69.2 ± 5.2 71.1 ± 7.3谷丙转氨酶(U/L) 32.0 ± 6.2 31.0 ± 7.1谷草转氨酶(U/L) 25.6 ± 5.3 24.8 ± 7.2
2.2EPCs体外迁移能力
采用改良Boyden小室法,我们比较12周的运动前后老年志愿者EPCs体外迁移能力变化。我们的实验结果显示:相比于运动前,运动后老年人EPCs体外的迁移能力明显提高(P<0.01)(图1)。
2.3EPCs体外粘附能力
通过内皮细胞粘附实验,我们发现:老年志愿者运动后荧光显微镜计数粘附在内皮细胞单层的EPCs数量明显多与运动前(P<0.01)(图2)。

图2 运动前后老年志愿者EPCs体外粘附能力比较(n=10)
2.4 EPCs体内再内皮化实验
借助于颈动脉内皮损伤拉脱模型,我们将培养7天后的内皮祖细胞用DiI标记,通过尾静脉注射到裸鼠体内,3天后比较裸鼠颈动脉内皮损伤修复的面积。我们的研究结果显示:相比于运动前,12周运动后老年志愿者EPCs损伤血管内皮化面积明显更大(运动前:36.2%±5.8%;运动后:52.1%±8.9%;P<0.01)(图3)。

图3 运动前后老年志愿者EPCs内皮化比较(n=10)
2.5EPCs表面基因检测
为了探讨运动改善EPCs内皮损伤修复能力的可能分子机制,我们采用实时定量PCR检测了12周运动前后志愿者EPCs表面与损伤修复相关基因的表达情况。结果显示,CXCR4基因表达明显上调(P<0.01),而CXCR7等其它基因无明显改变(P>0.01)。
2.6CXCR4信号通路的检测
采用Western-blotting法,我们检测EPCs CXCR4蛋白表达情况,结果显示:运动明显上调内皮祖细胞CXCR4蛋白表达(运动前:1.0±0.2;运动后:2.4±0.5;P<0.01)(图3)。研究显示,蛋白质酪氨酸激酶(Janus kinase 2,JAK2)是CXCR4的重要的下游基因之一,参与EPCs的血管损伤的修复过程[12]。因此,我们进一步观察了EPCs的JAK2蛋白表达情况,研究结果表明:p-JAK2表达明显上调(运动前:1.0±0.2;运动后:2.2 ±0.3;P<0.01)。

图4 运动前后CXCR4信号通路蛋白的表达(n=10)

表2 运动对老年志愿者EPCs表面基因表达的影响
3 讨论
研究表明,外周血中EPCs的数量及功能活性下降与增龄所致血管内皮功能障碍密切相关[5,6,13,14]。因此,如何提高EPCs数量,改善血管其内皮修复能力,对于动脉粥样硬化性心血管疾病的防治具有重要意义。运动是一种有效的生活干预方式,可影响循环外周血中EPCs数量和功能[7-9]。然而,体育运动对于老年人EPCs的内皮损伤修复能力的影响及其可能的分子机制尚未有研究报道。
本研究招募老年健康志愿者进行12周的平板运动,探讨了运动对老年志愿者EPCs内皮损伤修复能力的影响及分子机制。我们的研究结果显示:12周平板运动明显提高老年志愿者EPCs体外迁移及粘附能力;同时,通过裸鼠颈动脉内皮拉脱损伤模型,我们观察到运动后培养的老年志愿者EPCs归巢到颈动脉内皮损伤局部参与内皮损伤修复的能力显著增加。这些有趣的结果表明:体育运动不仅能提高老年志愿者EPCs的体外及体内功能活性,还能明显改善其内皮损伤修复的能力。这与我们的前期研究显示的急性运动可显著提高青年健康志愿者外周血中EPCs的数量和迁移能力相符合[9]。
为了明确运动改善EPCs功能活性可能的分子机制,我们将运动前后老年志愿者EPCs表面与内皮修复
相关的基因进行检测,结果显示CXCR4基因表达明显上调,其余相关基因无明显变化。众所周知,JAK2是CXCR4的重要下游靶点之一,参与EPCs的内皮损伤修复过程[12,15]。因此,我们对运动前后老年志愿者EPCs表面CXCR4/JAK2的蛋白表达进行的比较,结果显示,CXCR4及下游的p-JAK2蛋白表达明显上调,提示CXCR4/JAK2信号通路可能参与运动相关的EPCs功能活性的改善。
总之,我们的研究结果显示,体育运动可明显改善老年志愿者内皮祖细胞的内皮损伤修复能力,其机制可能与上调CXCR4/JAK2信号通路密切相关。本研究为运动作为一种重要的生活方式抵抗衰老相关的疾病提供新的理论基础,对于干细胞在心血管疾病预防和治疗提供了新的证据。有关运动调节内皮祖细胞改善血管内皮损伤的具体机制还有待我们进一步的研究继续探讨。
[1]Lakatta EG.Cardiovascular regulatory mechanisms in advanced age.Physiol Rev,1993,73(2):413-467.
[2]Sniderman AD,Furberg CD.Age as a modifiable risk factor for cardiovascular disease.Lancet,2008,371(9623):1547-1549.
[3]Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk.N Engl J Med,2003,348(7):593-600.
[4]Steinmetz M,Nickenig G,Werner N.Endothelial-regenerating cells:an expanding universe.Hypertension,2010;55(3):593-599.
[5]Heiss C,Keymel S,Niesler U,et al.Impaired progenitor cell activity in age-related endothelial dysfunction.J Am Coll Cardiol,2005,45(9):1441-1448.
[6]Giannotti G,Doerries C,Mocharla PS,et al.Impaired endothelial repair capacity of early endothelial progenitor cells in prehypertension:relation to endothelial dysfunction. Hypertension,2010,55(6):1389-1397.
[7]Vita JA,Keaney Jr JF.Exercise:toning up the endothelium. N Engl J Med,2000,342(7):503-504.
[8]DeSouza CA,Shapiro LF,Clevenger CM,et al.Regular aerobic exercise prevents and restores age-related declines in endothelium -dependent vasodilation in healthy men. Circulation,2000,102(12):1351-1357.
[9]Yang Z,Wang JM,Chen L,et al.Acute exercise induced nitric oxide production contributes to upregulation of circulating endothelial progenitor cells in healthy subjects.J. Hum.Hypertens,2007,21(6):452-460.
[10]Fletcher GF,Balady GJ,Amsterdam EA,et al.Exercise standards for testing and training:a statement for healthcare professionals from the American Heart Association. Circulation,2001,104(14):1694-1740.
[11]Zhang XY,Su C,Cao Z,et al.CXCR7 upregulation is required for early endothelial progenitor cell -mediated endothelial repair in patients with hypertension.Hypertension. 2014;63(2):383-389.
[12]Chen L,Wu F,Xia WH,et al.CXCR4 gene transfer contributes to in vivo reendothelialization capacity of endothelial progenitor cells.Cardiovasc Res,2010;88(3):462-470.
[13]Lamping K.Endothelial progenitor cells sowing the seeds for vascular repair.Circ Res,2007,100(9):1243-1245.
[14]Fadini GP,de Kreutzenberg S,Albiero M,et al.Gender differences in endothelial progenitor cells and cardiovascular risk profile:the role of female estrogens. Arterioscler Thromb Vasc Biol,2008,28(5):997-1004.
[15]Sainz J,Sata M.CXCR4,a key modulator of vascular progenitor cells.Arterioscler Thromb Vasc Biol,2007,27(2):263-265.
Improvement of Reendothelialization Capacity of Endothelial Progenitor Cells in Elderly Subjects through Physical Exercise
Xia Wenhao,Jia Min,Zhang Xiaoqin,Li Yan,He Jiang,Yu Bingbo,Tao Jun
First Affiliated Hospital of Sun Yat-Sen University,Guangzhou,China 510080 Corresponding Author:Tao Jun,Email:taojungz123@163.com
Objective To investigate the effect of physical exercise on the reendothelialization capacity of endothelial progenitor cells(EPCs)of elderly subjects and its underlying molecular mechanism.Methods 30 elderly healthy male subjects(64.3±5.6 years)without clinical evidences of cardiovascular risk factors and without concomitant medications were enrolled into the study.They were instructed to exercise according to modified Bruce treadmill endurance-type exercise protocol(30 minutes per day,3 days per week for 12 weeks)(Exercise Standards for Testing and Training of American Heart Association).The EPCs were isolated and cultured from peripheral blood by density gradient centrifugation method and migration and adhesion function in vitro and reendothelialization capacity in vivo of the subjects were observed before and after the exercise.Results The migration and adhesion function of EPCs in vitro increased from 33.1%±6.2%before the exercise to 50.6%±7.1%after the exercise(P<0.01).The expression of chemokine receptor 4(CXCR4)signaling on EPCs were up-regulated obviously after the 12-week exercise.Conclusion Endurance exercise attenuates age-associated reduction in endothelial repair capacity of endothelial progenitor cells probably through the regulation of CXCR4 signaling pathway.
physical exercise,endothelial progenitor cells,endothelial injury,endothelial repair,CXCR4 signaling
2016.01.17
国家自然科学基金(81200249,31370941,31530023);广东省科技计划项目(2016A020215056);中山大学附属第一医院优秀青年人才计划(2012年);中山大学青年教师培育项目(2014年)
陶军,Email:taojungz123@163.com

