Li以及Li化合物的添加对17Mg/12Al复合材料储氢性能影响的研究*
蓝志强,吕韶霞,曾 科,经 辉,郭 进
(广西大学 物理科学与工程技术学院 广西高校新能源材料及相关技术重点实验室,南宁 530004 )
Li以及Li化合物的添加对17Mg/12Al复合材料储氢性能影响的研究*
蓝志强,吕韶霞,曾 科,经 辉,郭 进
(广西大学 物理科学与工程技术学院 广西高校新能源材料及相关技术重点实验室,南宁 530004 )
通过粉末烧结制备17Mg/12Al复合材料,然后再添加Li,LiH以及LiAlH4混合球磨制备17Mg/12Al+10M(M=0,Li,LiH,LiAlH4)复合材料。经研究发现,烧结后的17Mg/12Al复合储氢材料主要由Mg17Al12和Mg2Al3组成,经过20 h机械球磨后,Mg17Al12和Mg2Al3转变为具有FCC结构的Mg-Al固溶体。Li以及Li化合物的添加能提高Mg-Al固溶体的储氢容量和改善Mg-Al固溶体的热力学性能,如17Mg/12Al复合材料的储氢容量为1.73%(质量分数),添加Li以及Li化合物后,17Mg/12Al+10M(M=Li,LiH,LiAlH4)的吸氢量则分别上升到2.23%,2.36%和1.81%(质量分数),且脱氢活化能从194.5 kJ/mol分别降低到172.8,146.3和155.4 kJ/mol。
机械合金化;固溶体;储氢性能;激活能
0 引 言
MgH2的理论储氢容量为7.76%(质量分数),是一种高能量密度的储氢材料,镁和镁基合金作为储氢材料一直备受关注[1-5]。然而由于MgH2过于稳定,在623~673 K,3 MPa的氢压下才能完全被氢化[6],且在高于573 K的温度时,才能在常压下释放出氢气,导致它们的实际应用受到限制。近来,对镁和镁基合金储氢材料研究的重点在于如何改善它们的储氢热力学性能和动力学性能。根据目前的报道,其主要通过以下途径来实现:(1) 采用机械合金化进行制备,此方法可以提高材料的表面活性,增加缺陷密度,提高相转变机率以及减小材料的颗粒尺寸,从而有利于氢原子在合金体内的扩散[7-8];(2) 在镁或者镁基合金中添加催化剂,如金属氧化物[9-11]、氟化物[12]或者卤化物[13]等;(3) 制备纳米结构复合材料[14-15];(4) 与其它储氢材料复合构建新的体系[16-17]。然而(1)~(3)方法通常会导致镁或镁基合金储氢容量下降,方法(4)则有望在保证储氢容量的同时提高材料的综合热力学性能,因此,采用与其它储氢材料复合的办法有望实现上述目标。Al也是一种轻质金属元素,其理论储氢容量可达10%(质量分数),也是一种极具发展的储氢材料。然而由于AlH3脱氢反应焓仅为10 kJ/mol左右[18-19],易分解,不易合成,导致Al作为储氢材料受到限制。可是从热力学角度出发, Mg和Al彼此间的热力学性能具有互补的特性,采用复合的办法有可能在一定程度上提高材料的综合储氢性能,因此对Mg-Al体系储氢材料的研究成为近年来Mg基储氢材料的一个主要方向。根据目前的报道[20-21],Mg-Al之间容易形成Mg17Al12和Mg2Al3,Mg17Al12在氢化过程须由向Mg2Al3中间相转变,然后再进一步脱氢,因此储氢容量也相应降低。可是通过制备工艺的调整,或者适当的调节Al与Mg之间的原子比,也可使Mg-Al间化合物的氢化过程避免出现Mg2Al3相,且能在一定程度上降低氢化物的脱氢反应焓[22]。对于Mg-Al复合材料的改性研究,根据过去的办法,在Mg-Al复合材料中添加催化剂能降低材料的吸放氢温度,提高材料的储氢性能,然而如前所述,催化剂的添加往往会导致储氢容量下降。与Mg和Al相比,Li的原子量更小,理论储氢材料高达12.5%(质量分数),其储能密度更高,本文拟以17Mg/12Al为基体,采用热处理与机械合金化法相结合的制备工艺,研究Li以及Li化合物的添加对17Mg/12Al复合材料储氢性能的影响。
1 实验方法
实验中所用原材料均从Alfa aser公司购买,纯度均为99%以上,按Mg∶Al=17∶12的原子比均匀混合后压制成圆形片状,然后在氩气保护下烧结,烧结温度600 ℃,烧结时间为10 h。接着在氩气保护下进行破碎,然后按照(Li、LiH、LiAlH4)∶(17Mg/12Al)=10∶1摩尔比分别在经烧结后的样品中添加Li、LiH和LiAlH4进行机械球磨,球磨时球料比85∶1,转速500 r/min,球磨时间为20 h。样品储氢性能测试在自制的PCT测试仪上完成,吸氢时氢压为40 atm,放氢时压力为0.001 atm。复合材料氢化物的热力学性能在Setaram Labsys Evo同步热分析仪上进行,测试时以纯度为99.99%的氩气进行保护,气流大小为30 mL/min。利用日本理学Rinku-3015型X射线衍射仪对复合材料进行物相结构测试,测试时采用Cu靶Kα射线进行步进式扫描,扫描范围为10~90°,扫描速率为10°/min。
2 结果与讨论
2. 1 相结构
图1为17Mg/12Al以及添加Li、LiH、LiAlH4混合球磨20 h后的XRD图谱。从1图中,经过退火处理后17Mg/12Al复合材料主要由Mg17Al12和Al3Mg2相组成,经退火处理后再球磨或者在退火处理后的材料中添加Li以及Li的化合物混合球磨后,复合材料中均出现了FCC结构固溶体。其中17Mg/12Al+10LiH样品衍射图样和17Mg/12Al样品衍射图样的峰形几乎一致,且在17Mg/12Al+10LiH衍射图中并未找到LiH对应的衍射峰,这说明LiH已经溶入Mg和Al晶格体内,形成了Mg-Al-Li三元系FCC结构固溶体。以Li作为添加剂,经过20 h的混合球磨后,除了出现FCC结构固溶体外,还出现LiAl相。而当以LiAlH4作为添加剂混合球磨20 h后,除了出现FCC结构相之外,还出现了LiAlH6以及MgH2。

图1 17Mg/12Al以及17Mg/12Al+10M(Li,LiH,LiAlH4)球磨20 h后的XRD图
Fig 1 XRD patterns for 17Mg/12Al and 17Mg/12Al+10M(Li,LiH,LiAlH4) composites
2.2 储氢性能
图2 为17Mg/12Al以及17Mg/12Al+10M(M=Li、,LiH,LiAlH4)球磨20 h后的变温吸放氢曲线。如图2(a)所示,退火后Mg-Al复合材料初始吸氢温度为200 ℃,而当把退火所得的样品球磨20 h,Mg-Al复合材料的初始吸氢温度为150 ℃左右,比球磨前的初始吸氢温度降低了约50 ℃左右,当吸氢温度从室温升高到350 ℃时,复合材料吸氢量从球磨前1.1%(质量分数)提高到了球磨后的1.73%(质量分数)。若在退火所得的17Mg/12Al复合材料添加Li以及Li化合物混合球磨后,17Mg/12Al+10M(M=Li,LiH,LiAlH4)复合材料的吸氢量则分别增加到2.23%,2.36%和1.81%(质量分数),吸氢量均有不同程度提高,其中以Li和LiH为添加剂的复合材料,储氢容量增幅较大。为了研究复合材料的脱氢性能,图2(b)列出了复合材料变温脱氢曲线。从图2(b)可看出,球磨前的17Mg/12Al复合材料初始脱氢温度约为278 ℃,经过20 h球磨后其初始脱氢温度下降到了198 ℃;而在17Mg/12Al复合材料中添加Li以及Li化合物后混合球磨20 h后,17Mg/12Al+10M(M=Li,LiH,LiAlH4)复合材料的初始脱氢温度依次为268,256和256 ℃,比未添加任何添加剂混合球磨样品脱氢温度依次增加了70,58和58 ℃,显然,球磨有利于降低17Mg/12Al复合材料的放氢温度,但Li以及Li化合物的添加导致17Mg/12Al复合材料的初始脱氢温度增高。此外从图2(b)可看到,未经球磨的17Mg/12Al复合材料脱氢量为1.46%(质量分数),球磨20 h后17Mg/12Al复合材料的脱氢量上升到了1.82%(质量分数);而当在17Mg/12Al复合材料中添加Li以及Li化合物后混合球磨20 h后,17Mg/12Al+10M(M=Li,LiH,LiAlH4)复合材料的脱氢量依次为2.04%,1.97%和1.51%(质量分数)。很显然,LiAlH4的添加不利于Mg-Al复合材料的脱氢,但Li和LiH的添加则有利于提高Mg-Al复合材料脱氢量。这可能是在Mg-Al复合材料中,Li原子对Mg-Al复合材料的脱氢过程起抑制作用,促使Mg-Al复合材料的脱氢势垒高度增高,导致复合材料的初始脱氢温度升高。

图2 17Mg/12Al以及17Mg/12Al+10M(M=Li,LiH,LiAlH4)变温吸放氢曲线
Fig 2 Hydrogenation/dehydrogenation kinetic of 17Mg/12Al and 17Mg/12Al+10M(M=Li,LiH,LiAlH4)composites
为了研究不同Li以及Li化合物的添加对Mg-Al复合材料吸放氢动力学性能的影响,在300 ℃温度下对复合材料吸放氢动力学性能进行测试,测试结果如图3所示。 从图3(a)可知,经过烧结处理后的样品经过1 000 s时间吸氢后,其吸氢量仅仅为0.6%(质量分数),若机械球磨20 h后,在不到200 s时间内吸氢量可达1.38%(质量分数),当以Li和LiH作为添加剂时,在200 s时间内吸氢量可达1.60%(质量分数)左右,然而若是以LiAlH4作为添加剂,吸氢量反而下降,在同样的时间内吸氢量仅为1.31%(质量分数)左右。图3(b)为复合材料的放氢动力学曲线,由图3(b)可知,复合材料未经球磨前其动力学性能较差,若对材料进行球磨处理,则其动力学性能得到迅速提升。如球磨20 h后,未添加Li以及Li化合物的复合材料经过250 s即可完全脱氢。然而若在Mg-Al复合材料中添加Li或者Li化合物混合球磨后,复合材料动力学性能比不添加任何Li以及Li化合物直接球磨的样品反而降低。这可能是由于Li的熔点较低,质地较软,由于吸放氢过程需要在较高的温度下进行,高温促使Li熔融覆盖于Mg-Al复合材料颗粒表面,一方面导致复合材料的颗粒尺寸增大,氢原子的扩散路径增加;另一方面,熔融的Li形成Li膜覆盖于Mg-Al表面,导致氢原子从Mg-Al表面向内部,或者从Mg-Al内部向表面扩散受限。这也进一步说明Li原子或Li+的存在不利于Mg-Al复合材料中氢原子的解离,但可能由于是同为FCC结构的Mg-Al-Li(LiH)固溶体和Mg-Al固溶体相比,Mg-Al-Li(LiH)固溶体的储氢位置更多,导致相同条件下其吸放氢量更高。

图3 17Mg/12Al烧结以及17Mg/12Al+10M(M=Li,LiH,LiAlH4)在300 ℃温度下吸放氢动力学曲线
Fig 3 Isotherms hydrogenation/dehydrogenation kinetic of 17Mg/12Al and 17Mg/12Al+10M(M=Li,LiH,LiAlH4)composites at 300 ℃
图4为17Mg/12Al复合材料氢化物的DSC-TG曲线。
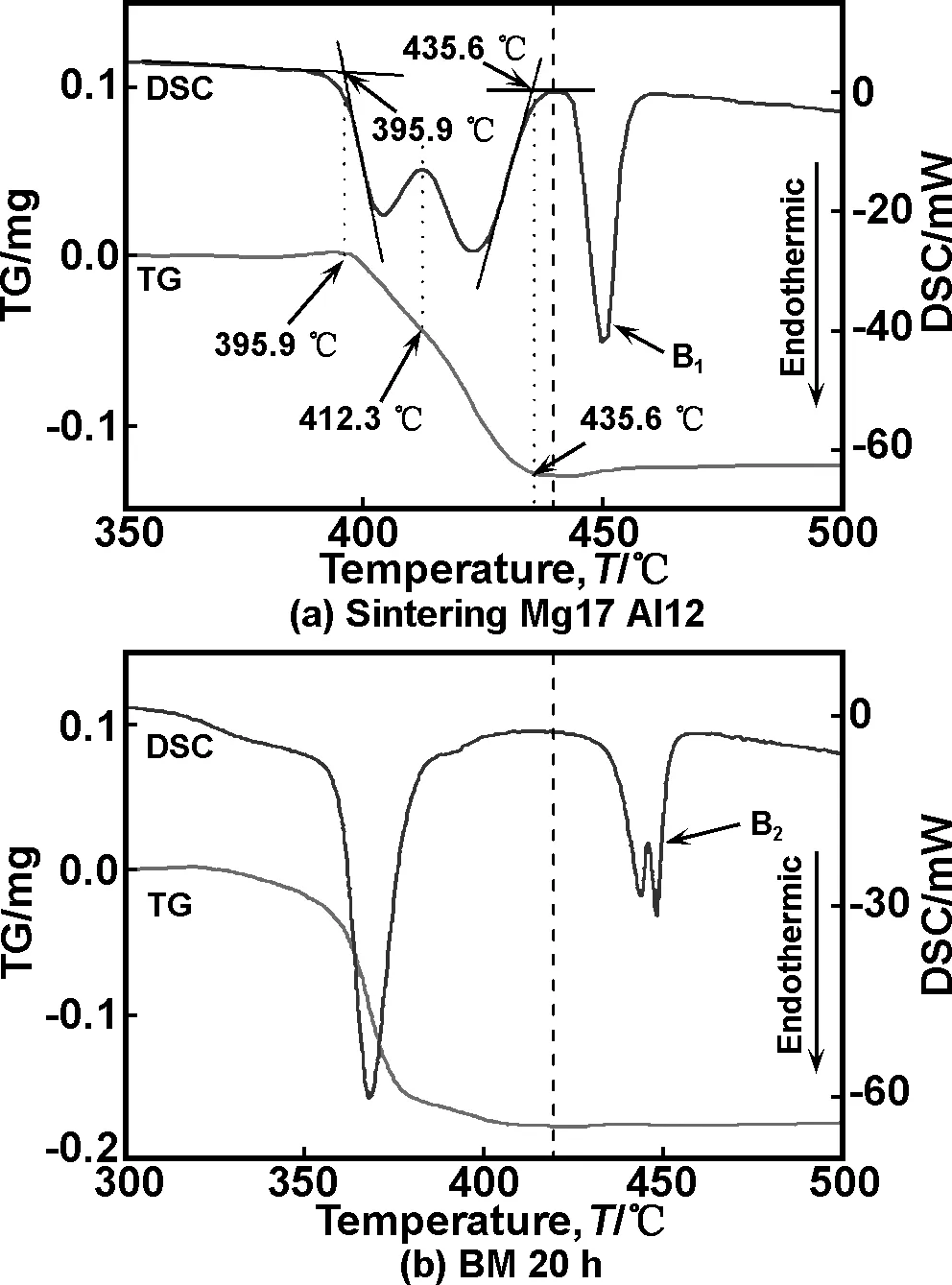
图4 17Mg/12Al复合材料氢化物的DSC-TG曲线
Fig 4 DSC-TG curves for 17Mg/12Al composite hydride
如图4(a)所示,烧结后的17Mg/12Al复合材料氢化物在350~500 ℃温度范围内出现三个吸热峰,其中第一和第二个吸热峰对应的TG曲线正处于失重状态,此时对应的是17Mg/12Al复合材料处于脱氢分解过程,其中第一个吸热峰对应的是MgH2和Al结合生成Mg2Al3和H2,而第二个峰对应的是MgH2与Mg2Al3作用进一步脱氢,生成Mg17Al12和H2,可用如下方程进行描述[23-24]
(1)
(2)
从DSC-TG曲线可知,出现第三个吸热峰时,复合材料并未失重,因此可断定第三个吸热峰对应的是熔融状态。此外,从图4(b)可知,当球磨时间增加到20 h时,复合材料氢化物在350~500 ℃温度范围内只有两个吸热峰,第一个吸热峰对应的是复合材料的脱氢分解,而第二个吸热峰对应的是吸热熔融,由前述XRD分析可知,经过20 h机械球磨后,材料主要由FCC结构的Mg-Al固溶体组成,为此图4(b)中第一个吸热峰对应的是FCC结构的Mg-Al固溶体氢化物脱氢分解。
图5为17Mg/12Al以及17Mg/12Al +10M(M=Li,LiH,LiAlH4)复合材料氢化物的DSC曲线。从图5可知,经过球磨处理后17Mg/12Al复合材料氢化物的脱氢峰温度明显降低,但熔融峰温度基本不变;当在17Mg/12Al复合材料中添加Li以及Li化合物混合球磨后,复合材料氢化物的脱氢峰温度进一步降低,但熔融峰温度增高。说明由于引入了原子半径更小的Li 金属元素,导致复合材料的金属性增强。

图5 17Mg/12Al以及17Mg/12Al +10M(M=Li,LiH,LiAlH4)复合材料氢化物的DSC曲线
Fig 5 DSC curves for 17Mg/12Al and 17Mg/12Al +10M(M=Li,LiH,LiAlH4)composites
为了进一步研究17Mg/12Al以及17Mg/12Al +10M(M=Li,LiH,LiAlH4)复合材料的热力学性能,以不同的升温速率测试材料的DSC曲线,并根据脱氢峰对应的温度,利用Kissinger方程计算复合材料的表观活化能[25]
(3)
式子,βi为恒定加热速率,Ti为在恒定加热速率βi条件下的最大放氢速率,即DTA或者DSC曲线所对应的峰值温度,R为气体普适常数,R=8.31 J/(mol·K),Ek为表观活化能。在以5,10,15以及20 K/min的恒定升温速率条件下对复合材料进行加热,所得相应数据后绘制图6,根据图6直线的斜率计算出复合材料的表观活化能列于表1。

图6 17Mg/12Al以及17Mg/12Al +10M(M=0,Li,LiH,LiAlH4)复合材料的Kissinger曲线
Fig 6 Kissnger curves for17Mg/12Al and 17Mg/12Al +10M(M=0,Li,LiH,LiAlH4)composites
由图6以及表1可知,退火处理后的样品,第一步反应的表观活化能为287.5 kJ/mol,而第二步反应时表观活化能为246.0 kJ/mol,当球磨是时间增加到20 h后,复合材料在脱氢过程只出现一个脱氢峰,此时表观活化能为194.5 kJ/mol,显然,球磨有利于提高17Mg/12Al复合材料热力学性能。若在17Mg/12Al复合材料中添加Li或者Li化合物混合球磨后,17Mg/12Al +10M(M=Li,LiH,LiAlH4)复合材料的活化能依次下降到172.8、146.3和155.4 kJ/mol。可见Li和Li化合物的添加有利于降低复合材料的脱氢活化能,提高材料的热力学性能,其可能是在低温下Li原子对Mg-Al的催化活性较低,但随着温度的升高,Li原子的催化活性提高,为此在较高的温度下,Mg-Al固溶体材料中的氢原子能快速解离,从而降低材料的脱氢活化能。
表1 17Mg/12Al以及17Mg/12Al +10M(M=0,Li,LiH,LiAlH4)复合材料的脱氢活化能
Table 1 The apparent active energy for 17Mg/12Al and 17Mg/12Al +10M(M=0,Li,LiH,LiAlH4)composites

样品激活能Ek/kJ·mol-117Mg/12Al烧结 第一步反应第二步反应287.5246.0 17Mg/12Al烧结+球磨194.5 17Mg/12Al烧结+Li球磨172.8 17Mg/12Al烧结+LiH球磨146.3 17Mg/12Al烧结+LiAlH4球磨155.4
3 结 论
采用烧结法制备17Mg/12Al二元固溶体,再添加Li以及Li化合物混合球磨制备17Mg/12Al和17Mg/12Al +10M(M=Li,LiH,LiAlH4)复合储氢材料。退火处理后17Mg/12Al复合材料主要由Mg17Al12和Al3Mg2相组成,在球磨的作用下,Mg17Al12和Al3Mg2转变为Mg-Al FCC结构固溶体;在退火后的17Mg/12Al材料中添加Li或者LiH混合球磨后,复合材料容易形成具有FCC结构的Mg-Al-Li(LiH)固溶体。球磨能降低17Mg/12Al复合材料的初始吸氢温度,由于Li或者Li+的抑制作用,17Mg/12Al+10M(M=Li,LiH,LiAlH4)复合材料吸放氢动力学性能下降,但Li和LiH的添加能提高复合材料的储氢容量和热力学性能。如在17Mg/12Al中添加Li或LiH混合球磨后,17Mg/12Al复合材料的表观活化能从194.5 kJ/mol依次下降到172.8和146.3 kJ/mol。
[1] Bobet J L, Chevalier B, Song M Y, et al. Improvements of hydrogen storage properties of Mg-based mixtures elaborated by reactive mechanical milling[J]. Journal of Alloys and Compounds, 2003, 356-357:570-574.
[2] Zhang Y, Tsushio Y, Enoki H, et al. The study on binary Mg-Co hydrogen storage alloys with BCC phase[J]. Journal of Alloys and Compounds, 2005, 393(1-2):147-153.
[3] Choi Y J, Lu J, Sohn H Y, et al. Hydrogen storage properties of the Mg-Ti-H system prepared by high-energy-high-pressure reactive milling[J]. Journal of Power Sources, 2008, 180(1):491-497.
[4] Luo X, Grant D M, Walker G S. Catalytic effect of nano-sized ScH2on the hydrogen storage of mechanically milled MgH2[J]. Journal of Alloys and Compounds, 2015, 622:842-850.
[5] Wan Q, Li P, Shan J, et al. Superior catalytic effect of nickel ferrite nanoparticles in improving hydrogen storage properties of MgH2[J]. The Journal of Physical Chemistry C, 2015, 119(6):2925-2934.
[6] Mushnikov N V, Ermakov A E, Uimin M A, et al. Kinetics of interaction of Mg-based mechanically activated alloys with hydrogen[J]. Physics of Metals and Metallography, 2006, 102(4):421-431.
[7] Shang C X, Guo Z X. Structural and desorption characterisations of milled (MgH2+Y,Ce) powder mixtures for hydrogen storage[J]. International Journal of Hydrogen Energy, 2007, 32(14):2920-2925.
[8] Liu W, Aguey-Zinsou K F. Size effects and hydrogen storage properties of Mg nanoparticles synthesised by an electroless reduction method[J]. Journal of Materials Chemistry A, 2014, 2(25):9718-9726.
[9] Song M Y, Kwak Y J, Park H R, et al. Improvement in the hydrogen-storage properties of Mg by the addition of metallic elements Ni, Fe, Ti, and an oxide Fe2O3[J]. Materials Research Bulletin, 2011, 46(11):1887-1891.
[10] Bellemare J, Huot J. Hydrogen storage properties of cold rolled magnesium hydrides with oxides catalysts[J]. Journal of Alloys and Compounds, 2012, 512(1):33-38.
[11] Polanski M, Bystrzycki J, Varin R A, et al. The effect of chromium (Ⅲ) oxide (Cr2O3) nanopowder on the microstructure and cyclic hydrogen storage behavior of magnesium hydride (MgH2)[J]. Journal of Alloys and Compounds, 2011, 509(5):2386-2391.
[12] Malka E, Bystrzycki J, Plocinski T, et al. Microstructure and hydrogen storage capacity of magnesium hydride with zirconium and niobium fluoride additives after cyclic loading[J]. Journal of Alloys and Compounds, 2011, 509:S616-S620.
[13] Malka I E, Czujko T, Bystrzycki J. Catalytic effect of halide additives ball milled with magnesium hydride[J]. International Journal of Hydrogen Energy, 2010, 35(4):1706-1712.
[14] Tian M, Shang C. Nano-structured MgH2catalyzed by TiC nanoparticles for hydrogen storage[J]. Journal of Chemical Technology and Biotechnology, 2011, 86(1):69-74.
[15] Zou J, Zeng X, Ying Y, et al. Study on the hydrogen storage properties of core-shell structured Mg-RE (RE = Nd,Gd,Er) nano-composites synthesized through arc plasma method[J]. International Journal of Hydrogen Energy, 2013, 38(5):2337-2346.
[16] Fu Y, Groll M, Mertz R, et al. Effect of LaNi5and additional catalysts on hydrogen storage properties of Mg[J]. Journal of Alloys and Compounds, 2008, 460(1-2):607-613.
[17] Liu H, Wang X, Liu Y, et al. Improved hydrogen storage properties of MgH2by ball milling with AlH3preparations, derehydriding properties, and reaction mechanisms[J]. Journal of Materials Chemistry A, 2013, 1(40):12527-12535.
[18] Graetz J, Reilly J J. Thermodynamics of the alpha, beta and gamma polymorphs of AlH3[J]. Journal of Alloys and Compounds, 2006, 424(1-2):262-265.
[19] Ke X Z, Kuwabara A, Tanaka I. Cubic and orthorhombic structures off aluminum hydride AlH3predicted by a first-principles study[J]. Physical Review B, 2005, 71(18):184107-1-184107-7.
[20] Crivello J C, Nobuki T, Kuji T. Improvement of Mg-Al alloys for hydrogen storage applications[J]. International Journal of Hydrogen Energy, 2009, 34(4):1937-1943.
[21] Tanniru M, Slattery D K, Ebrahimi F. A study of phase transformations during the development of pressure-composition-isotherms for electrodeposited Mg-Al alloys[J]. International Journal of Hydrogen Energy, 2011, 36(1):639-647.
[22] Zhong H C, Wang H, Ouyang L Z. Improving the hydrogen storage properties of MgH2by reversibly forming Mg-Al solid solution alloys[J]. International Journal of Hydrogen Energy, 2014, 39(7):3320-3326.
[23] Crivello J C, Nobuki T, Kato S, et al. Hydrogen absorption properties of the gamma-Mg17Al12phase and its Al-richer domain[J]. Journal of Alloys and Compounds, 2007, 446:157-161.
[24] Andreasen A. Hydrogenation properties of Mg-Al alloys[J]. International Journal of Hydrogen Energy, 2008, 33(24):7489-7497.
[25] Kissinger He. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11):1702-1706.
The effect of Li and Li-based compound additions on the hydrogen storage properties of 17Mg/12Al composite
LAN Zhiqiang, LV Shaoxia, ZENG Ke, JING Hui, GUO Jin
(Guangxi Colleges and Universities Key Laboratory of Novel Energy Materials and Related Technology,College of Physics Science and Technology, Guangxi University, Nanning 530004, China)
In this work, 17Mg/12Al was synthesized by sintering and then milling with Li, LiH and LiAlH4to prepared 17Mg/12Al+10M(M=0,Li,LiH,LiAlH4) composites. The results show that the sintered 17Mg/12Al composite is mainly compose of Mg17Al12and Mg2Al3, and the Mg17Al12and Mg2Al3phase transform into FCC structure Mg-Al solid solution after milled for 20 h. The hydrogen capacity and the thermodynamics property of 17Mg/12Al can be improved by Li or Li-based compound. Such as the hydrogen storage capacity and the activation energy of the 17Mg/12Al composite is 1.73wt% and 194.5 kJ/mol. While for the 17Mg/12Al+10M(M=Li,LiH,LiAlH4) composites, the hydrogen storage capacity increases to 2.23wt%,2.36wt%,1.81wt% and the activation energy reduces to 172.8,146.3 and 155.4 kJ/mol, respectively.
mechanical alloying; solid solution; hydrogen storage property; activation energy
1001-9731(2016)11-11076-05
国家自然科学基金资助项目(51271061, 51571065);广西教育厅基金资助项目(2013YB006);广西大学科研基金资助项目(XBZ120574)
2015-10-10
2016-04-22 通讯作者:郭 进,E-mail: guojin@gxu.edu.cn
蓝志强 (1980-),男(瑶族),广西都安人,博士,高级实验师,主要从事功能材料研究。
TG139.7
A
10.3969/j.issn.1001-9731.2016.11.015

