甲状腺乳头状微小癌中央区淋巴结清扫319例临床分析
宋旗,张家衡
(武汉市中西医结合医院乳甲外科,湖北 武汉 43002)
刘春萍
(华中科技大学同济医学院附属协和医院乳腺甲状腺外科,湖北 武汉 430056)
甲状腺乳头状微小癌中央区淋巴结清扫319例临床分析
宋旗,张家衡
(武汉市中西医结合医院乳甲外科,湖北 武汉 43002)
刘春萍
(华中科技大学同济医学院附属协和医院乳腺甲状腺外科,湖北 武汉 430056)
目的:探讨甲状腺乳头状微小癌中央区淋巴结不同手术方式的意义。方法:回顾性分析2011年9月至2014年12月间接受手术的甲状腺乳头状微小癌319例患者临床资料。按手术切除淋巴结范围不同,分为A组:98例,行甲状腺全切除+同侧中央区淋巴结清扫术;B组:187例,行甲状腺全切除+双侧中央区淋巴结清扫术;C组:34例,仅行甲状腺全切除或近全切除术。比较不同组间患者术后并发症发生率以及复发/转移的差异。结果:永久性声带麻痹和甲状旁腺功能低下在B组的发生率分别为1.1%、1.6%,在A组和C组均为0。暂时性声带麻痹的发生率A组、B组分别为7.1%、8.0%,比C组的2.9%要高。暂时性低钙的发生率A、B、C组分别为18.4%、34.2%和5.9%。各组随访期内无死亡病例,A组出现颈侧区淋巴结转移1例,B组出现颈侧区淋巴结转移3例,肺转移1例,C组无复发/转移病例。结论:手术清扫的范围越大,术后并发症的发生率就越高,尤其是暂时性甲状旁腺功能低下。预防性淋巴结清扫手术可以结合患者癌灶的临床病理特征选择单侧或者双侧中央区淋巴结清扫术。
甲状腺乳头状微小癌;淋巴转移;淋巴结清扫;中央区
甲状腺乳头状癌(papillary thyroid cancer,PTC)是最常见的甲状腺恶性肿瘤,普遍生长缓慢,预后良好。它的一个显著特征是易于转移到颈部淋巴结。转移淋巴结的检出率取决于不同的检查方法,触诊可以检出5%~10%的患者淋巴结转移,超声可以将这一比率提高到30%。如果常规切除淋巴结,普通组织病理切片检查会发现20%~50%的患者淋巴结转移。但是若更细致的切片,高达90%的患者可以发现有微小转移[1]。目前已经明确,淋巴结转移与PTC患者的肿瘤持续存在和复发有明显关系[2]。
微小癌(thyroid microcarcinoma,TMC)是指腺体内病灶最大直径≤10mm的甲状腺癌,对于有没有包膜外浸润、淋巴结转移或远处转移并无限定。甲状腺乳头状微小癌(papillary thyroid microcarcinoma,PTMC)可以单发,也可以是多灶性,有包膜侵犯及腺体内转移的可能,而且可以出现早期颈部淋巴结转移[3]。与PTMC手术有关的颈部淋巴结一般分为两大区域,中央区(central lymph node,CLN)和颈侧区(lateral neck lymph node)。对于颈侧区淋巴结,现在普遍接受的观点是,如果术前或术中检查发现有转移,就应该施行治疗性淋巴结清扫术,若没有转移的证据,预防性清扫是没有必要的[4]。对于CLN,治疗性中央区淋巴结清扫术(central lymph node dissection,CLND)也没有太大分歧,争论的焦点集中在预防性CLND手术上。CLND能否改善PTMC患者的预后,会不会增加手术后并发症,特别是喉返神经损伤和甲状旁腺功能低下的发生率,由于缺乏大样本的前瞻性研究,目前尚不能取得一致意见。现总结华中科技大学同济医学院附属协和医院和中西医结合医院收治的PTMC患者,分析不同淋巴结清扫手术方式的意义。
1 对象与方法
1.1 对象
2011年9月至2014年12月间,两院手术治疗的甲状腺癌患者2257例。选择符合以下条件的患者:①术后组织病理学证实是甲状腺乳头状癌;②肿瘤最大直径≤10mm;③术前没有颈侧区淋巴结转移的影像学证据, 颈淋巴结阴性的诊断参考Kowalski等[5]提出的颈淋巴结临床评价标准。并排除有以下情况之一者:①既往有甲状腺、甲状旁腺手术史;②术前有血钙、磷浓度异常;③术前喉镜检查发现声带活动异常;④术中发现肿瘤侵犯,为清除病灶而行喉返神经切除;⑤施行了颈侧区淋巴结清扫手术;⑥随访失去联系。入选病例共319例,其中男33例,女286例。年龄19~69岁,平均年龄48.7岁。病理证实双侧甲状腺乳头状癌37例,其余均为单侧癌。
1.2 手术方式
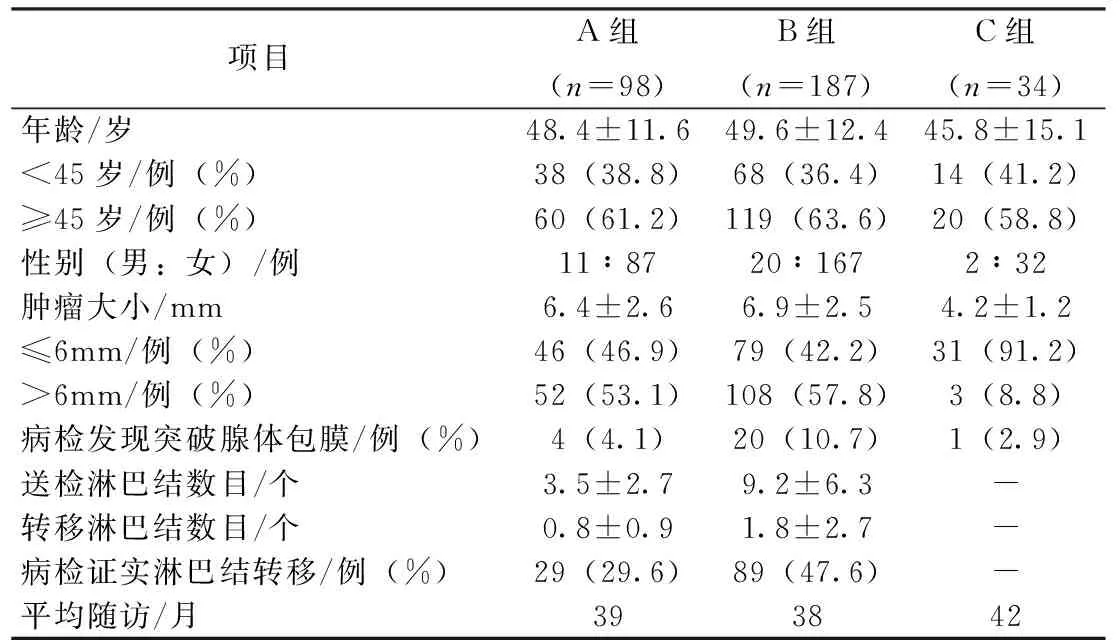
表1 各组患者一般情况比较
CLN也就是Ⅵ区淋巴结,其外侧界为颈动脉鞘的内侧缘,上界为舌骨,下界为胸骨切迹。同侧CLN切除即切除同侧气管旁和气管前淋巴结,双侧CLND即切除双侧气管旁和气管前淋巴结[6]。根据手术切除淋巴结范围不同,分为A组(98例):术前或术中确诊为PTMC,术中怀疑CLN有转移,但证据不足(无术前淋巴结穿刺细胞学或术中快速冰冻切片病检支持),仅行甲状腺全切除+同侧CLN切除;B组(187例):术中证实CLN有转移、双侧腺叶PTMC或者肿瘤有较明显的包膜外侵犯,行甲状腺全切除+双侧CLND;C组(34例):因良性疾病行甲状腺全切除或近全切除手术,术后病检发现合并PTMC,未行CLN切除。各组患者情况比较见表1。
在切除甲状腺时,按精细化被膜解剖法,不强行要求暴露喉返神经全程,初步判断、标记双侧甲状旁腺的位置,保护好其血供。切除一侧气管旁淋巴结时,要求全程显露喉返神经,加以保护。至少暴露该侧上甲状旁腺并确认血供完好,该侧下甲状旁腺应尽量避免损伤血供和误切。对于完全失去血供和误切的甲状旁腺经术中病检证实后均自体移植到同侧胸锁乳突肌或颈前肌中。
1.3 术后治疗和随访
记录CLN转移数目。复查血钙浓度和甲状旁腺激素浓度,有低钙症状的给予钙剂和维生素D治疗。暂时性低钙是指术后6个月以内血钙浓度小于2.0mmol/L(正常范围:2.10~2.58 mmol/L),能自行恢复正常者。永久性低钙为超过6个月仍持续需要补充钙剂和维生素D者。术后有声音改变者行喉镜检查,暂时性声带麻痹是指术后6个月内恢复声带正常运动,超过6个月未能恢复正常者为永久性声带麻痹[7]。病检证明有包膜外侵犯和淋巴结转移,术后给予I131治疗。内分泌治疗常规口服优甲乐,根据甲状腺功能调整剂量,将促甲状腺素(TSH)控制在低水平。随访至少每年一次,包括体检、超声、测甲状腺球蛋白(Tg)浓度等。对于I131消融过的患者,如果Tg浓度上升,行CT、MRI、骨扫描、I131全身扫描等确定是否复发及位置。
1.4 统计学分析
2 结果
以45岁为界,3组患者年龄构成没有明显差异。在肿瘤大小比较上,A组和B组之间,以及这两组与C组比较差异有统计学意义(P<0.05)。术前诊断为良性甲状腺疾病,术前超声检查未能发现、术中未能引起医生怀疑恶性的结节,在术后病理检查中证实的微小癌(有学者称之为偶发癌[8]),本组资料显示C组偶发癌病灶普遍较小。A组患者术中没有发现癌灶突破腺体包膜,但术后常规病检仍发现有4.1%(4/98)患者突破腺体包膜,C组患者中也有2.9%(1/34)突破腺体包膜,但是与B组10.7%(20/187)相比,差异有统计学意义(P<0.05)。术后常规病检检出有转移淋巴结的患者比例,A组为29.6%(29/98),B组为47.6%(89/187),与文献报道的比例接近[1,3]。PTMC的癌灶虽然较小,淋巴结转移比例却不低。
手术后并发症的比较中,永久性声带麻痹和甲状旁腺功能低下在A组和C组均为0,B组这两个并发症的发生率分别为1.1%(2/187)、1.6%(3/187)。暂时性声带麻痹的发生率A组、B组分别为7.1%、8.0%,比C组的2.9%要高。暂时性低钙的发生率A、B、C组分别为18.4%(18/98)、34.2%(64/187)和5.9%(2/34),手术切除范围越大,暂时性甲状旁腺功能低下的发生率就越高。
随访时间20~59月,期间无死亡病例。A组1例患者同侧CLN 病检有2枚转移,28月后同侧颈侧区淋巴结增大,手术切除证实为转移,术后健康存活。B组3例出现颈侧区淋巴结转移,1例肺转移,经手术或I131治疗后病灶消退。这4例患者均有>1枚CLN转移,其中2例为双侧PTMC,2例突破腺体包膜。C组无复发/转移病例。粗略来看,B组复发/转移病例数较多,这可能与我们分组的选择偏差有关,考虑到PTMC的良好预后,我们短时间的随访尚不足以说明存在差异。
3 讨论
美国国立癌症研究所的数据显示,从1973年到2002年,甲状腺乳头状癌的年发病率增加了2倍以上,这一上升趋势目前仍未改变[9]。随着超声和超声引导下FNAC技术发展和推广,检出的乳头状癌中微小癌所占的比例也逐渐加大,由30%上升到39.5%、42%。在某些医院,上世纪六、七十年代PTMC手术只占所有甲状腺癌手术的5%,到了九十年代,这一比例已经是22%[10,11]。意大利比萨大学的Miccoli统计了2000年到2005年手术的PTC患者2766例,其中PTMC1305例,高达47.1%[12]。虽然有少部分学者试验不手术、密切观察的方法治疗PTMC[13],但是常规的治疗方法还是手术。PTMC已经成为临床工作中最主要的研究对象,但是关于初次手术的切除范围和术后辅助核素治疗等一直争议不断。由于缺乏有说服力的Ⅰ类研究证据,新版ATA指南中对这些争议也没有给出明确的结论[14]。
PTC颈部淋巴结转移很常见,发生率从20%到90%不等,一般认为大约2/3的患者有淋巴结转移。通常,医生将CLN认作甲状腺癌淋巴结转移的第一站,而将侧颈区淋巴结认作第二站。传统的观点认为,PTC局部淋巴结转移只会增加局部复发率,对生存率没有影响[15]。在AMES、AGES、MACIS等甲状腺癌预后评分系统中,都不计入局部淋巴结转移情况。近几年报道的研究数据正在改变以前的观点,已经有多个大样本的研究表明,局部淋巴结转移会增加患者的死亡率[7]。许多外科医生对淋巴结清扫变得积极了,特别是采取预防性中央区淋巴结清扫术。这是因为一方面,CLN多较细小,前方有甲状腺腺体遮挡,而且紧挨着气管,术前的多种临床检查手段对判断其有无转移很困难。到目前为止,还没有值得信赖的微小侵袭方法在术中可以查出所有的转移灶。另一方面,在甲状腺全切除手术后行CLN清扫并不需要延长切口,不明显增加患者的痛苦。而CLN复发常侵犯气管、大血管、喉返神经,比颈侧区复发治疗起来更困难、更复杂。再者,最近的AJCC TNM分期中,45岁以上的甲状腺乳头状癌患者若有CLN转移,其分期就从Ⅰ期或Ⅱ期跃升至Ⅲ期,患者就可能需要辅以放射性碘治疗,还能从TSH抑制治疗中获益。如果淋巴结中未见转移,低风险的患者就不需要放射性碘治疗和TSH抑制治疗。所以,很多甲状腺专科医疗单位在PTC初次手术时,就常规施行CLN清扫手术。
手术切除范围的扩大势必带来更高的并发症风险,常规行CLN清扫手术就必须考虑喉返神经损伤和甲状旁腺功能低下的问题。对于一名有经验的甲状腺外科医生来说,手术中人为损伤喉返神经的几率很低,大部分文献认为,甲状腺全切除术后永久性喉返神经损伤的发生率只有1%~2%。同时,文献也报道,甲状腺癌手术清扫CLN同单纯甲状腺全切除术相比较,喉返神经的损伤发生率无明显差异[15~17]。影响手术后神经并发症发生率高低的主要不是手术方式,而是手术技术。本资料A组和C组患者永久性声带麻痹的发生率均为0%,B组患者中2例出现永久性声带麻痹,发生率为1.1%,组间差异无统计学意义(P>0.05)。随着甲状腺全切除术的普及以及手术技巧的不断完善,医生手术过程中主要的保护对象已经从喉返神经变为甲状旁腺。与喉返神经损伤不同,手术范围对甲状旁腺功能低下的影响明显要大。甲状旁腺功能低下的发生率,甲状腺全切除+CLND手术比仅行甲状腺全切除术高,双侧CLN清扫术比单侧CLN清扫术高,这样的研究数据较多[18~20]。本资料中,A组发生暂时性低钙的比例为18.4%(18/98),B组为34.2%(64/187),C组为5.9%(2/34)。与C组比较,A组P<0.05,B组P<0.01,差异都有统计学意义。再比较A组和B组,χ2=5.03,P<0.05,提示手术清扫范围越大,甲状旁腺功能受影响越严重。A组和C组无永久性低钙发生,B组的发生率为1.6%(3/187)。虽然在组间比较中,差异无统计学意义,但我们仍发现B组发生这类严重并发症的发生率高于A组,值得我们注意。
PTMC预后良好,绝大多数患者可以通过手术治愈。患者长期存活,对生活质量的要求就比一般的恶性肿瘤更高。如果在没有明显淋巴结转移征象的情况下,对PTMC患者施行CLND手术,术后出现永久性甲状旁腺功能低下,患者长期甚至终身不能脱离维生素D和钙剂治疗,手术就是失败。避免出现不必要的手术并发症的一个积极策略就是准确的评估淋巴结有无转移,通过寻找淋巴结转移的征象来指导手术切除的范围。有些学者建议将PTMC进一步细分为≤5mm和>5mm,两者在淋巴结转移(13%vs59%)和腺体外浸润(3%vs10%)的发生率上有明显区别[21,22]。Lim等研究发现,年龄大于45岁、男性、高MACIS评分、瘤体大于5mm、多原发灶、肿瘤位于腺叶下极、淋巴血管侵犯或包膜侵犯的PTMC患者同侧CLN转移几率较高[23]。在Mercante的研究中,经多变量分析发现,肿瘤侵犯甲状腺旁组织和肿瘤侵犯腺体包膜都是影响PTMC持续存在和复发的因素[24]。学者们试图发现CLN转移的规律,通过已经掌握的临床病理数据,得出CLN清扫手术的合理指征。笔者采纳了上述研究中的一些结论,对于确诊为单侧PTMC的患者,只要术中怀疑淋巴结可能有转移,我们就行单侧CLND手术。若具有双侧腺叶癌灶、突破腺体包膜甚至侵犯腺体周围组织,或证实有中央区淋巴结转移等临床病理特征者,就行双侧CLND手术。在随访期间,B组复发/转移病例数相对较多,显示出具有这些临床病理特征的PTMC预后可能较差。
因为双侧CLND会导致更高的并发症风险,我们除了提高手术技能以外,还需要鉴别出哪些患者能从双侧CLND手术中获益,这一点对于施行预防性CLND手术尤其重要。本文的B组中部分患者为术中明确诊断CLN有转移,手术为治疗性双侧CLND。另外一部分患者术中没有明确CLN转移,但是患者具有其它可能导致较差预后的临床病理特征,施行的是预防性双侧CLND。
对于预防性CLND手术意义的争论远还没有结束,在支持的一方中,又有预防性单侧CLND和预防性双侧CLND的争论。Moo等报道了一项前瞻性研究,116例PTC患者,癌灶≤10mm者没有出现双侧淋巴结转移,癌灶>10mm者31%有双侧转移。对于癌灶≤10mm者,同侧CND就足够了[25]。Ito等认为,局限于一侧腺叶的PTMC,对侧CLN转移的发生率为8.1%,预防性切除对侧CLN并没有改善患者的DFS[26]。Barczyn′ski回顾640例患者,通过评价总生存率和局部控制率,得出结论,建议所有的PTC患者行预防性双侧CLND[7]。Hartl等最近总结,要是为了分期,常规双侧预防性CLND更好[27]。考虑到双侧CLND对患者甲状旁腺功能的影响,本文采取的是结合患者临床病理特征进行综合评价的策略,选择具有较差临床病理特征的患者施行双侧CLND手术。这还需要进一步随访观察不同手术方式对患者远期的生存率和局部复发率的影响。
曾经,学者们对于甲状腺全切除术治疗PTC的有效性和风险争论了数十年。直到2007年,Bilimoria的研究结果出现,共有52173例患者纳入研究,结论是对于≥1cm的PTC,甲状腺全切除术比腺叶切除术复发率更低、生存率显著升高[28]。这才使关于甲状腺全切除术的有效性和安全性的争议消停下来。现阶段对于CLN清扫手术意义的争论让人不禁想起这一不太久远的历史。我们期待不久的将来再出现像Bilimoria的研究一样、有说服力的数据,为广大PTMC患者个体化手术方式提供理论依据,在疾病控制和生活质量两方面共同进步。
[1]Sippel R S, Chen H. Controversies in the surgical management of newly diagnosed and recurrent residual thyroid cancer[J]. Thyroid, 2009, 19(12): 1373~1380.
[2]Machens A, Hinze R, Thomusch O, et al. Pattern of nodal metastasis for primary and reoperative thyroid cancer[J]. World J Surg, 2002, 26(1): 22~28.
[3]Noguchi S,Yamashita H,Murakami N,et a1.Small carcinoma of the thyroid. A long~term follow~up of 867 patients[J]. Arch Surg, 1996, 131(2): 187~191.
[4]Randolph G W, Duh Q Y, Heller K S, et al. The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension[J]. Thyroid, 2012, 22(11): 1144~1152.
[5]Kowalski L P, Bagietto R, Lara J R, et a1. Prognostic significance of the distribution of neck node metastasis from oral carcinoma[J].Head Neck,2000,22: 207~214.
[6]Roh J L, Kim J M, Park C I. Central lymph node metastasis of unilateral papillary thyroid carcinoma: patterns and factors predictive of nodal metastasis,morbidity, and recurrence[J]. Ann Surg Oncol, 2011, 18: 2245~2250.
[7]Barczyn′ski M, Konturek A, Stopa M, et al. Prophylactic central neck dissection for papillary thyroid cancer[J]. Br J Surg, 2013, 100: 410~418.
[8]吴毅. 分化型甲状腺癌诊治中值得关注的一些问题[J]. 中国实用外科杂志, 2011, 31(5): 374~375.
[9]Davies L, Welch H G. Increasing incidence of thyroid cancer in the United States, 1973-2002[J]. JAMA, 2006, 295: 2164~2167.
[10]Besic N, Pilko G, Petric R, et al. Papillary thyroid microcarcinoma:prognostic factors and treatment[J]. J Surg Oncol, 2008, 97: 221~225.
[11]Ross D S, Litofsky D, Ain K B, et a1. Recurrence after treatment of micropapillary thyroid cancer[J].Thyroid,2009,19(10):1043~1048.
[12]Miccoli P, Minuto M N, Ugolini C, et a1. Intrathyroidal differentiated thyroid carcinoma: tumor size~based surgical concepts[J]. World J Surg, 2007, 31: 888~894.
[13]Ito Y, Tomoda C, Uruno T, et al. Papillary microcarcinoma of the thyroid: how should it be treated[J]? World J Surg, 2004, 28: 1115~1121.
[14]Haugen B R, Alexander E K, Bible K C, et a1.2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer [J].Thyroid,2016,26(1):1~13.
[15]Mazzaferri E L, Doherty G M, Steward D L. The pros and cons of prophylactic central compartment lymph node dissection for papillary thyroid carcinoma[J]. Thyroid, 2009,19(7):683~689.
[16]Tisell L E, Nilsson B, Molne J, et a1. Improved survival of patients with papillary thyroid cancer after surgical microdissection[J].World J Surg,1996,20: 854~859.
[17]Steinmuller T, Klupp J, Wenking S, et a1. Complications associated with different surgical approaches to differentiated thyroid carcinoma[J].Langenbecks Arch Surg,1999,384:50~53.
[18]Roh J L, Park J Y, Park C I. Total thyroidectomy plus neck dissection in differentiated papillary thyroid carcinoma patients: pattern of nodal metastasis, morbidity, recurrence,postoperative levels of serum parathyroid hormone[J]. Ann Surg, 2007, 245: 604~610.
[19]Palestini N, Borasi A, Cestino L, et al. Is central neck dissection a safe procedure in the treatment of papillary thyroid cancer? Our experience[J]. Langenbecks Arch Surg, 2008, 393:693~698.
[20]Roh J L, Park J Y, Park C I. Prevention of postoperative hypocalcemia with routine oral calcium and vitamin D supplements in patients with differentiated papillary thyroid carcinoma undergoing total thyroidectomy plus central neck dissection[J]. Cancer, 2009, 115:251~258.
[21]Hundahl S A, Fleming I D, Fremgen A M, et al. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the US, 1985-1995[J]. Cancer, 1998, 83: 2638~2648.
[22]Furlan J C, Bedard Y, Rosen I B. Biologic basis for the treatment of microscopic, occult well~differentiated thyroid cancer[J]. Surgery, 2001, 130: 1050~1054.
[23]Lim Y C, Choi E C, Yoon Y H, et al. Central lymph node metastases in unilateral papillary thyroid microcarcinoma[J]. Br J Surg, 2009, 96: 253~257.
[24]Mercante G, Frasoldati A, Pedroni C, et al. Prognostic factors affecting neck lymph node recurrence and distant metastasis in papillary microcarcinoma of the thyroid: results of a study in 445 patients[J]. Thyroid,2009,19(7):707~716.
[25]Moo T A, Umunna B, Kato M, et al. Ipsilateral versus bilateral central neck lymph node dissection in papillary thyroid carcinoma[J]. Ann Surg, 2009, 250: 403~408.
[26]Ito Y, Tomoda C, Uruno T, et al. Clinical significance of metastasis to the central compartment from papillary microcarcinoma of the thyroid[J]. World J Surg, 2006, 30: 91~99.
[27]Hartl D M, Leboulleux S, Al Ghuzlan A, et al. Optimization of staging of the neck with prophylactic central and lateral neck dissection for papillary thyroid carcinoma[J]. Ann Surg, 2012, 255: 777~783.
[28]Bilimoria K Y, Bentrem D J, Ko C Y, et al. Extent of surgery affects survival for papillary thyroid cancer[J]. Ann Surg, 246: 375~384.
[编辑] 一凡
2016-09-30
宋旗(1974-),男,硕士,主治医师,主要从事乳腺甲状腺疾病临床诊治工作,songq107@126.com。
R736.1
A
1673-1409(2016)36-0001-05
[引著格式]宋旗,张家衡,刘春萍. 甲状腺乳头状微小癌中央区淋巴结清扫319例临床分析[J].长江大学学报(自科版),2016,13(36):1~5.

