鱼类PPARs基因组织表达及功能研究进展
高俊 杜富宽 顾若波
(南京农业大学无锡渔业学院,江苏 无锡 214081) 徐钢春 南京农业大学无锡渔业学院,江苏 无锡 214081;中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081 南京农业大学无锡渔业学院,江苏 无锡 214081;中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081
鱼类PPARs基因组织表达及功能研究进展
高俊 杜富宽 顾若波
(南京农业大学无锡渔业学院,江苏 无锡 214081) 徐钢春 南京农业大学无锡渔业学院,江苏 无锡 214081;中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081 南京农业大学无锡渔业学院,江苏 无锡 214081;中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081
过氧化物酶体增殖物激活受体(PPARs)是一种新型的固醇类激素受体,也是配体依赖的核转录因子,由英国科学家Issemann等在1990年首先发现。近年来,PPARs在人类、啮齿动物及家禽家畜的各方面研究取得突出进展。目前,对于鱼类PPARs的研究主要集中在基因克隆、组织表达和功能预测上。对鱼类PPARs基因的组织表达及功能研究进展进行了综述。
PPARs;组织表达;功能;鱼类
过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPARs),由英国科学家Issemann等[1]在1990年首先发现。自发现以来,国内外研究人员对PPARs进行了广泛的研究。目前,国内外研究人员对啮齿动物和人类以及家禽家畜的PPARs基因的结构和功能、各组织中的表达量、调控脂类代谢和影响表达的因素等方面进行了广泛而深入的研究。PPARs主要作用于特定的目标基因来调控脂肪酸的合成与分解代谢、脂肪细胞的增殖和分化、心肌的能量与脂肪平衡、胎盘发育、炎症反应等,并影响胰岛素敏感性和糖类代谢[2]。人类的PPARs在动脉粥样硬化有关的脂质代谢和血管反应中起到重要作用[3],而且能够抑制其他心血管疾病,还能在2型糖尿病、胰岛素抵抗等糖尿病代谢综合征中发挥关键作用[4]。PPARs信号转导途径是脂质代谢三条主要途径之一[5]。近年来,鱼类PPARs的研究也正在开展起来,取得了一些进展。现对鱼类PPARs的组织表达及功能研究进展进行综述。
1 PPARs的亚型、结构和作用机制
PPARs具有PPARα、PPARβ(也称PPARδ)、PPARγ 3种亚型。在河豚(Takifugurubripes)、斑马鱼(Daniorerio)、日本青鳉(Oryziaslatipes)、大菱鲆(Scophthalmusmaximus)及草鱼(Ctenopharyngodonidellus)等鱼类中,PPARα有2种类型,即PPARα1和PPARα2[6]。根据启动子和拼接方式的不同,PPARγ产生了4种mRNA异构体,分别是PPARγ1、PPARγ2、PPARγ3、PPARγ4[7]。
PPARs的结构可分为A、B、C、D、E、F 6个区。其中5‘端的A/B区称为配体非依赖的转录激活域,该区保守性很差,主要通过磷酸化作用来调节配体和受体之间的亲和力来调节PPARs的活性;C区为DNA结合域(DNA biding domain,DBD),该区高度保守,包含2个锌指结构和1个α螺旋的DNA结合基序;D区为灵活的铰链区(hinge),主要连接DBD与配体结合域(ligand biding domain,LBD),参与PPARs的构象变化;3’端的E/F区为保守性较差的LBD[2]。
PPARs的表达需要LBD与配体的结合。PPARs的转录活性需要靶基因启动子上的PPAR反应元件(peroxisome proliferator response element,PPRE)。被配体激活的PPARs与类视黄醇X受体(retinoid X receptor,RXR)结合形成异二聚体,PPAR/RXR异二聚体与PPRE相结合,调节靶基因转录[8]。
2 PPARs的基因克隆和组织表达
目前,国内外研究获得了多种鱼类的PPARs基因的全长,但是许多研究只是研究了PPARs的某一种亚型,根据开放阅读框的序列推算出编码的氨基酸的个数以及氨基酸的序列,并检测了PPARs基因在各个组织的表达情况(表1)。
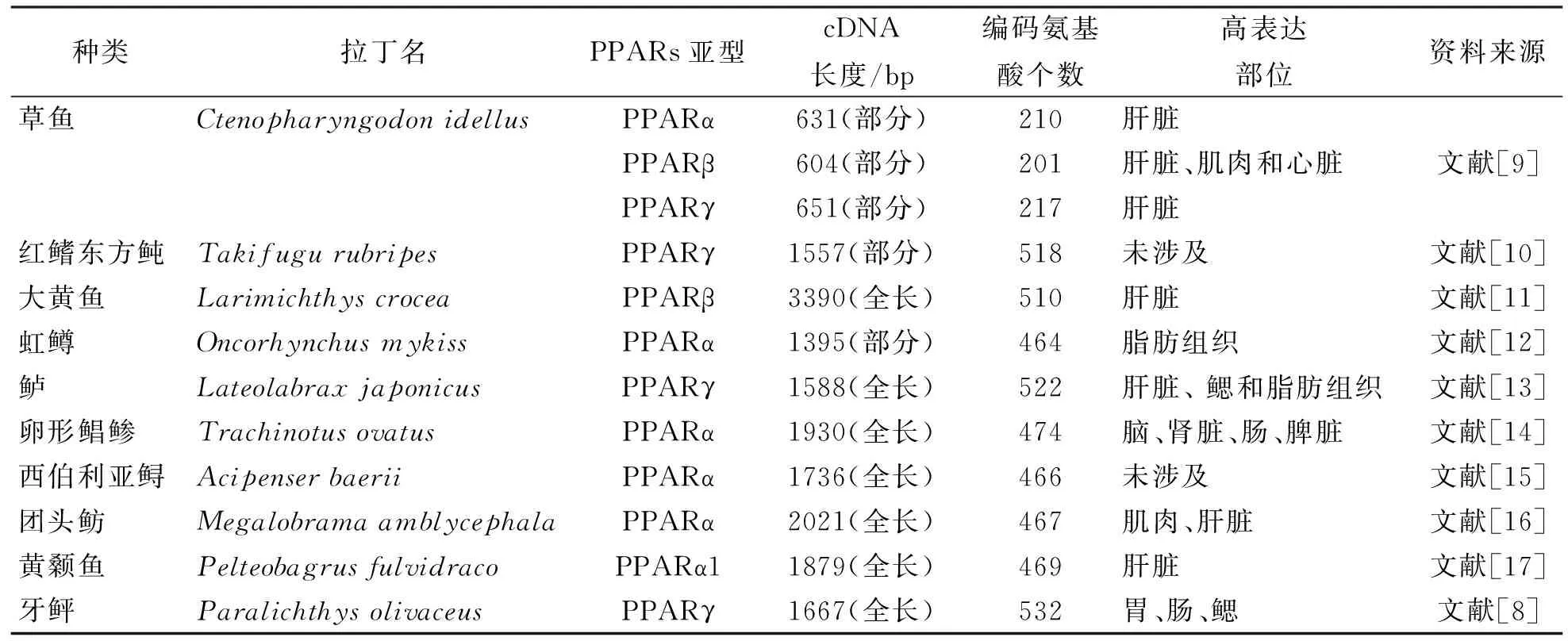
表1 鱼类 PPARs 基因的克隆与组织表达情况
从表1可以看出,PPARs在不同鱼类的表达存在组织特异性。这种情况还表现在其他鱼类上。例如在斑马鱼中也检测到了PPARs的 3种亚型,其中PPARα基因主要表达于肝脏、 肾脏、 肠和胰腺;PPARβ基因则在肝脏、肾近端和远端小管、肾小球、胰腺等众多组织中均有表达;PPARγ基因在胰腺、肠和性腺中表达量则很微弱[18]。在真鲷中,3种PPARs广泛表达在脂肪组织、鳃、心脏、幼鱼的肝细胞和成鱼的卵巢中,然而,在精巢中没有检测到PPARα的表达,在肌肉中则没有检测到PPARγ的表达[19]。
3 PPARs的功能
目前有关鱼类PPARα和PPARγ的功能研究有很多,而有关鱼类PPARβ的研究较少,对于鱼类的研究也主要集中在脂质代谢上。PPARs在调控脂肪细胞的分化、脂质代谢和部分脂肪因子的分泌起到重要作用[20]。鱼类PPARα参与多种多样的生理进程,可以通过调控参与脂质代谢的酶和基因来维持体内平衡[17],还可以通过调节靶基因编码的参与过氧化物酶体和线粒体脂肪酸β氧化的酶来调节脂质代谢[20],表明PPARα在脂质代谢活跃的组织中高表达。贾成霞等[12]研究发现,虹鳟PPARα的mRNA在脂肪组织和脂肪含量较高的腹部肌肉、肠以及肾脏等脂肪酸代谢率较高的组织中表达;方玲玲等[14]研究表明,卵形鲳鲹PPARα的mRNA在脑脂肪组织、头肾、肠和脾脏等脂肪含量丰富的组织中表达量较高。此外,Zhao等[16]研究发现,PPARα在精巢和卵巢中表达,精巢支持细胞和间质细胞中的PPARα和其他2种亚型能为精子的发生提供环境,它们可能会直接参与生殖细胞的成熟。PPARγ是诱导调控脂肪细胞的分化的关键转录因子之一,也是脂肪组织中调节脂质沉积的主要调节因子[20]。鲈(Lateolabraxjaponicus)的PPARγ基因主要表达在肝脏、鳃和脂肪组织中,与斑马鱼(Daniorerio)、金头鲷(Sparusaurata)PPARγ的组织分布类似,推测鱼类PPARγ在功能上可能与哺乳动物不同[13]。然而,Cho等[8]研究表明,牙鲆PPARγ与哺乳动物类似,在脂质代谢和脂肪生成中具有重要作用。此外,他们的研究还发现在饥饿状况下和早期发育时期,PPARγ是不可或缺的。除此之外,PPARs还参与多种个体发生相关的生理进程,例如,骨骼的形成和分化、细胞增殖和上皮细胞分化以及个体发生过程中的脂质代谢调节和免疫作用[21]。近年来,脂肪含量作为影响鱼肉品质的一项重要因素备受关注。PPARs在介导脂肪酸氧化及脂肪代谢中起到重要作用,其靶基因均与脂质转运和代谢相关[22]。
长期以来,脂肪组织一直被认为是被动的、不活跃的组织,因此国内外大量研究在考虑减少鱼体脂肪含量时主要从饲料组成角度开展工作,尝试通过降低饲料脂肪含量,即被动减少养殖鱼类脂肪摄入量来减少鱼体脂肪含量,但是结果并不理想,不仅鱼肉质量没有提高,而且抑制了鱼类的正常生长,降低了养殖效率[12]。研究发现,许多脂肪酸及其代谢产物、贝特类和噻唑烷二酮类药物、罗格列酮、小檗碱等是PPARs的激动剂[23~26],能够通过影响PPARs进而影响生物体内脂肪合成和代谢。Li等[27]研究发现,团头鲂中微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTTP)与PPARα和PPARβ存在某种潜在的联系。Cunha等[21]发现PPARs可通过对硬骨鱼类卵和早期仔鱼发育的脂肪酸代谢基因的调节来影响胚胎个体发育。
4 展望
综上所述,PPARs在脂质代谢方面发挥着重要的作用。此外,PPARs还能够缓解氧化应激引起的炎症反应和细胞凋亡。Zhang等[28]对脂肪性肝炎大鼠灌喂PPARα和PPARγ激动剂非诺贝特和罗格列酮,发现上调了PPARα和PPARγ的表达,还原性谷胱甘肽(GSH)和超氧化物歧化酶(SOD)的量显著上升,丙二醛(MDA)的量显著下降,炎症反应因子肿瘤坏死因子α(TNF-α)显著下降。Rani等[29]对高血糖大鼠腹腔注射PPARγ激动剂5,7-二羟黄酮,抑制了晚期糖基化终末产物及其受体(AGE-RAGE)引起的氧化应激和炎症反应。Collino等[30]对大脑缺血再灌注损伤的大鼠灌喂PPARγ激动剂罗格列酮和吡格列酮,发现PPARγ表达的上调对大鼠大脑缺血再灌注引起的海马体损伤起到了保护作用。曹泽玲等[31]对心肌缺血再灌注损伤的大鼠静脉注射PPARγ激动剂吡格列酮,发现PPARγ的活化有效减少了心肌梗死面积,抑制心肌细胞的凋亡。李健等[32]的研究同样也表明吡格列酮预处理减少了大鼠缺血再灌注损伤的心肌细胞梗死面积和细胞凋亡。然而,PPARs在鱼类氧化应激引起的炎症反应和细胞凋亡过程中的作用机制需要进一步研究。
[1] Issemann I,Green S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J]Nature,1990,347:645~ 650.
[2]黄春红,肖调义,刘巧林,等.畜产动物过氧化物酶体增殖物激活受体基因的表达模式及功能研究进展[J].动物营养学报,2013,(5):923~931.
[3]高鹏,杜丹华,吴江,等.PPARγ基因多态性与动脉粥样硬化性脑梗死的相关性研究[J].中风与神经疾病杂志,2009,(2):136~138.
[4]郝利霞,苏秀兰,毕力夫.PPARγ2基因P12A单核苷酸多态性与2型糖尿病肾病的相关性[J].内蒙古医科大学学报,2013,(4):290~294,298.
[5]马瑶,程海东.PPAR基因多态性的研究进展[J].中国优生与遗传杂志,2007,(9):6~9.
[6]Dong X,Xu H,Mai K,etal.Cloning and characterization of SREBP-1 and PPAR-α in Japanese seabass Lateolabrax japonicus,and their gene expressions in response to different dietary fatty acid profiles.[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2014,180C:48~56.
[7]刘寒,李苏,赵玉华,等.PPARα和PPARγ的克隆表达研究进展[J].中国农学通报,2013,29(14):31~36.
[8]Cho H K,Kong H J,Nam B H,etal.Molecular cloning and characterization of olive flounder (Paralichthysolivaceus) peroxisome proliferator-activated receptor γ[J].General & Comparative Endocrinology,2009,163:251~258.
[9]陈亮,梁旭方,瞿春梅,等.草鱼过氧化物酶体增殖物激活受体(PPAR)基因cDNA序列的克隆及其组成型表达[J].暨南大学学报(自然科学与医学版),2011,(1):80~87.
[10]张伟,付云,李翠萍,等.红鳍东方鲀PPARγ真核基因表达载体构建及亚细胞定位研究[J].现代农业科技,2014,(18):243~244,246.
[11]钱伦,钱云霞,童丽娟.大黄鱼PPAR β全长cDNA的克隆和组织表达[J].生物学杂志,2010,(6):1~4.
[12]贾成霞,张照斌,张清靖,等.虹鳟PPARα基因克隆、序列分析及其组织表达分布[J].中国水产科学,2012,(4):707~714.
[13]钱云霞,杨孙孝,梁洪,等.鲈PPARγ基因的克隆、组织表达及其抗体制备[J].水产学报,2010,(8):1156~1164.
[14]方玲玲,陈刚,王忠良,等.卵形鲳鲹PPARα基因cDNA序列的克隆、组织表达及生物信息学分析[J].广东海洋大学学报,2015,(4):1~9.
[15]艾立川,于晓彤,王嘉,等.西伯利亚鲟肝脏中过氧化物酶体增殖物激活受体α、脂蛋白脂酶、肝脂酶基因全长cDNA克隆与序列分析[J].动物营养学报,2015,(3):956~970.
[16]Zhao Y,Gul Y,Li S,etal.Cloning,identification and accurate normalization expression analysis of PPARα,gene by GeNorm inMegalobramaamblycephala[J].Fish & Shellfish Immunology,2011,31:462~468.
[17]Zheng J L,Zhuo M Q,Luo Z,etal.Peroxisome proliferator-activated receptor gamma(PPARγ) in yellow catfishPelteobagrusfulvidraco:Molecular characterization,mRNA expression and transcriptional regulation by insulininvivo,andinvitro[J].General & Comparative Endocrinology,2015,212:51~62.
[18]Ibabe A,Grabenbauer M,Baumgart E,etal.Expression of peroxisome proliferator-activated receptors in zebrafish (Daniorerio)[J].Histochemie,2002,118:231~239.
[19]Oku H,Umino T.Molecular characterization of peroxisome proliferator-activated receptors (PPARs) and their gene expression in the differentiating adipocytes of red sea breamPagrusmajor[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2008,151:268~277.
[20]王远孝,朱秋凤,黄进,等.过氧化物酶体增殖物激活受体对脂肪代谢的调控[J].畜牧与兽医,2008,(7):100~104.
[21]Cunha I,Galante-Oliveira S,Rocha E,etal.Dynamics of PPARs,fatty acid metabolism genes and lipid classes in eggs and early larvae of a teleost[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2013,164:247~258.
[22]徐有良.PPAR与动物脂肪细胞分化和脂肪代谢[J].广东畜牧兽医科技,2007,32(6):9~11.
[23]葛恒,王长谦.PPAR配体作用机制及新配体筛选研究进展[J].中国药学杂志,2004,39(3):170~172.
[24]郑刚,王佩显.贝特类和噻唑烷二酮类药物对代谢综合征血液化学异常的作用[J].国际内科学杂志,2005,32(10):431~435.
[25]马跃东,廖新学,唐安丽,等.PPARγ激动剂罗格列酮对大鼠心肌缺血-再灌注心律失常的影响[J].中山大学学报:医学科学版,2007,28(4):413~417.
[26]师凌云,田蜜,常伟,等.小檗碱对脂质代谢相关基因PPARα和CPTIA表达的影响[J].中国药理学通报,2008,24(11):1461~1464.
[27]Li J Y,Zhang D D,Jiang G Z,etal.Cloning and characterization of microsomal triglyceride transfer protein gene and its potential connection with peroxisome proliferator-activated receptor (PPAR) in blunt snout bream (Megalobramaamblycephala)[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2015,189:23~33.
[28]Yan Z,Yan C,Wang X L,etal.PPARγ agonists and antagonists differently affect hepatic lipid metabolism,oxidative stress and inflammatory cytokine production in steatohepatitic rats[J].Cytokine,2015,75:127~135.
[29]Rani N,Bharti S,Bhatia J,etal.Chrysin,a PPARγ-agonist improves myocardial injury in diabetic rats through inhibiting AGE-RAGE mediated oxidative stress and inflammation[J].Chemico-biological interactions,2016,250:59~67.
[30]Collino M,Aragno M,Mastrocola R,etal.Modulation of the oxidative stress and inflammatory response by PPARγ agonists in the hippocampus of rats exposed to cerebral ischemia/reperfusion[J].European Journal of Pharmacology,2006,530:70~80.
[31]曹泽玲,叶平,龙超良,等.吡格列酮对缺血再灌注心肌细胞凋亡影响的实验研究[J].中华心血管病杂志,2005,(7):648~652.
[32]李健,冯义柏,田莉,等.吡格列酮预处理对大鼠缺血再灌注心肌细胞凋亡和线粒体超微结构的影响[J].临床心血管病杂志,2008,24(8):720~724.
2016-07-26
公益性行业(农业)科研专项(201203065);江苏省科技成果转化专项(BA2015167);江苏省水产三新工程重大专项(D2015-14)。
高俊(1992-),硕士生,研究方向为鱼类规模化繁育及健康养殖技术。通信作者:顾若波,gurb@ffrc.cn。
Q75;Q959.4
A
1673-1409(2016)33-0043-04
[引著格式]高俊,徐钢春,杜富宽,等.鱼类PPARs基因组织表达及功能研究进展[J].长江大学学报(自科版),2016,13(33):43~46.

