烟花苷对刀豆蛋白A致小鼠急性肝损伤的保护作用
张石蕾, 赵 军, 刘 涛, 吉腾飞, 徐 芳
(1新疆医科大学公共卫生学院, 乌鲁木齐 830011; 2新疆维吾尔自治区药物研究所维吾尔药重点实验室, 乌鲁木齐 830004;
·药学研究·
烟花苷对刀豆蛋白A致小鼠急性肝损伤的保护作用
张石蕾1, 赵 军2, 刘 涛1, 吉腾飞3, 徐 芳2
(1新疆医科大学公共卫生学院, 乌鲁木齐 830011;2新疆维吾尔自治区药物研究所维吾尔药重点实验室, 乌鲁木齐 830004;
3中国医学科学院药物研究所天然药物活性成分与功能国家重点实验室, 北京 100050)
目的 探究烟花苷对刀豆蛋白A (Con A) 致小鼠急性免疫性肝损伤的保护作用。方法 选取48只昆明种小鼠随机分为正常组、模型组、联苯双酯阳性对照(150 mg/kg体质量)组和烟花苷低、中、高剂量(25、50、100 mg/kg体质量)组。烟花苷低、中、高剂量和联苯双酯阳性对照组连续给药10 d,末次给药 1 h后,模型组、联苯双酯阳性对照组和烟花苷低、中、高剂量尾静脉注射刀豆蛋白A(Con A)20 mg/kg体质量造模,正常组小鼠尾静脉注射相同体积PBS溶液。造模8 h后采血,处死小鼠,剖腹取肝脏,制备肝匀浆。检测小鼠肝脏血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)活性;检测肝脏组织匀浆中丙二醛 (MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和一氧化氮(NO)的含量;并通过HE染色观察肝脏组织的病理学变化。结果 与模型组比较,烟花苷中、高剂量组小鼠血清AST水平降低,差异有统计学意义(P<0.05),低、中、高剂量组小鼠血清ALT水平降低,差异有统计学意义(P<0.05);烟花苷中、高剂量组能降低小鼠血清MDA和NO水平,差异有统计学意义(P<0.05),低、中、高剂量组SOD和GSH水平明显提高,差异有统计学意义(P<0.05);烟花苷低、中、高剂量组小鼠血清TNF-α、IL-6和IL-1β水平降低, 差异有统计学意义(P<0.05),高剂量组小鼠血清IFN-γ水平降低, 差异有统计学意义(P<0.05);肝脏病理学检测显示烟花苷能明显减轻Con A对肝脏组织的病理损伤。结论 烟花苷对ConA致小鼠急性免疫性肝损伤有明显的保护作用,其机制与其抗氧化、抑制促炎因子的表达密切相关。
烟花苷; 刀豆蛋白A; 肝损伤; 保肝作用
维吾尔药睡莲花为睡莲科睡莲属多年生水生草本植物雪白睡莲(Nymphaea candida Presl)的干燥花蕾,是炎消迪娜儿糖浆等抗肝炎药物的主要组成之一,被《维吾尔药志》收载[1]。烟花苷(山奈酚-3-O-β-D芸香糖苷)是睡莲花的主要标识性成分之一,是一种连接有芸香糖的黄酮醇苷类化合物,存在于多种植物中,具有抗氧化、抗菌、抗病毒、抗炎镇痛及神经保护等多种生物活性[2-4],但其保肝作用的系统研究鲜有文献报道。本研究在前期研究的基础上,通过刀豆蛋白A诱导的小鼠急性免疫性肝损伤模型探讨烟花苷的保肝护肝作用,以期为烟花苷的深入开发提供数据基础,现报道如下。
1 材料与试剂
1.1 实验动物 SPF级昆明种小鼠,雄性,体质量18~22 g,购自新疆医科大学实验动物研究中心,合格证号:SYXK(新)2011-0004,使用许可证号:SYXK(新)2011-0001。实验室通风良好,室温(20±2)℃,湿度30%~40%,清洁环境,实验动物自由饮水进食。
1.2 试剂 烟花苷提取物自制(含量>95%),联苯双酯滴丸(北京协和药厂生产,批号:0505010r7),刀豆蛋白TypeⅣ (ConA)(北京博奥拓达,批号:20151026),总蛋白定量(BCA法)、MDA、SOD、GSH、NO试剂盒(南京建成生物工程研究所,批号:20151219、20151207、20150610、20151112、20150605),IL-1β、IL-6、TNF-α、IFN-γ试剂盒(武汉博士德生物有限公司,批号:11611921015、132111031015、24111951015、9711891015),PBS缓冲液(上海易利生化试剂有限公司,批号:20150617),其它试剂均为分析纯。
1.3 仪器 全自动生化分析仪(深圳迈瑞生物医疗有限公司),UV1200 紫外可见分光光度计(上海美谱达仪器有限公司),BIO-RAD全波长酶标仪(Bench Mark PLUS),FSH-2A可调高速匀浆机(金坛市医疗仪器厂),MIKR022R低速冷冻离心机(杭州普瑞特仪器有限公司),电热恒温水温箱(北京市永光明医疗仪器厂)。
2 方法
2.1 小鼠急性免疫性肝损伤模型的建立 昆明种小鼠48只,体质量18~22 g,随机分为正常组、模型组、联苯双酯对照组(150 mg/kg体质量)和不同浓度的烟花苷高、中、低剂量组(100、50、25 mg/kg体质量)。除正常组和模型组每天灌胃等体积的蒸馏水1次外,其他各给药组小鼠按10 mL/kg体质量每天灌胃给药1次,连续灌胃10 d。末次给药1 h后,模型组和各给药组尾静脉注射ConA 20 mg/kg体质量造模,正常组小鼠尾静脉注射相同体积PBS溶液。禁食8 h后,摘眼球取血,4℃放置2 h后,3 000 r/min离心10 min,留取血清待检。颈椎脱臼处死小鼠,解剖,摘取肝脏。精确称取各组小鼠同部位肝脏组织0.5 g置于冷生理盐水中,滤纸吸干水分,按 1∶9( 质量体积比) 加入生理盐水4.5 mL,冰浴研磨至浆状,3 000 r/min离心10 min,取肝匀浆上清液待检。
2.2 检测指标 按试剂盒说明书测定肝匀浆中丙二醛 (MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和一氧化氮(NO)的含量,采用全自动生化仪测定血清谷草转氨酶(AST)、谷丙转氨酶(ALT)含量;采用ELISA法测定血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)活性。
2.3 病理组织学观察 处死小鼠后,取肝脏左叶距边缘0.5 cm处小块组织,用10%甲醛固定,HE染色,光镜下观察肝组织病理学变化。
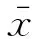
3 结果
3.1 烟花苷对ConA致急性肝损伤小鼠血清AST和ALT的影响 与正常组比较,模型组小鼠血清ALT和AST活性显著提高(P<0.05),表明肝细胞膜的结构和功能损伤,造模成功。与模型组比较,烟花苷中、高剂量组小鼠血清AST水平降低,差异有统计学意义(P<0.05)。与对照组比较,烟花苷低、中、高剂量组小鼠血清ALT水平降低,差异有统计学意义(P<0.05),见表1。
3.2 烟花苷对ConA致急性肝损伤小鼠肝匀浆MDA、SOD、GSH和NO的影响 与正常组相比较,模型组小鼠肝匀浆MDA和NO水平提高,差异有统计学意义(P<0.05);SOD和GSH水平显著降低,差异有统计学意义(P<0.05)。与模型组比较,烟花苷中、高剂量组小鼠血清MDA和NO水平降低,差异有统计学意义(P<0.05);烟花苷低、中、高剂量组SOD和GSH水平明显提高,差异有统计学意义(P<0.05),效果接近于对照组,见表2。


组别剂量/(mg/kg体质量)ALT/(U/L)AST/(U/L)正常组-44.7±11.65104.07±13.82模型组-77.22±28.91#133.02±11.62#对照组15054.4±15.73*120.91±12.19烟花苷高剂量组10045.57±11.66*110.58±19.59*烟花苷中剂量组5053.76±8.20*116.51±13.16*烟花苷低剂量组2557.7±27.05*122.95±13.24
注:与正常组比较,#P<0.05; 与模型组比较,*P<0.05。

表2 烟花苷对ConA致急性肝损伤小鼠肝匀浆MDA、SOD、GSH和NO的影响(n=8, ±s)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05。
3.3 烟花苷对ConA致急性肝损伤小鼠血清IL-1β、TNF-α、IL-6和IFN-γ的影响 与正常组相比较,模型组小鼠血清IL-1β、TNF-α、IL-6和IFN-γ水平提高,差异有统计学意义(P<0.05);与模型组相比较,烟花苷低、中、高剂量组小鼠血清TNF-α、IL-6和IL-1β水平降低,差异有统计学意义(P<0.05);与模型组相比较,烟花苷高剂量组小鼠血清IFN-γ水平降低,差异有统计学意义(P<0.05),中、低剂量组IFN-γ降低,但差异无统计学意义,见表3。

表3 烟花苷对ConA致急性肝损伤小鼠血清细胞因子的影响(n=8, ±s)
注:与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
3.4 烟花苷对ConA致急性肝损伤小鼠肝组织病理形态学的影响 光镜下观察可见正常组小鼠肝细胞以中央静脉为中心呈放射状排列,肝小叶结构完整,无病理改变,汇管区未见炎细胞浸润(图1A)。模型组小鼠肝细胞严重水肿,细胞质疏松化,中央静脉肝血窦扩张充血,肝窦内可见红细胞堆集,肝内出现弥漫性分布的点、片状坏死,小叶周边脂肪变性,弥散性炎细胞、淋巴细胞浸润,嗜酸性变(图1B)。联苯双酯组小鼠肝细胞水肿不明显,偶见点状坏死,汇管区只有少量炎细胞浸润(图1C)。睡莲花烟花苷各剂量组相比,模型组肝细胞损伤程度明显减轻,炎性细胞浸润显著减少,其中烟花花苷高(图1D)、中(图1E)剂量组较低(图1F)剂量组,受损程度及修复情况较好。
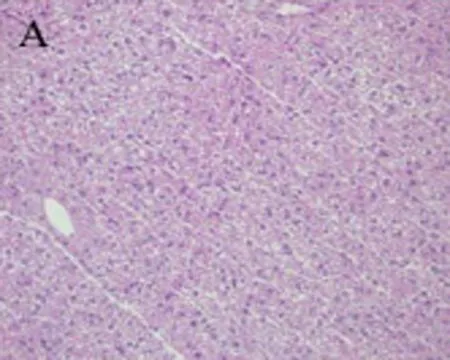

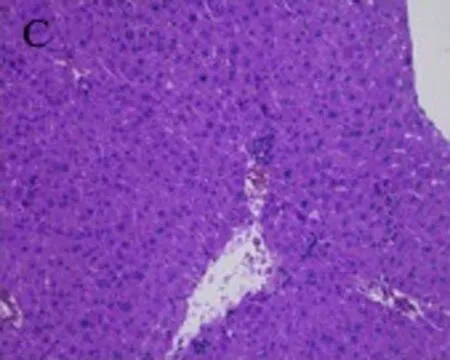
A:正常组 B:模型组 C:联苯双酯阳性对照组150 mg/kg
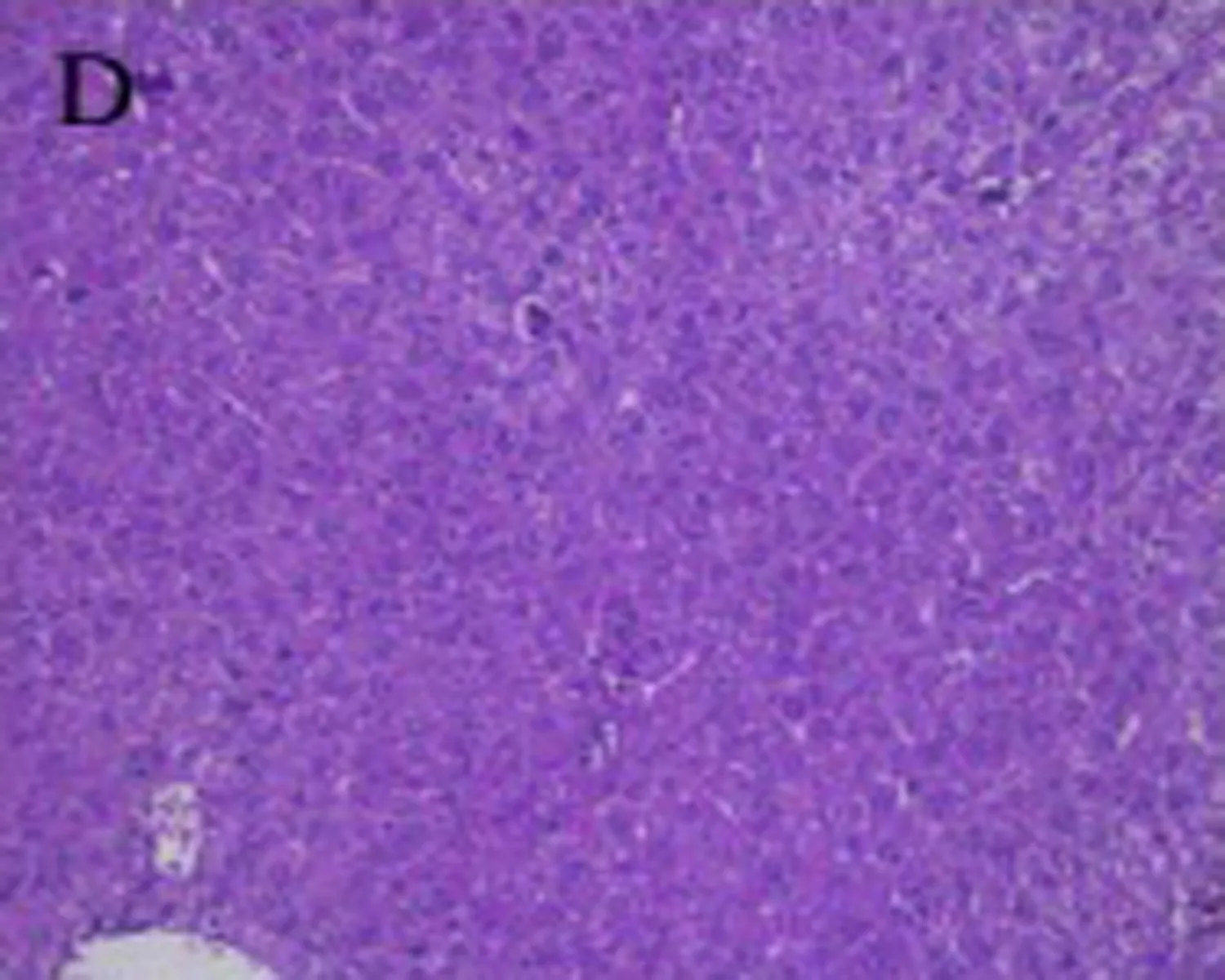


D:烟花苷高剂量组100 mg/kg E:烟花苷中剂量组 50 mg/kg F:烟花苷低剂量组 25mg/kg
图1 烟花苷对ConA致急性肝损伤小鼠肝脏病理组织学的影响(HE染色,×200)
4 讨论
Con A是一种被广泛应用可活化T细胞的有丝分裂原,其诱导T淋巴细胞依赖性肝损伤病理与人类自身免疫性肝病,急、慢性病毒性肝炎相似[5-6]。在急性免疫性肝损伤模型中,T淋巴细胞被确认为是ConA诱导的小鼠免疫性肝损伤模型的效应细胞,引起小鼠T细胞依赖性肝损伤[7]。辅助性T淋巴细胞(Th)主要分为:Th1和Th2。Th1和Th2细胞因子有相互抑制和调节的作用,机体正常状态时Th1和Th2处于相对平衡状态,这种平衡状态被打破就会引起疾病的产生。脂质过氧化反应是肝损伤发生的重要机制。脂质过氧化的主要降解产物脂质过氧化物MDA,可严重损伤肝细胞膜结构,导致肝细胞的肿胀、坏死,可反映机体脂质过氧化程度,是评价自由基损伤的关键指标,其含量高低与自由基损伤程度密切相关。SOD是体内重要的氧自由基清除剂,SOD活性的降低将导致氧自由基蓄积,从而诱导细胞损伤。NO是许多肝脏疾病中重要的炎性介质之一,肝细胞在体外可经特异性细胞因子及LPS协同诱导,持续产生大量的NO,介导多种病理生理效应,包括肝细胞毒性效应。Con A 活化Th1 细胞后可刺激库普弗细胞和肝细胞产生大量TNF-α,TNF-α可通过激活核因子诱导多个调节免疫与炎症过程的基因转录,包括TNF-α、诱导型一氧化氮合酶(iNOS)及IFN-γ等,这些细胞因子的转录激活都与肝损伤密切相关[8-10]。
本研究表明Con A诱导急性肝损伤后,小鼠血清ALT、AST活性明显升高。预先给予及治疗性给予烟花苷后,小鼠血清ALT、AST活性较模型组明显降低,并且可减轻小鼠肝脏的病理损伤程度。此外,烟花苷可降低MDA、NO含量,并升高SOD、GSH活性。表明烟花苷有明显抑制肝组织脂质过氧化反应,提示其作用机制可能与其抗氧化作用有关。给小鼠注射Con A后,活化Th细胞和巨噬细胞产生过量TNF-α、IFN-γ、IL-1β、IL-6等细胞因子。烟花苷中、高剂量组小鼠血清中TNF-α、IFN-γ和IL-1β、IL-6水平明显降低。
综上所述,烟花苷对小鼠急性免疫性肝损伤有明显的保护作用,其机制可能与抗氧化及炎性细胞因子的抑制有关。
[1] 刘勇民.维吾尔药志[M].乌鲁木齐:新疆科技卫生出版社,1999:496.
[2] Wang Y, Chen P, Tang CY, et al. Antinociceptive and anti-inflammatory activities of extract and twoisolated flavonoids of Carthamustinctorius[J]. J of Ethnopharm Pharm, 2014,151 :944-950.
[3] Li R, Guo ML, Zhang G,Xu XF, et al. Neuroprotection of Nicotiflorin in permanent focal cerebral ischemiaand in neuronal cultures[J].Biol Pharm Bull,2006,29(9): 1868-1872.
[4] Huang JL,Fu ST, Jiang YY, etal. Protective effects of Nicotiflorin on reducing memory dysfunction, energymetabolism failure and oxidative stress in multi-infarct dementia model rats[J].Pharm Bioch Behavior,2007, 86:741-748.
[5] 刘耕陶.中药药理研究与药物创新[M].北京:中国协和医科大学出版社,2006:34-35.
[6] 张翔,凌保东,李蕊兴,等.肝病冲剂对实验性肝损伤的保护作用[J].川北医学院学报,1991,5(2):22-24.
[7] 曲建慧,张修礼.Con A性小鼠肝损伤模型的研究及应用[J].中国肝脏,2001, 6(3):180-181.
[8] 刘光伟,王灵台,高月求,等.刀豆蛋白A诱导的肝损伤模型T细胞亚群变化及机制探讨[J].中国中西医结合消化杂志, 2008, 16(5): 332-334.
[9] Nakamura K, Okada M, Yoneda M, et al. Macrophage inflammatory protein-2 induced by TNF-alpha plays a pivotal role in concanavalin A-induced liver injury in mice [J]. J Hepatol, 2001, 35(2): 217-224.
[10] Gantner F,Leist M, Lohse AW,et al. Concanavalin A-induced T-cell mediated hepatic injury in mice:the role of tumor necrosis factor[J]. Hepatology,1995,21(1):190 -198.
(本文编辑 施洋)
The protective effect of nicotiflorin on acute hepatic injury in mice induced by concanavalin A
ZHANG Shilei1, Zhao Jun2, LIU Tao1, JI Tengfei3, XU Fang2
(1CollegeofPublicHygiene,XinjiangMedicalUniversity,Urumqi830011,China;2XinjiangKeyLaboratoryforresearchandDevelopmentofUighurMedicines;XinjiangInstituteofMateriaMedica,Urumqi830004.3StateKeyLaboratoryofBioactiveSubstanceandFunctionofNaturalMedicines,InstituteofMateriaMedica,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100050,China)
Objective To study protective effect of Nicotiflorin from Nymphaea andida on immunological liver injury induced by ConA in mice and its mechanism. Methods Forty-eight healthy adult mice were divided into six groups equaled randomly: control group, model group, dimethyl diphenyl bicarboxylate (DDB) positive control group and Nicotiflorin group (25, 50, 100 mg/kg·d), intragastric administration for ten days. One hour after the last medication, the mice except the blank control group were tail vein injected with ConA 20 mg/kg PBS solution. Mice were sacrificed at the 8th hour and blood was collected, the liver was harvested for liver homogenate. The levels of ALT, AST, IL-1β , IL-6, IFN-γ and TNF-α in serum, and the contents of MDA, SOD, NO and GSH in 1iver homogenate were measured. And histopathlogical examination was observed. Results Compared with that of model group, the levels of serum AST were decreased in the high dose group, which the difference was statistically significant (P<0.05); the low, middle and high dose group could reduce the level of serum ALT in mice, and the difference was statistically significant (P<0.05); the serum levels of MDA and NO were decreased in the high dose group, which the difference was statistically significant (P<0.05); and the low, medium and high dose group could significantly improve the level of SOD and GSH, and the difference was statistically significant (P<0.05); the low, medium and high dose group could reduce serum TNF-α, IL-6 and IL-1β (P<0.05), and the high dose group could reduce the level of serum IFN-γ (P<0.05) in mice and the hepatic pathological features were improved. Conclusion Nicotiflorin has a protective effect on acute damage of liver in mice induced by ConA, and its mechanism might be related to anti-oxidant and decrease of releasing inflammatory cytokines.
nicotiflorin; concanavalin A; liver injury; protective effect
新疆维吾尔自治区科技支撑计划项目(20133318)
张石蕾(1992-),女,在读硕士,研究方向:新疆特色药兼药用植物的应用研究。
刘 涛,女,博士,教授,硕士生导师,研究方向:新疆特色药兼药用植物的应用研究,E-mail:xjmult@163.com。
R966
A
1009-5551(2016)12-1559-05
10.3969/j.issn.1009-5551.2016.12.018
2016-6-10]

