多b值扩散加权成像对兔肝纤维化分期诊断的价值
王 皓, 郝 璐, 王 红, 王云玲, 贾文霄
(1新疆医科大学第二附属医院影像中心, 乌鲁木齐 830028; 2新疆医科大学, 乌鲁木齐 830011)
多b值扩散加权成像对兔肝纤维化分期诊断的价值
王 皓1, 郝 璐1, 王 红1, 王云玲1, 贾文霄2
(1新疆医科大学第二附属医院影像中心, 乌鲁木齐 830028;2新疆医科大学, 乌鲁木齐 830011)
目的 探讨磁共振多b值扩散加权成像对兔肝纤维化分期诊断的价值,并寻找判断肝纤维化严重程度的敏感指标。方法 新西兰大白兔70只,实验组60只,四氯化碳腹腔注射建立肝纤维化模型,对照组10只,腹腔注射生理盐水。对兔肝纤维化模型行MRI多b值扩散加权成像,分别测量ADClow、ADChigh、ADC10b及ADCperf值。结果 随着肝纤维化程度加重,ADCperf和ADC10b值依次降低,差异有统计学意义(P<0.01),ADCperf预测S2期及以上肝纤维化时曲线下面积最大。ADC10b预测S1期及以上肝纤维化时曲线下面积最大。肝脏ADCperf值和ADC10b值与肝纤维化的严重程度呈负相关(r=-0.720、-0.685,P<0.01)。结论 ADCperf能够反映肝纤维化各期血流灌改变,可以对肝纤维化进行评价。ADCperf值和ADC10b值具有定量肝纤维化严重程度的能力。
肝纤维化; 动脉模型; 磁共振成像
肝纤维化是许多慢性肝病,如慢性肝炎、脂肪肝共同的病理过程,如不阻断病因任其发展最终可发展为肝硬化。肝纤维化经积极治疗可以好转,而肝硬化则难以逆转[1]。因此,早期诊断并实施干预措施对防止肝纤维化进一步发展具有重要的临床意义。目前,临床公认为肝脏穿刺活组织病理检查是判定肝纤维化严重程度的“金标准”,但这种检查存在诸多不足,首先易受组织取材部位的大小以及观察者影响,其次是一种创伤性检查,有一定的并发症风险,不为部分患者接受,动态观察和随访有很多不便[2]。
MR扩散加权成像(Diffusion Weighted Imaging,DWI)是磁共振的一种功能成像,它能够无创性反映活体组织内水分子扩散运动状态以反映组织内部结构特点。其对脑缺血性病变及肿瘤性病变的诊断价值已得到广泛认可。本研究通过对兔肝纤维化模型进行多b值的DWI扫描,分别拟合出各种组合图像并测量对应的ADC值,分析其变化情况,判断与肝纤维化分级之间的关系。
1 材料与方法
1.1 实验动物及模型制作 本研究通过伦理委员会审核,选取70只成年新西兰大白兔,雌雄不限,体质量2.5~4.5 kg,平均(3.4±1.1)kg。随机分成两组,实验组60只,对照组10只。实验组腹腔注射四氯化碳油溶液,浓度为10%,按0.1 mL/kg四氯化碳注射,每周注射2次[3]。对照组腹腔注射生理盐水,按0.1 mL/kg注射,每周注射2次。实验组和对照组均共计注射12 w。
1.2 扫描技术和参数 采用SE-EPI序列,横断面扫描,多个b值的扩散加权成像。扫描参数如下:TR:2 000 ms,TE:65 ms,FOV:120 mm,采集次数(NSA)8次,矩阵168×113,层厚2.0 mm,层数:18层,层间距1 mm。分别施加不同梯度因子,采用10个扩散敏感梯度因子b值,分别为0、100、200、300、400、500、600、700、800、1 000 s/mm2。扫描时间约240 s。
1.3 图像后处理 将得到的10个b值扩散加权成像原始图像输入Bio-map后处理软件内,计算出不同b值组成的拟合ADC图。先根据10个b值拟合获取ADC10b图(图1);3个较大b值(700、800、1 000 s/mm2)拟合出ADChigh(图2);使用较低b值(0、100、200 s/mm2)拟合出ADClow图(图3)。最后将ADClow与ADChigh信号之间的差异定义为ADCperf值且拟合出ADCperf图(图4)。
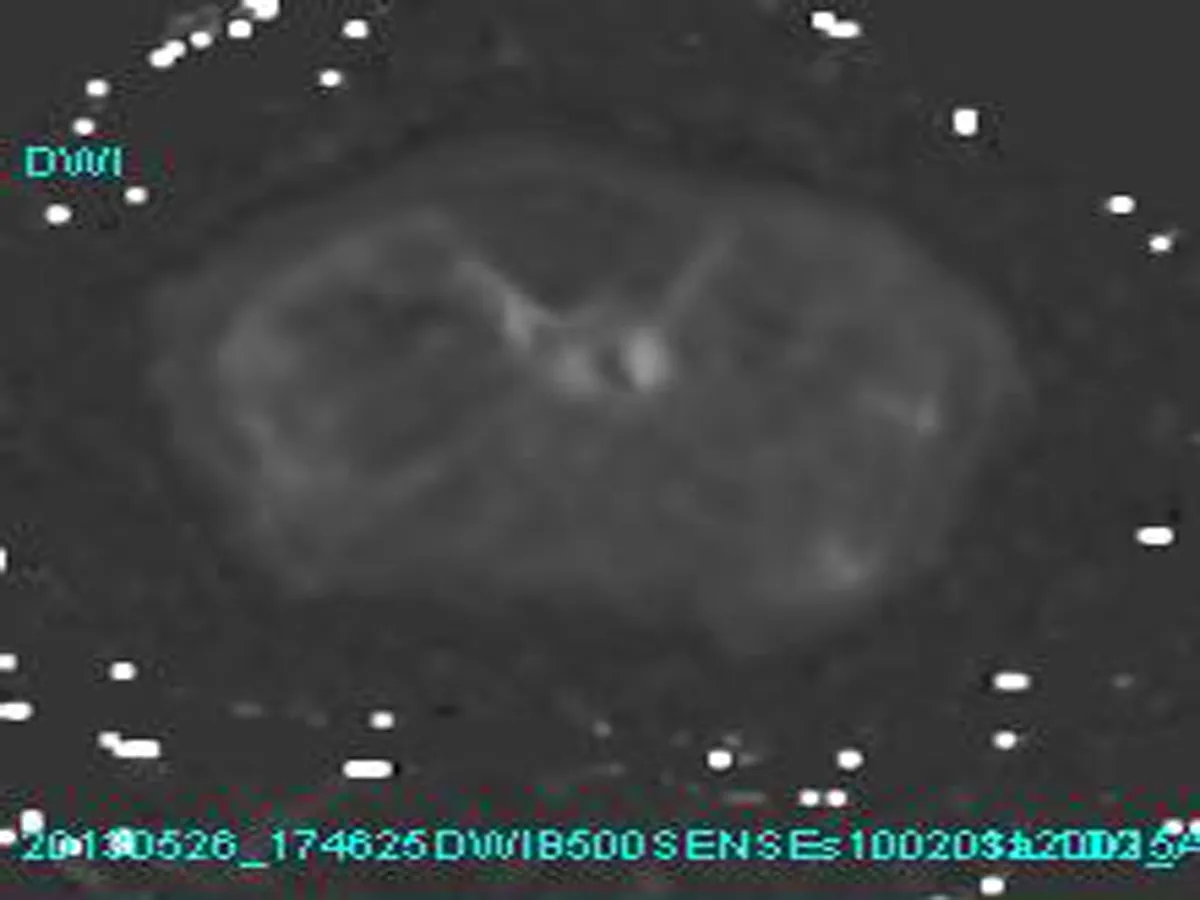
图1 ADC10b图

图2 ADChigh图

图3 ADClow图

图4 ADCperf图
1.4 病理检查 完成影像学检查,处死动物。解剖肝脏,选择与感兴趣区层面相对应断面,观察肝脏的断面结构。在肝脏的左右叶各取2块组织,分别行苏木精-伊红(HE)及Masson三色染色。肝纤维化的病理分期参照以下标准[4]:S0期:无肝纤维化,肝细胞排列整齐,小叶结果清晰;S1期:汇管区纤维化扩大,局限于窦周和小叶内纤维化,肝小叶结构完整,无纤维间隔形成,可见小叶中央血管扩张;S2期:汇管区周围纤维化,纤维间隔形成,但小叶结构保留;S3期:小叶结构紊乱,无假小叶形成,纤维间隔形成较明显,无肝硬化;S4期即早期肝硬化,小叶结构破坏,假小叶形成且被纤维间隔环绕。
1.5 统计学分析 采用统计软件包SPSS 17.0对拟合所得ADC值进行统计学处理。对不同程度肝纤维化组间各拟合ADC值差异的比较运用单因素方差分析(One-Way Anova),组间两两比较采用最小显著差异法(LSD)。利用受试者工作特征曲线(ROC)判定各参数对肝纤维化分期的诊断效能,选择约登指数最大的值为截断点,选择最佳的敏感性和特异性。扩散参数与肝纤维化分期的相关性采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 造模情况及病理检测结果 实验组60只新西兰大白兔,死亡14只,死亡多出现在造模早期,原因分别为腹腔出血、腹泻、肝损伤等。另外6只因图像质量较差不符合要求予以剔除。实验组图像符合软件分析的共40只,对照组10只全部完成扫描并获得满意图像。
对照组兔肝脏质地柔软,表面呈鲜红色。实验组随着肝纤维化程度的增加,肝脏肿胀明显,肝脏呈灰白色,质地逐渐变硬,部分肝脏表面可见结节样改变,并可见腹腔积液。对照组肝脏标本经过HE及Masson染色后,分期均为S0期,镜下观察HE染色见兔肝小叶结构完整,肝细胞呈放射状排列,汇管区结构清晰(图5);Masson染色未见纤维组织沉积(图6)。实验组肝脏为S1、S2、S3、S4期,经HE及Masson三色染色后,分别观察。S3期,HE染色可见小叶结构紊乱(图7);Masson染色可见纤维间隔增厚,假小叶形成不明显(图8)。实验组根据病理分级,S1期11只,S2期12只,S3期9只,S4期8只。对照组10只均为S0期。
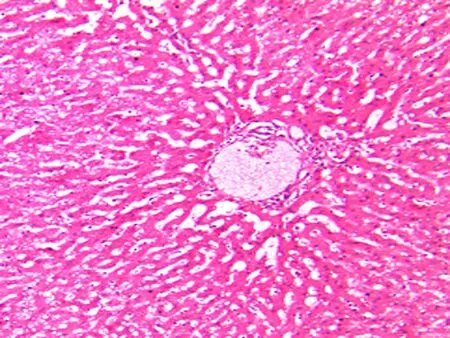
图5 S0期(HE×100)
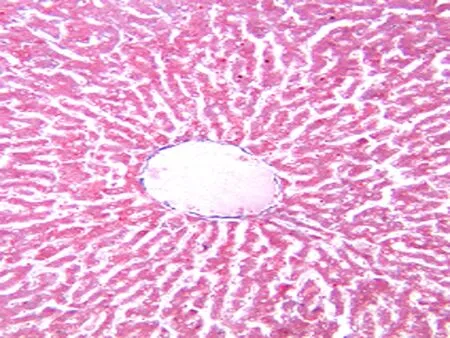
图6 S0期(Masson×100)

图7 S3期(HE×100)
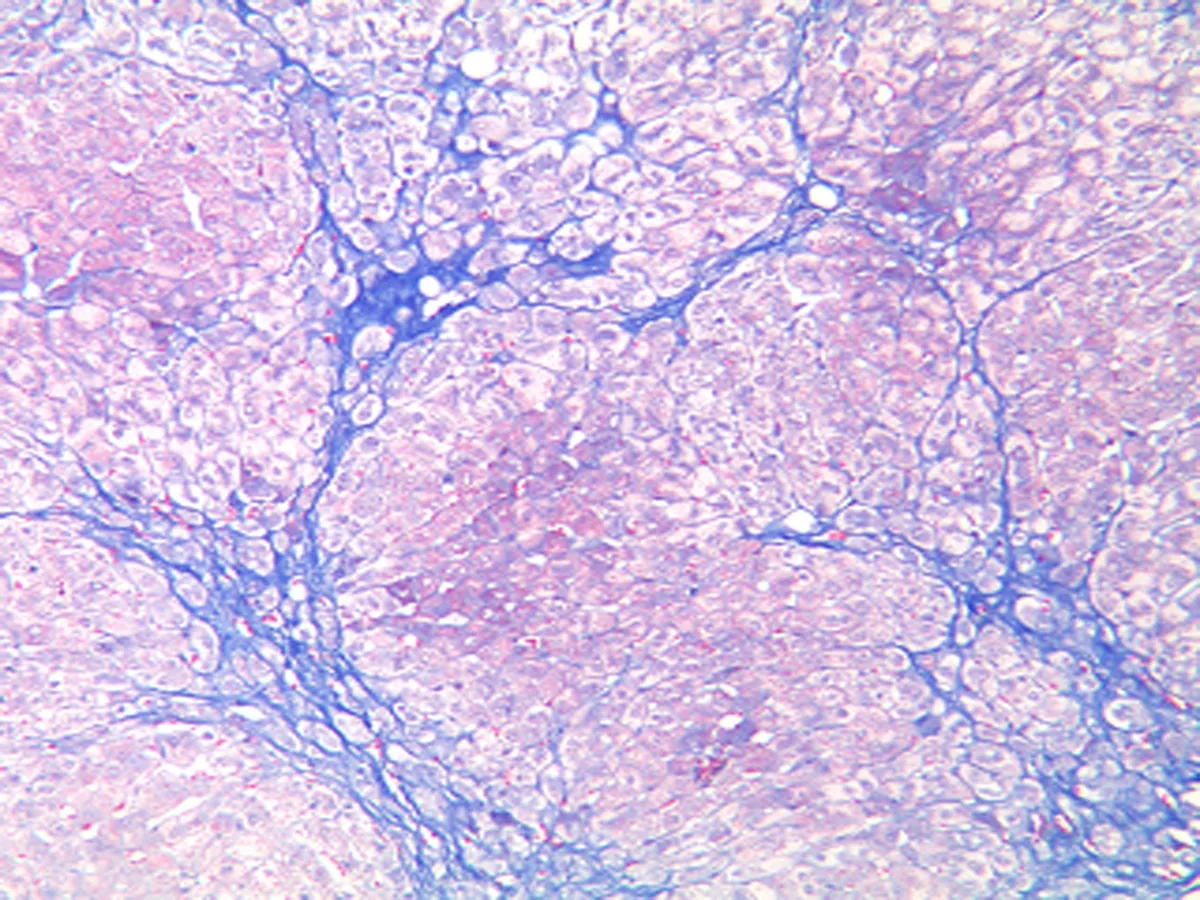
图8 S3期(Masson×100)
2.2 肝脏拟合ADC值 观察未拟合的多b值图像可以发现,随着b值的增加,图像的信噪比降低。随着肝纤维化程度的加重,DWI信号升高,ADC图信号强度下降。根据肝纤维化的分期进行分组,观察不同分组的拟合的变化情况(表1)。比较发现,不同b值拟合出的4个扩散加权成像指标均随着肝纤维化程度的加重,呈现逐渐下降的趋势。其中ADCperf、ADC10b差异有统计学意义(P<0.01),而ADClow、ADChigh差异无统计学意义(P>0.05)。两两比较后显示,对于ADCperf,S0期与S1、S2、S3、S4期比较差异有统计学意义(P<0.05),S1期与S2、S3、S4期比较差异有统计学意义(P<0.05);对于ADC10b,S0期与S2、S3期比较差异具有统计学意义(P<0.01),S1期与S2、S3期比较差异具有显著统计学意义(P<0.01)。ROC曲线显示,ADCperf预测S2期及以上肝纤维化时曲线下面积最大,AUC=0.937(图9);ADC10b预测S1期及以上肝纤维化时曲线下面积最大,AUC=0.869(图10)。

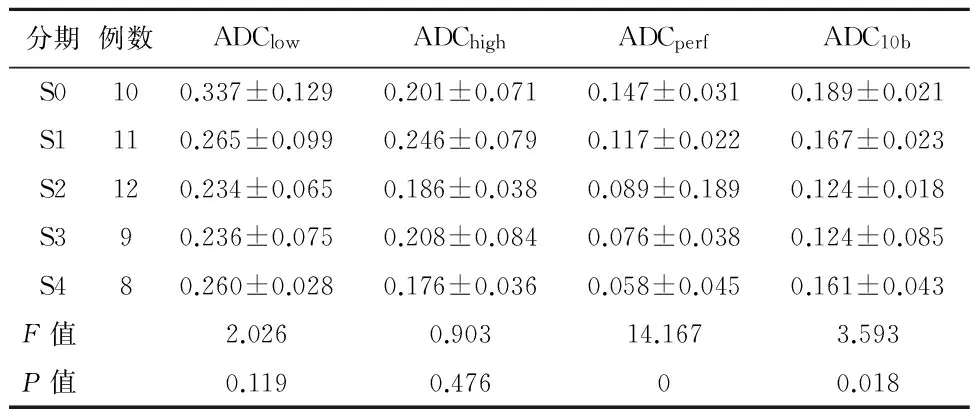
分期例数ADClowADChighADCperfADC10bS0100.337±0.1290.201±0.0710.147±0.0310.189±0.021S1110.265±0.0990.246±0.0790.117±0.0220.167±0.023S2120.234±0.0650.186±0.0380.089±0.1890.124±0.018S390.236±0.0750.208±0.0840.076±0.0380.124±0.085S480.260±0.0280.176±0.0360.058±0.0450.161±0.043F值2.0260.90314.1673.593P值0.1190.47600.018
相关分析后显示ADCperf、ADC10b与肝纤维化的严重程度呈负相关(r=-0.720、-0.685,P<0.01)。ADClow、ADChigh与肝纤维化严重程度无明显相关性(P>0.05)。
3 讨论
3.1 DWI序列多b值的选择 对于DWI评价肝纤维化的作用及机制存在不少争议。因为b值选择的不同,导致肝纤维化分级的阈值存在差异[5-8]。本研究从0~1 000 s/mm2中选取10个不同b值进行多b值的DWI成像,分别为0、100、200、300、400、500、600、700、800、1 000,扫描时间约240 s。将10个b值的DWI原始图像输入Bio-map后处理软件内,计算得到不同b值组成的各项ADC值以及相应的拟合ADC图。先拟合获取ADC10b图(上述10个b值),再使用3个低b值拟合的ADClow图(0、100、200 s/mm2),3个高b值拟合出ADChigh(700、800、1 000 s/mm2)。国外有研究者[9-11]根据不同b值对ADC影响,提出了ADCperf值的概念,认为高低b值的ADC值之间的差异可以基本除外组织中水分子扩散运动对ADC值的影响,反映组织血流灌注情况,基于该理论,选择ADClow与ADChigh信号之差为ADCperf值,并且拟合出ADCperf图。
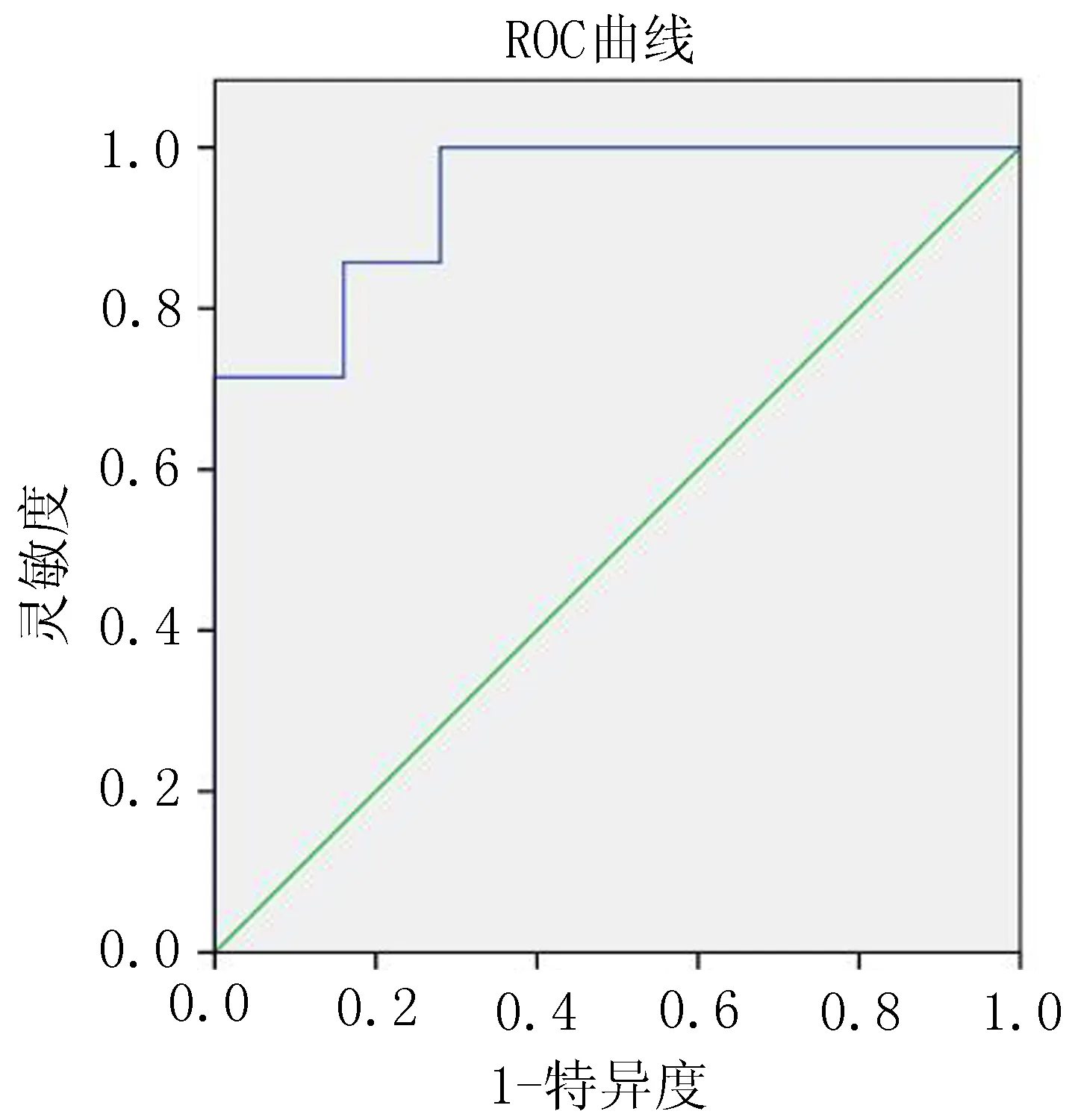
图9 ADCperf诊断≥S2期肝纤维化
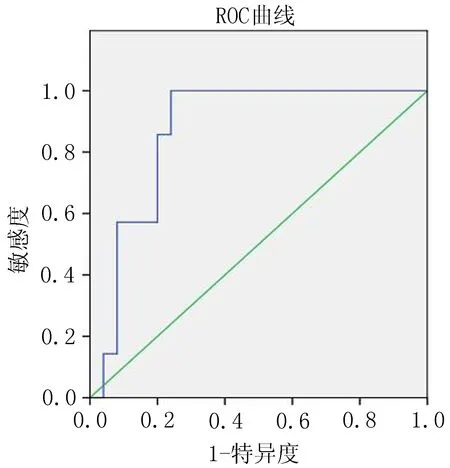
图10 ADC10b诊断≥S1期肝纤维化
当选择较大的b值时,反映组织的真实扩散情况,并且能够排除血液灌注的影响。故本研究选取3个较大的b值DWI图像拟合出ADChigh图,能客观反映水分子的扩散程度。而当b值较小时,主要是微循环血流灌注引起的扩散效应,故本研究选取3个低b值拟合出ADClow图。本研究又用全部10个b值DWI图拟合出ADC10b图,故得出的ADC10b包括组织水分子的扩散程度和微循环血流灌注情况,这样较常规单一b值结果更准确,图像质量更好。
3.2 拟合ADC值测量结果分析 本课题组通过对兔肝纤维化模型的病理分期和多b值拟合的ADC值对照研究发现,随着肝纤维化程度加重,ADC值逐渐降低,这个结果与单一b值ADC值变化情况一致。在病理上为肝内胶原纤维和网状纤维沉积导致水分子的活动空间减小,限制了水分子的扩散运动。随着肝纤维化程度的加重,ADClow和ADChigh值的差异无统计学意义,考虑是由于肝纤维化时,ADC值的测量受很多因素影响[12],比如肝脏铁质沉积、肝内脂肪浸润,另外微循环和组织结构改变也会有影响,样本选择及测量的准确度也会影响到统计分析。
本研究发现ADCperf值随着肝纤维化程度的加重而逐渐减低,差异具有显著统计学意义(P<0.01),大致可以评估组织的灌注状态。这种血流灌注减低反映在组织学上为肝内纤维沉积导致肝脏灌注阻力增大和门脉压力增大所致。本研究结果与目前多数CT及MR研究肝纤维化时灌注改变相一致。本研究经两两比较,发现S0期与S1、S2、S3、S4期和S1期与S2、S3、S4期差异有统计学意义,考虑肝纤维化早期,炎性水肿导致肝脏血管受压使灌注减小,随着肝纤维化的进展,大量纤维沉积导致血液循环压力增高使灌注进一步下降。S1期与S2期比较差异无统计学意义,说明在肝纤维化早期中,肝脏病理组织结构变化不明显,肝纤维沉积较少,范围局限,对水分子的扩散运动限制作用不明显。S2、S3、S4期比较差异无统计学意义,考虑随着肝纤维化的发展,肝脏自身调节作用会增加肝脏的灌注,同时由于ADC值测量干扰因素很多,导致差异不显著。ROC曲线显示,ADCperf预测S2期以上肝纤维化时曲线下面积最大,说明在肝纤维化发展过程中,S2期的改变最为关键。相关分析显示ADCperf与肝纤维化的严重程度呈负相关(r=-0.720,P<0.01)。Zhang等[13]通过体速不相干运动(IVIM)研究大鼠肝纤维化模型,发现反映灌注的指标(f)与肝纤维化严重程度呈负相关(r=-0.934, P<0.001)。当有患者因肾功能损害无法进行增强检查时,可以用ADCperf值来替代反映组织血流灌流情况。另外这个分析软件对于基层医院,比较容易开展。
对于ADC10b,随着肝纤维化程度的加重,呈逐渐减低,差异具有显著统计学意义(P<0.01)。S0期与S2、S3期比较差异具有显著统计学意义,S1期与S2、S3期比较差异具有显著统计学意义(P<0.01)。ADC10b预测S1期以上肝纤维化时曲线下面积最大。相关分析后显示ADC10b与肝纤维化的严重程度呈负相关(r=-0.685,P<0.01)。在常规MR扫描发现形态学改变之前,ADC值可以更早地反映肝纤维化微观改变。在b取不同值时,图像质量变化很大,合适的b值是扩散加权成像的关键问题。MR扩散加权成像b值选取的原则应在满足诊断需要的前提下,使测得的ADC值稳定且真实可靠。
由于各研究使用的硬件及参数设置不同,同类研究之间缺乏可比性。很多因素都会导致ADC值测量不准确,比如肝内铁质沉积、脂肪浸润等。测量的重复性较差需要进一步研究来完善。在扫描技术上,要减少运动伪影,提高图像质量,增加信噪比。
[1] Huang SY, Abdelsalam ME, Harmoush S, et al. Evaluation of liver fibrosis and hepatic venous pressure gradient with MR elastography in a novel swine model of cirrhosis[J]. J Magn Reson Imaging, 2014,39(3):590-597.
[2] Rockey DC, Caldwell SH, Goodman ZD, et al. Liver biopsy[J]. Hepatology, 2009, 49(3) :1017-1044.
[3] 王晓昆, 唐瑛. 肝纤维化动物模型研究进展[J]. 动物医学进展, 2007, 28(3):95-98.
[4] 中华肝脏病学会肝纤维化学组. 肝纤维化诊断及疗效评估共识[J]. 中华肝脏病杂志, 2002, 10(5):327-328.
[5] Roth Y, Tichler T, Kostenich G, et al. High-b-value diffusion-weighted MR imaging for pretreatment prediction and early monitoring of tumor response to therapy in mice[J]. Radiology, 2004, 232(3):685-692.
[6] 王蕊, 于浩, 方慧, 等. 肝ADC值及MR肝脾体积比值对肝纤维化、肝硬化诊断价值的比较[J]. 实用放射学杂志, 2014, 30(7):1141-1143.
[7] 杨洋, 宋彬, 吴苾, 等. 磁共振弥散加权成像技术评价慢性病毒性肝炎的纤维化程度及活动度[J]. 中国医学科学院学报,2009, 31(2):155-159.
[8] Taouli B, Tolia AJ, Losada M, et al. Diffusion-weighted MRI for quantification of liver fibrosis:preliminary experience[J]. AJR, 2007,189 (4):799-806.[9] Ogura A, Hayakawa K, Miyati T, et al. The effect of susceptibility of gadolin-ium contrast media on diffusion-weighted imaging and the apparent diffusion c-oefficient[J]. Acad Radiol, 2008, 15(7):867-872.
[10] Lencioni R, Llovet JM. Modified RECIST(mRECIST)assessment for hepatocell-ular carcinoma[J]. Semin Liver Dis, 2010, 30(1):52-60.
[11] Imamura M, Yamamoto H, Nakamura N, et al. Prognostic significance of angi-ogenesis in gastrointestinal stromal tumor[J]. Mod Pathol, 2009,20(5):529-537.
[12] Balassy C, Feier D, Peck-Radosavljevic M, et al. Susceptibility-weighted MR imaging in the grading of liver fibrosis:a feasibility study[J]. Radiology, 2014,270(1):149-158.
[13] Zhang Y, Jin N, Deng J, et al. Intra-voxel incoherent motion MRI in rodent model of diethylnitrosamine-induced liver fibrosis[J]. Magnetic Resonance Imaging, 2013, 31(6):1017-1021.
(本文编辑 张巧莲)
The value of multi-b diffusion weighted imaging in staging diagnosis of hepatic fibrosis in rabbits
WANG Hao1, HAO Lu1, WANG Hong1, WANG Yunling1, JIA Wenxiao2
(1DepartmentofImagingCenter,theSecondAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830028,China;2XinjiangMedicalUniversity,Urumqi830011,China)
Objective To explore the evaluation of hepatic fibrosis stage by multi-b value diffusion weighted imaging and to find a sensitive indicator to judge the severity of hepatic fibrosis in rabbit model. Methods 60 New Zealand white rabbits were established hepatic fibrosis model by intraperitoneal injection of carbon tetrachloride as the experimental group, paralleled with 10 rabbits as the control group, intraperitoneal injection of saline. All rabbits underwent multi-b value diffusion weighted imaging. ADClow, ADChigh, ADC10band ADCperfwere measured in MRI diffusion weighted imaging. Results With the increase of the degree of hepatic fibrosis, ADC10band ADCperfdecreased, which the difference was statistically significant (P<0.01), ADCperfpredicted the area under the curve of ≥S2 stage was the largest. ADC10bpredicted the area under the curve of ≥S1 stage was the largest. ADCperfand ADC10bwere negatively correlated with the severity of hepatic fibrosis (r=-0.720, -0.685, P<0.01), which indicated that ADCperfand ADC10bwould quantify the severity of hepatic fibrosis. Conclusion ADCperfcan reflect the perfusion change of hepatic fibrosis stages.
hepatic fibrosis; animal model; magnetic resonance imaging
新疆医科大学科研创新基金(XJC201341)
王 皓(1979-),男,硕士,主治医师,研究方向:腹部疾病影像学诊断。
贾文霄,男,教授,主任医师,博士生导师,研究方向:磁共振功能成像,E-mail:jwx-xj@163.com。
R-33; R445
A
1009-5551(2016)12-1526-05
10.3969/j.issn.1009-5551.2016.12.011
2016-07-21]

